類泛素-蛋白酶體系統和藥物外排泵抑制劑對結核分枝桿菌單純利福平耐藥性影響的研究
朱薈云,吳 芳,吳江東,張 杰,董江濤,章 樂,張 帥,張大龍,武青青,張萬江
?
類泛素-蛋白酶體系統和藥物外排泵抑制劑對結核分枝桿菌單純利福平耐藥性影響的研究
朱薈云1,吳 芳1,吳江東1,張 杰2,董江濤3,章 樂1,張 帥1,張大龍4,武青青4,張萬江1
目的 探討類泛素-蛋白酶體系統對結核分枝桿菌單純利福平耐藥性的影響。方法 采用刃天青顯色法檢測利福平對結核分枝桿菌的最低抑菌濃度(minimum inhibitory concentration,MIC),比較分析結核分枝桿菌Pup、Dop、PafA、Mpa基因的過表達或缺失突變對結核分枝桿菌利福平MIC的差異;檢測分別加入羰基氰氯苯腙、利血平、維拉帕米和氯丙嗪4種外排泵抑制劑前后各菌株對利福平MIC的影響。結果 結核分枝桿菌Pup、Dop、PafA和Mpa基因的過表達均能增強單純耐利福平結核分枝桿菌對利福平的耐藥性,而Pup、Mpa、Dop和PafA基因的缺失均能顯著降低單純耐利福平結核分枝桿菌對利福平的耐藥性,P值均<0.05。4種藥物外排泵抑制劑能不同程度的降低各過表達菌株對利福平的MIC,P值均<0.05,并且,類泛素-蛋白酶體系統與外排泵抑制劑之間存在一定交互作用。結論 類泛素-蛋白酶體系統對結核分枝桿菌單純利福平耐藥性的產生有影響;類泛素-蛋白酶體系統可能通過調控外排相關通路蛋白來影響結核分枝桿菌單純利福平耐藥性的產生。
結核分枝桿菌;類泛素-蛋白酶體系統;利福平;最小抑菌濃度;藥物外排泵;耐藥性
結核病(Tuberculosis,TB)是一種由結核分枝桿菌(Mycobacteriumtuberculosis,MTB)引起的一種感染性疾病,也是一種人獸共患病。半個世紀前由于使用了抗結核藥物,結核病疫情得到一定的控制[1]。然而,由于耐藥結核病,特別是耐多藥(multi-drug resistant,MDR)結核病的出現,影響了結核病的有效治療和控制[2]。我國結核病利福平(rifampin ,RFP)耐藥率為9.63%,高于全球平均水平[3]。因此,本文將探討研究耐利福平結核桿菌耐藥機制。
2008 年,Pearce等人[4]在結核桿菌中發現了分枝桿菌蛋白酶體降解信號原核類泛素蛋白(Prokaryotic ubiquitin-like,Pup) ,結核桿菌的Pup與結核桿菌蛋白酶體組成了結核桿菌Pup-蛋白酶體系統 (Pup-poroteasome system,PPS) 。Pup在輔助因子蛋白酶體關聯ATP酶(Mycobacterium proteasomal ATPase,Mpa)、蛋白酶體輔助因子A(proteasome accessory factor A,PafA)和Pup脫酰胺酶(deamidase of Pup,Dop)的輔助作用下將底物蛋白傳遞到蛋白酶體內進行降解或者參與廣泛的調控作用。結核分枝桿菌的蛋白酶水解功能依賴ATP,這一過程對病原體的毒力是必不可少的[5]。
本課題組前期的研究結果表明,類泛素-蛋白酶體系統中的Pup基因、Dop基因、PafA基因和Mpa基因對結核分枝桿菌的耐藥性有影響[6],但是具體機制尚不明確。本研究通過應用4種不同外排泵抑制劑,調控外排泵的功能,來觀察各結核桿菌菌株的MTB PPS對利福平藥物敏感性的影響,探討MTB PPS對單純耐利福平MTB耐藥性的影響及其機制,為揭示結核桿菌的耐藥機制提供理論依據。
1 材料與方法
1.1 菌株 單純耐利福平結核桿菌臨床分離株、Pup基因、Dop基因、Mpa基因、PafA基因過表達的耐利福平結核桿菌菌株(rRFP-MTB::Pup菌株、rRFP-MTB::Dop菌株、rRFP-MTB::Mpa菌株、rRFP-MTB::PafA菌株)、Pup基因、Dop基因、Mpa基因、PafA基因缺失突變的耐利福平結核桿菌菌株(RFP-MTB△Pup菌株、RFP-MTB△Dop菌株、RFP-MTB△Mpa菌株、RFP-MTB△PafA菌株)由本實驗室構建、鑒定和保存。
1.2 試劑 利福平購自Sigma公司,羰基氰氯苯腙、利血平、維拉帕米和氯丙嗪購自上海信誼藥廠有限公司,刃天青購自上海Aladdin有限公司,二甲基亞楓購自山西太谷化工廠,10%的醋酸購自天津市坤華化工有限公司,Tween 80購自天津化學試劑廠,生理鹽水購自上海生物工程有限公司,胰蛋白胨OXOID、酵母提取物OXOID購自英國Tryptone 公司,OADC細菌增菌液、羅氏固體培養基和7H9培養基購自美國BD公司。
1.3 繪制各菌株的生長曲線分別挑取羅氏固體培養基上生長良好的RFP MTB菌株、4種MTB PPS過表達的耐利福平結核桿菌菌株(rRFP-MTB::Pup菌株、rRFP-MTB::Dop菌株、rRFP-MTB::Mpa菌株、rRFP-MTB::PafA菌株)4種MTBPPS缺失突變的耐利福平結核桿菌菌株(rRFP-MTB△Pup菌株、rRFP-MTB△Dop菌株、rRFP-MTB△Mpa菌株、rRFP-MTB△PafA菌株)單一菌落,接種于7H9液體培養基,37 ℃搖床培養,每3 d取1次菌液,測定菌液在波長600 nm處的吸光度(A)值。以培養時間為橫坐標,A600值為縱坐標,繪制各菌株生長曲線,觀察各菌株的生長特點。
1.4 MIC測定
1.4.1 操作程序 參考Franzblau SG方法[7],并在此基礎上稍加改進。在一次性無菌96孔培養板(1~10孔)中每孔加7H9液體培養基工作液100 μL。第1孔加適當稀釋的抗結核藥原液 100 μL,雙倍連續稀釋至第 8孔,使各孔藥物終濃度為RFP8-0.06 μg/mL,第9孔為不含抗菌藥物的生長對照孔。
1.4.2 MIC值 刃天青顯色法檢測RFP-MTB菌株、MTB PPS過表達結核桿菌菌株、MTB PPS缺失突變結核桿菌菌株MIC值。
1.4.3 藥物外排泵抑制劑對各菌株MIC的影響測定 試驗前,在96孔板中加入4種外排泵抑制劑,使藥物外排泵抑制劑羰基氰氯苯腙、利血平、維拉帕米和氯丙嗪的終濃度分別為0.05 μg/mL、6 μg/mL、64 μg/mL、4 μg/mL。4種藥物外排泵抑制劑濃度參考文獻[8]并根據預實驗確定。
1.5 統計學分析 采用SPSS 19.0統計軟件,采用成對樣本t檢驗,比較單純耐利福平結核桿菌臨床分離株、4種MTB PPS過表達的耐利福平結核桿菌菌株、4種MTB PPS缺失突變的耐利福平結核桿菌菌株MIC值,以P<0.05為差異有統計學意義。采用析因設計,分析在加入不同濃度羰基氰氯苯腙(carbonyl cyanidem-chlorophenyl hydrazine,CCCP)、利血平(reserpine,RP)、維拉帕米(verapamil,VP)和氯丙嗪(chlorpromazine,CPZ)上述各菌株MIC值,以P<0.05為差異有統計學意義。
2 結 果
2.1 各菌株的生長曲線 RFP-MTB菌株培養3 d后即進入對數生長期,培養24 d后進入生長穩定期。rRFP-MTB::Pup菌株、RFP-MTB△Pup菌株、rRFP-MTB::Dop菌株、RFP-MTB△Dop菌株、rRFP-MTB::Mpa菌株、rRFP-MTB△Mpa菌株、rRFP-MTB::PafA菌株、rRFP-MTB△PafA菌株培養6 d后即進入對數生長期,培養24 d后進入生長穩定期。rRFP-MTB::Pup菌株、RFP-MTB△Pup菌株、rRFP-MTB::Dop菌株、RFP-MTB△Dop菌株、rRFP-MTB::Mpa菌株、RFP-MTB△Mpa菌株、rRFP-MTB::PafA菌株、RFP-MTB△PafA菌株的適應期較RFP-MTB菌株長,生長周期基本相近,為30 d左右。(圖1)
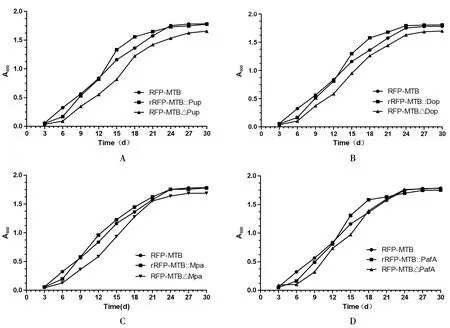
a.RFP-MTB菌株、rRFP-MTB::Pup菌株、RFP-MTB△Pup菌株的生長曲線;b. RFP-MTB菌株、rRFP-MTB::Dop菌株、RFP-MTB△Dop菌株的生長曲線;c. RFP-MTB菌株、rRFP-MTB::Mpa菌株、RFP-MTB△Mpa菌株的生長曲線;d. RFP-MTB菌株、rRFP-MTB::PafA菌株、RFP-MTB△PafA菌株的生長曲線。
a.The growth curve of RFP-MTB strains,rRFP-MTB::Pupstrains,RFP-MTB△Pupstrains;b.The growth curve of RFP-MTB strains,rRFP-MTB::Dopstrains,RFP-MTB△Dopstrains;c.The growth curve of RFP-MTB strains,rRFP-MTB::Mpastrains,RFP-MTB△Mpastrains;d.The growth curve of RFP-MTB strains,rRFP-MTB::PafAstrains,RFP-MTB△PafAstrains.
圖1 試驗菌株生長曲線
Fig.1 The growth curve of test strains
2.2 各菌株的利福平MIC結果rRFP-MTB::Pup菌株、rRFP-MTB::Dop菌株、rRFP-MTB::Mpa菌株rRFP-MTB::PafA菌株MIC與RFP-MTB菌株MIC相比明顯增高,rRFP-MTB△Pup菌株、rRFP-MTB△Dop菌株、rRFP-MTB△Mpa菌株、rRFP-MTB△PafA菌株MIC與RFP-MTB菌株MIC相比差異均具有統計學意義(P<0.01)。(圖2)
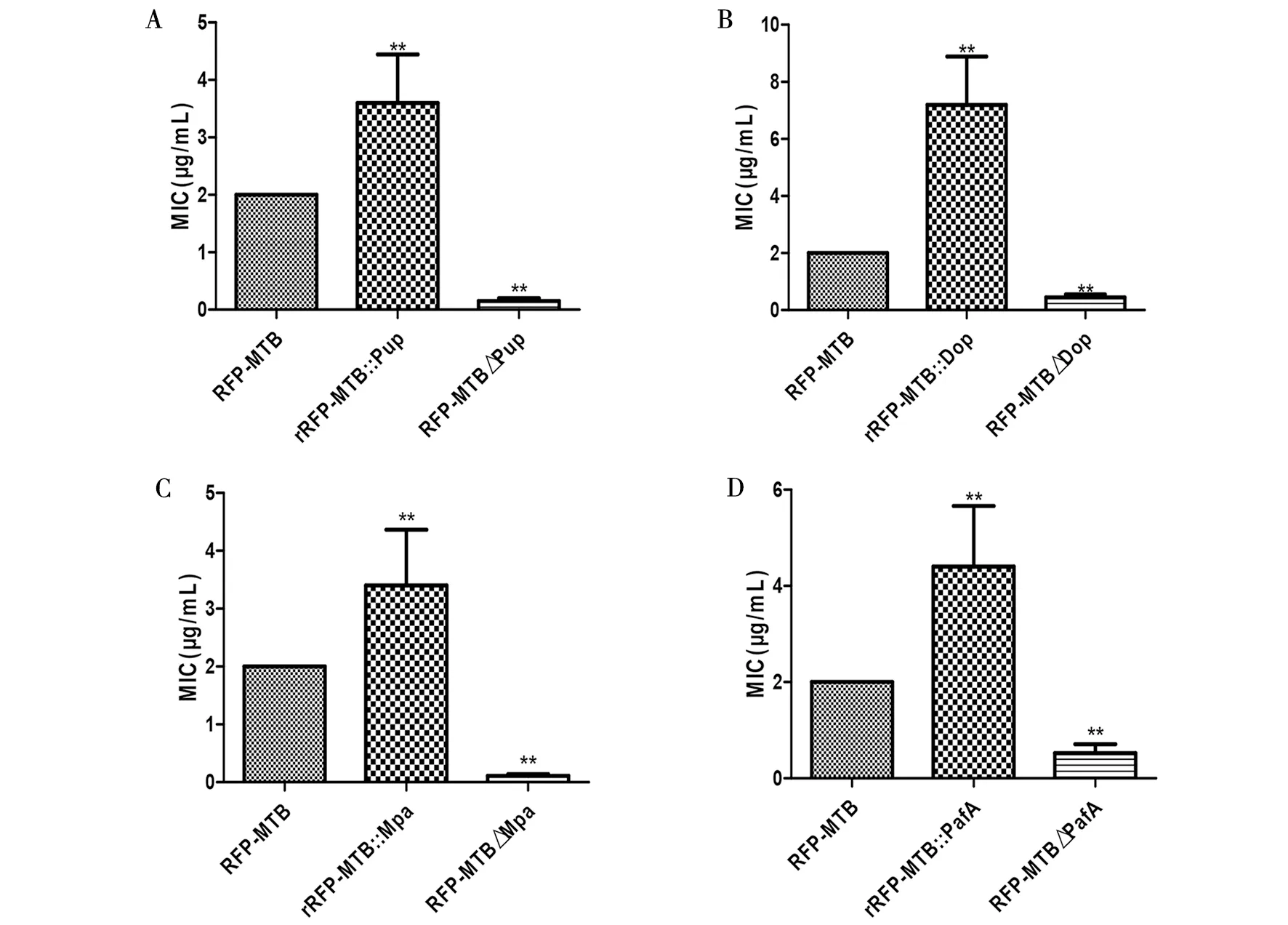
a. rRFP-MTB::Pup菌株、RFP-MTB△Pup菌株MICs與單純耐利福平的MTB MIC的比較;b. rRFP-MTB::Dop菌株、RFP-MTB△Dop菌株MICs與單純耐利福平的MTB MIC的比較;c. rRFP-MTB::Mpa菌株、RFP-MTB△Mpa菌株MICs與單純耐利福平的MTB MIC的比較;d. rRFP-MTB::PafA菌株、RFP-MTB△PafA菌株MICs與單純耐利福平的MTB MIC的比較**與對照組MIC比較,P<0.01a. Comparison of rRFP-MTB::Pup strains,RFP-MTB△Pup strains and the RFP-MTB MICs resistance to rifampin;b. Comparison of rRFP-MTB::Dop strains, RFP-MTB△Dop strains and the RFP-MTB MICs resistance to rifampin;c. Comparison of rRFP-MTB::Mpa strains, RFP-MTB△Mpa strains and the RFP-MTB MICs resistance to rifampin;d. Comparison of rRFP-MTB::PafA strains, RFP-MTB△PafA strains and the RFP-MTB MICs resistance to rifampin;** compared to the control MIC, P<0.01圖2 各菌株MICs與單純耐利福平的MTB MICs的比較Fig.2 Comparison of different strains and the RFP-MTB MICs resistance to rifampin
2.3 4種外排泵抑制劑對各過表達菌株的利福平MIC的影響 CCCP的終濃度為0.05 μg/mL時,利福平對RFP-MTB的MIC由2.0 μg/mL降低至0.075 μg/mL。RP的終濃度為6 μg/mL時,RP對RFP-MTB的MIC由2.0 μg/mL降低至0.9 μg/mL。VP的終濃度為64 μg/mL時,利福平對RFP-MTB的MIC降低至0.3 μg/mL。CPZ的終濃度為4 μg/mL時,利福平對RFP-MTB的MIC由2.0 μg/mL降低至1.2 μg/mL。在使用4種外排泵抑制劑之后,利福平對rRFP-MTB::Pup、rRFP-MTB::Dop、rRFP-MTB::Mpa、rRFP-MTB::PafA的MIC都有所降低。與RFP-MTB菌株相比,Pup基因過表達可以使利福平的MIC由2.0 μg/mL升高至3.6 μg/mL,在加入外排泵抑制劑之后,利福平的MIC降低,最低為0.113 μg/mL。與RFP-MTB菌株相比,Dop基因過表達可以使利福平的MIC升高至7.2 μg/mL,在加入終濃度為0.05 μg/mL的RP時,利福平的MIC可降低至0.15 μg/mL。Mpa基因過表達可以使利福平的MIC升高為3.4 μg/mL,在使用外排泵抑制劑之后,利福平的MIC最低可降至0.225 μg/mL。PafA基因過表達可以使利福平的MIC顯著升高,在加入外排泵抑制劑之后,利福平的MIC也出現不同程度的降低(圖2、圖3)。通過SPSS析因分析,發現Pup基因、Mpa基因、Mpa基因、PafA基因與CCCP、RP、VP和CPZ 4種外排泵藥物之間,存在一定的交互作用。
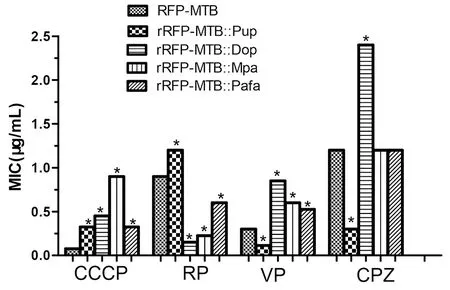
注: *與對照組MIC比較,P<0.05Compared to the control MIC,P<0.05圖3 4種外排泵抑制劑對過表達各菌株的利福平MIC值Fig.3 Four kinds of efflux pump inhibitors on expression of various strains of rifampin MICs value
3 討 論
原核生物分枝桿菌屬中廣泛存在一種類似真核生物泛素-蛋白酶體系統的蛋白降解系統,命名為類泛素-蛋白酶體系統。在類泛素-蛋白酶體系統中,通過輔助因子的作用,Pup可標記多種功能蛋白,并介導被標記的蛋白通過蛋白酶體降解。其中標記的靶蛋白廣泛參與了信號通路等細菌生命活動的各個環節,多個與此系統相關基因的突變會導致結核分枝桿菌對NO的敏感性增加,同時降低了結核分枝桿菌的存活率。
Pup-蛋白酶體系統選擇性降解蛋白質的過程:Pup側鏈末端的谷氨酰胺在連接作用之前首先被Dop脫去酰胺基后變成谷氨酸(此過程需要與ATP的結合但不是其水解作用)[9],然后在PafA的催化下谷氨酸的1個羧基通過異肽鍵連接到底物賴氨酸上。與底物的賴氨酸相連接的可能是α-羧基也可能是γ-羧基(此過程需要ATP的水解作用)[10]。最后,MTB蛋白酶體的Mpa負責將底物運載到蛋白酶體內使其降解[11]。Pup羧基末端的螺旋部分會與Mpa氨基末端卷曲螺旋區域相互作用[12]。Chen X等[13]發現,PafA在PPS系統中可自動調節,自身可發生pup化。
本研究結果顯示,與單純耐利福平MTB相比,過表達Pup、Dop、PafA和Mpa基因均能夠使單純耐利福平的結核桿菌對利福平的耐藥性增強。缺失Pup基因、Mpa基因、Dop基因、PafA基因均能顯著降低單純耐利福平MTB對利福平的耐藥性。據報道Pup能夠對 MTB 中待降解的蛋白質進行識別和修飾,并將修飾好的靶蛋白帶入蛋白酶體進行降解[14]。
CCCP是最典型的質子泵抑制劑,為一種抑制質子轉運的解耦聯劑,可以抑制主動外排系統能量來源的質子濃度梯度,導致轉運蛋白失去能量供應,破壞外排系統的主動外排作用,表現為藥物在細菌中的蓄積顯著增加,恢復細菌對藥物的敏感性[15]。目前CCCP已是研究外排耐藥系統必不可少的工具試劑,能顯著降低耐藥菌的MIC,幾乎成為判斷主動外排系統存在的標志,但是其本身具有一定毒副作用。鄒永勝等[16]研究發現,主動外排泵抑制劑 CCCP 可以使氟喹諾酮類抗菌藥物對 MDR大腸埃希菌的 MIC 降低。本實驗結果顯示,加入CCCP終濃度為0.05 μg/mL時,實驗組MIC的變化范圍有不同程度的降低。通過析因分析發現PPS系統與CCCP之間存在一定交互作用,說明PPS系統可能通過影響外排泵功能發揮作用。CCCP可以阻斷菌體表面蛋白能量的供應,使外排泵無法正常工作,藥物不被外排而蓄積于菌體內,也有可能使得ATP依賴的MTB PPS系統無法降解相關蛋白,從而提高結核分枝桿菌對藥物的敏感性。目前CCCP還沒有成功應用于臨床,究其原因,主要是因為使用劑量較大,副作用大,對機體存在毒性傷害。
RP為一種抗高血壓藥物, 對結核分枝桿菌無殺菌或抑菌作用,但它是一種細菌的外排泵抑制劑已得到證實。它屬于吲哚生物堿類,主要通過 ATP 水解釋能途徑減少細菌能量供應,從而減少細菌對底物的外排使細菌恢復對藥物的敏感性[17]。Pup和ATP蛋白水解酶體在序列上的高度保守,以及折疊Pup被誘導的結合反應,作為一種普遍的識別機制,存在于細菌的蛋白酶體系統中。2013年,周云等[18]在體外用4種外排泵抑制劑對鮑曼不動桿菌的耐藥性進行實驗,發現對細菌耐藥有明顯的逆轉作用。有關報道,利血平對于MFS及ABC型外排泵具有抑制作用。本實驗中,外排系統與PPS系統存在交互作用,可能是因為MTB PPS降解過程中需要ATP的參與。
VP是罌粟堿的衍生物,是一種質子梯度依賴泵抑制劑,也是一種鈣離子通道阻滯劑。蘇啟表等人[19]的研究結果顯示,在脂多糖誘導產生的全身性急性炎癥狀態下,以上2個步驟均參與了大鼠肝P-gp的翻譯后修飾過程。本研究結果顯示,PPS系統與維拉帕米之間存在一定的交互作用,提示可能PPS系統調控了有關外排通路。張志剛等人[20]提出,外源性野生型泛素基因轉染腫瘤細胞及應用糖化抑制劑抑制P-gP蛋白糖化過程均可增加P-gP的泛素化和蛋白降解,反之應用蛋白酶體阻斷劑則可減少P-gP降解,使已泛素化的P-gP增加。同時,泛素化增強可使腫瘤細胞P-gP功能下降及其對抗腫瘤藥物敏感性增強。但維拉帕米在作為外排泵抑制劑使用時所需劑量較高,容易發生心血管系統的不良反應,從而限制了其臨床應用。加入維拉帕米后,MTB PPS系統的MIC值發生顯著降低,提示P糖蛋白可能參與MTB的外排轉運過程。
CPZ屬于吩噻嗪類藥物,是一種強效的抗焦慮和抗抑郁藥物。甲硫達嗪作用機理同氯丙嗪。Daniel等[21]在實驗中發現吩噻嗪類化合物能抑制抗凋亡基因 NF-κB。王騫等人[22]的研究表明,NF-κB途徑參與結核炎癥反應。提示,MTB PPS系統可能通過調控相關通路,影響細菌耐藥性。
細菌對進入菌體的抗生素進行主動外排作用是細菌產生耐藥性的一個重要機制[23]。2009 年,Festa 等[24]采用串聯親和層析和質譜分析法對 MTB 中的Pup標記蛋白進行了系統分析,共發現有55個被Pup標記的靶蛋白,這些蛋白涉及物質中間代謝、信號通路、毒性與抗毒性因子、細胞壁和細胞膜組分等多個方面。鑒于這些Pup-蛋白酶體系統底物蛋白的生理功能,Pup-蛋白酶體系統可以通過調控蛋白質降解,在MTB的生長調控和致病性中發揮重要作用。本研究發現MTB PPS系統可能與外排泵相關,利用pupylation網站和pupdb數據庫,研究探討MTB PPS影響利福平耐藥性的靶蛋白為結核病的耐藥機制,疫苗的研制提供基礎。
[1] Wade MM,Zhang Y. Mechanisms of drug resistance inMycobacteriumtuberculosis[J]. Front Biosci,2004,9: 975-994. DOI: 10.1016/j.jgg.2016.10.002
[2] Kurz SG,Furin JJ,Bark CM. Drug-resistant tuberculosis: Challenges and progress[J]. Infect Dis Clin North Am,2016,30(2): 509-522. DOI: 10.1016/j.idc.2016.02.010
[3] Yin L,Xiao DL,Wang WJ,et al. A baseline survey of drug resistance in the whole nation[M]. Beijing: People’s Medical Publishing House,2010: 48-52. (in Chinese)
尹力,肖東樓,王文杰,等.全國結核病耐藥性基線調查報告[M].北京:人民衛生出版社,2010:48-52.
[4] Pearce MJ,Mintseris J,Ferreyra J,et al. Ubiquitin-like protein involved in the proteasome pathway ofMycobacteriumtuberculosis[J]. Science,2008,322(5904): 1104-1107. DOI: 10.1126/science.1163885
[5] Zhang YQ,Zhang WJ. Research progress about the relationship between the pup-proteasome system and the pathogenicity ofMycobacteriumtuberculosis[J]. Chin J Zoonoses,2014,30(9): 971-977. DOI:10.3969/j.issn.1002-2694.2014.09.020(in Chinese)
張玉清,張萬江. 泛素樣蛋白-蛋白酶體系統與結核分枝桿菌致病性的相關性研究進展[J].中國人獸共患病學報,2014,30(9): 971-977.
[6] He L,Zhu B,Zhang WJ,et al. Study on the gene expression of the ubiquitin like protein (Pup)-proteasome system of drug resistantMycobacteriumtuberculosis[J]. Chin J Immunol,2015: 31(6):741-747. (in Chinese)
何麗,朱彬,張萬江,等.耐藥結核桿菌原核類泛素蛋白(Pup)-蛋白酶體系統基因表達的研究[J].中國免疫學雜志,2015:31(6):741-747.
[7] Franzblau SG,Witzig RS,McLaughlin JC,et al. Rapid,low-technology MIC determination with clinicalMycobacteriumtuberculosisisolates by using the microplate Alamar Blue assay[J]. J Clin Microbiol,1998,36(2): 362-366.
[8] Fan GR,Yang ZB,Huang J,et al. Study on mechanism of rifampin resistantMycobacteriumabscess[J]. Chin J Zoonoses,2013,(12): 1172-1176. DOI:10.3969/j.issn.1002-2694.2013.12.009(in Chinese)
范貴榮,楊致邦,黃進,等.膿腫分枝桿菌耐利福平機制的研究[J].中國人獸共患病學報,2013(12): 1172-1176.
[9] Striebel F,Imkamp F,Sutter M,et al. Bacterial ubiquitin-like modifier Pup is deamidated and conjugated to substrates by distinct but homologous enzymes[J]. Nat Struct Mol Biol,2009,16(6): 647-651. DOI: 10.1038/nsmb.1597
[10] Kraut DA,Matouschek A. Pup grows up:invitrocharacterization of the degradation of pupylated proteins[J]. EMBO J,2010,29(7): 1163-1164. DOI: 10.1038/emboj.2010.40
[11] Sutter M,Striebel F,Damberger FF,et al. A distinct structural region of the prokaryotic ubiquitin-likeprotein (Pup) is recognized by the N-terminal domain of theproteasomal ATPase Mpa[J]. FEBS Lett,2009,583(19): 3151-3157. DOI: 10.1016/j.febslet.2009.09.020
[12] Imkamp F,Ziemski M,Weber-Ban E. Pupylation-dependent and independent proteasomal degradation in mycobacteria[J]. Biomol Concepts,2015,6(4): 285-301. DOI: 10.1515/bmc-2015-0017
[13] Chen X,Li C,Wang LL,et al. The mechanism ofMycobacteriumsmegmatisPafA self-Pupylation[J]. PLoS One,2016,11(3): 1-16. DOI: 10.1371/journal.pone.0151021
[14] Zhang Z,Liu ZQ,Zheng PY,et al. Influence of efflux pump inhibitors on the multidrug resistance ofHelicobacterpylori[J]. World J Gastroenterol,2010,16(10): 1279-1284.
[15] Aeschlimann JR,Dresser LD,Kaatz GW,et al. Effects of NorA inhibitors oninvitroantibacterial activities and postantibiotic effects of levofloxacin,ciprofloxacin,and norfloxacin in genetically related strains ofStaphylococcusaureus[J]. Antimicrob Agents Chemother,1999,43(2): 335-340.
[16] Zou YS,Wang X,Huang YM,et al. Efflux pump inhibitor carbonyl cyanide m-chlorophenylhydrazone effect of drug resistance on multiresistantEscherichiacoli[J]. Infect Dis Informat,2013(1): 29-31. (in Chinese)
鄒永勝,王旭,黃永茂,等.外排泵抑制劑羰酰氰間氯苯腙對多重耐藥大腸埃希菌的耐藥性影響[J].傳染病信息,2013(1):29-31.
[17] Brown MH,Panlsen IT,Slurray RA. The multidrug effluxprotein Nor M is a prototype of a new family of transporters[J]. Mol Microbiol,1999,31(1): 394-395.
[18] Zhou Y,Ling BD. Four efflux pump inhibitorAcinetobacterresistance to the Bauman effect of inhibiting[J]. Chin J Antibiotics,2013,38(6): 461-466. (in Chinese)
周云,凌保東.4種外排泵抑制劑對鮑曼不動桿菌耐藥性的抑制影響[J].中國抗生素雜志,2013,38(6):461-466.
[19] Su QB,Wei GN,Wang LY,et al. Ubiquitin proteasome system involved in the expression of P-protein in rat liver in acute inflammation state[J]. Chin J Clin Pharmacol,2016,(16): 28. (in Chinese)
蘇啟表,韋桂寧,王來友,等.泛素-蛋白酶體系統參與急性炎癥狀態下大鼠肝P-糖蛋白表達下調[J].中國臨床藥理學雜志.2016(16):28.
[20] Zhang ZG,Yang JM,Hait WN. The effects of ubiquitin regulation on the stability and function of tumor cell drug resistance gene protein[C]. The 2005 Academic Annual Conference of the Chinese Society of Medicine.Yichang:Chinese Pathological Society,2005(4): 70. (in Chinese)
張志剛,楊金銘,William N.Hait.泛素化調節對腫瘤細胞耐藥基因蛋白P-gp的穩定型和功能的影響[C].中華醫學會病理學分會2005年學術年會論文匯編.宜昌:中華醫學會病理學分會,2005(4): 70.
[21] Nagel D,Spranger S,Vincendeau M,et al. Pharmacologic inhibition of MALT1 protease by phenothiazines as a therapeutic approach for the treatment of aggressive ABC-DLBCL[J]. Cancer Cell,2012,22(6): 825-837. DOI: 10.1016/j.ccr.2012.11.002
[22] Wang Q,Niu NK,Wang ZL,et al. Experimental study on 2KLF4 regulation of the TLR-2/ p38MAPK / NF-κB the signaling pathway in the pathogenesis of spinal tuberculosis[J]. Chin J Orthopaed Surg,2016,24(7): 636-642. (in Chinese)
王騫,牛寧奎,王自立,等.2KLF4 調控的TLR-2/ p38MAPK / NF-κB 信號通路在脊柱結核發病機制中的實驗研究[J].中國矯形外科雜志,2016,24(7): 636-642.
[23] Aygul A. The importance of efflux systems in antibiotic resistance and eddlux pump inhibitors in the man-agement of resistance[J]. Mikrobiyol Bul,2015,49(2): 278-291.
[24] Festa RA,McAllister F,Pearce MJ,et al. Prokayrotic ubiquitin-like protein proteome ofMycobacteriumtuberculosis[J]. PLoS One,2010,5(1): e8589. DOI: 10.1371/journal.pone.0008589
Effects of theMycobacteriumtuberculosisprokaryotic ubiquitin-like protein-proteasome system on the mono-resistant to rifampin resistance toMycobacteriumtuberculosis
ZHU Hui-yun1,WU Fang1,WU Jiang-dong1,ZHANG Jie2,DONG Jiang-tao3,ZHANG Le1, ZHANG Shuai1,ZHANG Da-long4,WU Qing-qing4,ZHANG Wan-jiang1
(1.DepartmentofPathophysiology,ShiheziUniversitySchoolofMedicine/TheKeyLaboratoryofXinjiangEndemicandEthnicDiseases/CollaborativeInnovationCenterofHighIncidenceofZoonosesCommunicableDiseasePreventionintheWesternRegion,Shihezi832002,China;2.EmergencySurgeryDepartment,theFirstAffiliatedHospitalofShiheziUniversityMedicalCollege,Shihezi832002,China;3.DepartmentofNeurosurgery,theFirstAffiliatedHospitalofShiheziUniversityMedicalCollege,Shihezi832002,China; 4.DepartmentofCriticalMedicine,theFirstAffiliatedHospitalofShiheziUniversityMedicalCollege,Shihezi832002,China)
We studied the effect of theMycobacteriumtuberculosisprokaryotic ubiquitin-like protein-proteasome system on mono-resistant to rifampin resistance toM.tuberculosis. A resazurin-based assay was employed to evaluate minimum inhibitory concentration (MIC) and comparative research on mono-resistant to rifampin MTB withPup,Dop,PafA,Mpagenes expression and deletion of the difference. Above testing strains,respectively,carbonyl cyanide chlorobenzene hydrazone (CCCP),reserpine (RP),verapamil (VP) and chlorpromazine (CPZ) were tested. We compared and analyzed the change of rifampicin MICs on the various strains. Compared with rifampin resistant MTB,overexpression ofPup,Dop,PafAandMpagenes were able to make mono-rifampicin ofM.tuberculosisto enhance resistance to rifampin. Deletion ofPupgene,Mpagene,Dopgene,PafAgene significantly decreased the resistance to rifampicin alone MTB,and thePvalue was <0.05. Results indicated that 4 kinds of efflux pump inhibitors can reduce the degree of rifampin MIC in different strains. Through the factorial analysis,there were some interactions between MTB and PPS efflux pump inhibitors,and thePvalue was <0.05. MTB PPS has influence on mono-rifampin resistance to MTB and it may regulate the efflux pathway related protein to influence its resistance.
Mycobacteriumtuberculosis; prokaryotic ubiquitin-like protein-proteasome system; rifampin; minimum inhibitory concentration; active efflux; drug resistance
Zhang Wan-jiang; Email: zwj1117@126.com
國家自然科學基金資助項目(No.81260261,No.81160192);石河子大學高層次人才科研啟動項目(No.RCZX201446)
張萬江,Email: zwj1117@126.com
1.石河子大學醫學院病理生理學教研室/《新疆地方與民族高發病》教育部重點實驗室/《西部地區高發人獸共患傳染性疾病防治》協同創新中心,石河子 832002; 2.石河子大學醫學院第一附屬醫院急診外科,石河子 832002; 3.石河子大學醫學院第一附屬醫院神經外科,石河子 832002; 4.石河子大學醫學院第一附屬醫院重癥醫學科,石河子 832002
10.3969/j.issn.1002-2694.2017.07.009
R378.91
A
1002-2694(2017)07-0617-07
2016-10-24 編輯:張智芳
Supported by the National Natural Science Foundation (Nos. 81260261,81160192) and the High-level Personnel Scientific Research Projects of Shihezi University (No. RCZX201446)

