基于腦連接網(wǎng)絡(luò)的阿爾茨海默病臨床變量值預(yù)測
路子祥,屠黎陽,祖辰,張道強
(南京航空航天大學(xué) 計算機科學(xué)與技術(shù)學(xué)院,江蘇 南京 211106)
基于腦連接網(wǎng)絡(luò)的阿爾茨海默病臨床變量值預(yù)測
路子祥,屠黎陽,祖辰,張道強
(南京航空航天大學(xué) 計算機科學(xué)與技術(shù)學(xué)院,江蘇 南京 211106)
目前腦功能連接網(wǎng)絡(luò)已被廣泛用于大腦疾病診斷,然而傳統(tǒng)的腦網(wǎng)絡(luò)分類方法無法評估疾病所處的階段以及預(yù)測病情的發(fā)展。近期的研究表明,腦疾病的臨床變量值可以有效地幫助醫(yī)生進行疾病評估,為此提出一種基于腦連接網(wǎng)絡(luò)的方法,用于對阿爾茨海默病臨床變量值進行預(yù)測。首先從腦影像中提取功能連接網(wǎng)絡(luò),然后使用LASSO進行特征選擇,剔除不具有判別性的邊。同時融合網(wǎng)絡(luò)的聚類系數(shù)和邊的權(quán)重作為特征。最后使用支持向量回歸機預(yù)估臨床變量值。在ADNI數(shù)據(jù)集上對提出的方法進行驗證,實驗結(jié)果表明,提出的方法不僅能夠準(zhǔn)確地預(yù)測疾病臨床變量值而且還驗證了多種特征融合的有效性。
大腦功能;特征選擇;特征提取;特征融合;網(wǎng)絡(luò)分析;回歸分析;阿爾茨海默病;醫(yī)學(xué)影像
中文引用格式:路子祥,屠黎陽,祖辰,等. 基于腦連接網(wǎng)絡(luò)的阿爾茨海默病臨床變量值預(yù)測[J]. 智能系統(tǒng)學(xué)報, 2017, 12(3): 355-361.
英文引用格式:LU Zixiang, TU Liyang, ZU Chen, et al. Prediction of clinical variables in Alzheimer’s disease based on brain connective network[J]. CAAI transactions on intelligent systems, 2017, 12(3): 355-361.
阿爾茨海默病(Alzheimer’s disease,AD),即老年癡呆癥,是發(fā)生在老年期及老年前期的一種原發(fā)性退行性腦疾病,其臨床表現(xiàn)為認知和記憶功能減退。Brookmeyer等研究結(jié)果顯示,全球約有2 660萬人患有老年癡呆癥,到2050年平均每85人中有1人會受到老年癡呆癥的影響[1-2]。輕度認知障礙(mild cognitive impairment,MCI)是正常人轉(zhuǎn)化為阿爾茨海默病的一個中間過程,每年有高達15%的輕度認知障礙患者會轉(zhuǎn)化為AD[3-4]。因此準(zhǔn)確地診斷AD和MCI,對盡早治療和減緩疾病的惡化是非常重要的。醫(yī)學(xué)上的診斷主要依靠NINCDS-ADRDA、 DSM-IV等臨床診斷標(biāo)準(zhǔn),這些方法無法自動地診斷病人的病情發(fā)展?fàn)顟B(tài),因此需要可以識別出細微生物標(biāo)志的算法。
近些年來,神經(jīng)影像技術(shù)迅速發(fā)展,主要包括結(jié)構(gòu)核磁共振成像(structural magnetic resonance imaging, SMRI),彌散張量成像(diffusion tensor imaging, DTI),功能核磁共振成像(functional MRI, fMRI),腦電圖(electro-encephalogram, EEG)和腦磁圖(magnetoencephalography, MEG)。在fMRI、EEG和MEG圖像中,人們可以獲取功能連接網(wǎng)絡(luò),用于反映不同腦區(qū)的解剖連接模式。
最近出現(xiàn)的研究認為,臨床變量值可以用于評估AD的階段以及預(yù)測病情的發(fā)展。在現(xiàn)有的研究中,Cheng等[5]提出了一種新的半監(jiān)督多模態(tài)向量回歸法預(yù)測臨床評分;Zhang等[6]提出了一種多模態(tài)多任務(wù)的方法同時解決腦疾病的回歸和分類問題;Zhu等[7]提出了一種基于損失函數(shù)的相似性度量矩陣,充分利用高階信息解決腦疾病的回歸和分類問題。然而,上述的方法都是基于腦影像的研究,而目前大多數(shù)有關(guān)功能連接網(wǎng)絡(luò)的研究[8-9]主要關(guān)注于診斷受試人員是否患有該疾病,并不能很好地判斷出受試人員目前所處的狀態(tài),以及受試人員是否有潛在患AD的隱患。基于功能網(wǎng)絡(luò)的研究已經(jīng)成功地應(yīng)用于AD/MCI的分類診斷[10-11],說明 AD/MCI引起了功能網(wǎng)絡(luò)的變化,這為功能網(wǎng)絡(luò)用于預(yù)測臨床得分提供了理論保證。
為解決已有研究所存在的不足,本文提出了一種基于腦連接網(wǎng)絡(luò)的阿爾茨海默病臨床變量值預(yù)測的方法,用于對AD/MCI病人的臨床評分進行回歸分析。具體來說,首先對獲取到的fMRI圖像做預(yù)處理,獲得對應(yīng)的功能連接網(wǎng)絡(luò)。其次,從功能網(wǎng)絡(luò)中提取兩種特征,一種是節(jié)點的聚類系數(shù),整個網(wǎng)絡(luò)的聚類系數(shù)定義為各個節(jié)點的聚類系數(shù)的均值,它可以描述網(wǎng)絡(luò)中節(jié)點之間的連接緊密程度;另一種是邊的權(quán)重,對邊的權(quán)重使用LASSO算法選擇出具有判別性的邊。最后,將上一步中經(jīng)過提取、選擇后的特征合并成一個向量,用支持向量回歸機(support vector regression machine, SVRM)進行回歸預(yù)測。
1 數(shù)據(jù)集
本文所分析的數(shù)據(jù)集來源于阿爾茨海默病神經(jīng)影像學(xué)ADNI(http://adni.loni.usc.edu/),ADNI由國際老年研究所,生物醫(yī)學(xué)成像和生物工程研究所,美國食品和藥物管理局,民營醫(yī)藥企業(yè)和非營利組織于2003年啟動。ADNI是許多學(xué)術(shù)機構(gòu)和私營機構(gòu)共同努力的結(jié)果,被招募被試者來自于美國和加拿大中超過50個以上的地區(qū)。ADNI的最初目標(biāo)是招募800名成人,年齡55~90歲之間,其中大約有200個認知能力正常的老年人,400個輕度認知障礙(MCI)患者,200個阿爾茨海默病(AD)患者。認知正常人和MCI數(shù)據(jù)是連續(xù)3年跟蹤測試得到的,而AD數(shù)據(jù)是連續(xù)2年跟蹤測試得到的。
在本文的研究中使用了包含臨床變量值簡易精神狀態(tài)檢查(Mini mental state examination,MMSE)值的fMRI模態(tài)數(shù)據(jù)(總共139個樣本),其中40個正常人(normal control,NC),79個MCI病人(45個EMCI(early MCI)病人和34個LMCI(late MCI)病人),20個AD病人。表1給出了這些受試者的詳細信息。
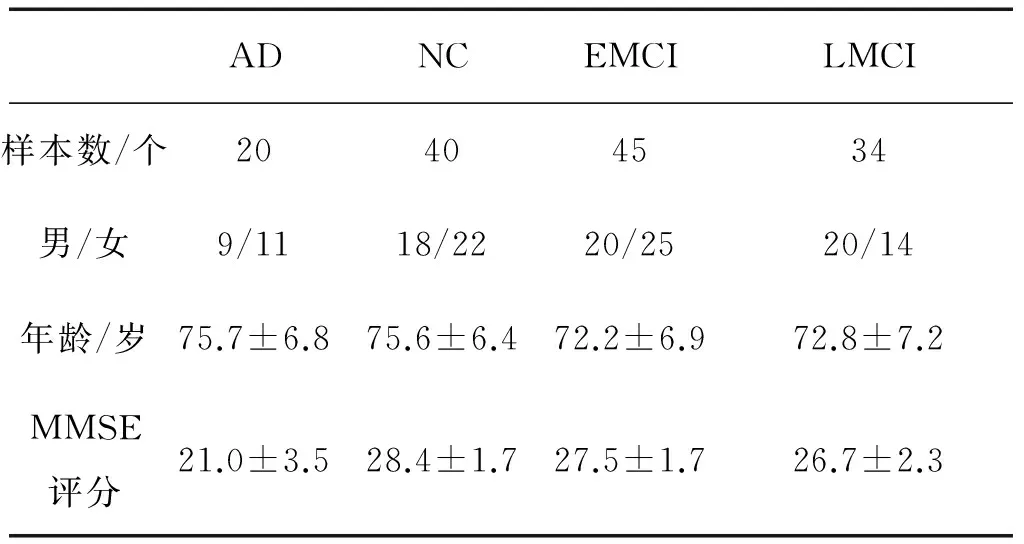
表1 受試者信息統(tǒng)計表
2 數(shù)據(jù)預(yù)處理及特征提取方法
AD/MCI回歸預(yù)測主要分為5個步驟:1)預(yù)處理,通過處理原始的fMRI圖像來構(gòu)建功能連接網(wǎng)絡(luò);2)網(wǎng)絡(luò)節(jié)點特征提取;3)網(wǎng)絡(luò)邊權(quán)重特征的選擇;4)特征融合;5)使用SVR進行回歸預(yù)測。圖1給出了本文的方法框架。
2.1 數(shù)據(jù)預(yù)處理
對采集到的原始數(shù)據(jù),我們使用Data Processing Assistant for Resting-State fMRI (DPARSF)[12]進行切片時間校正(slice timing)、頭動校正(motion correlation)和空間正則化(spatial normalization)等標(biāo)準(zhǔn)預(yù)處理流程。接著每個對象的fMRI圖像所對應(yīng)的腦空間根據(jù)AAL(automated anatomical labeling)模板被分割為90個腦區(qū)(每個腦區(qū)對應(yīng)圖中的一個頂點),計算每個腦區(qū)的平均時間序列以及腦區(qū)間的Pearson 相關(guān)系數(shù)作為腦區(qū)間的連接強度,從而獲得了大腦的功能性連接網(wǎng)絡(luò)。這里,得到了一個90×90維的加權(quán)全連接腦網(wǎng)絡(luò),且該網(wǎng)絡(luò)是一個對角線上為1的對稱矩陣。
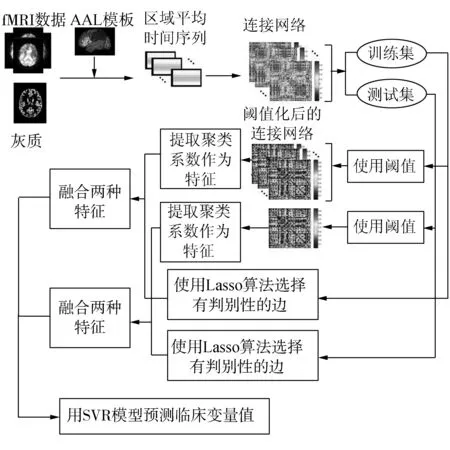
圖1 提出方法的框架Fig.1 The framework of the proposed method
2.2 網(wǎng)絡(luò)節(jié)點特征提取
聚類系數(shù)常被用來作為網(wǎng)絡(luò)的特征[13-14],整個網(wǎng)絡(luò)的聚類系數(shù)定義為各個節(jié)點的聚類系數(shù)的均值,它可以描述網(wǎng)絡(luò)中節(jié)點之間的連接緊密程度。聚類系數(shù)含義清晰,定義簡單,計算量小,因此成為了功能網(wǎng)絡(luò)研究中首選的特征之一。值得注意的是,聚類系數(shù)一般定義在無權(quán)網(wǎng)絡(luò)中,而我們構(gòu)建的功能網(wǎng)絡(luò)是有權(quán)網(wǎng)絡(luò)。因此本文使用閾值化的方法,將有權(quán)的功能網(wǎng)絡(luò)轉(zhuǎn)化為無權(quán)網(wǎng)絡(luò),然后計算無權(quán)網(wǎng)絡(luò)中每個節(jié)點的聚類系數(shù)。這里,閾值的設(shè)置是0和1之間的任意值。
式中n表示感興趣區(qū)域ROI(region of interest)的個數(shù)。
定義2(聚類系數(shù)) 給定一個無權(quán)無向圖G,G中的第i個節(jié)點的聚類系數(shù)計算公式為
式中:ki表示第i個節(jié)點的鄰接點的個數(shù),Ei可由式(3)計算得到
式中:n表示ROI的個數(shù);aij代表第i個節(jié)點和第j個節(jié)點之間的連接強度,經(jīng)過閾值化后,連接強度值為0或者1。
從式(2)可以看出,當(dāng)一個點的鄰接點之間的連接越緊密,聚類系數(shù)的值就越高。在腦疾病患者的功能網(wǎng)絡(luò)中,聚類系數(shù)可以很好地反映單個感興趣區(qū)域的異常。
我們首先使用式(1)將有權(quán)網(wǎng)絡(luò)轉(zhuǎn)化為無權(quán)網(wǎng)絡(luò),接著使用式(2)計算節(jié)點的聚類系數(shù),得到一個節(jié)點的特征矩陣A∈Rn×c,其中n表示樣本個數(shù),c表示節(jié)點特征個數(shù)。
2.3 網(wǎng)絡(luò)邊權(quán)重特征選擇
邊是構(gòu)成整個功能網(wǎng)絡(luò)的重要數(shù)據(jù),反映了不同腦區(qū)之間的連接強度,可以有效地區(qū)別不同類型患者之間的差異。對預(yù)處理得到的加權(quán)全連接腦網(wǎng)絡(luò),將網(wǎng)絡(luò)中的邊權(quán)值取出拉成一個向量。對單個樣本,其腦網(wǎng)絡(luò)維度為90×90維,可以拉成一個90×(90-1)/2=4 005維的向量。
然而,并不是所有的邊都具有判別性,本文使用Lasso算法[15]選擇出具有判別性的邊作為特征。
Lasso是一種基于一范式的特征選擇方法,與已有的特征選擇方法相比,Lasso不僅能夠準(zhǔn)確地選擇出與類相關(guān)的變量,同時還具有特征選擇的穩(wěn)定性。并且經(jīng)驗數(shù)據(jù)表明,當(dāng)有大量不相關(guān)的特征而卻只有少量樣本時Lasso方法非常有效[16]。
Lasso回歸估計稀疏表示系數(shù)w可描述為
將求得的系數(shù)矩陣w中值為0所對應(yīng)的原始數(shù)據(jù)中的特征值去掉。得到了一個經(jīng)過特征選擇后的較低維的特征矩陣B∈Rn×e,其中n表示樣本個數(shù),e表示具有判別性的邊的特征個數(shù)。
2.4 特征融合
研究人員發(fā)現(xiàn)數(shù)據(jù)的不同特征可互為補充,以提高分類預(yù)測性能。可以同時利用數(shù)據(jù)的不同特征來提高分類準(zhǔn)確率。這種融合的方法對于有限的訓(xùn)練樣本尤為有效。可以看出,融合思想是一種綜合分析的思想,因此,對于同一模態(tài)的數(shù)據(jù)的多種特征進行綜合分析、評判和決策處理也是某種意義上的融合方式。對于腦功能網(wǎng)絡(luò)的研究,其所需要的數(shù)據(jù)信息可以從以上提取到的各種特征中,通過融合得出一種貢獻最大、最具有判別性的綜合特征。
在本文的實驗中,將前面提取到的兩種數(shù)據(jù)特征進行線性融合。具體計算如下,設(shè)節(jié)點的特征矩陣為
邊特征矩陣為
則融合后的特征矩陣為
式中:n表示樣本個數(shù);c表示節(jié)點特征個數(shù);e表示邊特征個數(shù)。
2.5 模型訓(xùn)練
對于融合后的特征,使用支持向量回歸機SVR對阿爾茨海默病的臨床變量值MMSE進行回歸預(yù)測。
3 實驗結(jié)果與分析
3.1 實驗設(shè)置
本文的實驗考慮4種回歸問題:AD vs. NC、AD vs. MCI、MCI vs. NC以及EMCI vs. LMCI。為了評估所有比較方法的性能,計算了預(yù)測臨床評分和真實的臨床評分之間的相關(guān)系數(shù)(correlation coefficient,CC)和均方根誤差(root mean squared error,RMSE)。相關(guān)系數(shù)越大說明預(yù)測值和真實值這兩組數(shù)據(jù)之間相關(guān)性越強。均方根誤差越小說明預(yù)測模型越能更好地描述實驗數(shù)據(jù)。
本文比較的所有方法均采用留一法進行交叉驗證。具體而言,在每次的實驗中,選取一個樣本作為測試樣本,其余樣本作為訓(xùn)練樣本。計算出的預(yù)測值組成的預(yù)測向量和原始標(biāo)簽向量做相關(guān)分析,來衡量該模型的性能。
在使用Lasso做特征選擇的過程中,本文使用穩(wěn)定性特征選擇算法[17]來避免過擬合。穩(wěn)定性選擇是一種基于二次抽樣和選擇算法相結(jié)合較新的方法,它的主要思想是在不同的數(shù)據(jù)子集和特征子集上運行特征選擇算法,不斷地重復(fù),最終匯總特征選擇結(jié)果。
在本文的實驗中,采用網(wǎng)格搜索的方法來確定最優(yōu)的聚類系數(shù)閾值和Lasso模型中的一范數(shù)參數(shù)。
3.2 比較方法
本文選取如下的方法進行比較。
基于原始特征的方法:使用沒有經(jīng)過任何特征選擇的腦網(wǎng)絡(luò)數(shù)據(jù),作為基線方法。
基于邊特征的方法:只使用腦網(wǎng)絡(luò)中的邊權(quán)重,選擇出具有判別性的特征,本文的實驗中使用Lasso算法做特征選擇。
基于節(jié)點特征的方法:只使用腦網(wǎng)絡(luò)中節(jié)點的聚類系數(shù)。
3.3 實驗結(jié)果
本文通過對臨床變量值MMSE的估計來評估回歸性能。在表2、圖2、圖3中顯示了比較方法計算得到的CC和RMSE的值。從表2中可以看到?jīng)]有經(jīng)過特征選擇、特征提取的原始數(shù)據(jù)的回歸性能最不好,這說明特征的選擇和提取對于之后的模式識別有著至關(guān)重要的影響。此外,本文所提出的融合多特征的方法在任意一組對照實驗中均優(yōu)于單一特征的方法。可以看到各個方法對于MMSE這一臨床評分的預(yù)測性能,在AD vs. NC中,使用本文方法,計算得到的CC達到了0.692 2,RMSE為3.097 2。而單一特征CC值最高達到了0.618 9,RMSE最小的為3.378 0。在AD vs. MCI中,本文方法計算得到的CC值達到了0.623 3,RMSE值為2.776 7。而單一特征CC值最高達到了0.549 3,RMSE最小的為3.024 1。本文提出的方法在MCI vs. NC 和EMCI vs. LMCI實驗中同樣獲得了好的預(yù)測結(jié)果。

圖2 不同方法的相關(guān)系數(shù)Fig.2 The correlation coefficient of the competing methods
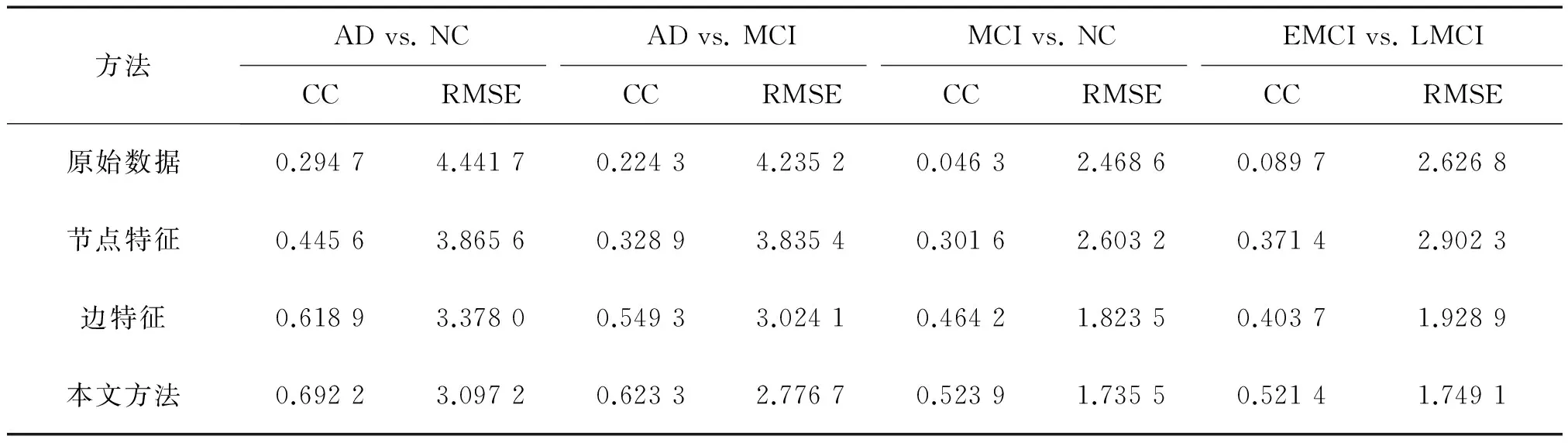
方法ADvs.NCADvs.MCIMCIvs.NCEMCIvs.LMCICCRMSECCRMSECCRMSECCRMSE原始數(shù)據(jù)0.29474.44170.22434.23520.04632.46860.08972.6268節(jié)點特征0.44563.86560.32893.83540.30162.60320.37142.9023邊特征0.61893.37800.54933.02410.46421.82350.40371.9289本文方法0.69223.09720.62332.77670.52391.73550.52141.7491

注:每幅圖上面的為AD vs. NC,下面的為MCI vs. NC圖3 使用不同方法獲得的散點圖和相關(guān)系數(shù)Fig.3 Scatter plots and the respective correlation coefficients obtained by the competing methods
圖2的柱狀圖更加直觀地顯示了所提出的融合多特征的方法優(yōu)于單一特征的方法。圖3繪制的散點圖顯示了不同特征在不同的回歸問題上所表現(xiàn)出的不同性能。
表2、圖2、圖3還表明,本文方法在AD和NC這一對照實驗中,有著更好的回歸性能。這種情況說明患者和正常人的腦功能網(wǎng)絡(luò)特征存在明顯的差異,這使得模式識別過程更加容易。同時也說明了該類腦疾病的發(fā)作會影響其腦連接網(wǎng)絡(luò)的結(jié)構(gòu),與前人的研究結(jié)果相符合。
3.4 最具判別性的腦區(qū)
本文還研究了所使用的特征選擇方法挑選出的最具判別性的腦區(qū)。因為在每次進行交叉驗證時,所用的訓(xùn)練集不同導(dǎo)致選擇出的邊也不完全相同。因此,我們選擇在所有交叉驗證中出現(xiàn)頻率最高的特征作為最具有判別力的特征。表3給出了在MCI vs. NC實驗中出現(xiàn)頻率最高的10個腦區(qū)。圖4在一個大腦模板空間中畫出了在MCI vs. NC實驗中的10個最具有判別性的腦區(qū)。從表3中可以看出,大部分選擇腦區(qū)和以前研究人員使用組分析方法研究的結(jié)果是一致的。特別是一些腦如杏仁核(Amygdala)、海馬旁回(ParaHippocampus)和顳前葉(Precuneus)等已被廣泛認為可能與AD是相關(guān)的[18-23]。本文結(jié)果和前人研究結(jié)果是一致的,這也表明提出的方法能夠發(fā)現(xiàn)與疾病相關(guān)的大腦區(qū)域從而輔助治療。
表3 MCI vs. NC實驗中出現(xiàn)頻率最高的10個腦區(qū)名稱
Table 3 The name of top 10 selected brain regions in MCI vs. NC
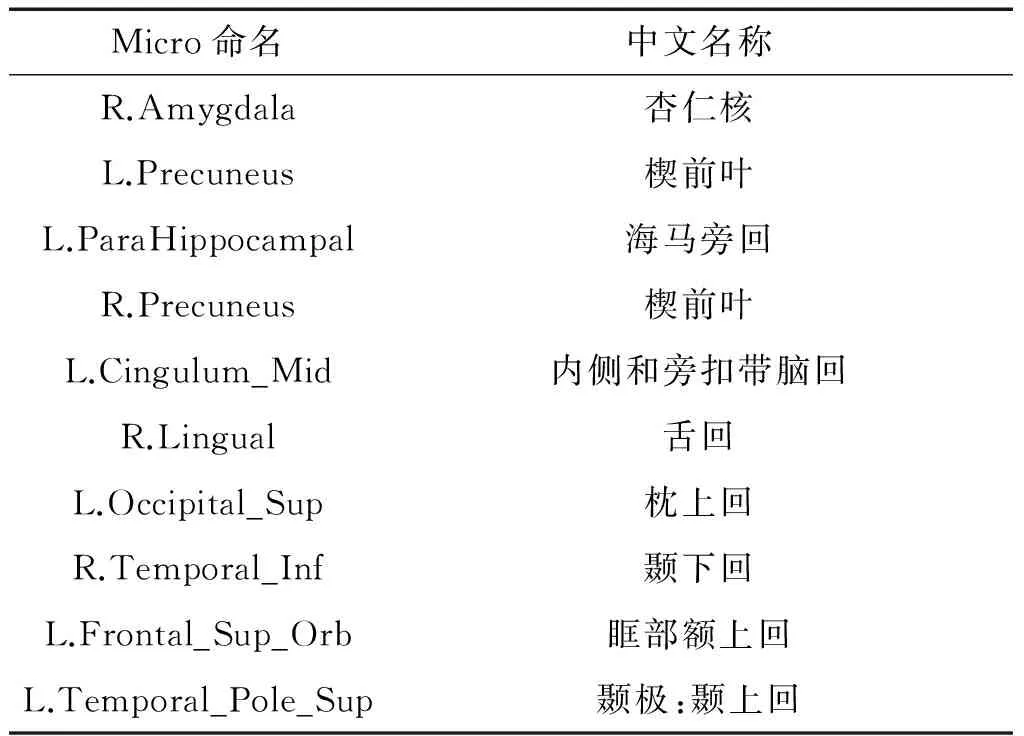
Micro命名中文名稱R.Amygdala杏仁核L.Precuneus楔前葉L.ParaHippocampal海馬旁回R.Precuneus楔前葉L.Cingulum_Mid內(nèi)側(cè)和旁扣帶腦回R.Lingual舌回L.Occipital_Sup枕上回R.Temporal_Inf顳下回L.Frontal_Sup_Orb眶部額上回L.Temporal_Pole_Sup顳極:顳上回
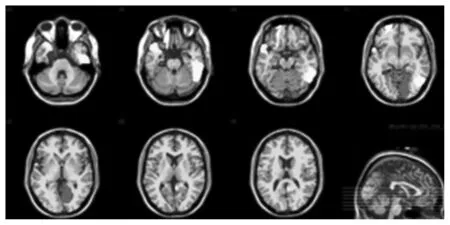
圖4 MCI vs. NC實驗中出現(xiàn)頻率最高的10個腦區(qū)Fig.4 Top 10 selected brain regions in MCI vs. NC
4 結(jié)束語
本文提出了一種基于腦連接網(wǎng)絡(luò)的方法,用于預(yù)測AD臨床變量值,其中選擇點的聚類系數(shù)和邊的權(quán)重作為特征。通過對不同類型特征的融合,大大提高了預(yù)測的性能。從本文的實驗中可以發(fā)現(xiàn),在腦疾病的回歸問題上,腦功能連接網(wǎng)絡(luò)模態(tài)也有較好的回歸性能;多個特征融合的使用優(yōu)于單一特征的使用。
然而本文更多的是為了證明腦功能連接網(wǎng)絡(luò)的數(shù)據(jù)信息能夠用來預(yù)測臨床評分這一問題。在特征提取和特征選擇上運用了研究中較為普遍的算法。今后的工作中將嘗試對現(xiàn)有的特征選擇、特征提取算法有針對性地加以改進,使得模型能夠更好地挖掘腦網(wǎng)絡(luò)信息,增強模型的預(yù)測能力,從而輔助醫(yī)生的診斷。
[1]BROOKMEYER R, JOHNSON E, ZIEGLER-GRAHAM K, et al. Forecasting the global burden of Alzheimer’s disease[J]. Alzheimers and dementia, 2007, 3(3): 186-91.
[2]FAN Yong, RAO Hengyi, HURT H, et al. Multivariate examination of brain abnormality using both structural and functional MRI[J]. NeuroImage, 2007, 36(4): 1189-1199.
[3]PETERSEN R C, DOODY R, KURZ A, et al. Current concepts in mild cognitive impairment[J]. Archives of neurology, 2001, 58(12): 1985-1992.
[4]PETERSEN R C, SMITH G E, WARING S C, et al. Mild cognitive impairment: clinical characterization and outcome[J]. Archives of neurology, 1999, 56(3): 303-308.
[5]CHENG Bo, ZHANG Daoqiang, CHEN Songcan, et al. Semi-supervised multimodal relevance vector regression improves cognitive performance estimation from imaging and biological biomarkers[J]. Neuroinformatics, 2013, 11(3): 339-353.
[6]ZHANG Daoqiang, SHEN Dinggang, Alzheimer’s Disease Neuroimaging Initiative. Multi-modal multi-task learning for joint prediction of multiple regression and classification variables in alzheimer’s disease[J]. NeuroImage, 2012, 59(2): 895-907.
[7]ZHU Xiaofeng, SUK H I, SHEN Dinggang. A novel matrix-similarity based loss function for joint regression and classification in AD diagnosis[J]. NeuroImage, 2014, 100: 91-105.
[8]Wee C Y, Yap P T, Li Wenbin, et al. Enriched white matter connectivity networks for accurate identification of MCI patients[J]. NeuroImage, 2011, 54(3): 1812-1822.
[9]CHEN Gang, WARD B D, XIE Chunming, et al. Classification of Alzheimer disease, mild cognitive impairment, and normal cognitive status with large-scale network analysis based on resting-state functional MR imaging[J]. Radiology, 2011, 259(1): 213-221.
[10]WANG Jinhui, ZUO Xinian, DAI Zhengrui, et al. Disrupted functional brain connectome in individuals at risk for Alzheimer’s disease[J]. Biological psychiatry, 2013, 73(5): 472-481.
[11]JIE Biao, ZHANG Daoqiang, WEE C Y, et al. Topological graph kernel on multiple thresholded functional connectivity networks for mild cognitive impairment classification[J]. Human brain mapping, 2014, 35(7): 2876-2897.
[12]WEE C Y, YAP P T, ZHANG Daoqiang, et al. Identification of MCI individuals using structural and functional connectivity networks[J]. NeuroImage, 2012, 59(3): 2045-2056.
[13]YAN Chaogan, FENG Yufeng. DPARSF: a MATLAB toolbox for “pipeline” data analysis of resting-state fMRI[J]. Frontiers in systems neuroscience, 2010, 4: 13.
[14]ZANIN M, SOUSA P, PAPO D, et al. Optimizing functional network representation of multivariate time series[J]. Scientific reports, 2012, 2: 630.
[15]TIBSHIRANI R. Regression shrinkage and selection via the lasso[J]. Journal of the royal statistical society, 1996, 58(1): 267-288.
[16]NG A Y. Feature selection,L1, vs.L2, regularization, and rotational invariance[C]//Proceedings of the twenty-first International Conference on Machine Learning. New York, NY: ACM, 2004.
[17]MEINSHAUSEN N, BüHLMANN P. Stability selection[J]. Journal of the royal statistical society, 2010, 72(4): 417-473.
[18]WOLF H, JELIC V, GERTZ H J, et al. A critical discussion of the role of neuroimaging in mild cognitive impairment[J]. Acta neurologica scandinavica supplementum, 2003, 107(S179): 52-76.
[19]POULIN S P, DAUTOFF R, MORRIS J C, et al. Amygdala atrophy is prominent in early Alzheimer’s disease and relates to symptom severity[J]. Psychiatry research: neuroimaging, 2011, 194(1): 7-13.
[20]SOLODKIN A, CHEN E E, VAN HOESEN G W, et al. In vivo parahippocampal white matter pathology as a biomarker of disease progression to Alzheimer’s disease[J]. Journal of comparative neurology, 2013, 521(18): 4300-4317.
[21]DERFLINGER S, SORG C, GASER C, et al. Grey-matter atrophy in Alzheimer’s disease is asymmetric but not lateralized[J]. Journal of Alzheimer’s disease: JAD, 2011, 25(2): 347-357.
[22]DAI Zhengjia, YAN Chaogan, LI Kuncheng, et al. Identifying and mapping connectivity patterns of brain network hubs in Alzheimer’s disease[J]. Cerebral cortex, 2015, 25(10): 3723-3742.
[23]HU Chenghui, JU Ronghui, SHEN Yusong, et al. Clinical decision support for Alzheimer’s disease based on deep learning and brain network[C]//Proceedings of 2016 IEEE International Conference on Communications. Kuala Lumpur: IEEE, 2016: 1-6.
Prediction of clinical variables in Alzheimer’s diseaseusing brain connective networks
LU Zixiang,TU Liyang,ZU Chen,ZHANG Daoqiang
(College of Computer Science and Technology, Nanjing University of Aeronautics and Astronautics, Nanjing 211106, China)
Brain functional connectivity networks have been widely used for diagnosing brain diseases. However, a traditional brain network based on classification methods cannot assess the stage or predict the development of the disease. Recent studies show that the values of the clinical variables of brain disease can effectively help doctors evaluate the disease. In this study, a novel brain-connectivity-network-based method was proposed for estimating the values of the clinical variables of Alzheimer’s disease. First, the functional connectivity network was extracted from the brain images. Then, LASSO , which is a regression analysis method, was adopted for feature selection and elimination of redundant features; the clustering coefficients and edge weights of the network were fused as features. Finally, support vector machine regression was used to predict the values of the clinical variables. The proposed method was validated on the ADNI dataset, and the experimental results demonstrate that the proposed method can accurately predict the values of clinical variables and verify the effectiveness of the fusion of multiple features.
brain function; feature selection; feature extraction; feature fusion; network analysis; regression analysis; Alzheimer’s disease; medical image
10.11992/tis. 201607020
http://kns.cnki.net/kcms/detail/23.1538.TP.20170404.1218.006.html
2016-07-23. 網(wǎng)絡(luò)出版日期:2017-04-04.
國家自然科學(xué)基金項目(61422204,61473149);江蘇省杰出青年基金項目(BK20130034);高等學(xué)校博士學(xué)科點專項科研基金課題(20123218110009);南京航空航天大學(xué)基本科研業(yè)務(wù)費項目(NE2013105).
張道強. E-mail:dqzhang@nuaa.edu.cn.
TP181
A
1673-4785(2017)03-0355-07

路子祥,女,1992年生,碩士研究生,主要研究方向為數(shù)據(jù)挖掘、模式識別與圖像處理。

屠黎陽,男,1992年生,碩士研究生,主要研究方向為數(shù)據(jù)挖掘、模式識別與醫(yī)學(xué)圖像處理。

張道強,男,1978年生,教授,博士生導(dǎo)師,主要研究方向為機器學(xué)習(xí)、模式識別與醫(yī)學(xué)圖像分析。

