例析近年高考中焓變的命題角度
浙江 李大艷
例析近年高考中焓變的命題角度
浙江 李大艷
化學反應中的熱效應一直是高考考查的熱點和重點。其中有關焓變的考查更是能量命題的核心內容。
何謂焓變?在恒溫恒壓條件下,化學反應過程中吸收或釋放的熱量稱為反應的焓變,用ΔH表示,單位常采用kJ·mol-1。吸收熱量的反應,其ΔH>0,放出熱量的反應,其ΔH<0。下面將結合近3年高考題中有關焓變的試題從以下兩個大方面分類例析。
一、焓變(ΔH)正負的判斷(即反應是吸熱反應還是放熱反應)
角度一:根據反應特點進行判斷
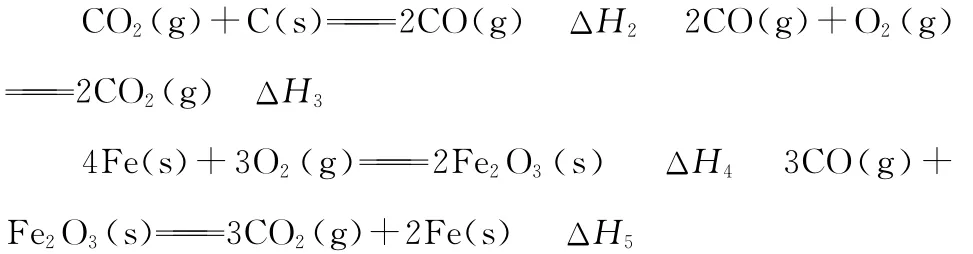
下列關于上述反應焓變的判斷正確的是 ( )
A.ΔH1>0,ΔH3<0
B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4+ΔH5
【解析】根據反應特點,碳燃燒放熱,故ΔH1<0;二氧化碳和碳反應吸熱,故ΔH2>0;CO燃燒反應放熱,故ΔH3<0;鐵和氧氣反應放熱,故ΔH4<0;CO還原氧化鐵反應吸熱,故ΔH5>0;故A、B選項錯誤。C、D選項考查蓋斯定律的應用,此處暫不展開。本題答案為C。
【知識要點】根據反應的特點歸納出常見的放熱反應和吸熱反應。
常見的放熱反應:①可燃物的燃燒;②酸堿中和反應;③大多數化合反應;④金屬跟酸的置換反應;⑤物質的緩慢氧化;⑥鋁熱反應等。
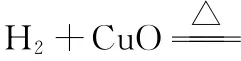
角度二:根據反應物和生成物具備的能量判斷
例2 (2016海南,11)由反應物X轉化為Y和Z的能量變化如圖所示。下列說法正確的是 ( )

A.由X→Y反應的ΔH=E5-E2
B.由X→Z反應的ΔH<0
C.降低壓強有利于提高Y的產率
D.升高溫度有利于提高Z的產率
【解析】A選項,由圖可知,反應物的總能量為E2,生成物的總能量為E3,所以由X→Y反應的ΔH=E3-E2,故A選項錯誤;B選項,由圖可知,反應物的總能量高于生成物的總能量,由X→Z反應是放熱反應,ΔH<0,故B選項正確;C、D選項考查平衡的移動,此處暫不展開。本題答案為B和C。
【知識要點】一個確定的化學反應在發生過程中是吸收能量還是放出能量,決定于反應物總能量與生成物總能量的相對大小,若反應物的總能量大于生成物的總能量,該反應放熱,ΔH<0;若反應物的總能量小于生成物的總能量,該反應吸熱,ΔH>0。
角度三:根據化學反應的本質(化學鍵斷裂和形成時吸收或釋放的能量)判斷
例3 (2016海南,6節選)順-1,2-二甲基環丙烷和反-1,2-二甲基環丙烷可發生如下轉化:

已知:t1溫度下,該反應的活化能Ea(正)小于Ea(逆),則ΔH________(填“小于”“等于”或“大于”)0。
【解析】該反應的活化能Ea(正)小于Ea(逆),說明舊鍵斷裂吸收的能量比新鍵形成放出的能量要少,說明反應是放熱反應,故ΔH小于0。本題答案:小于。
【知識要點】當物質發生化學反應時,斷開反應物中的化學鍵(即舊鍵的斷裂)要吸收能量,而形成生成物中的化學鍵(新鍵的形成)要釋放能量,當舊鍵斷裂吸收的能量高于新鍵形成放出的能量,反應為吸熱反應,ΔH>0;當舊鍵斷裂吸收的能量低于新鍵形成放出的能量,反應為放熱反應,ΔH<0。
角度四:根據平衡移動原理進行判斷

①用離子方程式表示Na2CrO4溶液中的轉化反應:____________________。
【知識要點】根據平衡移動原理,其他條件不變的情況下,升高溫度,化學平衡向吸熱反應方向移動;降低溫度,化學平衡向放熱反應方向移動。故升高溫度,若平衡正移,則正反應是吸熱反應,若平衡逆移,則逆反應是吸熱反應;降低溫度,若平衡正移,則正反應是放熱反應,若平衡逆移,則逆反應是放熱反應。
化學平衡常數的數值隨溫度的改變而改變,但其改變趨勢與反應本身是吸熱反應,還是放熱反應有關。若升高溫度,某反應的化學平衡常數變大,則該反應是吸熱反應,反之則是放熱反應;若降低溫度,某反應的化學平衡常數變大,則該反應是放熱反應,反之則是吸熱反應。
角度五:根據反應能否自發進行判斷
例5 (2016天津,10節選)氫氣可用于制備H2O2。
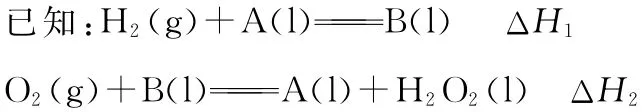
其中A、B為有機物,兩反應均為自發反應,則H2(g)+O2(g)=H2O2(l)的ΔH________(填“>”“<”或“=”)0。
【知識要點】判斷化學反應方向的綜合判據ΔG=ΔHTΔS,若ΔG=ΔH-TΔS<0,反應能自發進行,若ΔG=ΔH-TΔS=0,反應達到平衡狀態,若ΔG=ΔH-TΔS>0,反應不能自發進行。
①ΔH<0,ΔS>0的反應一定能自發進行;
③ΔH和ΔS的作用相反,且相差不大時,溫度對反應的方向起決定性作用。當ΔH<0,ΔS<0時低溫下反應能自發進行;當ΔH>0,ΔS>0時,高溫下反應能自發進行。
二、焓變(ΔH)的計算
角度一:利用蓋斯定律計算
例6 (2016新課標Ⅱ,26節選)聯氨(又稱聯肼,N2H4,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料。
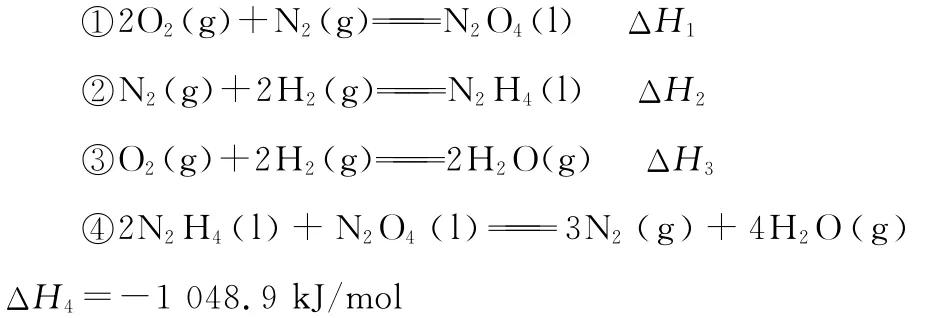
上述反應熱效應之間的關系式為ΔH4=________。
【知識要點】蓋斯定律:一個化學反應,無論是一步完成,還是分幾步完成,其總的熱效應是完全相同的。
蓋斯定律表明,一個化學反應的焓變只與反應體系的起始狀態和最終狀態有關,與反應的途徑無關。
在城市軌道交通線路實際運營中,經常會發生由于屏蔽門處站臺絕緣帶絕緣不佳或車站結構滲漏水造成屏蔽門與車站主體結構接觸,從而導致屏蔽門打火的情況[8],為了快速消除此打火現象,運營維護人員經常通過常閉車站鋼軌電位限制裝置來解決。看似該故障已經得到了解決,實際上并沒有真正找到造成打火的根本原因。由于常閉車站鋼軌電位限制裝置使得鋼軌長期接地,在某種程度上導致雜散電流的增多[9]。
蓋斯定律的常見用法:
(1)方程式加減法
已知焓變的幾個熱化學方程式,通過一定倍數的相加或相減,得到未知焓變的熱化學方程式,則相應的焓變做相同的加減處理即可求得該未知熱化學方程式的焓變。
(2)“虛擬路徑”法
若反應物A變為生成物D,可以有兩個途徑:
①由A直接變成D,反應熱為ΔH;
②由A變成B,B變成C,再由C變成D,每步的反應熱分別為ΔH1、ΔH2、ΔH3。
如圖所示:
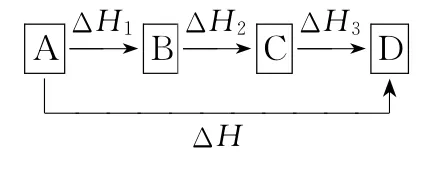
則有ΔH=ΔH1+ΔH2+ΔH3。
角度二:利用鍵能計算
例7 (2015浙江,28)乙苯催化脫氫制苯乙烯反應:
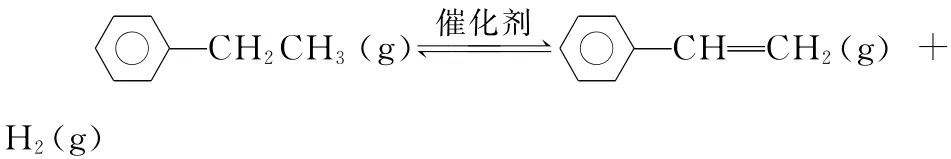
(1)已知:
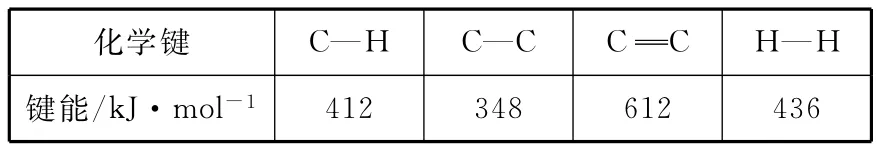
_____化學鍵 C—H C— C C C H—H_鍵能/k J·mol-14 1 2 3 4 8 6 1 2 4 3 6__
計算上述反應的ΔH=________kJ·mol-1。
【解析】ΔH=反應物的總鍵能-生成物的總鍵能。
反應物的總鍵能=苯環的鍵能總和+5個C—H鍵能+1個C—C鍵能
ΔH=412kJ·mol-1×5+348kJ·mol-1-412kJ·mol-1×3-612kJ·mol-1-436kJ·mol-1=124kJ·mol-1。本題答案為124。
【知識要點】從鍵能的角度計算:ΔH=反應物的總鍵能-生成物的總鍵能。
提醒:要分析清楚物質中每種的化學鍵的數目。
角度三:利用物質具備的能量計算
例8 (2014福建,23節選)一定條件,在水溶液中1mol Cl-、Cl(x=1,2,3,4)的能量(kJ)相對大小如下圖所示。
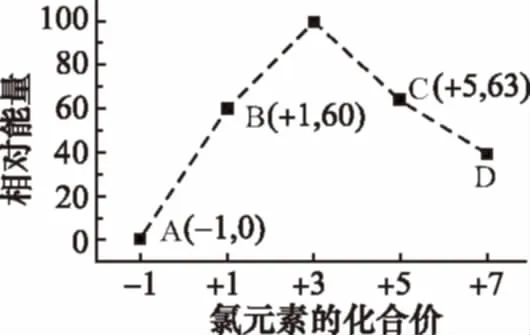
①D是_______________(填離子符號)。
②B→A+C反應的熱化學方程式為___________(用離子符號表示)。
【解析】①根據圖象可知,D中Cl元素化合價為+7價,所以Cl中x為4,則D為Cl;②根據氯元素的化合價可知,則B→A+C的方程式為,水溶液中的反應,狀態為aq,反應放出的熱量為63+2×0-3×60=117kJ,反應的焓變為-117kJ/mol。本題答案為①ClCl(aq)+2Cl-(aq)ΔH=-117kJ·mol-1。
【知識要點】從物質具備的能量角度計算:ΔH=生成物的總能量-反應物的總能量。
角度四:利用反應的熱量變化計算
例9 (2014安徽,26節選)CuCl(s)與O2反應生成CuCl2(s)和一種黑色固體。在25℃、101k Pa下,已知該反應每消耗1mol CuCl(s),放出44.4kJ熱量,該反應的熱化學方程式是___________________。
【解析】由CuCl(s)與O2反應生成CuCl2(s)和一種黑色固體,根據原子個數守恒和質量守恒,寫出化學方程式,該反應每消耗1mol CuCl(s),放熱44.4kJ,消耗4mol CuCl(s),則放熱44.4kJ×4=177.6kJ,故本題答案為4CuCl(s)+
【知識要點】焓變的計算常常與熱化學方程式的書寫結合考查。
熱化學方程式是能表示反應熱的化學方程式,不僅表明了化學反應中的物質變化,也表明了化學反應中的能量變化。在書寫時要注意:①應注明反應物、生成物的聚集狀態,一般用g表示氣體、l表示液體、s表示固體,aq表示水溶液。②應注明反應時的溫度和壓強(25℃、101k Pa時,可以不注明)。③熱化學方程式中化學計量數只表示該物質的物質的量,不表示物質分子個數或原子個數,因此,它可以是整數,也可以是分數。④ΔH只能寫在化學方程式的右邊,若為放熱反應,則ΔH為“-”;若為吸熱反應,則ΔH為“+”。其單位一般為kJ/mol或kJ·mol—1。對于同一反應,計量數不同,其ΔH數值不同。
(作者單位:浙江省紹興市魯迅中學)

