考前押題卷(二)
河南 陳 飛(特級教師)
考前押題卷(二)
河南 陳 飛(特級教師)
第Ⅰ卷(選擇題 共42分)
一、選擇題:本題共7小題,每小題6分,在每小題給出的四個選項中,只有一項是符合題目要求的。
7.(原創題)化學與生活、社會密切相關。下列說法正確的是( )
A.聚乙烯塑料的老化是由于發生了加成反應
B.煤經過氣化和液化等物理變化可以轉化為清潔燃料
C.鐵在潮濕的空氣中放置,易發生化學腐蝕而生銹
D.華商科學家高琨在光纖傳輸信息領域中取得突破性成就,光纖的主要成分是高純度的二氧化硅
8.(改編題)NA表示阿伏加德羅常數,下列敘述正確的是( )
A.電解法精煉銅(粗銅含鐵、鋅、銀、金雜質),陰極析出1mol Cu,陽極失去的電子數小于2 NA

C.64g SO2與足量的O2在一定條件下反應生成的SO3分子數為NA
D.在標準狀況下,2.24LNH3通入足量的水中形成氨水,NH+4數小于0.1 NA
9.(原創題)下列關于有機化合物的敘述正確的是( )
A.有機物CH2CHCH2CH2CH3和氫氣加成后的產物的二氯取代物有8種
C.乙烯使溴水褪色與苯與溴水混合振蕩后水層變為無色原理相同
D.CH2Cl2是純凈物說明甲烷是正四面體形結構而不是平面正方形結構
A.9種B.10種
C.11種D.12種
11.(改編題)下圖是鋰-空氣電池放電和充電時的工作示意圖。下列說法正確的是( )

A.該電池放電時,圖中電極a是正極,c為負極
B.該電池放電時,水性電解質pH不變
C.當給該鋰-空氣電池充電時,c極應接電源的負極
12.(改編題)下列實驗操作、現象、解釋和結論正確的是( )

實驗操作實驗現象解釋和結論白色沉淀為氯化銀,A在稀硝酸銀溶液中加入少量0.1mol/L NaCl溶液,再加入1mol/L NaBr溶液先出現白色沉淀,后出現黃色沉淀黃色沉淀為溴化銀說明氯氣和二氧化B分別向含酚酞的燒堿溶液中通入氯氣、二氧化硫氣體溶液顏色都變淺硫都有漂白性C向濃碘水中加入乙苯,振蕩、靜置液體分層,上層為紫紅色,下層幾乎無色說明乙苯的密度小于水的密度;乙苯難溶于水,I2易溶于乙苯說明該有機物一定D向某有機物溶液中加入鈉產生氣泡含有羧基
13.(改編題)短周期元素W、X、Y、Z的原子序數依次增大,其中Y與Z為金屬元素,四種元素的簡單離子的電子層結構相同。p、q是它們中的部分元素組成的化合物,r是W的單質,s是Z的單質。這些物質間的轉化關系如圖所示。下列說法不正確的是( )

A.離子半徑:W>X>Y>Z
B.p可以和強堿溶液發生離子反應
C.p和q均屬于供價化合物
D.X離子和Z離子均能促進水的電離
第Ⅱ卷(非選擇題 共58分)
二、非選擇題:包括必考題和選考題兩部分。第26~28題為必考題,每個試題考生都必須作答。第35、36題為選考題,考生根據要求作答。
(一)必考題(包括3小題,共43分)
26.(改編題)(14分)氯氣用于自來水的殺菌消毒,但在消毒時會產生一些負面影響,因此人們開始研究一些新型自來水消毒劑。某學習小組查閱資料發現NCl3可作為殺菌消毒劑,該小組利用下圖所示的裝置制備NCl3,并探究NCl3的漂白性。NCl3的相關性質如下:

回答下列問題:
(1)氯氣用于自來水的殺菌消毒,其原理是__________。
(2)根據實驗目的,按氣流方向用圖中數字表示接口連接的順序為1→4、5→________。
(3)儀器a的名稱是________;A裝置中發生反應的化學方程式為___________________________________________。
(4)B中的試劑為________;F中反應的離子方程式為_____________________。
(5)C裝置中發生反應的化學方程式為_____________________,當C裝置蒸餾燒瓶中出現較多油狀液體后,關閉接口2處的活塞,控制水浴加熱的溫度為________,冷凝管的冷卻水的進口是________(填“b”或“c”)。
(6)當E裝置的錐形瓶內有黃色油狀液體出現時,用干燥、潔凈的玻璃棒蘸取該液體滴到干燥的紅色石蕊試紙上,不褪色;若取該液體滴入熱水中,片刻后取該熱水再滴到干燥的紅色石蕊試紙上,先變藍后褪色,寫出該油狀液體與熱水反應的化學方程式:_________________________________。
27.(14分)銀銅合金廣泛用于航空工業。從切割廢料中回收銀并制備銅化工產品的工藝如下圖:

(1)電解精練銀時,陰極反應式為_________________;濾渣A與稀HNO3反應,產生的氣體在空氣中迅速變為紅棕色,該紅棕色氣體與水反應的化學方程式為___________。
(2)固體混合物B的組成為________;在生成固體B的過程中,必須控制NaOH的加入量,若NaOH過量,則因過量引起的反應的離子方程式為________________________。
(3)煅燒過程中生成的氧化產物與NH3在催化劑條件下反應的化學方程式為_________________。這個反應中會有白煙產生,該白煙為_________________________________。
(4)若銀銅合金中銅的質量分數為64%,理論上3.0kg廢料中的銅可完全轉化為________mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液________L。
28.(改編題)(15分)甲醇是重要的化工原料和清潔液體燃料。工業上可利用CO或CO2來生產甲醇。甲醇制備的相關信息如下表:
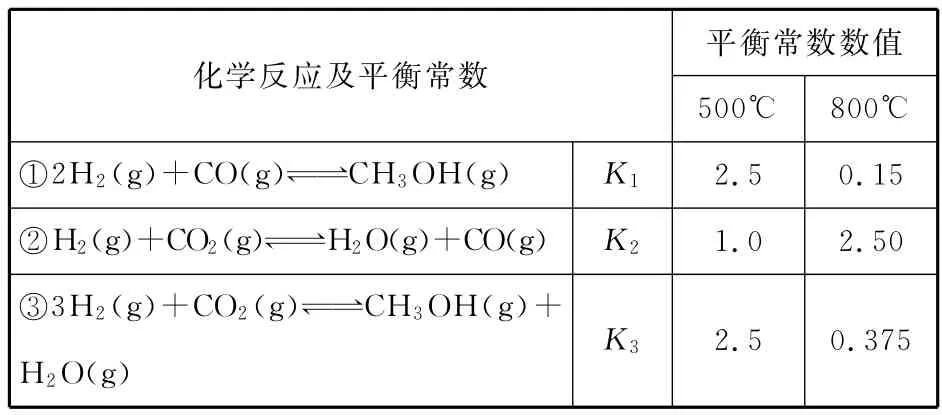
__平衡常數數值化學反應及平衡常數_____________________________________________500℃800℃①2H2(g)+CO(g)CH3OH(g)K1______2.5 0.15_②H2(g)+CO2(g)H2O(g)+CO(g)K2______1.0 2.50_③3H2(g)+CO2(g)CH3OH(g)+H2O(g)K32.5 0.375
(1)反應②是________(填“吸熱”或“放熱”)反應。
(2)據上表信息推導出K1、K2與K3之間的關系,K3=________(用K1、K2表示)。500℃時測得反應③在某時刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的濃度(mol/L)分別為0.8、0.1、0.3、0.15,此時v正_______________(填“>”“<”或“=”)v逆。
(3)若某溫度下反應①從開始到平衡CO和CH3OH的濃度變化如圖一所示,則用H2濃度變化表示此段時間內該反應的平均速率v(H2)=________;若某溫度下反應①中H2的平衡轉化率(α)與體系總壓強(p)的關系如圖二所示,則平衡狀態由A變到B時,平衡常數KA_______________(填“>”“<”或“=”)KB。

(4)一定溫度下,在體積固定的密閉容器中發生反應②,可判斷該反應已經達到平衡的是________。(用相應字母表示)
A.容器中總壓強不變
B.混合氣體的平均摩爾質量不變
C.混合氣體的密度不變
D.CO2(g)或CO(g)的濃度不變
(5)一定條件下甲醇與一氧化碳反應可合成醋酸。室溫下,將amol/L醋酸溶液與b mol/L NaOH溶液等體積混合。若溶液顯中性,則a________(填“>”“<”或“=”)b。若c(Na+)<c(CH3COO-),則溶液顯_________(填“酸”“堿”或“中”)性。
(二)選考題(15分。請考生從給出的兩道小題中任選一題作答。如果多做,則按所做的第一小題計分)
35.[化學—選修3:物質結構與性質](15分)
元素周期表是研究元素原子結構及性質的重要工具。現有X、Y和Z三種元素,其原子序數依次減小。X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一價離子也可形成負一價離子。請回答下列問題:
(1)Y元素原子的價層電子的軌道表示式為________,該元素的名稱是________;
(2)在X與Z形成的化合物XZ3中,X的雜化類型是______________,該化合物的空間構型為________;短周期元素形成的化合物中與XZ3互為等電子體的是________。
(3)請寫出X的兩種含氧酸的化學式:______________、______________,其中酸性較強的是________。
(4)Q與Z同主族。Q單質的晶胞如下圖所示,若設該晶胞的密度為ag/cm3,阿伏加德羅常數為NA,Q原子的摩爾質量為M,則表示Q原子半徑的計算式為___________________。
36.[化學—選修5:有機化學基礎](改編題)(15分)
制備液晶材料時經常用到有機物I,有機物I可以用E和H在一定條件下合成:

①A為丁醇且核磁共振氫譜有2種不同化學環境的氫
③一個碳原子上連有兩個羥基不穩定,易脫水形成羰基
請根據以下信息完成下列問題:
(1)B的結構簡式為_________________;D中含的官能團名稱是________________。
(2)A→B的反應類型為__________________;G→H的反應類型為_________________。
(3)芳香族化合物F的分子式為C7H8O,苯環上的一氯代物只有兩種,則F的結構簡式為_____________________。
(4)E與H反應生成I的化學方程式為_____________。
(5)K的相對分子質量比I小28。K的結構中能同時滿足如下條件:①K和I具有相同的官能團;②苯環上只有兩個取代基;③分子中不含甲基。則K共有________種同分異構體(不考慮立體異構)。試寫出上述同分異構體中任意一種消耗NaOH最多的有機物結構簡式:_____________。
寫出以甲醛和乙醛為原料合成CH3COOCH2COCl的路線流程圖(無機試劑任選)。
________________________________________________。
參考答案及解題提示
7.D 【解析】A項,聚乙烯已經不存在雙鍵,不能加成,錯誤;B項,煤的氣化和液化過程中包含比較復雜的化學變化,錯誤;C項,鐵在潮濕的空氣中放置,主要發生電化學腐蝕而生銹,錯誤;D項,光纖的主要成分為高純度二氧化硅,正確。

10.B 【解析】依題意,M的同分異構體不包括本身,且含有羥基、羧基和六元環,環上同一個碳原子上不連接兩個取代基。環上有三個取代基為甲基、羥基和羧基。先寫兩個取代基的同分異構體(鄰、間、對三種),然后再用羧基取代環上一個氫原子,分別得到2種、4種、4種同分異構體,符合條件的同分異構體有10種。
11.D 【解析】根據題意,A選項,圖中a電極為鋰,活潑金屬,易失電子,故a為負極,錯誤;B選項,電池工作時c為正極發生反應為,水性電解液pH變大,錯誤;當給圖中的鋰-空氣電池充電時,電池兩極發生的反應與放電時相反,為電解原理,a為陰極接電源負極,b為陽極應接充電電源的正極,電極反應式為4OH--↑,因此C選項錯誤,D選項正確。
12.C 【解析】溴化銀呈淺黃色,不是黃色,A項錯誤;二氧化硫與堿反應使溶液堿性減弱,說明二氧化硫是酸性氧化物,具有酸性氧化物的性質,不能說明其具有漂白性;氯氣溶于水生成的次氯酸具有漂白性,使溶液褪色,氯氣沒有漂白性,B項錯誤;乙苯類似于苯能作碘水的萃取劑,由實驗現象可知,乙苯的密度小于水的密度,乙苯難溶于水,碘溶于乙苯,C項正確;有機物中的羥基、羧基以及水都能與鈉反應產生氣泡,不能確定是否一定有羧基,D項錯誤。
13.C 【解析】p為氧化鋁,q為Na3[AlF6],W為氧元素,X為氟元素,Y為鈉元素,Z為鋁元素,r為氧氣,s為鋁。離子半徑:W>X>Y>Z,A項正確;氧化鋁可以和強堿發生離子反應,B項正確;氧化鋁和Na3[AlF6]均屬于離子化合物,熔融狀態可以導電,C項錯誤;F-離子和Al3+離子均能促進水的電離,D項正確。
26.(1)氯氣與水反應生成次氯酸,次氯酸有殺菌消毒作用 (1分)
(2)→2、3→6、7→10、9→8 (1分)
(5)3Cl2+(2分) 71~95℃ (1分) b (1分)
【解析】(1)略。(2)先制備純凈的氯氣(不必干燥),然后Cl2與NH4Cl溶液在低溫下反應生成NCl3,NCl3蒸氣冷凝后的液體通過牛角管接收到E裝置中,尾氣需用NaOH溶液進行吸收,故接口連接的順序為1→4、5→2、3→6、7→10、9→8。(3)略。(4)B中的試劑為飽和食鹽水,用于吸收氯氣中的氯化氫;F中為氫氧化鈉溶液,用于吸收氯氣,反應的離子方程式為(5)氯氣在C裝置的蒸餾燒瓶中與NH4Cl溶液反應生成NCl3,化學方程式為+4HCl。由于NCl3的沸點為71℃,其在95℃時會發生爆炸,故水浴加熱的溫度應在71~95℃之間。冷凝管的冷卻水應從下口進入,填b。(6)NCl3在熱水中會發生水解,得到的產物能使紅色石蕊試紙變藍,說明產物中有NH3,最后試紙又褪色,說明產物之一具有漂白性,該產物為HClO,從而可寫出NCl3與熱水反應的化學方程式:3HClO+NH3。
27.(1)Ag++2HNO3+NO↑ (2分)
(2)CuO[或Cu(OH)2]和Al(OH)3(2分) OH―+
(4)30 (2分) 15 (2分)
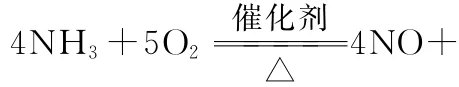
28.(1)吸熱 (1分)
(2)K1·K2(2分) > (2分)
(3)0.15mol·L-1·min-1(2分) = (2分)
(4)D (2分)
(5)> (2分) 酸 (2分)
【解析】(1)略。(2)據上表反應方程式可知K1=c(CH3OH)/[c2(H2)×c(CO)],K2=c(H2O)×c(CO)/[c(H2)×c(CO2)],K3=c(CH3OH)×c(H2O)/[c3(H2)×c(CO2)],所以K3=K1·K2;500℃時測得反應③在某時刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的濃度(mol/L)分別為0.8、0.1、0.3、0.15,把各物質的濃度帶入平衡常數表達式進行計算,計算結果小于500℃時的平衡常數值2.5,所以反應向正反應方向進行,v(正)>v(逆)。(3)根據圖一所示,v(H2)=2v(CO)=2×(1.00-0.25)mol/L÷10min=0.15mol·L-1·min-1;溫度不變,平衡常數不發生改變,所以KA=KB。(4)一定溫度下,在體積固定的密閉容器中發生反應②,反應過程中壓強始終不發生變化,所以如果容器中總壓強不變不一定達到平衡狀態;反應過程中混合氣體的平均摩爾質量始終不變,所以混合氣體的平均摩爾質量不變,不一定達到平衡;反應過程中混合氣體的密度始終不變,所以混合氣體的密度不變,不一定達到平衡;反應過程中CO2(g)和CO(g)的濃度不斷發生變化,可以判斷反應已經達到平衡狀態,選D。(5)室溫下,將amol/L醋酸溶液與b mol/L NaOH溶液等體積混合,若a=b,則溶液顯堿性,若溶液顯中性,則必有a>b。若c(Na+)<c(CH3COO-),根據電荷守恒關系式c(Na+)+c(H+)=c(OH-)+c(CH3COO-),則有c(H+)>c(OH-),溶液顯酸性。
(2)sp3(2分) 三角錐形 (2分) NH3和PH3(2分)
(3)H3AsO3、H3AsO4(2分) H3AsO4(2分)
【解析】X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子,X跟Y可形成化合物X2Y3,可以推出X為砷,Y為氧,Z元素既可以形成正一價離子也可形成負一價離子,可知Z為氫。
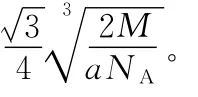
(2)消去反應 (1分) 水解反應(或取代反應) (1分)


【解析】A為丁醇且核磁共振氫譜有2種不同化學環境的氫,所以A為(CH3)3COH,在濃硫酸作用下發生消去反應生成的B為(CH3)2C CH2,結合信息②可知C為(CH3)2CHCH2OH,D為(CH3)2CHCHO,E為(CH3)2CHCOOH。(1)略。(2)略。(3)芳香族化合物F的分子式為C7H8O,苯環上的一氯代物只有兩種,則F的結構簡式為。(4)E與H反應生成I的方程式為(5)K的相對分子質量比I小28,所以K比I少2個碳原子,4個氫原子,其結構中能同時滿足如下條件:I中有酯基和醛基,分子中不含甲基且苯環上只有兩個取代基,所以兩個取代基可以是HCOOCH2—和—CHO或者是HCOO—和—CH2CHO,分別有鄰位、對位和間位3種,所以K共有6種同分異構體。消耗NaOH最多的有機物結構簡式為(鄰、間、對位均可)。(6)略。
(作者單位:河南省盧氏縣第一高級中學)

