橡膠樹HbFCA啟動子在轉基因煙草中的功能缺失分析
李季++戴雪梅++孫芳++黃天帶++華玉偉++黃華孫


摘 要 利用5′缺失設計一系列引物,擴增HbFCA啟動子質粒,獲得5個啟動子缺失片段,用這些片段分別替換PBI121載體中的CaMV35S啟動子,得到5個HbFCA的5′缺失表達載體,即pA、pB、pC、pD和pE。利用農桿菌介導葉盤法進行煙草遺傳轉化,對組培瓶內生根較好的煙草葉片GUS染色,結果發現,長度為最小片段的276 bp的pE可以較好地實現HbFCA啟動子的功能。對橡膠樹體細胞胚瞬時表達檢測發現,pE片段也能啟動表達,有較好的GUS活性,可以實現HbFCA啟動子的功能。
關鍵詞 橡膠樹 ;HbFCA ;啟動子 ;5′端缺失分析法 ;核心結構域
中圖分類號 S794.1 文獻標識碼 A Doi:10.12008/j.issn.1009-2196.2017.07.013
5' Deletion Analysis of HbFCA Promoter from Hevea brasiliensis
in Transgenic Tobacco
LI Ji DAI Xuemei SUN Fang HUANG Tiandai HUA Yuwei HUANG Huasun
(Rubber Research Institute, CATAS & Ministry of Agriculture Key Laboratory
of Rubber Biology, Danzhou, Hainan 571737)
Abstract Using the 5' end serial deletion analysis method, five HbFCA promoter deletion fragments which had different distances from transcription start site were amplified by PCR, and they were used to replace the CaMV35S promoter of PBI121 carrier to obtain 5 HbFCA 5'deletion expression vectors, i.e. pA, pB, pC, pD and pE. The expression vectors were transformed into tobacco by using agrobacterium-meditated leaf disc method, and the well-rooted transformed tobacco plants in tissue culture vessels were directly detected with GUS staining. The results showed that the pE 267 bp, the shortest among the fragments, had promoter activity. The transient expression analysis of somatic embryo of rubber tree showed that the fragment pE also had better GUS staining, and could function as a HbFCA promoter.
Keywords rubber tree ; HbFCA ; promoter ; 5' deletion analysis method ; functional domain
橡膠樹轉基因體系已相對完善[1-2],載體構建時多使用外源組成型啟動子(如CaMV35S[3-5])。但外源性啟動子存在著表達效率低下,多呈瞬時表達,穩定表達較少[6-9],容易引起外源基因的多拷貝整合[10]或轉基因沉默[11],以及影響外源基因的表達水平和表達模式[12]等問題。因此,選擇一個橡膠樹內源的,高效的組成型表達啟動子已成為橡膠樹遺傳轉化系統中的關鍵環節。
FCA基因的功能具有多樣性,除與開花調控外,還與種子休眠、種子千粒重和纖維產量的相關[13]。擬南芥FCA啟動子在多個組織中均能啟動FCA基因的表達[14]。橡膠樹HbFCA啟動子具有典型的真核生物核心啟動子區域,共有28種順式調控元件,在橡膠樹葉片、莖段、樹根和胚狀體等組織均能啟動報告基因的表達,具有組成型啟動子的特點[15]。
啟動子缺失分析是研究啟動子及其調控元件功能的一種重要、有效的方法。本研究在已獲得的橡膠樹HbFCA啟動子全長的基礎上,通過5′端缺失等實驗技術對其核心序列結構區域進行相關分析鑒定,為通過系統改造獲得啟動活性更強、序列長度更短、具有更廣泛應用價值的橡膠樹內源組成型表達啟動子奠定基礎。
1 材料與方法
1.1 材料和主要試劑
煙草本生煙,大腸桿菌菌株DH5α,PBI121載體(含CaMV35S啟動子和GUS報告基因),根癌農桿菌EHA105均為本實驗室保存。
prime STAR Max酶、PUC18載體和T4 DNA連接酶購于Takara公司,膠回收試劑盒、PCR產物回收試劑盒購于OMEGA公司。Taq DNA聚合酶、dNTPs、FastDigestr HindⅢ和FastDigest XbaⅠ購于Fermentas公司。DNA提取試劑盒購于TIANGEN公司(DP320)。DL 2 000 Marker購于Takara公司。
1.2 方法
1.2.1 含有不同長度的HbFCA啟動子表達載體的構建
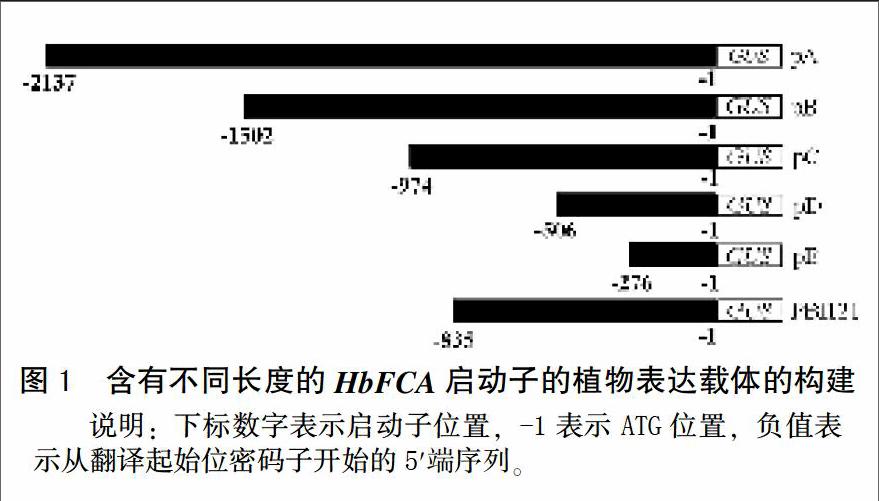
以HbFCA啟動子預測結果為依據,根據常見的CAAT-box、TATA-box以及甲基茉莉酸順式作用元件及光效應元件等位置,將其5′依次截短,設計引物FCA-L1-2、FCA-L2-2、FCA-L3-2、FCA-L4-2、FCA-L5-2和FCA-R,其中FCA-L1-2/FCA-R為啟動子全長擴增引物。前5個引物的5′端引入Hind Ⅲ酶切位點,FCA-R的5′端引入XbaⅠ酶切位點,以PHbFCA為模板,引物FCA-L1-2/FCA-R、FCA-L2-2/FCA-R、FCA-L3-2/FCA-R、FCA-L4-2/FCA-R、FCA-L5-2/FCA-R,prime STAR Max酶擴增,PCR 反應體系為15 μL,其中2×primeSTAR Max Premix 7.5 μL,左右引物(10 μmol/L)各0.5 μL,ddH2O 4.5 μL,模板(50 ng/μL)2 μL。PCR反應程序為98℃預變性4 min,98℃變性10 s,62℃退火15 s,72℃延伸5 s/Kb,72℃終延伸10 min。長度分別為2 137、1 502、974、506和276 bp。Hind Ⅲ/XbaⅠ酶切上述PCR產物,回收備用,PUC18載體同樣利用Hind Ⅲ/XbaⅠ雙切,T4 DNA連接酶連接,挑取單克隆,測序,選擇正確的菌液保菌,提取質粒后Hind Ⅲ/XbaⅠ雙切,溶液回收產物備用,PBI121利用Hind Ⅲ/XbaⅠ雙切,切除CaMV 35s啟動子,回收大片段分別與上述5個質粒酶切產物進行T4 DNA連接酶連接,PCR檢測陽性菌株,完成構建植物表達載體pA、pB、pC、pD和pE(圖1)。將重組載體通過凍融法導入農桿菌GV3101菌株備用。
1.2.2 煙草遺傳轉化與陽性植株篩選
本生煙的遺傳轉化采用農桿菌介導的葉盤侵染法,篩選培養基中添加激素為2.25 mg/L的BAP和0.3 mg/L的NAA,抗生素為500 mg/L的Carb和100 mg/L的Kan,生根培養基中添加1 mg/L的IBA、500 mg/L的Cef和50 mg/L的Kan,經培養獲得每個載體的轉化植株。陽性植株篩選不進行傳統的PCR檢測,而是在獲得的再生植株中,選擇生根較好的植株直接在組培瓶內進行取樣GUS染色,染色結果陽性的植株煉苗,移栽至花盆內繼續生長,收獲種子備用。
1.2.3 GUS染色陽性植株PCR檢測
待花盆內的煙草穩定后,選擇相應葉片進行DNA提取,PCR檢測,抗生素基因檢測反應體系為15 μL,各成分組成詳見[16]。基因檢測用PrimeSTAR Max DNA 聚合酶,反應體系和程序詳見1.2.1。ddH2O作為空白對照,本生煙基因組DNA為陰性對照,含有啟動子片段的載體為陽性對照(表1)。
1.2.4 橡膠樹瞬時表達檢測
挑選新鮮次生胚狀體至體胚誘導培養基預培養3 d。測量過夜培養的農桿菌OD600值,用未添加鐵鹽、CaCl2,蔗糖濃度30 g/L,去除Phytagel,添加100 μmol/L As的愈傷誘導液體培養基調至OD600=0.5作為侵染菌液,置三角瓶待用。將預培養3 d的胚狀體放入農桿菌懸浮液,扎好封口膜,然后放至真空干燥器,用2XZ-4型旋片式真空泵(浙江臨海)抽真空5 min,倒掉菌液,放入加了過濾布的離心管800 r/min離心30 s,取出后置無菌濾紙放工作臺吹干,期間用無菌三角濾紙吸干胚狀體彎曲處多余菌液,20℃共培養5 d。每個菌液檢測6個胚狀體,GUS染色,重復2次。
2 結果與分析
2.1 HbFCA啟動子缺失載體構建及鑒定
利用5對不同引物,分別對HbFCA啟動子質粒PCR擴增,分別獲得與預期一致的片段大小見圖2。經測序驗證,該序列完全正確。通過酶切連接的方式,將5個質粒導入切掉GUS基因的CaMV35s啟動子的PBI121載體中,其中PCR檢測結果如圖3所示,經驗證與預期片段大小一致,因此表明啟動子缺失片段載體構建成功,分別命名為pA、pB、pC、pD和pE。
2.2 轉基因煙草植株的獲得及陽性植株鑒定
將5個構建好的缺失表達載體及對照載體PBI121分別導入農桿菌GV3101菌株中,轉化煙草,選擇生根較好的植株組培瓶內取樣GUS染色,結果如圖4。5個缺失載體和對照PBI121均能很好地染色,且均較藍,初步判斷最小的缺失片段pE具有啟動子活性,葉片表面具有大面積藍色。
2.3 轉基因陽性植株PCR檢測
以煙草葉片基因組DNA為模板,卡那霉素(Npt-f/r)和GUS基因引物(Gus-f/r)對其進行PCR擴增,啟動子擴增引物進行高保真酶擴增,電泳檢測,部分檢測結果如圖5、6。結果表明,PCR檢測結果與GUS染色結果一致。
2.4 橡膠樹瞬時表達檢測
按照1.2.4的方法對橡膠樹體細胞胚進行5個缺失載體與對照PBI121載體瞬時表達驗證(圖7),結果表明,最小片段pE具有啟動子活性,胚狀體呈藍色。5個缺失載體較PBI121均較弱,表現在染色程度較淺,但5個載體間差異不大。
3 討論
啟動子5′缺失分析是研究啟動子表達特性和調控元件功能最常用的方法之一[17]。本研究中以HbFCA啟動子預測結果為依據,根據常見的順式作用元件及光效應元件等位置,構建了5個缺失載體,與對照載體同時轉化煙草,對轉化的煙草葉片GUS組織化學染色,發現5個缺失載體均能激活GUS基因的表達,但表達強度有差異,其中PBI121表達最強,HbFCA全長啟動子片段表達與PBI121較為一致,但其他片段GUS染色均較PBI121載體弱,而對T1代植株GUS蛋白組織染色及系統的定量分析將會更好的與組成型表達35s啟動子進行比較[18-20],因此本研究下一階段準備對煙草T1代轉基因植株進行GUS定性的分析。瞬時表達是快速研究基因表達等的重要手段[21],本研究中橡膠樹次生體胚瞬時表達結果顯示,PBI121中的CaMV35s啟動子作為雙子葉植物常用的組成型表達啟動子具有較強的GUS染色結果,但HbFCA啟動子一系列缺失載體表達均較弱,且各片段之間表達差別不大,考慮可能是因為HbFCA基因在橡膠樹體細胞胚中的表達活性本來就不高(見圖7中pA在橡膠樹胚狀體中瞬時表達檢測結果和孫芳[22]HbFCA基因在愈傷胚、根、葉片、樹皮、花及膠乳中的表達結果)。預測發現,最小片段pE啟動子區域含有的均為光效應元件、甲基茉莉酸應答順式調控元件、熱應答順式作用元件、水楊酸應答順式作用元件、晝夜調控順式元件以及-79和-107 bp的TATA-box和-26 bp的CAAT-box。叢明等[23]利用橡膠樹組培苗葉片瞬時表達比較306和378 bp的REF啟動子發現,二者均具有明顯的乳管表達活性,分析發現,REF啟動子的重要功能元件都集中在啟動子第73位點之后。
常規的轉基因煙草檢測是將獲得的轉化植株移栽到穴盆內,取葉片進行分子檢測,選擇陽性植株進行GUS染色[24]。而本研究中利用在組培瓶內選取生根較好的植株進行GUS染色來判斷陽性植株,這樣一方面直觀的獲得具有GUS基因表達的轉基因陽性植株,另一方面減輕轉基因植株鑒定的工作量。不過該方法可能會漏掉一些分子檢測為陽性,但是不表達的轉基因植株,但這些植株對后期的啟動子功能分析起不到相應的作用。
內源型啟動子由于其內源的調控序列能更好更充分地發揮其調控能力,在驅動外源基因的高效穩定表達中比外源啟動子更有優勢。與此同時,使用植物自身基因的啟動子可以降低外源基因在該植物轉基因個體中的拷貝數[10],且可有效避免基因沉默現象[25]。本研究中獲得這個HbFCA啟動子在橡膠樹葉片、根、莖和胚狀體中具有組成型啟動子的特點,但在膠乳和樹皮中表達相對較低。因此為獲得橡膠樹內源組成型高表達載體,筆者認為可以將這個啟動子的核心結構域與膠乳和樹皮中表達較高的啟動子進行人工串聯,獲得人工合成的橡膠樹內源組成型表達啟動子,為橡膠樹遺傳轉化的應用提供基礎。
參考文獻
[1] Blanc G, Baptiste C, Oliver G, et al. Efficient Agrobacterium tumefaciens-mediated transformation of embryogenic calli and regeneration of Hevea brasiliensis Mull Arg. Plants [J]. Plant Cell Rep,2006, 24(12): 724-733.
[2] 黃天帶,李 哲,孫愛花,等. 根癌農桿菌介導的巴西橡膠樹花藥遺傳轉化體系的建立 [J]. 作物學報,2010,36(9):1-7.
[3] Odell J T, Nagy F, Chua N H. Identification of DNA sequences required for activity of the caulifiower mosaic virus 35S promoter[J]. Nature, 1985, 313:810-812
[4] Mehrotra R, Gupta G, Sethi R, et al. Designer promoter:an artwork of cis engineering[J]. Plant Molecular Biology, 2011, 75(6): 527-536.
[5] 魏 晶,毛偉華,林擁軍,等. 1個新水稻組成型啟動子的克隆與功能鑒定[J]. 華中農業大學學報,2012,31(2):139-146.
[6] Shirasawa-Seo N, Mitsuhara I, Nakamura S, et al. Constitutive promoters available for transgene expression instead of CaMV35S RNA promoter:Arabidopsis promoters of tryptophan synthase protein β subunit and phytochrome B[J]. Plant Biotechnotogy, 2002, 19 (1): 19-26
[7] 李 杰,曲東京,劉玲玲,等. 不同啟動子驅動下轉基因鹽藻外源基因的穩定表達[J]. 中國生物工程雜志,2007,27(3):47-53
[8] Hirata R, Jeong Won-Joong, Saga N, et al. Heterologous activation of the Porphyra tenera HSP70 promoter in Bangiophycean algal cells[J]. Bioengineered, 2011, 2(5): 271-274.
[9] 石 晶,陳 彬,崔雪瓊,等. 不同啟動子驅動glgC在馬鈴薯體內的表達研究[J]. 西北植物學報,2012,32(11):2 190-2 194.
[10] 徐子勤,龔莉桂,黃 萱,等. 采用玉米Ubi-1啟動子獲得低拷貝轉基因玉米植株[J]. 生物工程學報,2004,20(1):120-125.
[11] Lardet L, Leclercq J, Bénistan, et al. Variation in GUS activity in vegetatively propagated Hevea brasiliensis transgenic plants[J]. Plant Cell Rep, 2011, 30: 1 847-1 856.
[12] Yoo S Y, Bomblies K, Ahn J H. The 35S promoter used in a selectable marker gene of a plant transformation vector affects the expression of the transgene [J]. Planta, 2005, 221(4): 523-530.
[13] Sun F, Liu C L, Zhang C J, et al. A conserved RNA recognition motif (RRM) domain of Brassica napus FCA improves cotton fiber quality and yield by regulating cell size [J]. Mol Breed, 2012, 30(1): 93-101.
[14] Macknight R, Duroux M, laurie R, et al. Functional significance of the alternative transcript processing of the Arabidopsis floral promoter FCA[J]. Plant Cell, 2002, 14(4): 877-888.
[15] 華玉偉,孫 芳,黃天帶,等. 橡膠樹HbFCA啟動子的克隆及其在橡膠樹中的表達分析[J]. 熱帶作物學報,2013,34(5):800-806.
[16] 李 季,黃天帶,蔡海濱,等. 橡膠樹體胚遺傳轉化中早代轉化胚狀體的PCR鑒定[J]. 熱帶作物學報,2013,(5):866-869.
[17] Iwamoto M, Higo H, Higo K. Strong expression of the rice catalase gene CatB promoter in protoplasts and roots of both a monocot and dicots[J]. Plant physiology and Biochemistry, 2004, 42(3): 241-249.
[18] 崔喜艷,陳眾峰,范 貝,等. 大豆rbcS基因啟動子的克隆及在轉基因煙草中的功能缺失分析[J]. 西北農林科技大學學報(自然科學版),2015,43(5):114-128.
[19] 關志輝,陳 新,王海燕,等. 木薯可溶性淀粉合成酶(MeSSⅡb)啟動子克隆及梯度缺失分析 [J]. 基因組學與應用生物學,2015,34(8):1753-1760.
[20] 王旭靜,李為民,唐巧玲,等. 中棉(Gossypium arboreum)光誘導基因Gacab啟動子在轉基因煙草中的功能缺失分析 [J]. 作物學報,2009,35(6):1 006-1 012.
[21] 趙金風,李 杰,張 爽,等. 楊樹木質部特異啟動子5′端側翼序列缺失表達載體構建及轉化煙草的研究 [J]. 蠶業科學,2013,39(5):858-861.
[22] 孫 芳. 巴西橡膠樹開花相關基因HbFCA的克隆及表達分析[M]. 海口:海南大學,2012.
[23] 叢 明,凌 華,黃惠琴,等. 利用REF啟動子構建橡膠樹乳管特異表達載體及GUS基因的瞬時表達 [J]. 熱帶作物學報,2005,26(2):29-33.
[24] 楊江濤,龐偉民,王旭靜,等. 陸地棉GhRACK1啟動子的克隆與缺失分析[J]. 作物學報,2016,42(3):368-375.
[25] Matzke M A, Matzke A J M. How and why do plants inactivate homologous (trans) genes?[J] Plant Physiol, 1995, 107(3): 679-685.

