利用短柄草進行TaWRKY2的抗赤霉病功能分析
郭秀秀,王 亮,蘇培森,虞光輝,葛文揚,王宏偉,李憲彬,孔令讓,李安飛
山東農業大學 農學院,山東 泰安 271018
利用短柄草進行TaWRKY2的抗赤霉病功能分析
郭秀秀,王 亮,蘇培森,虞光輝,葛文揚,王宏偉,李憲彬,孔令讓,李安飛*
山東農業大學 農學院,山東 泰安 271018
赤霉病是小麥的重要病害,嚴重影響小麥的產量和品質,但由于小麥遺傳轉化較難,其抗病機制的研究一直進展緩慢。短柄草作為單子葉模式植物,在生長特性和遺傳研究等方面具有很大優勢。本研究首先明確了短柄草穗部赤霉病發生的最適條件為:溫度28°C,相對濕度75%。比較小麥Apogee抗、感赤霉病近等基因系受赤霉菌誘導的表達譜,在抗病材料中克隆到一個特異表達的基因并命名為TaWRKY2。利用農桿菌介導的方法將TaWRKY2基因轉入短柄草Bd21中,通過穗部接菌鑒定和葉片離體鑒定的方法對轉基因植株進行抗病性鑒定,結果表明,與受體Bd21相比,轉基因短柄草植株的穗部和葉片赤霉病抗性均增強。作為SA信號路徑下游的基因,TaWRKY2可能通過介導水楊酸路徑下游病程相關蛋白基因(Pathogenesis related gene,PR基因)的表達,參與抗赤霉病過程。
赤霉病;短柄草;TaWRKY2
赤霉病(Fusahum graminearum)是小麥的主要病害之一,嚴重時會造成重大經濟損失,而且感染赤霉病的小麥會產生多種真菌毒素,對人類的健康構成威脅。近年來,中國黃淮麥區和關中麥區赤霉病的發生也日趨嚴重。2012年,在河南、山東、安徽等地小麥赤霉病大爆發,對小麥生產造成了嚴重損失[1,2]。盡管化學防治能夠減輕赤霉病危害,但培育抗赤霉病小麥新品種仍是控制和減小赤霉病危害的最安全、有效的措施。目前,傳統的雜交育種是選育小麥抗赤霉病新品種的有效途徑,在提高小麥的抗病性方面發揮了重要的作用[3]。但是,由于赤霉病抗源非常少,通過傳統育種的方法很難在赤霉病育種工作中取得突破。隨著基因工程和植物組織培養技術的發展,利用轉基因技術創制抗病種質材料的方法應運而生[4]。但是,小麥作為異源六倍體作物基因組復雜,而且作為單子葉植物其遺傳轉化的效率很低并且穩定性差。此外,小麥轉基因帶來的安全問題以及人們對于轉基因技術認識的局限也限制了小麥轉基因技術的應用。短柄草因其具有植株矮小、自交可育、生活周期短、生長條件簡單、再生能力強和轉化效率高等優點[5,6],已成為單子葉植物研究基因功能的最理想的模式植物。更為重要的是,其全基因組測序已經于2010年完成[7]。Peraldi等[8]認為短柄草可以用來研究小麥赤霉病,但其并沒有研究其發病條件,其穗部接種禾谷鐮刀菌后,如果條件不合適會導致菌絲迅速生長并包裹整個接菌小穗,尚不能應用到小麥赤霉病II型抗性的研究上。所以,利用短柄草研究小麥赤霉病體系亟待建立。
WRKY家族是近年來發現的植物所特有的一種新型鋅指類轉錄因子。因其N端含有一個由7個氨基酸WRKYGQK組成的高度保守區得名[9]。WRKY轉錄因子的主要生物學功能是調控植物的逆境防衛反應及其信號轉導途徑的建立[10-12]。在擬南芥中,對72個AtWRKY基因的功能分析表明,其中的49個基因響應了植物細菌性病原體的入侵和水楊酸的處理,4個基因在植物組織中被脫落酸誘導[13];此外,擬南芥中的抗性基因AtRRS1是典型的WRKY52蛋白,對植物病原青枯菌(Ralstonia solanacearum)有明顯抗性[14],有研究表明AtWRKY22和AtWRKY29作為MAPK通路中重要的下游組成成分,可以提高擬南芥對真菌和細菌的抗性[15]。Birkenbihl等[16]通過研究擬南芥AtWRKY33基因的突變體,發現AtWRKY33基因通過調節水楊酸、茉莉酸信號轉導途徑和基因表達來抵抗灰霉菌的侵染。通過對水稻中的45個WRKY轉錄因子在不同生物脅迫下表達情況的研究發現:當稻瘟病病菌侵染水稻植株時有15個轉錄因子響應表達,其中有12個轉錄因子在細菌誘導水稻植株時出現了上調表達的情況;另有研究表明粳稻亞種中的OsWRKY45-1和秈稻亞種中的OsWRKY45-2,在水稻中過量表達可以提高水稻抵抗真菌病原體侵染的能力,對于抵抗水稻白葉枯病也有一定的作用[17]。小麥中對WRKY基因的研究發現TaWRKY34基因可能與小麥抗白粉病有關[18],茍璐璐[19]也報道在條銹菌誘導下,WRKY轉錄因子的表達量發生變化。
本課題組研究發現,TaWRKY2基因可以響應禾谷鐮刀菌的誘導,推測該基因可能與提高小麥的赤霉病抗性有關。本研究從小麥Apogee抗、感赤霉病近等基因系中克隆得到一個在抗病品種中特異表達的基因TaWRKY2,通過農桿菌介導的遺傳轉化的方法將其轉到短柄草Bd21中,獲得轉基因短柄草植株,得到轉基因純系后進行赤霉病抗性鑒定,研究了TaWRKY2基因的功能,以期為小麥抗赤霉病分子育種提供有效的候選基因。
1 材料與方法
1.1 實驗材料
本實驗所用到的植物材料:小麥赤霉病感、抗近等基因系Apogee/Apogee73S2由美國農業部D.Garvin惠贈,短柄草品種Bd21由山東農業大學農學院吳佳潔博士提供。所用的禾谷鐮刀菌菌株由山東農業大學植物保護學院梁元純教授惠贈;農桿菌菌株AGL1為本實驗室保存;過表達載體為改造的pCAMBIA1300,由山東農業大學生命科學院安海龍教授惠贈。
1.2 實驗方法
1.2.1 短柄草抗赤霉病體系建立 Peraldi等認為短柄草可以與禾谷鐮刀菌產生相互作用,但是并沒有探索短柄草接種赤霉菌后的發病條件,使得接菌小穗菌絲迅速生長并包裹整個穗部,難以應用到實際的研究中。本實驗設立了2個不同的溫度條件分別為25°C和28°C,3個不同的相對濕度環境分別為40%、75%和95%以上。
1.2.2TaWRKY2基因克隆及載體構建 分析禾谷鐮刀菌處理72 h后的感、抗赤霉病近等基因系穎殼的表達譜差異,得到一個在抗病材料中特異表達的基因片段,通過檢索小麥基因組數據庫(http://wheat-urgi.versailles.inra.fr/)得其完整cDNA序列信息,根據其cDNA序列設計特異引物(表1),以禾谷鐮刀菌處理72 h抗病材料cDNA為模板進行擴增。PCR產物用1%的瓊脂糖凝膠電泳,并用膠回收試劑盒回收PCR產物,將回收產物與pMD18-T載體連接,轉入大腸桿菌,進行菌落PCR驗證后挑取陽性單克隆測序。
用分別含有KpnI和Spel酶切位點的引物TaWRKY2-F/R擴增pMD18-TaWRKY2質粒,PCR產物經電泳檢測后回收備用。提取短柄草遺傳轉化載體pCAMBIA1300-sGFP,分別用KpnⅠ和Spel對pCAMBIA1300-sGFP轉化載體和上述PCR回收產物進行雙酶切,回收載體片段和目的基因片段,連接并轉化DH5α感受態細胞,陽性克隆提取質粒,轉化AGL1農桿菌感受態細胞,菌液PCR鑒定陽性克隆。

表1 引物列表Table1 List of primer sequences
1.2.3TaWRKY2轉基因短柄草植株的獲得 取短柄草幼嫩的種子,用23 mL10%次氯酸鈉和27 mL無菌水滅菌5 min,然后用無菌水沖洗3~5次,取出幼胚,幼胚盾片向上接種在愈傷誘導培養基(CIM)上[20]。將取出的幼胚于28°C下暗培養4周誘導愈傷組織,愈傷組織經過2次繼代后侵染,侵染后的愈傷經過2次篩選進入分化階段,每次篩選時長為2周,30 d后進行壯苗,長出根后可以移栽到基質中。進入分化階段以后培養條件由原來的暗培養變為光照培養,光周期為16 h光照/8 h黑暗。
1.2.4 轉TaWRKY2基因短柄草檢測 首先通過PCR檢測以確定外源的TaWRKY2基因是否已整合到短柄草的基因組中,擴增引物序列見表1。然后通過觀察報告基因綠色熒光蛋白的表達情況確定外源TaWRKY2在短柄草轉基因株系中的表達情況。
1.2.5 轉TaWRKY2短柄草的抗赤霉病功能鑒定 轉TaWRKY2短柄草植株的抗赤霉病鑒定是通過類似小麥的單花滴注接種方法和葉片離體培養的方法進行的。
轉基因短柄草穗部接菌鑒定主要是參考小麥穗部接菌的方法[21]。短柄草穗部赤霉病鑒定通過選取尚未開花的短柄草小穗,選取倒數第二或第三個小花進行標記并接種赤霉菌,每個小花接種2.5 μL赤霉菌菌液(菌液的濃度為5-10×105個孢子/mL)。接種后套袋保濕,3 d后摘袋并開始記錄表型變化。
短柄草葉片離體培養的培養方法參考Chen等[22,23],在直徑9 cm的玻璃培養皿中倒入1%的瓊脂培養基,待凝固后切除中間寬3 cm的培養基待用。剪取3個不同轉基因株系和野生型Bd21的幼嫩的葉片,每份材料取6片葉子,葉長大約5 cm,用1 mL的槍頭在葉片近軸面的中間輕輕制造一個大小一致的接種點。把離體葉片的兩端插入培養基里,并用培養基塊壓住切口。在傷口處接種2 μL濃度為每亳升1×106個禾谷鐮刀菌分生孢子的菌液,封口膜封口,置于光照培養箱(24°C 16 h/20°C 8 h),5 d后觀察發病癥狀,并進行臺盼藍染色。
2 結果與分析
2.1 短柄草抗赤霉病體系建立
通過調整短柄草穗部與禾谷鐮刀菌互作的條件,發現在溫度為28°C,相對濕度75%的條件下短柄草的接菌穗可以在10 d內完全延展,但不至于菌絲過量生長(如圖1),此條件可以滿足短柄草穗部的赤霉病抗性鑒定。
2.2 TaWRKY2基因克隆及載體構建
通過分析小麥赤霉病感、抗近等基因系Apogee/Apogee73S2表達譜數據得到了在接種禾谷鐮刀菌的條件下特異表達的基因TaWRKY2,其可能與小麥赤霉病抗性相關。利用qRT-PCR對該基因在近等基因系Apogee/Apogee73S2中的表達模式分析,表明禾谷鐮刀菌處理下TaWRKY2基因在Apogee中的表達量略有上升,而在Apogee73S2中的表達量有較顯著的增加,其表達量的變化見圖2。

圖1 短柄草Bd21穗部接種赤霉菌后3d、7d和10d后的發病情況Fig.1Theincidenceof3days,7daysand10daysafterinoculation withFusahumgraminearuminBrachypodiumdistachyonBd21
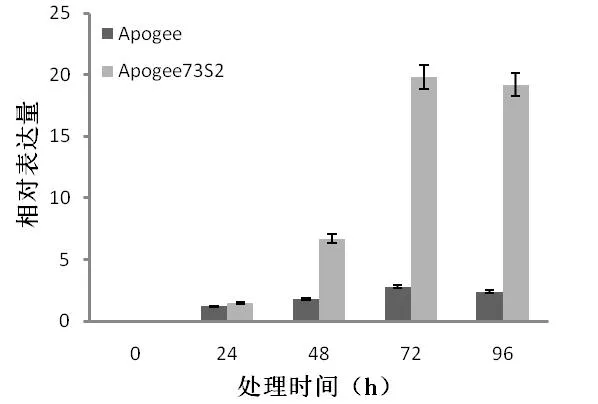
圖2 赤霉病誘導下TaWRKY2在感、抗近等基因系Apogee/Apogee73S2中的表達模式Fig.2ExpressionpatternsofTaWRKY2innear-isogeneticlinesApogee/Apogee73S2inducedbyFusahumgraminearum
將克隆得到的TaWRKY2基因連接到PMD19-T載體上,測序正確后亞克隆至表達載體,該表達載體含有2個報告基因,分別為潮霉素hptⅡ篩選標記和GFP綠色熒光標記。然后通過凍融法將構建好的表達載體轉入農桿菌AGL1感受態,經過菌落PCR驗證陽性克隆后加入40%甘油(v/v),存入-80°C待用。
2.3 TaWRKY2基因短柄草的遺傳轉化
本實驗中TaWRKY2的遺傳轉化所用的愈傷組織是2013年10月27日剝取的幼胚誘導產生的。本實驗剝取43個短柄草的幼胚,經過4周的培養,誘導得到10個胚性愈傷,經過第一次繼代得到367個胚性愈傷,2周后進行第二次繼代,得到1442個胚性愈傷。選取80個胚性愈傷進行TaWRKY2的農桿菌侵染轉化,得到27株轉基因陽性植株。現將組織培養的數據列于表2。

表2 短柄草侵染轉化數據統計表Table 2 Data statistics ofBrachypodium distachyoninfection transformation
2.4 轉TaWRKY2基因短柄草檢測
轉基因苗DNA水平的鑒定:將組培得到的抗性短柄草植株剪取葉片,用SDS法提取DNA,經過PCR檢測目的基因,PCR鑒定以短柄草基因組DNA為模板擴增目的基因,然后用1%的瓊脂糖凝膠電泳,鑒定得到27株陽性植株,結果見圖3A。
轉基因短柄草的表達鑒定:將轉基因短柄草T0代種子在濾紙上發芽,發芽3天后在熒光顯微鏡下觀察胚芽鞘的綠色熒光表達情況,有綠色熒光的表達則說明該基因已成功轉移到短柄草植株中,并能夠成功表達,結果見圖3B。

圖3 AT0代轉基因短柄草植株的PCR檢測結果Fig.3AIdentification of transgenicBrachypodium distachyon1-8:轉基因植株;9:野生型;10:陽性對照;11:陰性水對照;M:Maker。1-8 Transgenic plants;9 Wild type;10 Positive control;11 PCR product of negative control of ddH2O;M:Maker.
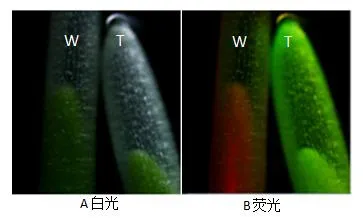
圖3 B T1代轉基因植株的熒光檢測Fig.3B Fluorescence detection of T1generation transgenic plantsA圖是正常光下胚芽鞘部分的圖像,B圖是綠色熒光下胚芽鞘部分的圖像;W是野生型;T是轉基因型。AUnder normal light;B Under green fluorescence;W:Wild type;T:Transgenic type.
2.5 轉TaWRKY2基因短柄草的抗赤霉病能力鑒定
短柄草轉基因植株抗赤霉病鑒定主要由穗部接菌鑒定和幼苗離體葉片接種鑒定兩個方面進行,均參照小麥的赤霉病鑒定方法進行。
短柄草的穗部接菌鑒定,采用單花滴注法接菌3 d后摘袋,從第4 d開始記錄短柄草發病情況并統計野生型對照和轉基因短柄草植株接菌后的延展情況,如圖4A。延展率是指發病小穗數與總小穗數的比值。相比野生型,轉基因短柄草小穗延展率降低,說明TaWRKY2可以提高短柄草穗部對赤霉菌的抗性(圖4B)。
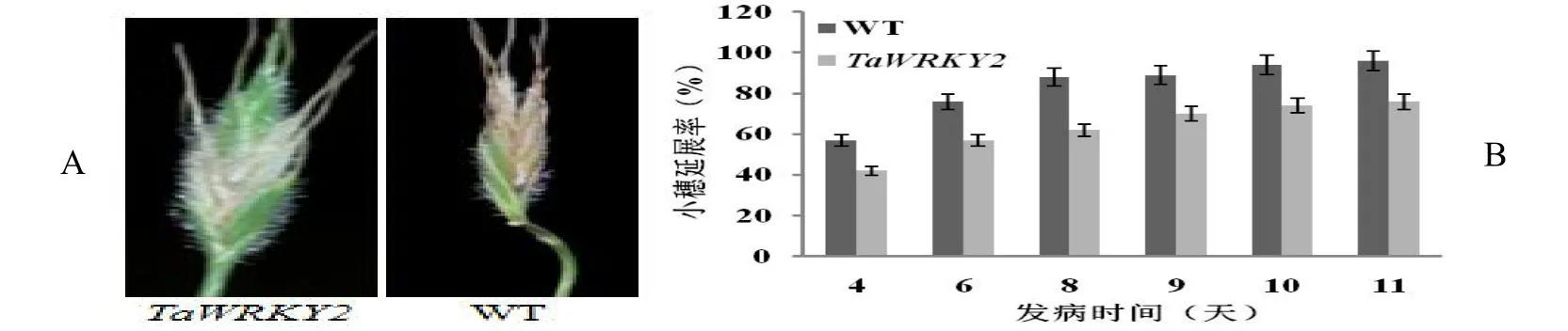
圖4 A短柄草穗部接種赤霉菌的發病情況Fig.4ABrachypodium distachyonincidence of ear inoculation ofFusahum graminearum圖4B轉TaWRKY2基因短柄草后代穗部赤霉病抗性鑒定Fig.4B Identification of resistance toFusariumhead blight in transgenic plants withTaWRKY2
葉片離體培養大約5 d后觀察赤霉菌的侵染情況,并拍照記錄,如圖5A。然后用臺盼藍染色,脫色后測量壞死斑的大小,結果表明,相比于野生型短柄草葉片轉基因短柄草葉片的壞死斑明顯較小,說明TaWRKY2對短柄草葉片感染赤霉菌也有一定的抗性見圖5B。
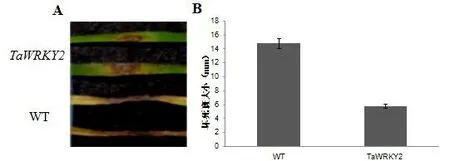
圖5 轉TaWRKY2基因短柄草葉片離體抗赤霉病鑒定Fig.5 Phenotypes of detached leaves of transgenicBrachypodium distachyonwith geneTaWRKY2againstFusahum graminearuminfectionA:野生型短柄草和轉TaWRKY2基因型短柄草離體葉片在接種赤霉菌5 d后的發病表型;B野生型和轉基因植株葉片壞死斑平均長度。A.The isolated leaves of wild type and transgenicTaWRKY2geneB.distachyonwere inoculated withF.graminearumand the phenotypes were checked 5 days later;B.Average length of leaf necrosis spot in wild type and transgenic plants.
3 討論
Peraldi[8]等研究了赤霉病在短柄草中的發病過程和機理,發現禾谷鐮刀菌與短柄草穗部存在互作,但利用短柄草研究小麥赤霉病的可行性尚需進一步驗證。本研究首先以二穗短柄草Bd21為材料,探索了其穗部進行赤霉病抗性鑒定的適宜條件。發現短柄草Bd21在室溫條件下具有較強II型抗性,單花滴注法接種禾谷鐮刀菌兩周后,禾谷鐮刀菌的菌絲仍然很難通過穗軸延展到鄰近的小穗,抗赤霉病相關基因的抗病性鑒定仍存在較大的難度。但在溫度為28°C,相對濕度為75%的條件下,禾谷鐮刀菌可以通過穗軸侵染其鄰近的小穗,發病過程與小麥中類似,因此,外界條件是影響短柄草抗赤霉病鑒定的重要因素。
SA、JA和乙烯作為植物抗病防衛基本信號通路的3種信號分子,在抵御環境脅迫應答過程中都起著重要作用。禾谷鐮刀菌的侵染機制非常復雜,在侵染初期屬于寄生型,48小時后轉為腐生型侵染,目前,小麥通過信號轉導抗病的分子機制尚不明確。早在2006年Makandar等[24]報道在小麥中過表達來自擬南芥的AtNPR1基因時,轉基因小麥對赤霉病的抗性有所提高,而NPR1基因是SA信號路徑的關鍵因子,WRKY轉錄因子位于SA信號路徑中NPR1基因的下游。由于一個轉錄因子的過量表達能夠激活下游多個抗逆基因的表達,從而獲得具有綜合抗逆能力的轉基因植株,所以轉錄因子在小麥抗逆方面的應用具有更高的價值。其中WRKY轉錄因子能夠與下游基因結合調控植物的生物和非生物脅迫,己經成為作物改良的重要研究內容[25]。
本研究利用Apogee抗、感赤霉病近等基因系,發現了一個在抗病材料中特異表達的WRKY基因,暗示了該基因很可能參與了小麥赤霉病的抗病性過程。過量表達該基因的短柄草轉基因植株無論是穗部還是葉片都表現出較強的的赤霉病抗性,這說明利用短柄草進行赤霉病抗性分析是可行的,而該基因在小麥中的赤霉病抗病能力需要進一步驗證。Ding等[26]利用轉錄組和蛋白組學研究小麥-禾谷鐮刀菌互作的結果推測,在禾谷鐮刀菌侵染前期水楊酸信號路徑可能扮演重要角色,而當其侵染機制轉換成腐生階段時,小麥茉莉酸通路可能起到更重要的作用。而本研究中熒光定量顯示該基因隨禾谷鐮刀菌侵染主要在后期誘導表達,表明TaWRKY2可能在侵染后期發揮作用,因此該基因如何受水楊酸和茉莉酸交叉調控還需進一步研究。另外,Gao等[27]報道將擬南芥中克隆得到的AtNPR1基因導入小麥后發現轉基因小麥的葉片和穗部與禾谷鐮刀菌作用時表現出了相反的表型,但本研究中并未發現這一點。本研究通過同源克隆技術得到了在小麥感、抗赤霉病材料中差異表達的TaWRKY2基因,通過在二穗短柄草中的過量表達該基因,提高了短柄草對赤霉病的抗性。
4 結論
本研究初步建立了利用短柄草鑒定小麥穗部赤霉病抗性體系,明確了最適的發病條件為:溫度28°C,相對濕度75%。本研究利用Apogee抗、感赤霉病近等基因系,從小麥抗病材料Apogee中克隆得到一個差異表達的基因TaWRKY2。該基因在短柄草中過量表達后發現其穗部和離體葉片均比受體對照表現出更強的赤霉病抗性,說明該基因可能參與小麥抗赤霉病過程。
參考文獻
[1]Yao J,Zhou M,Zhang X,et al.Molecular breeding for wheat Fusarium head blight resistance in China[J].Cereal Research Communications,2008,36(S6):203-212
[2]李海軍,孫蘇陽,王永軍,等.小麥赤霉病發生原因與防治措施[J].農技服務,2008,28(9):78,87
[3]何中虎,夏先春,陳新民,等.中國小麥育種進展與展望[J].作物學報,2011,37(2):202-215
[4]TesterM,LangridgeP.Breedingtechnologiestoincreasecropproductioninachangingworld[J].Science,2010,327(5967):818-822
[5]Draper J,Mur LAJ,Jenkins G,et al.Brachypodium distachyon.A new model system for functional genomics in grasses[J].Plant Physiology,2001,127(4):1539-1555
[6]Vogel JP,Gu YQ,Twigg P,et al.EST sequencing and phylogenetic analysis of the model grassBrachypodium distachyon[J].Theoretical andApplied Genetics,2006,113(2):186-195
[7]Vogel JP,Garvin DF,Mockler TC,et al.Genome sequencing and analysis of the model grassBrachypodium distachyon[J].Nature,2010,463(7282):763-768
[8]Peraldi A,Beccari G,Steed A,et al.Brachypodium distachyon:a new pathosystem to study Fusarium head blight and otherFusariumdiseases of wheat[J].BMC Plant Biology,2011,11(1):100
[9]Eulgem T,Rushton PJ,Robatzek S,et al.The WRKY superfamily of plant transcription factors[J].Trends in Plant Science,2000,5(5):199-206
[10]Rushton PJ,Torres JT,Parniske M,et al.Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes[J].The EMBO Journal,1996,15(20):5690
[11]Yu D,Chen C,Chen Z.Evidence for an important role of WRKY DNA binding proteins in the regulation of NPR1 gene expression[J].The Plant Cell,2001,13(7):1527-1540
[12]Deslandes L,Olivier J,Theulières F,et al.Resistance to Ralstonia solanacearum in Arabidopsis thaliana is conferred by the recessiveRRS1-Rgene,a member of a novel family of resistance genes[J].Proceedings of the National Academy of Sciences,2002,99(4):2404-2409
[13]Tosti N,Pasqualini S,Borgogni A,et al.Gene expression profiles of O3-treated Arabidopsis plants[J].Plant,Cell&Environment,2006,29(9):1686-1702
[14]Deslandes L,Olivier J,Peeters N,et al.Physical interaction between RRS1-R,a protein conferring resistance to bacterial wilt,and PopP2,a type III effector targeted to the plant nucleus[J].Proceedings of the National Academy of Sciences,2003,100(13):8024-8029
[15]Asai T,Tena G,Plotnikova J,et al.MAP kinase signalling cascade in Arabidopsis innate immunity[J].Nature,2002,415(6875):977-983
[16]Birkenbihl RP,Diezel C,Somssich IE.ArabidopsisWRKY33is a key transcriptional regulator of hormonal and metabolic responses toward Botrytis cinerea infection[J].Plant physiology,2012,159(1):266-285
[17]Rushton PJ,Somssich IE,Ringler P,et al.WRKY transcription factors[J].Trends in Plant Science,2010,15(5):247-258
[18]秦 偉,趙光耀,曲志才,等.小麥白粉病菌誘導的TaWRKY34基因的鑒定與分析[J].作物學報,2010,36(2):249-255
[19]茍璐璐.條銹菌誘導的小麥轉錄因子TaWRKY基因的克隆及表達分析[D].雅安:四川農業大學,2011
[20]Bablak P,Draper J,Davey MR,et al.Plant regeneration and micropropagation ofBrachypodium distachyon[J].Plant Cell,Tissue and Organ Culture,1995,42(1):97-107
[21]侯文倩.小麥赤霉病抗病相關基因的分離鑒定及BSMV-VIGS功能驗證[D].泰安:山東農業大學,2014
[22]牟晶晶.小麥硬脂酰基載體蛋白脂肪酸去飽和酶基因(TaSSI2-1)的功能分析[D].泰安:山東農業大學,2015
[23]Zhang XW,Jia LJ,Zhang Y,et al.In planta stage-specific fungal gene profiling elucidates the molecular strategies ofFusarium graminearumgrowing inside wheat coleoptiles[J].The Plant Cell,2012,24(12):5159-5176
[24]Makandar R,Essig JS,Schapaugh MA,et al.Genetically engineered resistance to Fusarium head blight in wheat by expression ofArabidopsisNPR1[J].Molecular Plant-Microbe Interactions,2006,19(2):123-129
[25]金 慧.水楊酸誘導番茄WRKY轉錄因子的克隆及功能分析[D].大連:大連理工大學,2011
[26]Ding L,Xu H,Yi H,et al.Resistance to hemi-biotrophicF.graminearuminfection is associated with coordinated and ordered expression of diverse defense signaling pathways[J].PloS One,2011,6(4):e19008
[27]Gao CS,Kou XJ,Li HP,et al.Inverse effects of ArabidopsisNPR1gene on fusarium seedling blight and fusarium head blight in transgenic wheat[J].Plant Pathology,2013,62(2):383-392
Functional Analysis ofTaWRKY2Involved in Fusarium Head Blight Resistance UsingBrachypodium distachyon
GUO Xiu-xiu,WANG Liang,SU Pei-sen,YU Guang-hui,GE Wen-yang,WANG Hong-wei,LI Xian-bin,KONG Ling-rang,LIAn-fei*
College of Agronomy/Shandong Agricultural University,Tai’an271018,China
Fusariumhead blight(FHB)is an important disease of wheat,which affects the quality and yield of wheat seriously.However,due to the difficulty of genetic transformation of wheat,the progress is slow in the research of FHB disease resistance mechanism.As a model of monocot plants,Brachypodium distachyonhas great advantages in terms of growth characteristics and genetic research.In this study,we established the system of FHB evaluation onB.distachyon,with the optimal conditions at 28°C and humidity of 75%.Based on the analysis of the gene expression profiling,we cloned a specific gene from FHB-resistant near-isogenic line of Apogge induced byFusahum graminearum,and it was designated asTaWRKY2and overexpressed inB.distachyonof Bd21 subsequently.The results showed that the transgenicB.distachyonexhibited stronger resistance to FHB both on spike and detached leaf.As a downstream transcription factor of SA signaling,TaWRKY2may participate in the process of resistance to scab by mediating the expression of pathogenesis related protein genes.
Fusariumhead blight;Brachypodium distachyon;TaWRKY2
S512.1
A
1000-2324(2017)04-0570-06
2016-06-05
2016-11-10
國家自然基金(31520103911,31471488);山東省良種工程
郭秀秀(1990-),女,在讀碩士研究生.主要從事小麥和短柄草的遺傳轉化工作.E-mail:guoxiuxiumkk@126.com
*通訊作者:Author for correspondence.E-mail:lianfei@sdau.edu.cn

