靶向敲除WT1基因誘導人肺癌A549細胞凋亡
王曉明,范慧康,劉 旸,溫得中
(1.吉林省人民醫院 病理科,吉林 長春130021;2.吉林大學臨床醫學院,吉林長春130021;3.吉林大學基礎醫學院,吉林 長春130021)
*通訊作者
靶向敲除WT1基因誘導人肺癌A549細胞凋亡
王曉明1,范慧康2,劉 旸2,溫得中3*
(1.吉林省人民醫院 病理科,吉林 長春130021;2.吉林大學臨床醫學院,吉林長春130021;3.吉林大學基礎醫學院,吉林 長春130021)
WT1(Wilms’ Tumor Gene 1)基因是一種與癌癥密切相關的基因,最早發現于腎母細胞瘤中[1]。WT1基因主要功能是調節RNA轉錄后加工的過程,同時具有抑制細胞分裂和分化的功能[3,4]。有研究表明,在乳腺癌、急性髓系白血病、惡性黑色素瘤等疾病中,WT1均存在異常高表達的情況,提示WT1可能是誘導腫瘤發生的一個重要因素,抑制/沉默WT1基因的表達,將有望控制相關腫瘤細胞的發生發展[5]。
CRISPR/Csa9技術是第三代基因編輯工具,其原理是通過gRNA引導,利用Cas9蛋白靶向切割基因組DNA,進而達到基因敲除的目的[6,7]。本研究利用CRISPR/Csa9技術,針對WT1基因的第一外顯子區域設計gRNA,擬在人肺癌A549細胞中靶向敲除WT1基因,觀察WT1基因敲除對A549細胞的生物學影響、在分子水平上進一步探索WT1基因與細胞凋亡的相關機制。
1 材料與方法
1.1 細胞株和主要試劑
人肺癌A549細胞和px459載體由北華大學醫學檢驗學院免疫教研室提供并保存。DMEM培養基和胎牛血清購自美國HyClone公司。Bbs I,Solution I購自美國Thermo Scientific公司。Bcl-2,Bax,TP53,β-actin抗體均購自美國Santa Cruz公司。質粒試劑盒,DNA提取試劑盒,BCA定量試劑盒,嘌呤霉素,Trizol A+試劑,DH5α,2 × Taq Plus PCR Master Mix均購自北京天根公司。熒光定量試劑盒,反轉錄試劑盒購自杭州博日公司。蛋白提取試劑盒購自上海碧云天公司。細胞凋亡檢測試劑盒購自北京凱基公司。測序樣品送至吉林庫美公司。
1.2 細胞培養
人肺癌A549細胞培養在含有10%胎牛血清的DMEM培養液中,待細胞長滿后按1∶3傳代,每48 h換液。待細胞融合度達到70%擬進行電轉染、備用。
1.3 WT1敲除載體構建和轉染
分析人的WT1序列(http://asia.ensembl.org/index.html):人的WT1基因有10個外顯子,編碼大約55 kDa的蛋白[2]。選擇第一外顯子區域,設計gRNA(http://crispr.mit.edu/),gRNA序列見表1。利用Solution I將gRNA連接到px459載體中,并在大腸桿菌中進行轉化,獲得的單克隆質粒,送公司進行Sanger測序。
實驗設對照組和敲除組兩組。待培養的A549細胞融合度達到70%,敲除組選擇鑒定正確的質粒,進行電轉染(BTX-ECM2001,電壓:300v 脈沖長度:3 ms、脈沖次數:1次)。電轉染后24 h,加入嘌呤霉素,對細胞進行篩選,培養5天后,收取細胞備用。對照組以空載體轉染,其它條件同敲除組。
1.4 流式細胞術分析
選擇Annexin V-FITC PI細胞凋亡檢測試劑盒,流式細胞儀(BD)分別對收取的敲除組及對照組細胞樣品進行凋亡檢測分析,具體操作方法按說明書。
1.5 DNA提取及鑒定
利用基因組DNA提取試劑盒分別對收取的敲除組及對照組細胞樣品進行提取,擬用于沉默WT1基因的鑒定,具體步驟參照試劑盒說明書。以基因組為模板,采用2 × Taq Plus PCR Master Mix進行擴增。具體條件如下:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共計35個循環;72 ℃ 5 min。PCR產物進行瓊脂糖凝膠電泳。紫外凝膠成像儀照相。WT1鑒定引物見表1。
1.6 RNA提取及qPCR分析
利用Trizol 法分別提取敲除組及對照組細胞樣品的RNA,擬用于qPCR分析,具體操作方法見說明書。將提取好的RNA利用反轉錄試劑盒,參照其說明書,進行反轉錄實驗。qPCR使用熒光定量試劑盒,進行擴增。反應程序采用三步法,具體條件為:①預變性,95 ℃,3 min;②變性為95 ℃,10 s,退火溫度為59 ℃,15 s,延伸為72 ℃,30 s。共計40個循環。熒光信號采集設置在延伸步驟中的72 ℃。③繪制融解曲線,設置為55 ℃,30 s。共計81個循環。實驗過程中,每一個待檢測樣品均重復檢測三次,檢測數據用于統計分析。凋亡相關基因引物見表1。采用2-ΔΔCT公式計算相對表達量。
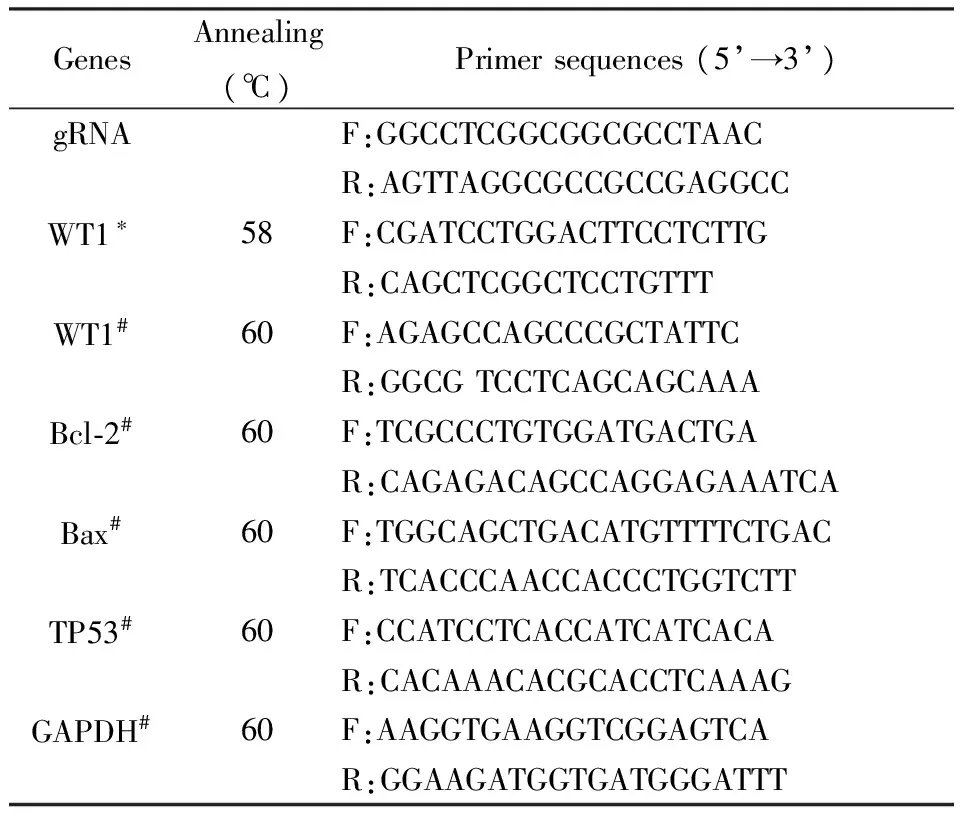
表1 gRNA和qPCR引物
注:*,用于DNA鑒定;#,用于qPCR。
1.7 蛋白提取及Western Blot分析
利用蛋白提取試劑盒分別對收取的敲除組及對照組細胞樣品進行蛋白提取,擬用于WesternBlot分析,具體步驟參照試劑盒說明書。從樣品中提取到的蛋白,利用BCA方法進行蛋白定量。配制12%丙烯酰胺凝膠,120 V,90 min,電泳,轉膜、封閉、加入一抗(Bcl-2,Bax,P53)過夜、加入二抗,避光孵育1 h。以β-actin作為內參,曝光拍照。
1.8 統計學分析

2 結果
2.1WT1基因靶向敲除表達載體的構建及鑒定
選擇人的WT1基因第一外顯子區域,設計gRNA進行切割(圖1A)。Sanger測序結果顯示,3例細胞單克隆樣品均有不同程度的堿基缺失(圖1B)。凝膠電泳結果顯示,對照組與WT1敲除組均出現的明顯條帶(圖1C)。qPCR結果顯示,與對照組相比,在A549細胞中,WT1敲除組表達顯著降低(P<0.01)(表2)。
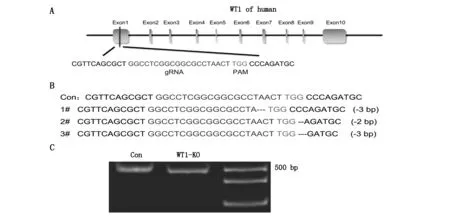
A schematic diagram of gRNA targeting the WT1 gene loci; B Sanger sequencing of WT1;
2.2 靶向敲除WT1基因后,對人肺癌A549細胞細胞凋亡的誘導
流式細胞儀分析顯示,對照組的凋亡率為(9.23 ±0.6 %),WT1敲除組凋亡率為(16.2±0.4%),差異顯著(P<0.01)(圖2,表2)。
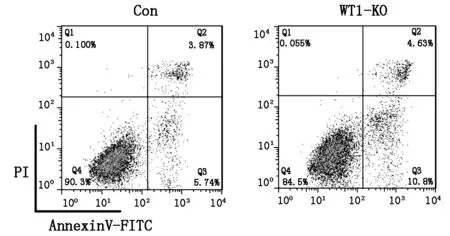
圖2 細胞凋亡分析

TestnConWT1?KOPvalueApoptosis39.233±0.622716.200±0.41630.0007?Bcl?2gene31.000±0.04080.575±0.08540.0041?Baxgene31.075±0.04791.400±0.08160.0139#TP53gene30.933±0.08820.785±0.40990.7416
*,P<0.01;#,P<0.05
2.3 相關凋亡基因和蛋白表達水平檢測
qPCR結果顯示,與對照組相比,WT1敲除組中Bcl-2的mRNA表達水平顯著降低(P<0.01),Bax表達上升(P<0.05),而TP53表達差異并不顯著(表2)。Western Blot結果顯示,Bcl-2蛋白表達下降,Bax表達上升,TP53蛋白表達無變化(圖3)。
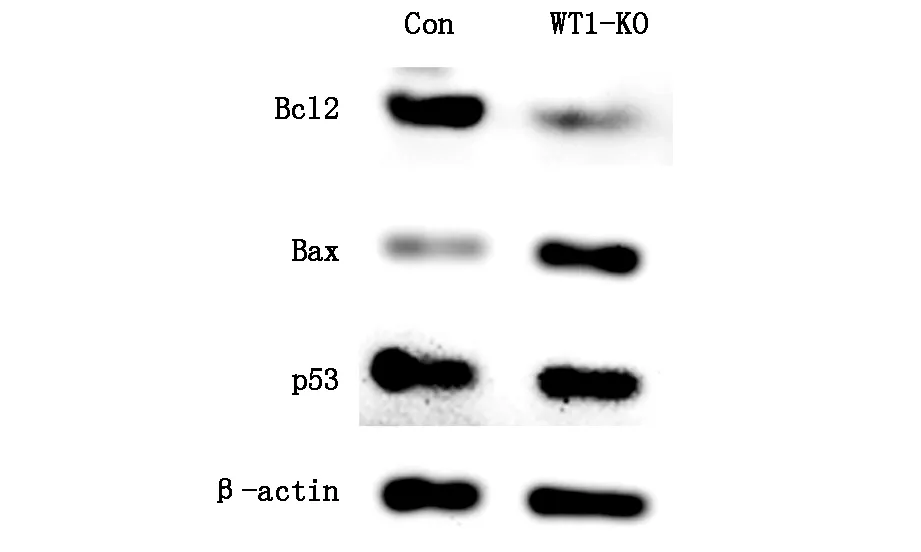
圖3 Bcl-2,Bax,P53蛋白表達
3 討論
WT1作為一種與癌癥密切相關的基因,一直是醫學研究的熱點之一,在乳腺癌、急性髓系白血病、腎母細胞瘤等腫瘤疾病中呈高表達[8]。抑制其過表達,可干擾腫瘤細胞的生長并促進其凋亡。在以往的研究中,通常使用RNA干擾的方法沉默WT1的表達[9,10]。但RNA干擾的方法本質是在轉錄水平,也就是RNA水平進行干預,因此并不能完全沉默目的基因[11]。與此相反,CRISPR/Csa9技術是在基因組水平對WT1進行切割,這就導致WT1基因序列的改變,進而引起基因功能的喪失[12]。在本實驗中,我們選擇人肺癌A549細胞做為靶細胞,利用CRISPR/Csa9技術成功構建WT1基因靶向敲除表達載體,擬用于轉染靶細胞,觀察敲除靶基因WT1后,人肺癌A549細胞的生長發展情況。
在成功獲得了低表達WT1基因的靶細胞后,流式細胞技術檢測結果顯示:在靶向敲除WT1基因后,人肺癌A549細胞凋亡顯著。這一結果與之前在HepG2[14]和人腦膠質瘤細胞[15]的報道一致。
有學者研究報道,WT1的異常表達可能會影響Bcl-2/Bax的表達[13],這提示靶向敲除WT1基因后,A549細胞發生凋亡的機制可能與Bcl-2/Bax等凋亡相關基因的表達異常有關。qPCR及WesternBlot實驗結果顯示敲除WT1后,A549細胞Bcl-2表達下降、Bax表達上升,但TP53并沒有變化。這提示靶向敲除WT1會影響凋亡基因Bcl-2/Bax的表達變化,進而誘導腫瘤細胞發生凋亡。
綜上所述,靶向敲除WT1基因會引起靶腫瘤細胞內Bcl-2/Bax表達發生變化,進而誘導細胞凋亡。這為進一步研究WT1基因與腫瘤細胞的發生發展及腫瘤治療提供了一定的實驗依據。
[1]Stiller CA,Parkin DM.International variations in the incidence of childhood renal tumours[J].British journal of cancer,1990,62:1026.
[2]Morrison AA,Viney RL,Ladomery MR.The post-transcriptional roles of WT1,a multifunctional zinc-finger protein[J].Biochim Biophys Acta,2008,1785:55.
[3]安培培.WT1基因對豬腎成纖維細胞和睪丸細胞的凋亡及發育基因表達影響的研究 [D].吉林大學,2013.
[4]齊曉偉.WT1在乳腺癌進展中的作用及機制研究 [D].第三軍醫大學,2012.
[5]萬鼎銘,邊志磊,劉延方等.急性髓系白血病患者骨髓WT1基因的表達與預后的關系[J].鄭州大學學報,2014,49(3):386.
[6]Shalem O,Doench JG,Zhang F,et al.Genome-scale CRISPR-Cas9 knockout screening in human cells[J].Science,2014,343(6166):84.
[7]Sessions JW,Alder JK,Jensen BD,et al.CRISPR-Cas9 directed knock-out of a constitutively expressed gene using lance array nanoinjection [J].SpringerPlus,2016,5(1):1521.
[8]Charlton J,Pritchard-Jones K.WT1 Mutation in Childhood Cancer[J].Methods in molecular biology,2016,1467:1.
[9]Li X,Nylander K,Li A,et al.Wilms' tumor gene 1 regulates p63 and promotes cell proliferation in squamous cell carcinoma of the head and neck [J].BMC Cancer,2015,15:342.
[10]周 靜,袁偉杰,謝院生,等.siRNA沉默WT1對小鼠細胞Wnt/β-catenin和nephrin表達的影響[J].中國病理生理雜志,2013,29(2):219.
[11]Jing Z,Wei-jie Y,Yi-Feng ZG.Down-regulation of Wt1 activates Wnt/beta-catenin signaling through modulating endocytic route of LRP6 in podocyte dysfunction in vitro [J].Cell Signal,2015,27(9):1772.
[12]Martin F,Pinedo-Gomez J,Benabdellah K,et al.Biased and Unbiased Methods for the Detection of Off-Target Cleavage by CRISPR/Cas9:An Overview[J].Int J Mol Sci,2016,17(9).pii:E1507.
[13]Mazzei L,Benardon ME,Manucha W,et al.WT-1 mRNA expression is modulated by nitric oxide availability and Hsp70 interaction after neonatal unilateral ureteral obstruction [J].Biocell,2010,34(3):121.
[14]Lv L,Li J,Gong J,et al.WT1-AS promotes cell apoptosis in hepatocellular carcinoma through down-regulating of WT1 [J].J Exp Clin Cancer Res,2015,34:119.
[15]Schittenhelm J,Meyermann R,Beschorner R,et al.WT1 expression in normal and neoplastic cranial and peripheral nerves is independent of grade of malignancy [J].Cancer biomarkers :section A of Disease markers,2010,7(2):73.
1007-4287(2017)08-1433-04
王曉明(1978-),吉林省人民醫院病理科,助理研究員、醫學碩士。
2016-07-19)

