解淀粉芽孢桿菌GSBa-1胞外多糖的發酵制取、流變學特性和應用
趙 雯,騰軍偉,張 健,趙 笑,姜云蕓,楊貞耐*
解淀粉芽孢桿菌GSBa-1胞外多糖的發酵制取、流變學特性和應用
趙 雯,騰軍偉,張 健,趙 笑,姜云蕓,楊貞耐*
(北京食品營養與人類健康高精尖創新中心,食品質量與安全北京實驗室,北京工商大學,北京 100048)
針對1 株從傳統酒曲中分離篩選得到的高產胞外多糖(exopolysaccharides,EPS)解淀粉芽孢桿菌GSBa-1,采用單因素試驗和響應面法確定了菌株的最優產EPS發酵條件:培養基組成為胰蛋白胨10 g/L、酵母浸粉5 g/L、蔗糖40 g/L、氯化鈉10 g/L;發酵溫度35 ℃、發酵時間36 h、搖床轉速160 r/min、接種量4%,在此條件下EPS產量為326.45 mg/L。對EPS的流變特性進行研究,結果表明,該EPS溶液的黏度較低,具有濃度依賴性和剪切變稠的特性,隨著溫度升高,黏度降低。采用激光光散射儀輔助測量EPS的分子形態:得到EPS在水溶液中重均分子質量為4.993×105g/mol,回旋半徑為48.34 nm,流體力學半徑為64.62 nm,結構參數為0.748,該分子可能為緊密的球狀結構。透射電子顯微鏡觀察驗證了EPS的球狀結構。將該EPS加入到酸性乳飲料中,既不會增加其黏度,又具有良好的穩定特性,表明解淀粉芽孢桿菌GSBa-1 EPS可以作為一種新型的食品穩定劑,具有潛在的應用價值。
胞外多糖;流變特性;激光光散射;酸性乳飲料
胞外多糖(exopolysaccharide,EPS)是由微生物(細菌、真菌、微藻類和酵母)在其生長繁殖的過程中分泌到外界環境中的一種長鏈、高分子物質[1]。通常EPS具有良好的水溶性、穩定性、保水性、增稠性、凝膠性以及乳化特性,是潛在的食品穩定劑[2-3]。在食品中,EPS一方面可以作為增稠劑,賦予食品良好的口感,另一方面可以作為穩定劑,結合水并限制物料的脫水收縮[4]。此外,不同的微生物可形成不同類型的EPS,既具有不同的功能特性,也可以耐受更大范圍的溫度、pH值以及離子強度,可以適應不同的食品加工過程[5]。目前常見的微生物EPS有黃原膠、結冷膠、琥珀酰聚糖等。
微生物EPS的產量受其生長環境的影響顯著。溫度、壓力、甚至是光照強度都會直接影響EPS的產量[6-7]。不同的氮源、碳源、無機鹽離子以及pH值不僅會影響EPS的產量,甚至會影響其組成和理化性質。苛刻的外界環境可能會抑制微生物生長進而降低EPS產量,但也有可能刺激微生物分泌大量多糖以保護自身不受不良環境因素傷害。目前關于微生物EPS的報道中,多糖的產量從0.002 2 g/L到86.3 g/L不等[8]。
酸性含乳飲料因其清爽自然的口感以及較高的營養價值而頗受消費者歡迎,但是其加工過程的殺菌工藝和酸性環境,易導致料液組織狀態不穩定,出現蛋白質沉淀、脂肪球上浮等現象[9]。通常情況下膠體系統的穩定性依賴于外界環境條件(pH值、溫度、離子強度等)、蛋白質-多糖的比例和濃度。當外界環境條件相同時,多糖的類型便成為了決定體系均一的主要因素[10-11]。目前少有關于適用于酸性乳飲料中具有良好穩定性又不會增加漿料黏稠度的多糖類穩定劑的報道[12]。
本研究針對一株從傳統酒曲中篩選得到的產EPS的解淀粉芽孢桿菌(Bacillus amyloliquefaciens)GSBa-1,采用響應面優化其培養基的組成,旨在提高該菌株產EPS的能力。進一步研究其流變學特性,探討其作為穩定劑應用于酸性乳飲料中的可行性,為EPS的產業化提供理論支持。
1 材料與方法
1.1 材料與試劑
解淀粉芽孢桿菌GSBa-1由本實驗室分離純化并冷凍保存。
胰蛋白胨、蛋白胨、大豆蛋白胨、酵母浸粉、牛肉膏、可溶性淀粉、蔗糖、麥芽糖、葡萄糖、果糖、氯化鈉、氯化鈣、氯化鎂、碳酸鈣、七水合硫酸鎂、濃硫酸、重蒸酚、三氯乙酸(trichloroacetic acid,TCA)、無水乙醇(均為分析純) 國藥集團化學試劑有限公司;果膠、羥丙基淀粉酯、羧甲基纖維素鈉(carboxymethylcellulose sodium,CMC)、大豆多糖河南千志商貿有限公司;實驗用水為超純水。
細菌基礎培養基(LB培養基):胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化鈉10 g/L、瓊脂粉20 g/L,于121 ℃高溫滅菌20 min。
細菌基礎發酵培養基:胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化鈉10 g/L,121 ℃高溫滅菌20 min。
1.2 儀器與設備
MLS-3750高壓蒸汽滅菌鍋 日本三洋公司;CR21GⅢ高速冷凍離心機 日本Hitachi公司;HZQ-Q氣浴恒溫搖床 哈爾濱東聯電子科技有限公司;Elx800型酶標儀 美國伯騰儀器有限公司;S20型數顯pH計瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 種子液的制備
挑取-80 ℃冰箱中甘油管保藏的解淀粉芽孢桿菌GSBa-1,于LB固體平板劃線活化,30 ℃培養箱中培養24 h。挑取少量單一菌落接種到細菌發酵培養基中,裝液量30%,于30 ℃、120 r/min條件下搖床培養24 h作為種子液。
1.3.2 解淀粉芽孢桿菌GSBa-1產EPS的分離提取
EPS的提取方法參照Wang Ji等[13]稍作改動。解淀粉芽孢桿菌GSBa-1發酵結束后,100 ℃水浴加熱15 min,以滅活可能會降解多糖的酶類。向發酵液中加入80% TCA,調節TCA質量分數至4%。室溫振蕩4 h后,4 ℃、10 000 r/min離心40 min,以除去破碎的細胞和蛋白質。向上清液中加入2 倍體積的無水乙醇置于4 ℃冰箱中過夜。4 ℃、10 000 r/min離心40 min,去上清液,用蒸餾水溶解沉淀,裝入截留分子質量為8~14 kD的透析袋中,每8 h換一次水,透析48 h。
1.3.3 EPS含量的確定
采用苯酚-硫酸法測透析液中EPS含量,以葡萄糖為標準品,分別配制0、20、40、60、80、100、120、140、160、180、200 mg/L的葡萄糖溶液,于490 nm波長處測吸光度。測得的葡萄糖標準曲線回歸方程為:y=0.008 78x+0.009 9,R2=0.999 4。
1.3.4 解淀粉芽孢桿菌GSBa-1產EPS單因素試驗設計
對影響EPS產量的主要因素進行單因素試驗,分別選定氮源、碳源、蔗糖質量濃度、發酵溫度、無機鹽離子和初始培養基的pH值作為單因素。
1.3.4.1 碳源種類對EPS產量的影響
以1.1節中酵母浸粉為唯一碳源的基礎上,分別添加果糖、蔗糖、麥芽糖、乳糖、可溶性淀粉和葡萄糖,添加量為10 g/L,接種量4%,發酵溫度35 ℃,發酵時間36 h,搖床轉速120 r/min,分別測定EPS產量。
1.3.4.2 蔗糖質量濃度對EPS產量的影響
向1.1節基礎發酵培養基中分別加入10、20、30、40、50 g/L的蔗糖,接種量4%,發酵溫度35 ℃,發酵時間36 h,搖床轉速120 r/min,分別測定EPS產量。
1.3.4.3 氮源種類對EPS產量的影響
在1.1節的基礎上,分別選取蛋白胨、大豆蛋白胨、牛肉膏、脫脂奶粉來替代基礎培養基中的胰蛋白胨,添加量為10 g/L。接種量4%,發酵溫度35 ℃,發酵時間36 h,搖床轉速120 r/min,分別測定EPS產量。
1.3.4.4 發酵溫度對EPS產量的影響
在1.1節的基礎上,在接種量4%、搖床轉速160 r/min的條件下培養24 h,測定不同的發酵溫度(25、30、35、40、45 ℃)條件下EPS產量。
1.3.4.5 發酵時間對EPS產量的影響
在1.1節的基礎上,在接種量4%、發酵溫度35 ℃、搖床轉速120 r/min的條件下,測定不同的發酵時間(12、24、36、48、60、72 h)條件下EPS產量。
1.3.4.6 無機鹽離子對EPS產量的影響
在1.1節的基礎上,分別選取氯化鈉、硫酸鎂、氯化鈣、碳酸鈣、氯化鎂作為無機鹽,添加量為10 g/L。接種量4%,發酵溫度35 ℃,發酵時間36 h,搖床轉速120 r/min,分別測定EPS產量。
1.3.4.7 初始培養基pH值對EPS產量的影響
在1.1節的基礎上,調節初始培養基pH值分別為5、6、7、8、9。接種量4%,發酵溫度35 ℃,發酵時間36 h,搖床轉速120 r/min,分別測定EPS產量。
1.3.5 響應面試驗
根據單因素試驗結果,選取發酵溫度、發酵時間和蔗糖質量濃度3 個因素,以EPS產量為響應值,根據Box-Behnken原理,設計三因素三水平響應面試驗,每組試驗重復3 次,結果見表1。通過Design-Expert 8.0.5b軟件,分析該菌株產EPS最佳發酵條件,得到最優條件后,通過驗證實驗,證明模型的有效性。
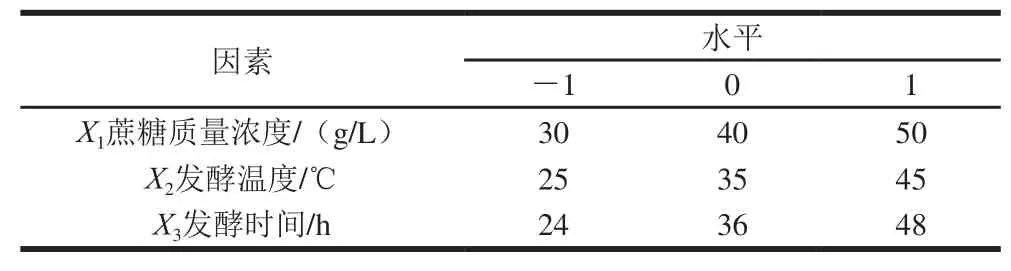
表1 響應面試驗因素與水平Table 1 Code and level of independent variables used for response surface methodology
1.3.6 流變學實驗測定
分別配制0.3、0.5、1.0 mg/mL EPS溶液,使用流變儀(CC10號轉子)分別測定其在不同的剪切速率(0~300 s-1)以及不同溫度(0~70 ℃)條件下的流變學行為。
1.3.7 激光光散射測定
配制0.4 mg/mL的EPS溶液,45 ℃水浴加熱4 h,輕輕攪動至完全溶解,過0.22 μm的濾膜。置于無塵處理過的石英池(25 mm)中,通過靜態和動態激光光散射儀在40 ℃、功率22 mW、波長632.8 nm條件下測定EPS流體力學半徑(hydrodynamic redius,Rh)、重均分子質量(weight-average molecular weight,mw)和均方回轉半徑(ridus of gyration,Rg)。結合Rg和Rh,可以計算結構參數:ρ=Rg/Rh。ρ是多聚體或膠體的重要特征參數,取決于高分子的鏈結構、構象和多分散性,與分子質量無關。
1.3.8 TEM觀察
采用透射電子顯微鏡(transmission electron microscope,TEM)對EPS的分子形態進行觀察。將EPS溶于無菌水中至終質量濃度0.5 mg/L,振搖4 h使其充分溶解,過0.22 μm濾膜。取一滴EPS溶液滴于覆有薄碳層的鋼絲膜上,室溫蒸發除水。200 kV條件下觀察EPS形態。
1.3.9 EPS在酸性乳飲料中的應用
1.3.9.1 調制酸性乳飲料
巴氏殺菌奶3.6%,蔗糖5%,分別加入0.1%、0.2%、0.3%、0.4%、0.5%的EPS、果膠、CMC、羥丙基淀粉酯和大豆多糖,混合均勻后冷卻到20 ℃以下,用10%檸檬酸調pH值至5.5。20 MPa均質后分裝于牛奶瓶,100 mL/瓶,巴氏殺菌(75 ℃、15 min)后室溫保存,通過測定其保水率來評估其穩定性[14]。
1.3.9.2 保水率測定
在有刻度的試管中,準確加入調制好的飲料20 mL,記錄試管質量m0,加入樣品后的質量m1。4 000 r/min離心20 min,棄去上清液,準確稱量沉淀物質量m2,根據下式計算保水率:
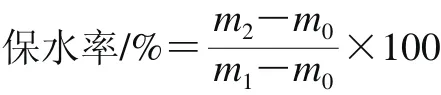
1.3.9.3 黏度測定
用布氏流變儀測定各酸性乳飲料黏度。選用34號轉子,剪切速率5 r/min,變量范圍為0~120 s-1。測定其黏度變化。
2 結果與分析
2.1 單因素試驗結果
2.1.1 碳源種類對EPS產量的影響
碳源一直是影響EPS產量的重要因素。不同的碳源種類對于同一菌株或者同一菌株對于不同的碳源,EPS產量都不相同。Polak-Berecka等[15]指出當使用乳糖作為碳源,Lactobacillus rhamnosus R的EPS產量相比于葡萄糖作為碳源會有大幅下降。
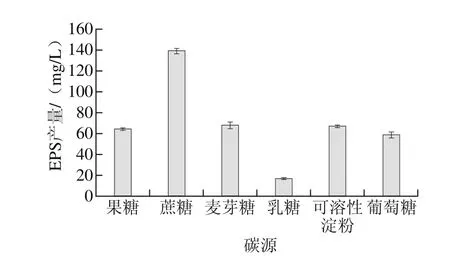
圖1 碳源種類對EPS產量的影響Fig. 1 Effect of carbon source on the yield of EPS
由圖1可知,以蔗糖作為碳源時EPS產量最大,因此選擇蔗糖作為培養基的碳源,此時最優產量為139.04 mg/L。
2.1.2 蔗糖質量濃度對EPS產量的影響
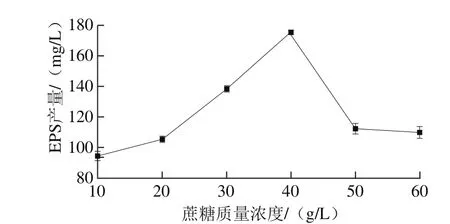
圖2 蔗糖質量濃度對EPS產量的影響Fig. 2 Effect of sucrose concentration on the yield of EPS
由圖2可知,隨著蔗糖質量濃度增加,可供菌體利用轉化的糖類底物質量濃度增加,當蔗糖質量濃度為40 g/L時,EPS產量為176 mg/L。繼續增加蔗糖質量濃度,則會對菌體產生滲透脅迫,抑制菌體生長,因此在本試驗中選取40 g/L為最適的蔗糖質量濃度。
2.1.3 氮源種類對EPS產量的影響
生物量是影響EPS產量的一個主要因素。研究表明氮源的添加有益于細胞生長,增加菌體密度,促進菌體細胞將糖類物質轉化為多糖[16]。De等[17]研究指出向MRS培養基中添加(NH4)2HPO4后,Rhzobium radiobacter CGMCC 12099產凝膠多糖是無氮源添加的2.1 倍。
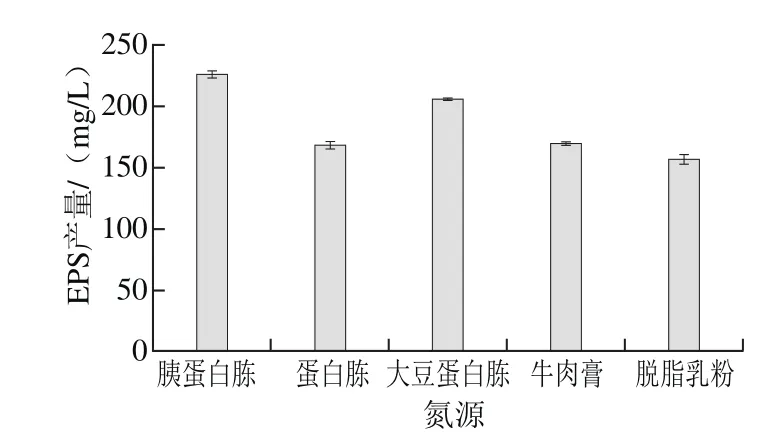
圖3 氮源種類對EPS產量的影響Fig. 3 Effect of nitrogen source on the yield of EPS
由圖3可知,胰蛋白胨作為氮源時,EPS產量最高,為226.24 mg/L。其次為大豆蛋白胨、牛肉膏、蛋白胨和脫脂乳粉,因此,選擇胰蛋白胨作為氮源進行下一步試驗。
2.1.4 發酵溫度對EPS產量的影響
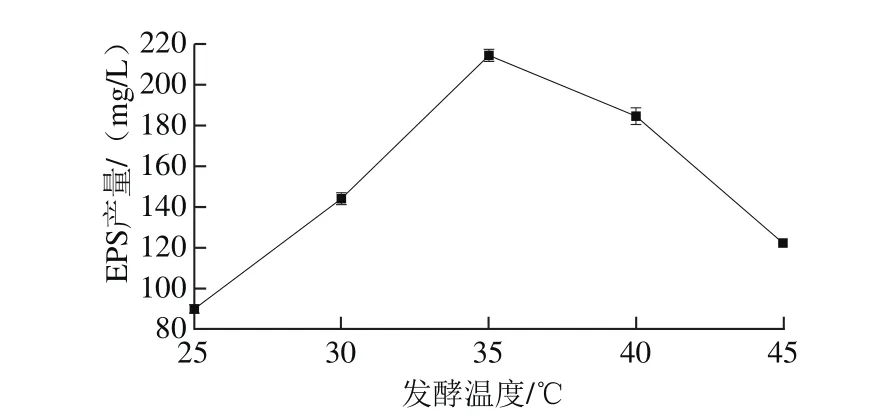
圖4 發酵溫度對EPS產量的影響Fig. 4 Effect of the fermentation temperatures on the yield of the EPS
由圖4可知,在35 ℃時,EPS產量達到最大值214.11 mg/L。但是隨著溫度升高,EPS產量下降,可能是高溫導致菌體合成多糖的酶活力下降。因此選擇35 ℃為最適的發酵溫度。
2.1.5 發酵時間對EPS產量的影響
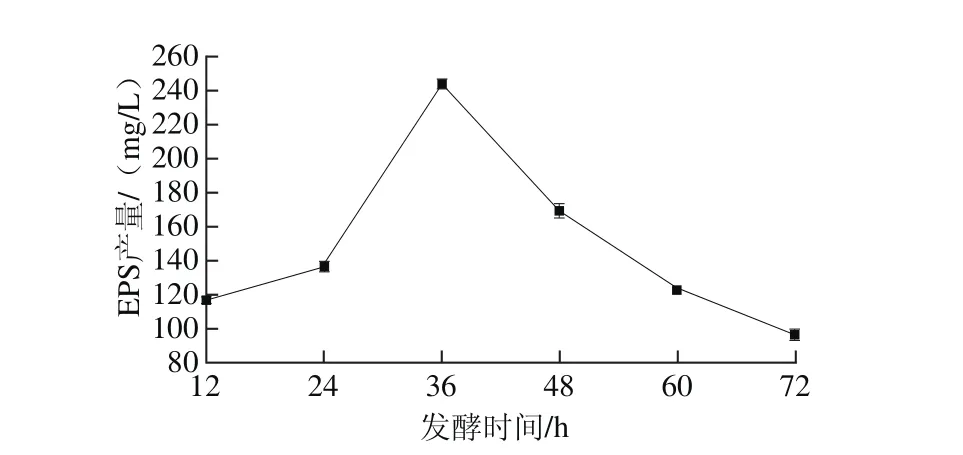
圖5 發酵時間對EPS產量的影響Fig. 5 Effect of fermentation time on the yield of EPS
如圖5所示,隨著發酵時間的延長,EPS產量呈現先增加后降低的趨勢,在36 h時,EPS的產量達到最大值243.62 mg/L。36 h后多糖的產量呈現大幅度下降,可能是由于酶解或者培養環境理化參數的改變[18]。發酵時間延長,菌體自溶,分解代謝多糖的酶分泌到胞外,進而降低EPS產量,因此在后續的試驗中選取36 h為最佳發酵時間。
2.1.6 無機鹽離子對EPS產量的影響
培養基中的金屬離子會影響菌體生長代謝相關的酶類。一方面直接影響與菌體糖代謝直接相關的酶類活性,另一方面調節培養基的滲透壓、pH值、氧化還原電位等來影響EPS的生成[19]。當微生物生長缺乏微量元素時會導致細胞生長緩慢,但過量又會對微生物機體產生毒害作用。因此,需要控制培養基中無機鹽離子的種類和比例。
由圖6可知,氯化鈣對EPS產量的影響最明顯,添加量為10 g/L時,EPS產量為153.12 mg/L。
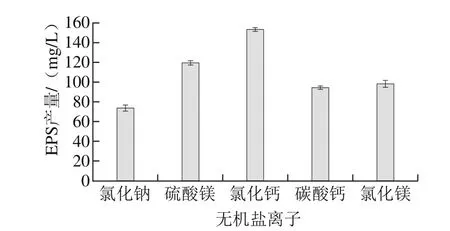
圖6 無機鹽離子對EPS產量的影響Fig. 6 Effect of inorganic salt ions on the yield of EPS
2.1.7 初始培養基pH值對EPS產量的影響
每種菌株都有其最適的生長和產EPS pH值范圍。pH值大小同樣會影響微生物生長過程中代謝酶和產物生成酶的活性。只有在最適pH值范圍內,才能最大程度提高酶促反應的速率,使微生物生長和代謝產物合成速率達到最大[20]。
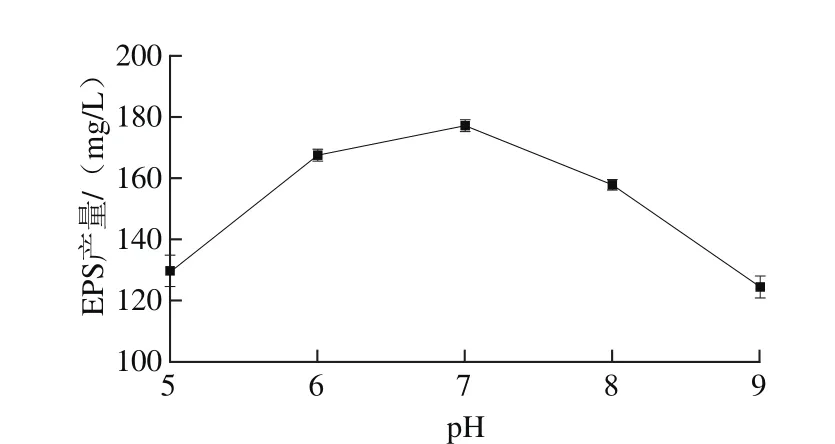
圖7 初始pH值對EPS產量的影響Fig. 7 Effect of initial pH on the yield of EPS
由圖7可知,隨著pH值的不斷升高,EPS產量呈現先增大后減小的趨勢,最適pH值為7,此時EPS產量為176.99 mg/L,明顯高于其他pH值條件。這與大多數研究結果相一致[21-22]。
通過以上單因素試驗能夠得出本試驗的最佳培養基組成為:蔗糖40 g/L、胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化鈉10 g/L。
2.2 響應面法優化發酵最佳條件
2.2.1 響應面試驗結果
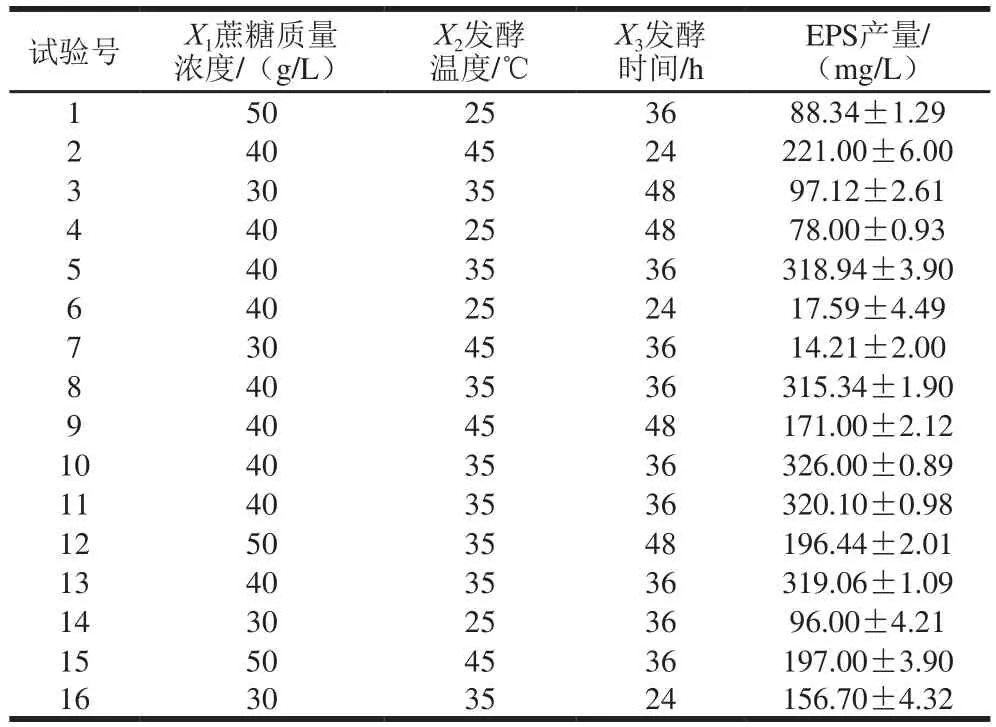
表2 Box-Behnken設計方案及結果Table 2 Box-Behnken design with response values
根據Box-Behnken原理,設計三因素三水平的響應面分析試驗。通過Design-Expert響應面設計軟件分析,共有16 個試驗點,以蔗糖質量濃度、發酵溫度、發酵時間為自變量,以EPS產量為響應值,不同試驗條件下所得的EPS產量如表2所示。
2.2.2 試驗模型的建立及顯著性分析
以EPS產量作為響應指標,利用Design-Expert 7.1.6軟件對表進行二次多元回歸擬合,得到EPS產量(Y)對編碼自變量X1、X2、X3的二次多項回歸方程:Y=320.20+ 19.38X1+37.38X2-22.00X3+21.75X1X3-98.85X12-89.85X22-67.10X32。
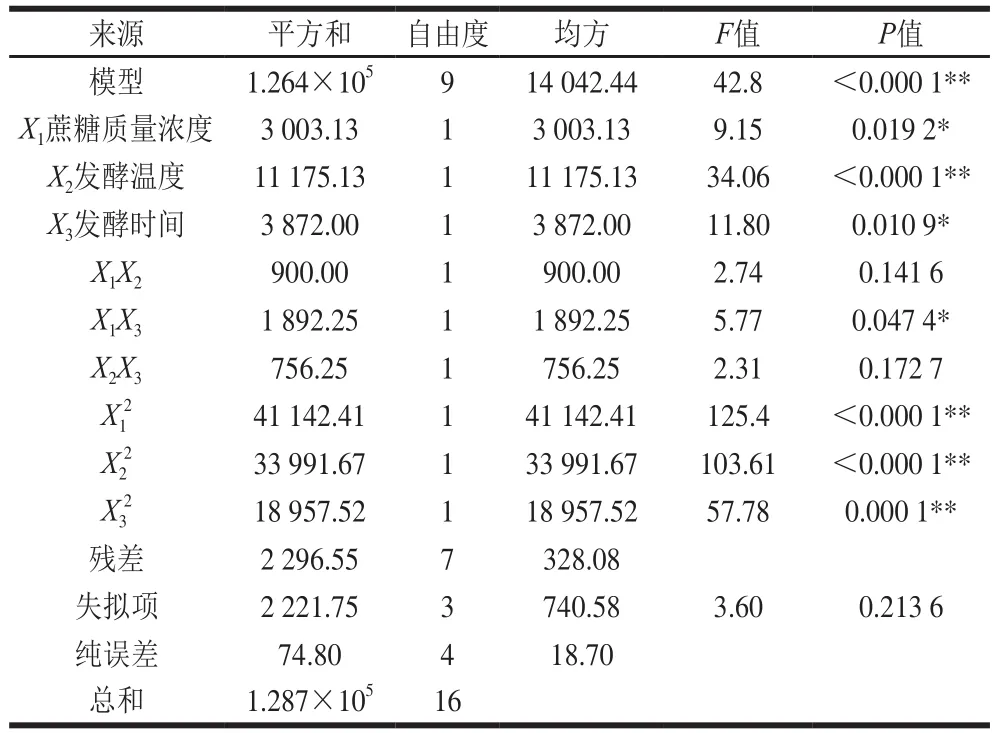
表3 回歸模型的方差分析Table 3 Analysis of variance of regression model
由表3可知,在設計的水平內,模型的F值為106.46,影響顯著。函數的相關系數R2為0.982 2,R2值越接近1說明誤差的影響越小,表明該函數可以較好地模擬發酵過程。校正系數R2Adj為0.959 2,說明95.92%的響應值變化可以用該模型來表示。失擬項的F值為3.60,P=0.213 6>0.05,即失擬不顯著,表明該函數關系可以充分的表現真實的發酵情況。通過比較各因素的F值,可以得出其對EPS產量的影響由大到小分別為:X2>X3>X1。其中,模型的一次項X2影響極顯著,X1和X3對EPS產量影響顯著,二次項X12、X22、X32極顯著,交互項X1X3顯著,其他交互項不顯著。以上結果表明各影響因素對發酵條件的影響不是簡單的線性關系。
2.2.3 響應面交互作用分析
由圖8a可知,等高線近似圓形,表明蔗糖質量濃度和發酵溫度交互作用不顯著。將發酵時間控制為0 h時,蔗糖質量濃度設定為固定值,隨著發酵溫度的逐漸升高,EPS產量先增大后減小,在發酵溫度25~45 ℃范圍內,EPS產量達到最大。
由圖8b可知,發酵時間和蔗糖質量濃度的等高線圖呈橢圓形,說明二者交互作用顯著。固定發酵溫度為0 ℃時,固定發酵時間為一固定值,隨著蔗糖質量濃度的升高,EPS產量提高。
由圖8c可知,發酵溫度和發酵時間的等高線圖接近圓形,說明二者交互作用不顯著。固定蔗糖質量濃度為零,當發酵溫度一定時,隨著發酵時間的延長,EPS的產量先增大后減少。
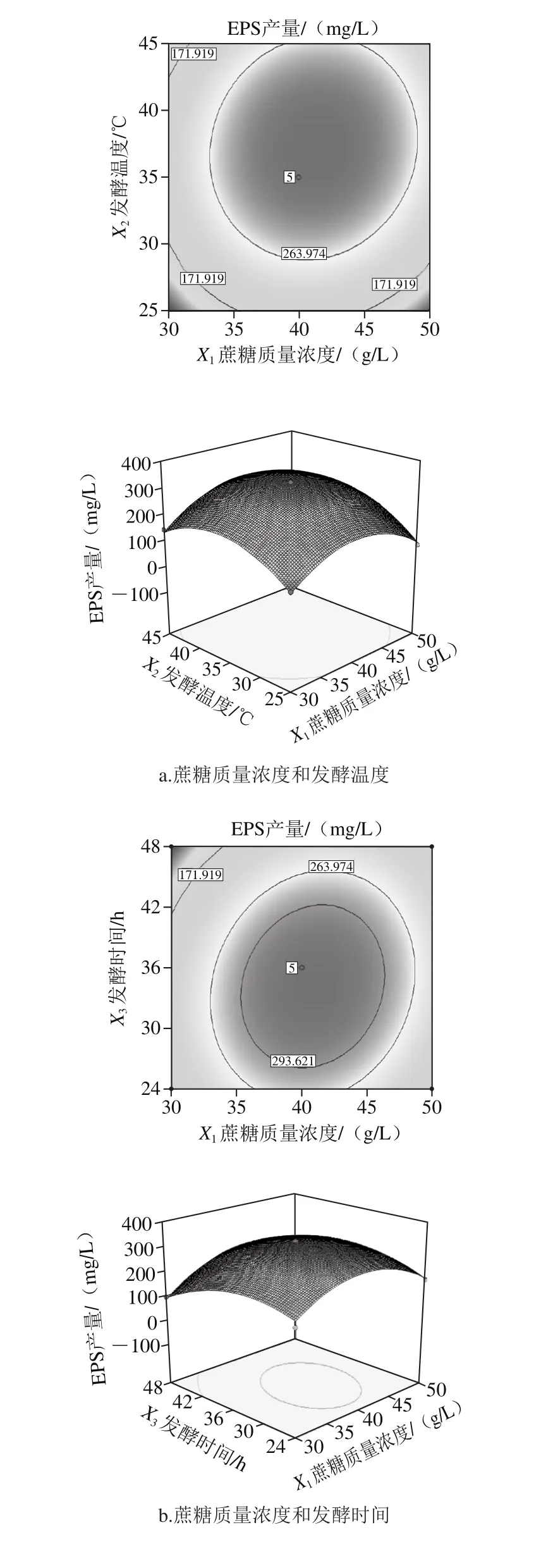
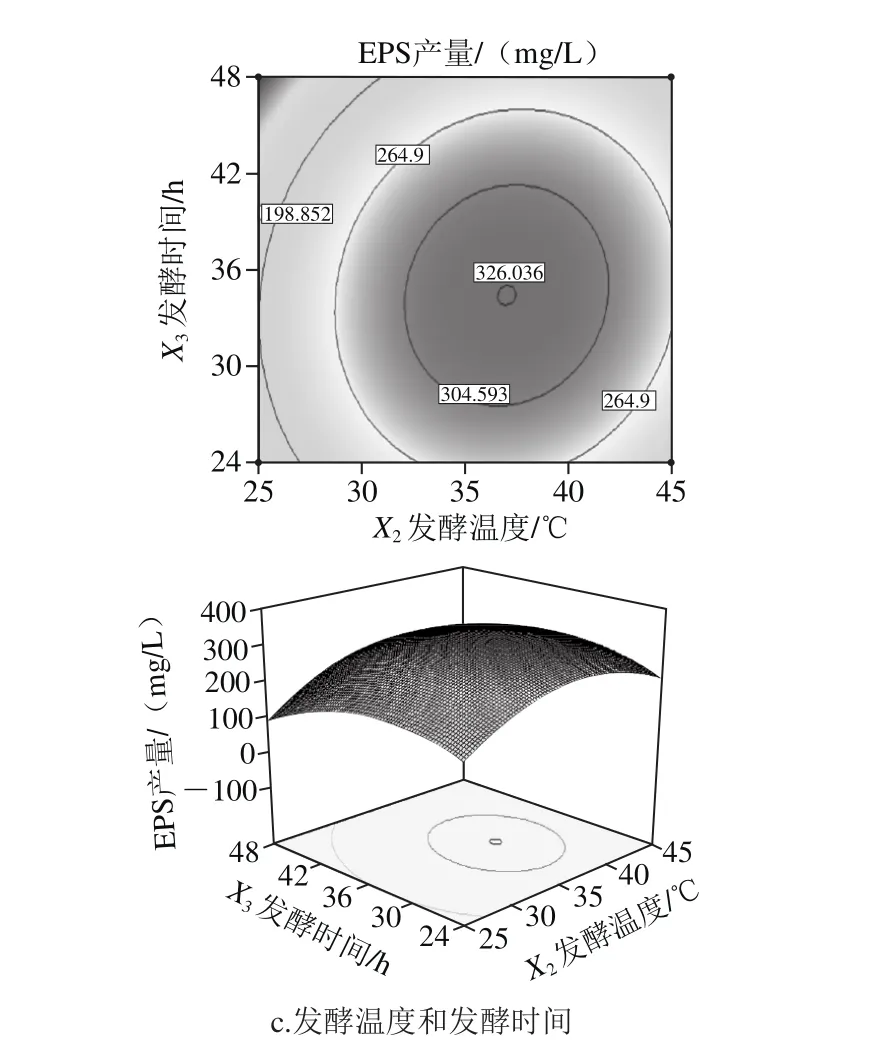
圖8 各因素交互作用對EPS產量影響的等高線和響應面圖Fig. 8 Response surface and contour plots showing the effects of various factors on the yield of EPS
綜上可知,響應值Y存在最大值,該值越大說明發酵水平越穩定,確定最大穩定點。因此發酵最佳條件為蔗糖質量濃度40 g/L、發酵時間36 h、發酵溫度35 ℃。帶入擬合的函數式,得到預測的EPS產量為327.594 mg/L。驗證實驗采用模型條件進行發酵,3 個平行實驗取平均值,所得到的結果為326.45 mg/L,與預測結果基本一致,說明該模型適用于模擬實際情況。
2.3 EPS的流變特性
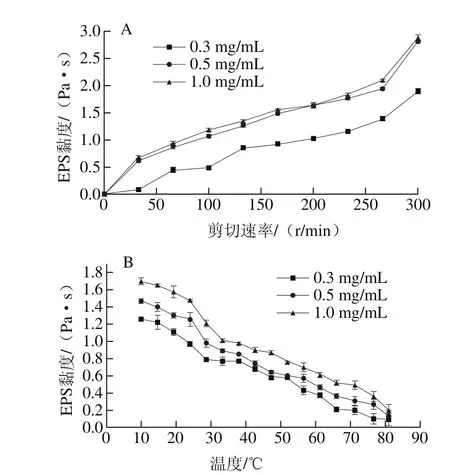
圖9 不同質量濃度EPS溶液在不同剪切速率(A)和溫度(B)條件下的黏度Fig. 9 Viscosity of EPS solution as a function of shearing rate and temperature
由圖9A可知,1 mg/mL EPS溶液仍表現出了較低的黏度。0.3、0.5、1.0 mg/mL EPS溶液黏度隨著剪切速率的升高而升高,表現出剪切增稠的現象。此現象在其他研究中也有報道[15-17],隨著剪切速率的增加可能會打破原本堅硬規則的結構,致使黏度增加。由圖9B可知,隨著溫度的升高其黏度下降,這與大多數報道相符,高溫會打破分子原本的規則結構使其呈現較為稀松的構象[23-25],降低其分子間的接觸頻率。另一方面高溫同樣也會導致EPS內部的分子發生重排,打破其結構完整性[26]。
2.4 EPS的光散射測定結果
通過光散射測量高分子的mw、Rg以及第二維里系數(A2);確定高分子的形狀。
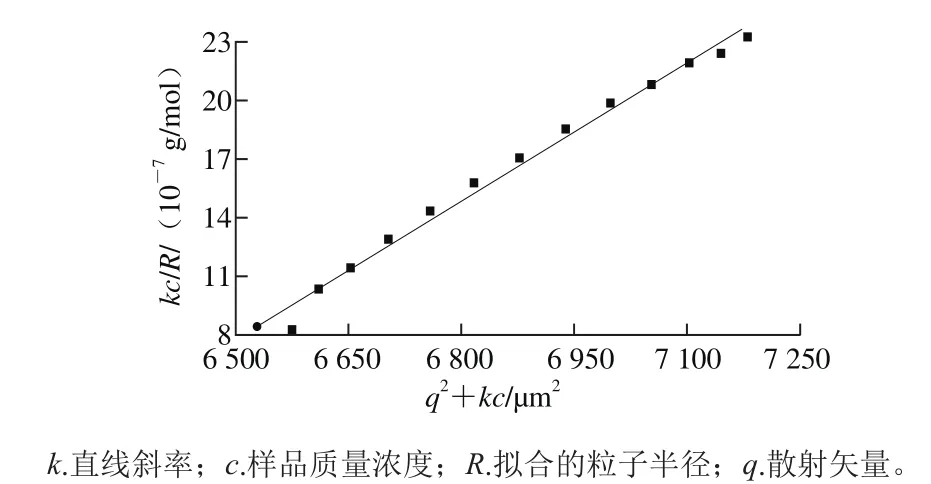
圖10 0.4 mg/mL EPS溶液靜態光散射的Zimm圖Fig. 10 Zimm plot of 0.4 mg/mL EPS solution
如圖10所示,0.4 mg/mL的EPS溶液在小散射角度沒有發生彎曲,說明該溶液中分子沒有發生聚集。當只有一個質量濃度的光散射數據時,如果質量濃度足夠低,該濃度下數據點成直線,該直線可以看做Zimm圖中c為0的線,可以根據該直線的斜率與截距計算mw、Rg。EPS在水溶液中mw為4.993×105g/mol,Rg為48.34 nm。
通過光散射儀在90°測得的EPS在水溶液中的Rh為64.62 nm。經計算得ρ為0.748,對于單分散體系來說,ρ等于0.775為致密球體。ρ在1.5~1.8之間為柔性無規則卷曲的鏈狀結構。ρ大于2為舒展的鏈結構[27]。因此推測該EPS可能為致密的球體結構。
2.5 EPS的TEM觀察結果

圖11 0.4 mg/mL的EPS溶液在TEM下的圖像Fig. 11 Transmission electron microscope images of 0.4 mg/mL EPS solution
如圖11所示,EPS在水溶液中,40 000 倍放大觀察,呈現黑色球體或橢圓形結構,在灰色背景下分子直徑在30~150 nm范圍內。這與Ren Wei等[28]TEM觀察Paenibacillus bovis sp. nov BD3526的EPS結構相一致。這種球形結構在嗜熱鏈球菌、變異鏈球菌和枯草芽孢桿菌EPS的結構解析中也曾有過報道[29]。這種球形結構可能是導致溶液低黏度的主要原因,相比于桿狀或者片狀的EPS,球狀的EPS在水溶液中具有較低的溶脹特性,分子間相互作用較少,不易使溶液增稠[30-32]。
2.6 EPS在酸性乳飲料中的應用
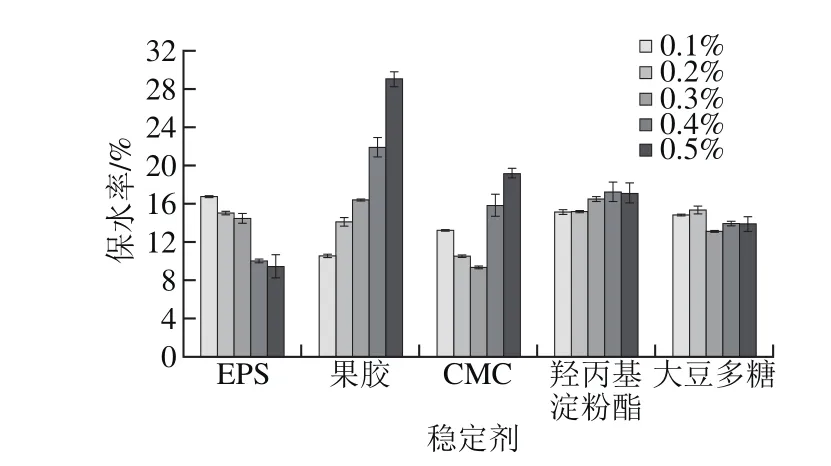
圖12 EPS溶液及常見穩定劑對酸性乳飲料保水性的影響Fig. 12 Effect of EPS solution and several common stabilizers on the water retention of acid beverage
由圖12可知,當EPS添加量為0.1%時,具有和大豆多糖、羥丙基淀粉酯相似的保水特性。隨著EPS含量的增加,其保水率略有下降,當EPS含量超過0.3%時,其保水性下降幅度較大。可能是因為粗EPS樣品中含有雜質,阻礙了其分子之間的相互作用[33-34]。
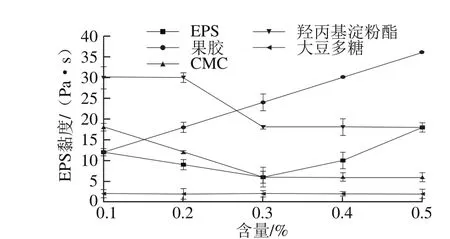
圖13 不同含量的EPS和穩定劑添加對酸性乳飲料的黏度影響Fig. 13 Effect of different concentrations of EPS solution and stabilizers on the viscosity of acid beverage
如圖13所示,當含量超過0.4%時,CMC表現出了良好的穩定性。果膠雖然具有較為明顯的穩定性優勢,但是隨著含量增加,果膠具有較為明顯的增稠作用,同時羥丙基淀粉酯也會使料液黏度增加,羥丙基淀粉酯在0.1%的添加量情況下,溶液黏度達到30 Pa?s,而EPS只有12 Pa?s。隨著EPS含量的增加,酸性乳飲料的黏度表現出了先下降后上升的趨勢。
綜上可知,大豆多糖具有較好的穩定性,并且隨著含量的增加,不會改變料液的黏度。CMC含量大于0.4%時,可以在不增大料液黏度的前提下具有良好的穩定性。但與之相比,添加0.3%粗EPS可以具有與0.3% CMC相同的黏度,但是穩定性明顯優于CMC,其中果膠和羥丙基淀粉酯會明顯增加料液稠度,并不適合單獨應用于酸性乳飲料。綜合結果表明,該EPS具有低黏度以及良好的穩定性,具有作為新型食品穩定劑的潛力。
3 結 論
本研究針對一株從傳統的江米酒酒曲中篩選得到的解淀粉芽孢桿菌GSBa-1,通過單因素試驗和響應面試驗對其產EPS的條件進行優化。得到最佳的發酵條件為:胰蛋白胨10 g/L、酵母浸粉5 g/L、蔗糖20 g/L、氯化鈣10 g/L、發酵溫度35 ℃、發酵時間36 h、搖床轉速160 r/min、接種量4%。在此條件下EPS產量為326.45 mg/L。經驗證該模型可靠。
使用哈克流變儀對不同質量濃度的EPS溶液進行流變學測定,結果表明該EPS溶液具有較低的黏度,且其黏度隨著質量濃度和剪切速率的增加而增加,隨著溫度升高而降低。根據光散射儀測定該EPS的流體流體力學半徑和回旋半徑,推測該EPS為緊密的球狀分子。采用TEM對該EPS分子進行形態觀察,驗證了該EPS球狀結構。
將提取得到的EPS作為穩定劑添加于酸性乳飲料中,該產品的穩定性與添加大豆多糖的酸性乳飲料相接近,其黏度高于大豆多糖,與添加CMC的酸性乳飲料相接近。綜合研究表明解淀粉芽孢桿菌GSBa-1 EPS具有作為食品穩定劑的應用前景。
[1] BERGILLOS-MECA T, CABRERA-VIQUE C, ARTACHO R, et al. Does Lactobacillus plantarum or ultrafiltration process improve Ca, Mg, Zn and P bioavailability from fermented goats’milk?[J]. Food Chemistry, 2015, 187: 314-321. DOI:10.1016/ j.foodchem.2015.04.051.
[2] SAIJA N, WELMAN A D, BENNETT R J. Development of a dairybased exopolysaccharide bioingredient[J]. International Dairy Journal, 2010, 20(9): 603-608. DOI:10.1016/j.idairyj.2010.03.011.
[3] KHATTAR J, JINDAL N. Isolation and characterization of exopolysaccharides produced by the cyanobacterium Phormidium valderianum[J]. Journal of Biotechnology, 2008, 136: 423-424. DOI:10.1016/j.jbiotec.2008.07.981.
[4] BULDO P, BENFELDT C, FOLKENBERG D M, et al. The role of exopolysaccharide-producing cultures and whey protein ingredients in yoghurt[J]. LWT-Food Science and Technology, 2016, 72: 189-198. DOI:10.1016/j.lwt.2016.04.050.
[5] JOLLY L, STINGELE F. Molecular organization and functionality of exopolysaccharide gene clusters in lactic acid bacteria[J]. International Dairy Journal, 2010, 11(9): 733-745. DOI:10.1016/S0958-6946(01)00117-0.
[6] 曹永強, 王輯, 趙笑, 等. 植物乳桿菌YW11生產胞外多糖的發酵條件研究[J]. 食品科學技術學報, 2016, 11(1): 42-49; 78.
[7] HAHN C, MULLER E, WILLE S, et al. Control of microgel particle growth in fresh cheese (concentrated fermented milk) with an exopolysaccharide-producing starter culture[J]. International Dairy Journal, 2014, 36(1): 46-54. DOI:10.1016/j.idairyj.2013.12.011.
[8] DONOT F, FONTANA A, BACCOU J C, et al. Microbial exopolysaccharides: main examples of synthesis, excretion, genetics and extraction[J]. Carbohydrate Polymers, 2012, 87(2): 951-962. DOI:10.1016/j.carbpol.2011.08.083.
[9] BOELS I C, VAN KRANENBURG R, HUGENHOLTZ J, et al. Sugar catabolism and its impact on the biosynthesis and engineering of exopolysaccharide production in lactic acid bacteria[J]. International Dairy Journal, 2001, 11(9): 723-732. DOI:10.1016/S0958-6946(01)00116-9.
[10] BULDO P, BENFELDT C, CAREY J P, et al. Interactions of milk proteins with low and high acyl gellan: effect on microstructure and textural properties of acidified milk[J]. Food Hydrocolloids, 2016, 60: 225-231. DOI:10.1016/j.foodhyd.2016.03.041.
[11] LANEUVILLE S I, TURGEON S, SYLVIE L, et al. Microstructure and stability of skim milk acid gels containing an anionic bacterial exopolysaccharide and commercial polysaccharides[J]. International Dairy Journal, 2014, 37(1): 5-15. DOI:10.1016/j.idairyj.2014.01.014.
[12] LI Y H, WANG W J, XU X J, et al. Short communication: changes in fluorescence intensity induced by soybean soluble polysaccharide-milk protein interactions during acidification[J]. Journal of Dairy Science, 2015, 98(12): 8577-8580. DOI:10.3168/jds.2015-9971.
[13] WANG J, ZHAO X, YANG Z N, et al. Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet Kefir[J]. Carbohydrate Polymers, 2015, 125: 16-25. DOI:10.1016/j.carbpol.2015.03.003.
[14] GIENTKA I, BZDUCHA-WRóBEL A, LIDIA S R, et al. The exopolysaccharides biosynthesis by Candida yeast depends on carbon sources[J]. Electronic Journal of Biotechnology, 22(8): 31-37. DOI:10.1016/j.ejbt.2016.02.008.
[15] POLAK-BERECKA M, CHOMA A, WA?KO A, et al. Physicochemical characterization of exopolysaccharides produced by Lactobacillus rhamnosus on various carbon sources[J]. Carbohydrate Polymers, 2015, 117: 501-509. DOI:10.1016/j.carbpol.2014.10.006.
[16] WANG K, LI W, CHEN X H, et al.Structural characterization and bioactivity of released exopolysaccharides from Lactobacillus plantarum 70810[J]. International Journal of Biological Macromolecules, 2014, 67: 71-78. DOI:10.1016/ j.ijbiomac.2014.02.056.
[17] DE P S, BASU P S. Extracellular polysaccharide production by a Rhzobium sp. from root nodules of Derris scandens[J]. Folia Microbiologica, 1996, 41(4): 368-372. DOI:10.1007/bf02814717.
[18] ALVESV D, FREITAS F, TORRES C A V, et al. Rheological and morphological characterization of the culture broth during exopolysaccharide production by Enterobacter sp.[J]. Carbohydrate Polymers, 2010, 81(4): 758-764. DOI:10.1016/j.carbpol.2010.03.048.
[19] CRUZ M, FREITAS F, TORRES C A V, et al. Influence of temperature on the rheological behavior of a new fucosecontaining bacterial exopolysaccharide[J]. International Journal of Biological Macromolecules, 2011, 48(4): 695-699. DOI:10.1016/ j.ijbiomac.2011.02.012.
[20] JUMEL K. Molar mass determination of complex bioglycopolymers by size exclusion chromatography and light scattering detection[J]. Journal of Chromatography Library, 2002, 66: 305-345. DOI:10.1016/ S0301-4770(02)80034-3.
[21] TORRES C A, ANTUNES V S, RICARDO A R, et al. Study of the interactive effect of temperature and pH on exopolysaccharide production by Enterobacter A47 using multivariate statistical analysis[J]. Bioresource Technology, 2012, 119: 148-156. DOI:10.1016/j.biortech.2012.05.106.
[22] TORRES C A V, MARQUES R, SILVIA A, et al. Kinetics of production and characterization of the fucose-containing exopolysaccharide from Enterobacter A47[J]. Journal of Biotechnology, 2011, 156(4): 261-267. DOI:10.1016/j.jbiotec.2011.06.024.
[23] XU X F, GAO C X, LIU Z M, et al. Characterization of the levan produced by Paenibacillus bovis sp. nov BD3526 and its immunological activity[J]. Carbohydrate Polymers, 2016, 144: 178-186. DOI:10.1016/j.carbpol.2016.02.049.
[24] KAVITA K, MISHRA A, JHA B, et al. Extracellular polymeric substances from two biofilm forming Vibrio species: characterization and applications[J]. Carbohydrate Polymers, 2013, 94(2): 882-888. DOI:10.1016/j.carbpol.2013.02.010.
[25] SARDARI R R R, KULCINSKAJA E, RON E Y C, et al. Evaluation of the production of exopolysaccharides by two strains of the thermophilic bacterium Rhodothermus marinus[J]. Carbohydrate Polymers, 2017, 156: 1-8. DOI:10.1016/j.carbpol.2016.08.062.
[26] SALZILLO R, SCHIRALDI C, CORSUTO L, et al. Optimization of hyaluronan-based eye drop formulations[J]. Carbohydrate Polymers, 2016, 153: 275-283. DOI:10.1016/j.carbpol.2016.07.106.
[27] GIENTKA I, BZDUCHA-WRóBEL A, STASIAK-Ró?A?SKA L, et al. The exopolysaccharides biosynthesis by Candida yeast depends on carbon sources[J]. Electronic Journal of Biotechnology, 2016, 22: 31-37. DOI:10.1016/j.ejbt.2016.02.008.
[28] REN W, XIA Y J, WANG G Q, et al. Bioactive exopolysaccharides from a S. thermophilus strain: screening, purification and characterization[J]. International Journal of Biological Macromolecules, 2016, 86: 402-407. DOI:10.1016/j.ijbiomac.2016.01.085.
[29] AI L, GUO Q, DING H, et al. Structure characterization of exopolysaccharides from Lactobacillus casei LC2W from skim milk[J]. Food Hydrocolloids, 2016, 56: 134-143. DOI:10.1016/ j.foodhyd.2015.10.023.
[30] K?ON?EKOVá P, BYSTRICKY P, VL?KOVá S, et al. Exopolysaccharides of Lactobacillus reuteri: their influence on adherence of E. coli to epithelial cells and inflammatory response[J]. Carbohydrate Polymers, 2016. 141: 10-19. DOI:10.1016/ j.carbpol.2015.12.037.
[31] LIU J, WANG X C, PU H M, et al. Recent advances in endophytic exopolysaccharides: production, structural characterization physiological role and biological activity[J]. Carbohydrate Polymers, 2017. 157: 1113-1124. DOI:10.1016/j.carbpol.2016.10.084.
[32] BADEL S, BERNARDI T, MICHAUD P. New perspectives for Lactobacilli exopolysaccharides[J]. Biotechnology Advances, 2011, 29(1): 54-66. DOI:10.1016/j.biotechadv.2010.08.011.
[33] DUBOC P, MOLLET B. Applications of exopolysaccharides in the dairy industry[J]. International Dairy Journal, 2001, 11(9): 759-768. DOI:10.1016/S0958-6946(01)00119-4.
[34] LAWS A P, MARSHAL L V M. The relevance of exopolysaccharides to the rheological properties in milk fermented with ropy strains of lactic acid bacteria[J]. International Dairy Journal, 2001, 11(9): 709-721. DOI:10.1016/S0958-6946(01)00115-7.
Production of Exopolysaccharide by Fermentation with Bacillus amyloliquefaciens GSBa-1, Its Rheological Characterization and Application
ZHAO Wen, TENG Junwei, ZHANG Jian, ZHAO Xiao, JIANG Yunyun, YANG Zhennai*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Laboratory of Food Quality and Safety, Beijing Technology and Business University, Beijing 100048, China)
The present study was carried out to optimize the fermentation conditions for exopolysaccharide (EPS) production by Bacillus amyloliquefaciens GSBa-1, isolated and screened from the traditional rice wine starter. The optimal fermentation conditions obtained by single factor experiments and response surface analysis were as follows: the culture medium consisted of peptone 10 g/L, yeast extract powder 5 g/L, sucrose 40 g/L, and NaCl 10 g/L and the fermentation was performed for 36 h at 35 ℃ with an inoculum size of 4% at a shaking speed of 160 r/min. The maximal production of EPS of 326.45 mg/L was obtained under the above conditions. The results of rheological studies indicated that the aqueous solution of the EPS had low viscosity, which increased with increasing its concentration and shearing rate. Measurement of molecular parameters by multi-angle laser light scattering showed that the weight-average molecular mass (mw) of the EPS was 4.993 × 105g/mol, the radius of gyration (Rg) 48.34 nm, hydrodynamic radius (Rh) 64.62 nm, and Rg/Rhratio (ρ) 0.748, indicating that the EPS molecule may be present as compact spheres. This was also confirmed by transmission electron microscope. The application of this EPS in acid milk beverage showed that the use of the EPS could improve the stability of the beverage without increasing its viscosity, indicating that the EPS from Bacillus amyloliquefaciens GSBa-1 can be potentially used as a novel food stabilizer.
exopolysaccharide; rheological characterization; laser light scattering; acid milk beverage
10.7506/spkx1002-6630-201716001
TS201.3
A
1002-6630(2017)16-0001-09
趙雯, 騰軍偉, 張健, 等. 解淀粉芽孢桿菌GSBa-1胞外多糖的發酵制取、流變學特性和應用[J]. 食品科學, 2017, 38(16): 1-9. DOI:10.7506/spkx1002-6630-201716001. http://www.spkx.net.cn
2016-10-06
國家自然基金科學面上項目(31371804)
趙雯(1994—),女,碩士研究生,研究方向為乳品生物技術。E-mail:13614317400@163.com
*通信作者:楊貞耐(1965—),男,教授,博士,研究方向為乳品科學及加工技術。E-mail:yangzhennai@th.btbu.edu.cn
ZHAO Wen, TENG Junwei, ZHANG Jian, et al. Production of exopolysaccharide by fermentation with Bacillus amyloliquefaciens GSBa-1, its rheological characterization and application[J]. Food Science, 2017, 38(16): 1-9. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716001. http://www.spkx.net.cn

