單核增生性李斯特菌hly缺失菌株的構建及生物特性的初步鑒定
謝曼曼,劉武康,丁承超,董慶利,陳國薇,曾海娟,郭 亮,劉 箐*
單核增生性李斯特菌hly缺失菌株的構建及生物特性的初步鑒定
謝曼曼,劉武康,丁承超,董慶利,陳國薇,曾海娟,郭 亮,劉 箐*
(上海理工大學醫療器械與食品學院,上海 200093)
為研究單核增生性李斯特菌(Listeria monocytogenes,Lm)hly基因對毒力的影響,利用同源重組原理,使用穿梭載體,構建單核細胞增生性李斯特菌野生菌株EGD-e的hly基因缺失菌株EGD-eΔhly。細菌活性實驗證明缺失菌株生長狀態與親本無差異,但EGD-eΔhly喪失溶血活性,細胞侵襲能力降低約90%,在107cells/mL腹腔注射條件下不表現動物毒性。在轉錄水平上EGD-eΔhly的毒力基因inlC、prfA的表達量分別下降了81%和76%,actA、plcB的表達量分別提高了2.7 倍和1.8 倍。hly缺失菌株的成功構建及生物特性的初步研究結果為研究Lm致病機理提供依據。
單核增生性李斯特菌;hly基因;同源重組;生物特性
單核細胞增生性李斯特菌(Listeria monocytogenes,Lm)是一種營細胞內寄生的人畜共患的食源性致病菌,廣泛存在于生鮮或即食食品中[1-2]。Lm可穿透人體的三大屏障——腸道屏障、血腦屏障和胎盤屏障,導致腸炎、腦膜炎、流產[3],是研究胞內寄生菌與宿主之間的相互作用的重要模式菌[4]。在寄生及繁殖的不同階段中,Lm有多個毒力因子來協助其進行機體的感染繼而發揮致病作用[5],目前已發現多個與Lm致病性與毒力相關因子,其中多是表面蛋白或者是分泌蛋白[6-7]。編碼這些蛋白的毒力基因(hly、plcA、plcB、mpl、actA、inlA和inlB)主要位于細菌染色體上的2 個毒力島上[8]。其中hly基因編碼溶菌素(listeriolysion O,LLO)是一個主要毒力因子[9]。
LLO是一種由529 個氨基酸組成具有溶血活性的成孔蛋白,屬膽固醇依賴性溶細胞素家族的成員[10]。它在Lm從初級和次級吞噬體逃逸中以及在宿主細胞質中的細菌增殖中都起到關鍵的作用[11-12]。基于hly基因在Lm致病性中起到的重要作用,構建Lm的hly缺失減毒菌株不僅對于研究開發Lm減毒疫苗研究等有重要意義[13-14]。而且,對于研究LLO在細胞內囊泡逃逸過程及其在Lm在細胞與細胞間的感染機理具有一定指導意義[15]。本研究利用同源重組技術構建hly基因敲除菌株EGD-eΔhly;并從生長狀態、毒力基因轉錄水平、宿主致死率等方面研究hly基因缺失菌株的生物特性,為食源性致病菌Lm致病機理研究提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株和質粒
單核細胞增生李斯特菌的標準株EGD-e、英諾克李斯特菌(Listeria innocua,Li)、Caco-2結腸腺癌細胞為本實驗室保藏;穿梭質粒pKSV7質粒由華中師范大學羅勤博士饋贈;大腸桿菌DH5α感受態細胞、pMD19-T Vector購于日本TaKaRa公司;6~8 周齡小鼠購于第二軍醫大學。
1.1.2 培養基和試劑
腦心浸液(brain heart infusion,BHI)培養基 北京陸橋技術股份有限公司;細菌基因組抽提試劑盒、核酸凝膠回收試劑盒 天根生化科技(北京)有限公司;Taq酶、反轉錄試劑 日本TaKaRa公司;DMEM(Dulbecco’s modified Eagle medium)細胞培養基 美國Sigma公司;其他化學試劑均為分析純。
1.1.3 引物
本實驗中使用的引物參照GenBank中公布的序列(ID:986837)設計,由生工生物工程(上海)股份有限公司合成,具體引物序列和對應酶切位點如表1所示。
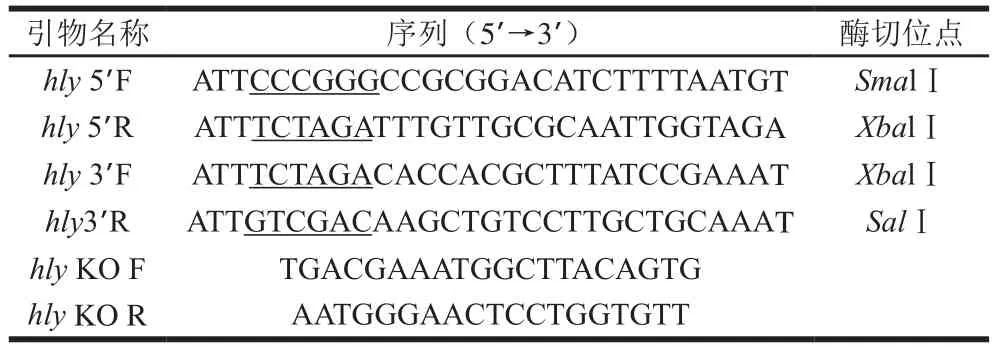
表1 引物序列Table 1 Primer sequences used in this study
1.2 儀器與設備
9500型普通聚合酶鏈式反應(polymerase chain reaction,PCR)儀、7500型實時熒光定量(quantitative real-time,qRT)-PCR儀 美國應用生物公司;DyCP-31CN型電泳儀、MicroPulser電轉儀 美國伯樂公司;SpectraMax M2型酶標儀 美國分子設備公司。
1.3 方法
1.3.1 hly敲除菌株的建立
EGD-eΔhly菌株的構建,原理如圖1。
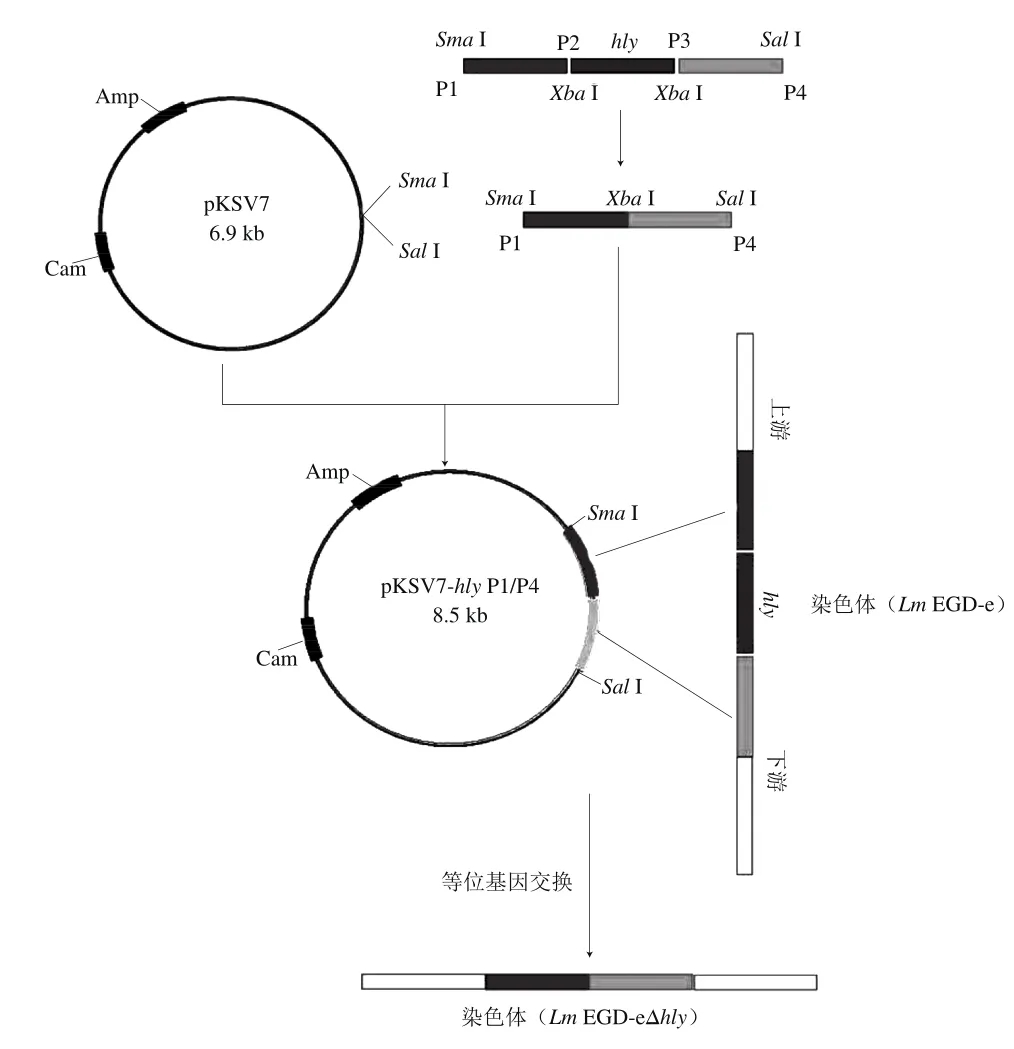
圖1 EGD-eΔhly菌株構建原理Fig. 1 Schematic illustration of the principle for EGD-eΔhly mutant construction
1.3.1.1 hly基因上下游同源臂的擴增及連接
將EGD-e接種于BHI培養基中于37 ℃、200 r/min搖床培養過夜,收集菌體使用細菌基因組抽提試劑盒獲得基因組。使用hly 5’F、hly 5′R、hly 3′F和hly 3’R引物以抽提的基因組為模板擴增hly的上下游同源臂。得到的PCR片段電泳后割膠回收,使用酶XbalⅠ對片段進行單酶切,并電泳割膠回收。產物使用T4 DNA連接酶連接,電泳割膠回收。
1.3.1.2 同源臂連接pMD19-T Vector并導入DH5α感受態細胞
得到的上下游連接產物鏈接pMD19-T Vector并轉化至DH5α感受態細胞中,得到的菌懸液涂布于含100 μL/mL Amp平板上,37 ℃條件下培養。挑取單菌落擴大培養后進行PCR鑒定,對應的陽性克隆菌液使用質粒抽提試劑盒抽提質粒,同時菌液-80 ℃保存。
1.3.1.3 pKSV7重組質粒的構建與電轉化
將連有同源臂的pMD19-T Vector與pKSV7質粒進行雙酶切,并進行瓊脂糖凝膠電泳并割膠回收,產物使用T4 DNA連接酶16 ℃條件下過夜連接并導入Lm感受態細胞。將陽性克隆的質粒抽提后進行雙酶切鑒定并測序,測序過程由華大基因公司完成,將序列比對正確的脫鹽質粒與Lm感受態混勻,每200 μL Lm(1×1011CFU/mL)感受態的質粒用量約1 μg,電轉化條件2.25 kV/cm、4 ms。電轉后將感受態細胞轉入3~5 mL的BHI培養基中振蕩培養約2 h,離心收集菌體后涂布于含10 μg/mL克拉霉素(clarithromycin,Cam)的BHI平板,30 ℃條件下培養,挑取菌落進行鑒定,將陽性克隆的菌液凍存。
1.3.1.4 hly基因缺失突變株的篩選與鑒定
將含有重組質粒的Lm轉接到BHI(含10 μg/mL Cam)液體培養基中,41 ℃條件下按1∶100(V/V,下同)連續轉接10 次,將末代細菌培養物劃線于BHI(含10 μg/mL Cam)平板上,41 ℃條件下過夜培養;挑取BHI(含10 μg/mL Cam)平板上的單菌落于BHI液體培養基中30 ℃條件下連續培養并按1∶100轉接8 次,取末代培養物劃線于BHI平板,30 ℃過夜培養;挑取單菌落進行PCR鑒定將疑似突變株分別劃線于抗性平板和非抗性平板,含Cam的抗性BHI平板上不生長,無抗性BHI平板上可生長的為疑似突變株,對疑似突變株進行PCR鑒定以確定突變株。
1.3.2 生長曲線測定
挑取EGD-e、EGD-eΔhly單菌落于BHI液體培養基中搖床過夜培養,按1∶100轉接至裝100 mL新鮮BHI培養基的錐形瓶中,37 ℃、200 r/min培養,每1 h取200 μL于酶標板中測定OD600nm值,共記錄12 h,得到的數據繪制細菌的生長曲線。
1.3.3 溶血活性的測定
溶血活性的測定參照Sivaranjani等[16]進行,挑取EGD-e、EGD-eΔhly、Li的單菌落于BHI中培養至穩定生長早期(OD600nm約為0.6)。將Lm培養物4 ℃、5 500 r/min離心10 min。取0.1 mL上清液樣品加入到1 mL溶血素緩沖液(0.145 mol/L NaCl、0.02 mol/L CaCl2)中,并加入0.025 mL脫纖維羊血。設置0.1 mL培養基用作陰性對照,0.1 mL 1% Triton-100X作為陽性對照。將混合物于37 ℃培養箱孵育30 min,5 500 r/min離心10 min。使用分光光度計測定上清液的OD540nm值[17]。
1.3.4 毒力基因轉錄表達測定
提取EGD-e和EGD-eΔhly RNA后,使用反轉錄試劑盒反轉錄成cDNA,用于qRT-PCR檢測。其中以Lm的16S rRNA為內參基因,按照試劑盒配置體系,設定反應程序參數測定Lm主要毒力基因轉錄水平的變化,基因名稱及引物詳細序列見表2。

表2 qRT-PCR引物序列Table 2 Primer sequences for qRT-PCR
1.3.5 Caco-2細胞侵襲實驗
胰酶消化下的Caco-2細胞,使用含20%胎牛血清(fetal bovine serum,FBS)的DMEM重懸,準確計數后均勻平鋪12 孔板底部,2.0×105cells/孔,放置于細胞培養箱(37 ℃,2.5% CO2)過夜。取對數生長期的細菌,按感染復數為100∶1接種于孔板中共培養2 h。每孔更換0.5 mL 200 μg/mL含20% FBS的DMEM配置的的慶大霉素溶液,于37 ℃培養箱中培養30 min以清除胞外菌。吸出慶大霉素溶液,使用磷酸鹽緩沖液(phosphate buffer saline,PBS)洗2 次,每孔加入1 mL 1% Triton X-100充分吹打,收集于1.5 mL無菌離心管中,稀釋后取100 μL涂布于BHI固體培養板中,37 ℃培養箱中培養24 h后計數統計。
1.3.6 致死率測定
取對數生長期的EGD-eΔhly 6 000 r/min離心4 min,使用無菌PBS重懸配置成濃度為107cells/mL菌懸液。3 組6~8 周齡小鼠,每組8 只,每只腹腔注射200 μL菌懸液,其中對照組注射200 μL PBS,每天記錄小鼠死亡狀況。
1.4 數據統計分析
本研究涉及的生物特性實驗除生長曲線測定外,均設置3 個平行,重復3 次。所得數據使用GraphPad軟件統計,采用最小顯著性差異法進行比較。
2 結果與分析
2.1 EGD-eΔhly菌株的構建
2.1.1 上下游同源臂的擴增及連接PMD-19T
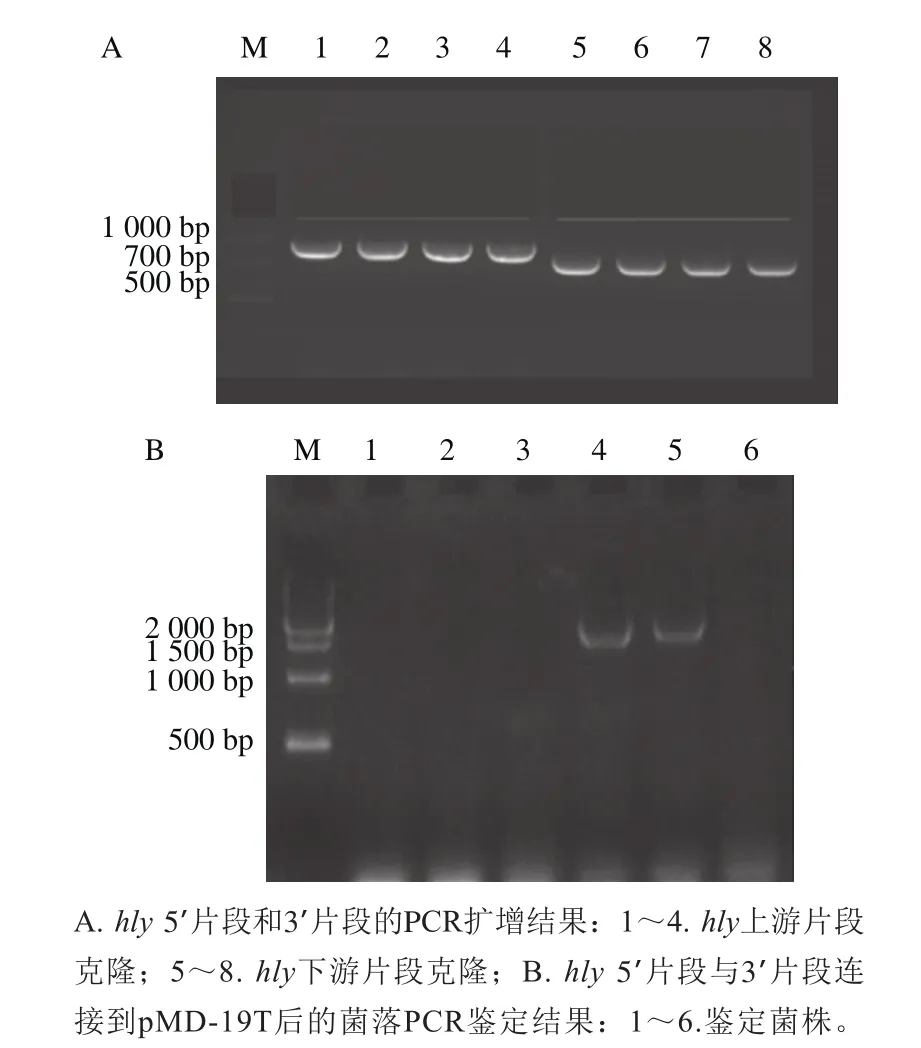
圖2 hly上下游片段的克隆Fig. 2 Cloning of hly up-stream and down-stream sequence
使用hly 5’和hly 3’引物擴增同源臂PCR凝膠電泳結果如圖2A所示,hly 5’片段條帶位置在900 bp左右,hly 3’片段條帶位置在700 bp左右。按照NCBI上提供的序列,2 個條帶應分別為880、724 bp,結果符合預期。圖2B為hly 5’和hly 3’片段連接到pMD-19T后導入大腸桿菌的菌落PCR鑒定結果,共挑取6 個菌落,其中4、5泳道出現陽性條帶,條帶位置與預期目標條帶1 604 bp相符。
2.1.2 PKSV7重組質粒的構建與電轉化
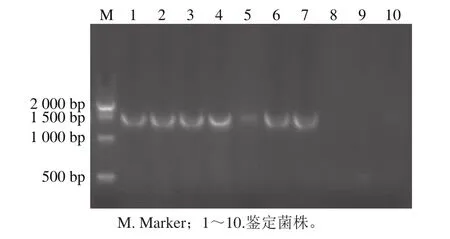
圖3 pKSV7重組質粒鑒定Fig. 3 Identification of pKSV7 recombinant plasmid by restriction enzyme digestion
構建好的pMD-19T與PKSV7質粒均使用限制性內切酶SalⅠ和SamⅠ進行雙酶切,使用T4連接酶連接切開的PKSV7與hly上下游重組片段得到重組的不含hly的重組質粒PKSV7-Δhly,經電轉化將PKSV7-Δhly載體導入到單核增生性李斯特菌感受態細胞內,增菌后,挑取單菌落進行PCR鑒定,陽性克隆出現的條帶大小理論值為1 604 bp。鑒定結果如圖3,鑒定實驗使用引物hly 5’F和hly 3’R,挑取的10 個菌落有6 個出現明顯條帶,條帶位置在1 600 bp左右,符合預期。
2.1.3 同源重組菌的篩選
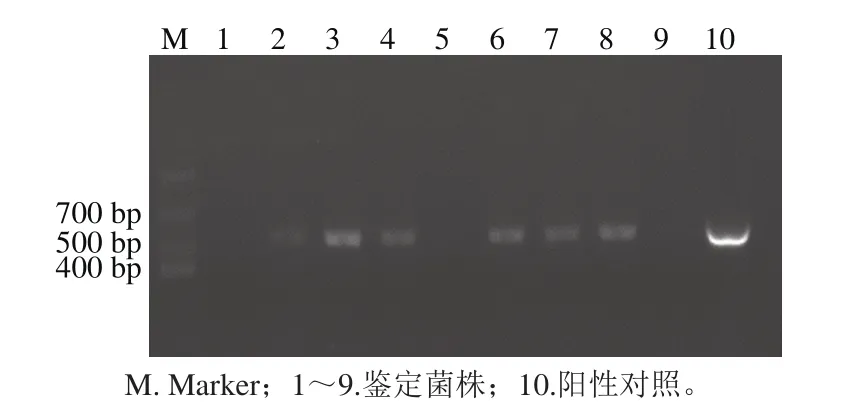
圖4 EGD-eΔhly鑒定結果Fig. 4 Identification of EGD-eΔhly by PCR
帶有PKSV7-Δhly質粒的EGD-e菌株,經氯霉素抗性和溫度篩選得到EGD-eΔhly菌株,菌株不含hly基因,設計hly基因上引物hly KO F與hly KO R,經PCR擴增、鑒定,缺失菌株無條帶,而沒有發生重組的菌株經擴增、凝膠電泳會出現對應的理論值為535 bp的條帶。挑取9 個單菌落,進行PCR擴增鑒定,結果如圖4,其中10泳道為陽性對照,1、5、9泳道對應的菌株為目標菌株。
2.2 EGD-eΔhly生長曲線
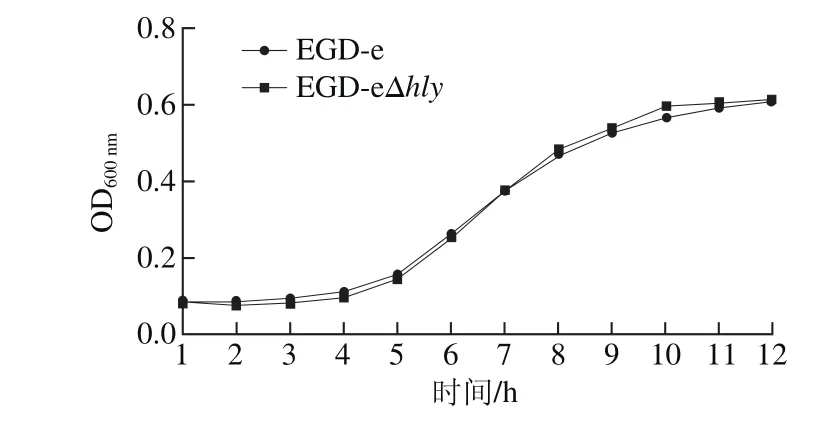
圖5 EGD-eΔhly生長曲線Fig. 5 Growth curve of EGD-eΔhly
如圖5所示,EGD-eΔhly與EGD-e在過夜培養,1∶100接菌37 ℃、200 r/min搖床培養的條件下,生長曲線基本重合,前3 h為生長初期,后經歷對數期,并在10 h到達穩定期,此時OD600nm約為0.61,各時期的生長速率基本一致。說明hly基因的缺失對EGD-e的生長不造成影響。
2.3 EGD-eΔhly溶血活性
hly基因編碼溶血素蛋白LLO,是參與EGD-e溶血效應的基因,使用溶血實驗驗證,實驗過程中設置的陰性對照OD540nm為0.118,與Li、EGD-eΔhly無顯著性差異(P>0.05),EGD-e與陰性對照有顯著性差異。
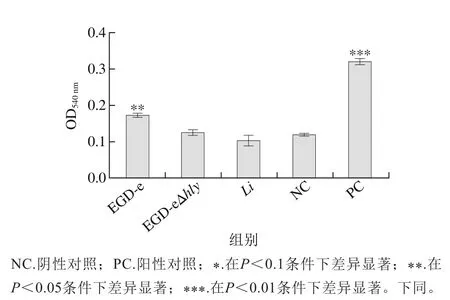
圖6 溶血實驗Fig. 6 Hemolysis assay
2.4 SyBR Green熒光染料法毒力基因qRT-PCR
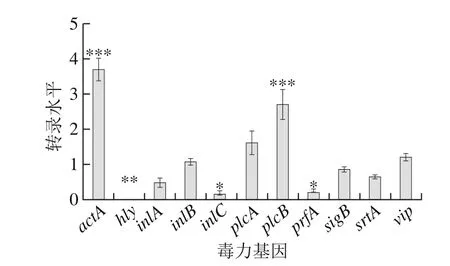
圖7 毒力基因qRT-PCRFig. 7 mRNA expression levels of virulence genes assayed with qRT-PCR
如圖7所示,以野生株EGD-e基因表達水平為對照,將對照組每個目的基因轉錄水平設為1,則與野生株EGD-e比,突變株EGD-eΔhly目的基因轉錄水平大于1為表達上調,反之則為下調。其中hly基因信號值比較低,與對照組有顯著性差異(P<0.001),驗證hly基因成功敲除,同時hly敲除還導致inlC和prfA基因的下調,數值分別降為0.19和0.24,下降了81%和76%。相反的,基因actA、plcB表現上調,與對照組有顯著性差異(P<0.001),表達量分別提高了2.7 倍和1.8 倍。
2.5 Caco-2細胞侵襲實驗與小鼠致死率
EGD-eΔhly菌株細胞侵襲實驗結果如圖8A所示,EGD-eΔhly小鼠致死結果如圖8B,hly基因敲除后,細胞實驗檢測到的菌落顯著降低,在腹腔注射200 μL 1.0×107cells/mL條件下,其致死結果與對照組(PBS注射組)一致,均未出現小鼠死亡現象。而EGD-e注射組在第3天出現小鼠死亡,至第7天死亡率達100%,大部分死亡發生在注射后的第3、4、5天。說明hly基因敲除后,EGD-e的毒性下降。hly編碼的蛋白LLO能夠作用于包裹細菌的囊泡,使細菌從囊泡逃逸進入宿主細胞質以擴散增殖[18]。失去hly基因的EGD-e LLO蛋白不能正常表達,細菌不能從囊泡中逃逸并轉染其他細胞,毒性大大降低,小鼠的死亡率降低。
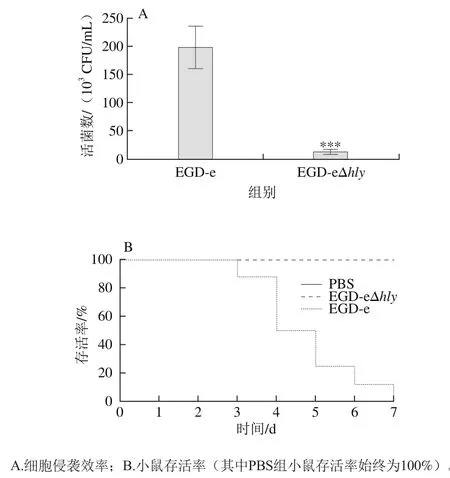
圖8 EGD-eΔhly與EGD-e的毒力鑒定Fig. 8 Identification of virulence of EGD-eΔhly and EGD-e
3 討 論
利用同源重組技術構建缺失菌株,是實驗室研究基因功能的常用手段。科研人員使用該方法已成功構建Lm inlA、inlB、actA、prfA等基因缺失菌株[19-20]。本研究通過構建帶有hly基因上下游片段的質粒利用同源重組刪除Lm染色體上約1 600 bp hly基因序列,成功構建hly缺失菌株EGD-eΔhly。生物特性研究證明缺失菌株的生長不受影響而毒力大大降低,表現為細胞侵襲實驗中檢測到的細菌數量下降約90%,而且在較高濃度(1.0×107cells/mL)腹腔注射條件下不表現出動物致死現象。有研究[21]使用山羊體內分離的Lm構建hly基因缺失菌株,結果顯示與野生型相比敲除菌株的半數致死量(LD50)從1.47×104cells/mL上升至2.15×109cells/mL,毒力降低,與本實驗相符。缺失菌株毒力的下降表明它對人和動物的致病性降低,為研制疫苗以預防李斯特疾病和或者作為疫苗載體提供研究基礎[22]。
Lm有多個毒力因子共同表現Lm毒性,其中由hly編碼的LLO是一種成孔毒素,與菌體從逃逸囊泡進入胞質有關,是細菌得以在胞液內增殖的先決條件[23]。本研究對hly基因敲除后其他主要毒力基因的轉錄水平的變化做了初步探索。其中inlC和prfA基因表現為下調,actA、plcB表現為上調。PrfA是Lm絕大多數毒力基因(包括prfA本身)的轉錄表達的調劑蛋白[24-25],該基因的低轉錄可能對其他毒力基因的轉錄表達造成影響。本實驗中出現inlC基因的下調。inlC編碼的蛋白InlC屬內化素家族[26],能夠通過減輕皮質張力,使質膜形成突起,從而促進Lm在細胞間的傳播[27],而hly基因的缺失,進入囊泡內的菌體不能復制逃逸,可能不需要更多的InlC以促進細菌向鄰近細菌的轉染而降低轉錄水平。plcA、plcB基因與hly基因的正常表達在細菌逃逸過程中是必須的,研究證明在缺乏LLO時,plcB基因表達的蛋白PC-PLC對于細胞二級雙膜空泡的消散是必不可少的[28]。hly基因缺失,可能會出現plcB基因轉錄上調以增強細菌逃逸。actA基因編碼一種肌動蛋白,已證明與Lm進入細胞相關[29],其上調的原因還不明確。迄今為止鑒定出的李斯特菌的毒力調節蛋白僅有PrfA,但明顯的細菌各個毒力因子間的相互聯系比較復雜,還需要進一步研究。
[1] 蘭欣怡, 李發弟, 王加啟, 等. 生鮮乳中單核細胞增生李斯特菌的研究進展[J]. 食品科學, 2014, 35(19): 318-323. DOI:10.7506/spkx1002-6630-201419063.
[2] 馬婷, 李芳, 單大亞. 基于物聯網技術的食品冷鏈物流跟蹤及追溯問題研究[J]. 上海理工大學學報, 2013, 35(6): 557-562.
[3] MCCOLLUM J T, CRONQUIST A B, SILK B J, et al. Multistate outbreak of listeriosis associated with cantaloupe[J]. New England Journal of Medicine, 2013, 369(10): 944-953. DOI:10.1056/ NEJMoa1215837.
[4] COSSART P, TOLEDOARANA A. Listeria monocytogenes, a unique model in infection biology: an overview[J]. Microbes & Infection, 2008, 10(9): 1041-1050. DOI:10.1016/j.micinf.2008.07.043.
[5] VáZQUEZ-BOLAND J A, KUHN M, BERCHE P, et al. Listeria pathogenesis and molecular virulence determinants[J]. Clinical Microbiology Reviews, 2001, 14(3): 584-640. DOI:10.1128/ CMR.14.3.584-640.2001.
[6] KANKI M, NARUSE H, TAGUCHI M, et al. Characterization of specific alleles in InlA and PrfA of Listeria monocytogenes, isolated from foods in Osaka, Japan and their ability to invade Caco-2 cells[J]. International Journal of Food Microbiology, 2015, 211: 18-22. DOI:10.1016/j.ijfoodmicro.2015.06.023.
[7] LEBRETON A, STAVRU F, COSSART P. Organelle targeting during bacterial infection: insights from Listeria[J]. Trends in Cell Biology, 2015, 25(6): 330-338. DOI:10.1038/nature06479.
[8] 王彬, 倪宏波. 單核細胞增生李斯特菌毒力因子研究進展[J]. 黑龍江八一農墾大學學報, 2008, 20(2): 62-67.
[9] BAHEy-EL-DIN M, CASEy P G, GRIFFIN B T, et al. Lactococcus lactis-expressing listeriolysin O (LLO) provides protection and specific CD8+T cells against Listeria monocytogenes in the murine infection model[J]. Vaccine, 2008, 26(41): 5304-5314. DOI:10.1016/ j.vaccine.2008.07.047.
[10] HEUCK A P, HOTZE E M, TWETEN R K, et al. Mechanism of membrane insertion of a multimeric β-barrel protein[J]. Molecular Cell, 2000, 6(5): 1233-1242. DOI:10.1016/S1097-2765(00)00119-2.
[11] RIBET D, HAMON M, GOUIN E, et al. Listeria monocytogenes impairs SUMOylation for efficient infection[J]. Nature, 2010, 464: 1192-1195. DOI:10.1038/nature08963.
[12] DANCZ C E, HARAGA A, PORTNOy D A, et al. Inducible control of virulence gene expression in Listeria monocytogenes: temporal requirement of listeriolysin O during intracellular infection[J]. Journal of Bacteriology, 2002, 184(21): 5935-5945. DOI:10.1128/ JB.184.21.5935-5945.2002.
[13] MACIAG P C, RADULOVIC S, ROTHMAN J. The first clinical use of a live-attenuated Listeria monocytogenes vaccine: a phase Ⅰsafety study of Lm-LLO-E7 in patients with advanced carcinoma of the cervix[J]. Vaccine, 2009, 27(30): 3975-3983. DOI:10.1016/ j.vaccine.2009.04.041.
[14] BAHEyELDIN M, CASEy P G, GRIFFIN B T, et al. Expression of two antigens (P60 and LLO) in and examination for use as live vaccine vectors[J]. 2010, 59: 904-912. DOI:10.1099/jmm.0.018770-0.
[15] CZUCZMAN M A, FATTOUH R, RIJN J M V, et al. Listeria monocytogenes exploits efferocytosis to promote cell-to-cell spread[J]. Nature, 2014, 509: 230-234. DOI:10.1038/nature13168.
[16] SIVARANIANI M, GOWRISHANKAR S, KAMALADEVI A, et al. Morin inhibits biofilm production and reduces the virulence of Listeria monocytogenes: an in vitro and in vivo approach[J]. International Journal of Food Microbiology, 2016, 237: 73-82. DOI:10.1016/ j.ijfoodmicro.2016.08.021.
[17] LIAO W Z, CHEN L y, MA X, et al. Protective effects of kaempferol against reactive oxygen species-induced hemolysis and its antiproliferative activity on human cancer cells[J]. European Journal of Medicinal Chemistry, 2016, 114: 24-32. DOI:10.1016/ j.ejmech.2016.02.045.
[18] SCHNUPF P, PORTNOy D A. Listeriolysin O: a phagosome-specific lysin[J]. Microbes & Infection, 2007, 9(10): 1176-1187. DOI:10.1016/ j.micinf.2007.05.005.
[19] 劉武康, 陳國薇, 吳嫚, 等. inlA和inlB基因缺失對單核細胞增生性李斯特菌侵襲HT29結腸癌細胞的影響[J]. 食品科學, 2016, 37(23): 166-172. DOI:10.7506/spkx1002-6630-201623028.
[20] 丁承超, 曾海娟, 鐘菲菲, 等. 雙基因敲除減毒單增李斯特菌(ΔactA/ ΔinlB)的構建及其生物學初步鑒定[J]. 現代食品科技, 2016, 32(7): 66-71. DOI:10.13982/j.mfst.1673-9078.2016.7.011.
[21] 郭亮, 陳國薇, 謝曼曼, 等. 單增李斯特菌prfA基因缺失菌株的構建及其生物學特性鑒定[J]. 食品科學, 2017, 38(10): 12-17.
[22] yIN y, ZHANG C, DONG H, et al. Protective immunity induced by a LLO-deficient Listeria monocytogenes[J]. Microbiology and Immunology, 2010, 54(4): 175-183. DOI:10.1111/j.1348-0421.2010.00211.x.
[23] 周云, 潘蕾, 郝春秋, 等. 單增李斯特菌作為疫苗載體的研究進展[J].中國免疫學雜志, 2011, 27(12): 1132-1134. DOI:10.3969/j.issn.1000-484X.2011.12.19.
[24] BIRMINGHAM C L, CANADIEN V, KANIUK N A, et al. Listeriolysin O allows Listeria monocytogenes replication in macrophage vacuoles[J]. Nature, 2008, 451: 350-354. DOI:10.1038/ nature06479.
[25] TOLEDO-ARANA A, DUSSURGET O, NIKITAS G, et al. The Listeria transcriptional landscape from saprophytism to virulence[J]. Nature, 2009, 459: 950-956. DOI:10.1038/nature08080.
[26] 馮飛飛, 張強, 王莉, 等. 毒力基因調控蛋白PrfA促進單核細胞增生李斯特菌生物被膜的形成[J]. 微生物學通報, 2011, 38(9): 1450-1457. DOI:10.13344/j.microbiol.china.2011.09.013.
[27] 羅勤, 周青春, 鄧靈福, 等. 依賴PrfA轉錄調控的單核細胞增生李斯特菌毒力基因inlC啟動子結構特點的初步研究[J]. 微生物學報, 2007, 47(1): 22-28. DOI:10.13343/j.cnki.wsxb.2007.01.006.
[28] RAJABIAN T, GAVICHERLA B, HEISIG M, et al. The bacterial virulence factor InlC perturbs apical cell junctions and promotes cellto-cell spread of Listeria[J]. Nature Cell Biology, 2009, 11(10): 1212-1218. DOI:10.1038/ncb1964.
[29] GRüNDLING A, GONZALEZ M D, HIGGINS D E. Requirement of the Listeria monocytogenes broad-range phospholipase PC-PLC during infection of human epithelial cells[J]. Journal of Bacteriology, 2003, 185(21): 6295-6307. DOI:10.1128/JB.185.21.6295-6307.2003.
[30] yOSHIKAWA y, OGAWA M, HAIN T, et al. Listeria monocytogenes ActA-mediated escape from 821 autophagic recognition[J]. Nature Cell Biology, 2009, 11(10): 1233-1240. DOI:10.1038/ncb1967.
Construction and Biological Characterization of hly Gene Knockout Listeria monocytogenes Mutant Strains
XIE Manman, LIU Wukang, DING Chengchao, DONG Qingli, CHEN Guowei, ZENG Haijuan, GUO Liang, LIU Qing*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
This study aimed to elucidate the effect of hly gene on the virulence of Listeria monocytogenes. We constructed a hly gene knockout mutant strain EGD-eΔhly from wild-type L. monocytogenes EGD-e by using a shuttle vector through homologous recombination. Biological characterization showed that there was no difference between the growth status of the mutant and parent strains. However, the mutant strain lost hemolytic activity, the cell invasion ability was decreased and there was no toxicity observed in animals receiving intraperitoneal injection at a concentration of 107cells/mL. At the transcriptional level, the knockout of hly gene down-regulated the expression levels of virulence genes inlC and prfA by 81% and 76% respectively and up-regulated the expression levels of actA and plcB genes by 2.7 and 1.8 times, respectively. This paper may provide a basis for the study of the pathogenic mechanism of Lm.
Listeria monocytogenes; hly gene; homologous recombination; biological characteristics
10.7506/spkx1002-6630-201716003
TS201.3
A
1002-6630(2017)16-0017-06
謝曼曼, 劉武康, 丁承超, 等. 單核增生性李斯特菌hly缺失菌株的構建及生物特性的初步鑒定[J]. 食品科學, 2017, 38(16): 17-22. DOI:10.7506/spkx1002-6630-201716003. http://www.spkx.net.cn
XIE Manman, LIU Wukang, DING Chengchao, et al. Construction and biological characterization of hly gene knockout Listeria monocytogenes mutant strains[J]. Food Science, 2017, 38(16): 17-22. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716003. http://www.spkx.net.cn
2016-12-08
國家自然科學基金面上項目(31371776);上海理工大學微創勵志創新基金項目(YS30809101);上海理工大學研究生創新基金項目
謝曼曼(1988—),女,博士研究生,研究方向為食源性致病菌致病機理。E-mail:xiemanman880224@163.com
*通信作者:劉箐(1970—),男,教授,博士,研究方向為食源性致病菌致病機理、疫苗及快速檢測技術。E-mail:liuq@usst.edu.cn

