酒曲中產凝乳酶微生物菌株的分離篩選及鑒定
騰軍偉,趙 笑,楊亞威,張 健,趙愛梅,姜云蕓,李 柳,鄭 喆,楊貞耐*
酒曲中產凝乳酶微生物菌株的分離篩選及鑒定
騰軍偉,趙 笑,楊亞威,張 健,趙愛梅,姜云蕓,李 柳,鄭 喆,楊貞耐*
(北京食品營養(yǎng)與人類健康高精尖創(chuàng)新中心,北京市食品添加劑工程技術研究中心,北京工商大學,北京 100048)
針對酒曲中的微生物進行分離純化,得到11 株細菌和2 株真菌,并采用酪蛋白平板法和Arima時間法篩選出了1 株產凝乳酶的細菌菌株編號為LB-51。通過形態(tài)學觀察、生理生化實驗和16S rDNA序列分析鑒定該菌株為解淀粉芽孢桿菌,將該產凝乳酶菌株命名為解淀粉芽孢桿菌GSBa-1。該菌株在液體LB培養(yǎng)基中發(fā)酵72 h產凝乳酶的凝乳活力為(431.53±15.89)SU/mL,蛋白水解活力為(5.05±0.59)U/mL,所產凝乳酶凝乳活力高而蛋白水解活力低,凝乳酶粗酶單位酶活力為1.54×105SU/g。解淀粉芽孢桿菌GSBa-1是分離篩選自酒曲中的一株高產凝乳酶細菌,因此其來源安全,可作為工業(yè)化候選菌株進一步研究開發(fā)。
酒曲;凝乳酶;分離鑒定;解淀粉芽孢桿菌
凝乳酶(EC 3.4.23.4)是干酪加工時添加于原料乳中使乳液凝固的關鍵性酶[1],其凝乳及蛋白水解活性對干酪的得率、質構和特殊風味有著非常重要的影響[2-5];傳統(tǒng)凝乳酶的制作是用鹽從牛犢皺胃中浸提出來。隨著世界干酪產量逐年上升,傳統(tǒng)凝乳酶的供應已無法滿足現(xiàn)代干酪工業(yè)生產的需求。為此,國內外科學家們進行了大量的研究以尋找凝乳酶新的來源。微生物具有生長不受氣候和地域的限制,來源廣泛且發(fā)酵容易控制,生長周期短、產酶量大、經濟效益高等優(yōu)勢,是目前最有發(fā)展?jié)摿Φ拿钢苿﹣碓碵6-9]。目前微生物源凝乳酶的研究主要集中在真菌的固態(tài)發(fā)酵產酶方面[10-12],工業(yè)上主要采用米黑毛霉、微小毛霉和粟疫霉等真菌發(fā)酵生產凝乳酶[5];而細菌具有較真菌體積小、繁殖快、產物易于提取分離、適合高密度培養(yǎng)增殖產酶等優(yōu)勢[13-14],因此利用細菌工業(yè)化發(fā)酵制備凝乳酶是近年來凝乳酶研究開發(fā)的熱點問題。
江米酒是我國一種傳統(tǒng)食品,由酒曲發(fā)酵江米制作而成。而宮廷奶酪是由江米酒凝固牛乳制作而成,口感細膩,具有良好的乳膠體穩(wěn)定性。其凝乳過程主要與江米酒中的凝乳酶有關[15-16];該酶是發(fā)酵劑酒曲中的微生物發(fā)酵江米代謝的產物[17-18]。目前,研究者主要從酒曲中篩選得到產凝乳酶的霉菌,并進行了相關的研究[19-22]。酒曲中的重要菌系——細菌,也屬于酒曲中的正常菌相;但國內尚鮮有從酒曲中篩選高產凝乳酶細菌的相關報道。江米酒作為一種傳統(tǒng)食品,采用其中篩選得到的菌株發(fā)酵生產凝乳酶,在食品衛(wèi)生學上是安全的。
本研究擬從江米酒中篩選高產凝乳酶細菌,對其形態(tài)學、生理生化特征和16S rDNA序列分析進行鑒定,并對其產凝乳酶的凝乳活力及蛋白水解活力進行測定。該研究拓寬了微生物源凝乳酶產生菌的菌源,為進一步研究開發(fā)食用安全的干酪加工用細菌凝乳酶提供了理論支持。
1 材料與方法
1.1 材料與培養(yǎng)基
酒曲產自江蘇蘇州;長江米購于北京市永輝超市;脫脂乳粉產自澳大利亞。
LB液體培養(yǎng)基:酵母提取物5 g/L、胰蛋白胨10 g/L、氯化鈉10 g/L,121 ℃高壓滅菌20 min。LB固體培養(yǎng)基:LB液體培養(yǎng)基添加15 g/L瓊脂粉。yEPD培養(yǎng)基:酵母粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、瓊脂粉15 g/L,pH 6.0,115 ℃濕熱滅菌20 min。PDA培養(yǎng)基:馬鈴薯浸粉15 g/L、葡萄糖3 g/L、瓊脂粉15 g/L、蒸餾水1L,121 ℃高壓滅菌20 min。酪蛋白培養(yǎng)基:蛋白胨0.25%、葡萄糖1%、酵母膏0.1%、干酪素1%、瓊脂2%、脫脂牛乳5%,pH7.0,95 ℃滅菌15 min。
1.2 儀器與設備
HWS 12恒溫水浴加熱鍋 上海一恒科學實驗裝備有限公司;HZQ-Q氣浴恒溫搖床 哈爾濱東聯(lián)電子科技有限公司;高速離心機CR21GⅢ、U-3900分光光度計日本日立有限公司;全自動凝膠成像系統(tǒng) 美國Bio-Rad公司。
1.3 方法
1.3.1 江米酒的制備
按5%的酒曲添加量接種于提前蒸熟冷卻好的長江米中,接著把經滅菌冷卻好的去離子水按40%添加到江米中,攪拌均勻,30 ℃、120 r/min搖床振蕩培養(yǎng)3 d。
1.3.2 江米酒中微生物的分離純化
采用梯度稀釋法將江米酒倍比稀釋,分別取10-4、10-5、10-6、10-7、10-8稀釋液各50 μL涂布于LB、yEPD和PDA 3 種固體培養(yǎng)基,將培養(yǎng)基放置于30 ℃恒溫培養(yǎng)箱內培養(yǎng),并于第2、3、5天挑取不同菌落進一步劃線純化,直至純種,分別將其編號以作進一步研究。
1.3.3 產凝乳酶優(yōu)勢菌的確定
酪蛋白法初篩產凝乳酶優(yōu)勢菌株:將達到純種的菌株分別以三點法接于酪蛋白平板上,放置于30 ℃恒溫培養(yǎng)箱內培養(yǎng)2 d,觀察不同菌株產白色凝乳圈的大小和水解圈的大小。
不同培養(yǎng)基發(fā)酵復篩菌株:在產生凝乳圈和水解圈的菌株中,分別從平板中挑取少量菌落接種于LB、yEPD和PDA 3 種不同液體培養(yǎng)基中,30 ℃、120 r/min搖床振蕩培養(yǎng)24 h作為活化種子液,然后按3%的接種量接于已滅菌的不同培養(yǎng)基中,30 ℃、120 r/min搖床振蕩培養(yǎng)后測定凝乳活力和蛋白水解活力。
1.3.4 凝乳活力的測定
酶活力根據改進的El-Bendary等[23]的方法測定,將脫脂乳粉溶于0.01 mol/L的CaCl2溶液配制成10%的脫脂乳溶液,室溫放置30 min;于35℃中保溫5 min,35 ℃條件下,準確量取待測酶液0.2 mL加入2 mL10%的脫脂乳溶液中,迅速混勻,開始計時,準確記錄至絮狀凝集顆粒出現(xiàn)為止。凝乳活力的定義:在40 min內凝固100 g/L的脫脂乳1 mL所要的凝乳酶量規(guī)定是一個索氏單位(Soxhelt unit,SU),按公式(1)計算:
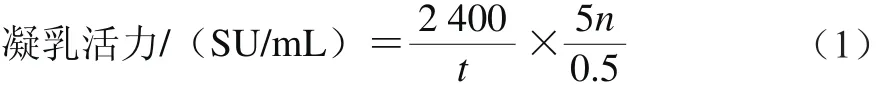
式中:t為凝乳時間/s;n為酶液稀釋倍數(shù)。
1.3.5 蛋白水解活力的測定
蛋白水解活力參考文獻[24]測定。取2 mL 1.5%酪蛋白溶液于35 ℃保溫5 min,加入0.5 mL預熱好的待測酶液混勻后繼續(xù)水浴恒溫放置60 min,然后加入2 mL 8%的三氯乙酸終止反應,將沉淀過濾后測定濾液在280 nm波長處的吸光度,記為A1。制備空白樣品時,先取0.5 mL待測酶液直接與8%的三氯乙酸混合,使其立刻終止反應,后加入2 mL 1.5%酪蛋白溶液,重復過濾步驟,濾液作為空白對照,測定其在280 nm波長處的吸光度,記為A2。
本實驗條件下,60 min引起A280nm增加0.001所需的酶量為1 個酶活力單位,按公式(2)計算:
1.3.6 產凝乳酶菌株的鑒定
1.3.6.1 形態(tài)學觀察
將產凝乳酶優(yōu)勢菌在LB固體平板上劃線,于30 ℃恒溫培養(yǎng)箱內培養(yǎng)2~3 d后觀察菌落生長情況及菌落形態(tài)。將菌體進行芽孢染色及革蘭氏染色后于高倍顯微鏡下觀察菌體形態(tài)。
1.3.6.2 API試劑條法對菌株鑒定
將平板中培養(yǎng)好的新鮮菌體用無菌生理鹽水溶解,根據API 50 CHB比濁法達到菌體濃度要求,然后分別加入API 50 CHB試劑盒各孔內,37 ℃靜置培養(yǎng)24 h和48 h,觀察試劑盒各孔顏色的變化。
1.3.6.3 菌株16S rDNA序列擴增與分析
采用細菌基因組DNA提取試劑盒提取細菌DNA,根據上述菌株鑒定所得由桿菌科的16S rDNA序列設計引物:正向引物P1:5’-AGAGTTTGATCCTGGCTCAG-3’;反向引物P2:5’-ACGGTTACCTTGTTACGACTT-3’。以菌株基因組DNA作為PCR擴增的模板,PCR體系(20 μL)為:上下游引物各1 μL、DNA模板1 μL、超純水7 μL、TaqDNA聚合酶10 μL。PCR參數(shù)為:95 ℃預變性3 min;95 ℃變性0.5 min,55 ℃退火0.5 min,72 ℃延伸2 min,30 個循環(huán);70 ℃末端延伸10 min,4 ℃保存。取5 μL產物進行1%的瓊脂糖凝膠電泳,將大小正確的目的片段送至北京鼎國昌盛生物技術有限責任公司測序。將測序結果提交到GenBank中選取相關菌株的16S rDNA基因序列進行比對分析,選取相似性較高的序列,與實驗菌株一起用軟件MEGA 6.0構建系統(tǒng)發(fā)育樹,進行系統(tǒng)發(fā)育分析[25]。
1.3.7 產凝乳酶菌株生長曲線和產酶活力曲線的的測定
1.3.7.1 生長曲線的測定
從產凝乳酶菌株的平板中挑取少量菌體接種于已滅菌的液體LB培養(yǎng)基中,30 ℃、120 r/min恒溫振蕩培養(yǎng),培養(yǎng)30 h,從2 h起每隔2 h測定菌體OD600nm值,實驗重復3 次,繪制菌株生長曲線。
1.3.7.2 酶活力曲線的測定
挑取少量LB-51菌體接入液體LB培養(yǎng)基中,30 ℃、120 r/min條件下恒溫振蕩12 h,作為活化種子液;以3%的接種量接種于已滅菌的LB液體培養(yǎng)基中,裝液量為體積分數(shù)40%,30 ℃、120 r/min條件下恒溫振蕩培養(yǎng),分別在培養(yǎng)0、12、24、36、48、60、72、84、96 h時,分別按照1.3.4和1.3.5節(jié)方法測定凝乳活力和蛋白水解活力,實驗重復3 次,繪制菌株產酶活力曲線圖。
1.3.8 菌株發(fā)酵產凝乳酶及其分離提取
將活化的菌液以3%的接種量接種到已滅菌的LB液體培養(yǎng)基中,30 ℃、120 r/min條件下恒溫振蕩培養(yǎng)72 h。發(fā)酵液經8 000 r/min離心30 min以去除菌體,上清液放置于4 ℃冰箱內冷卻2 h。向4 ℃的發(fā)酵液中加入預冷的無水乙醇,使混合后的乙醇體積分數(shù)為70%,迅速攪拌均勻,于4 ℃冰箱中靜置過夜,4 ℃、10 000 r/min離心30 min,沉淀用0.005 mol/L的pH 5.8的磷酸鹽緩沖液溶解以防止蛋白質凝聚或變性,溶解液放置在4 ℃冰箱中冷藏,之后于4 ℃條件下透析除鹽并冷凍干燥成酶粉。
1.3.9 凍干凝乳酶的凝乳活性評價
取0.01 g粗酶凍干粉于5 mL去離子水中,充分溶解后按照1.3.4節(jié)方法測定凝乳活力,根據公式(1)換算粗酶的單位酶活力,并與商業(yè)凝乳酶做對比。
2 結果與分析
2.1 酒曲中產凝乳酶優(yōu)勢菌株的確定
2.1.1 菌株初篩
利用倍比稀釋法從發(fā)酵的江米酒中分離純化得到13 株不同菌落形態(tài)的純種菌株,將分離純化得到的13 株不同菌株分別以三點法點接于酪蛋白平板上,置于30 ℃恒溫培養(yǎng)箱內培養(yǎng)2 d,觀察并測定菌株所產凝乳圈及水解圈直徑(表1)。

表1 不同菌株在酪蛋白平板上凝乳圈和水解圈直徑Table 1 Diameters of hydrolysis and deposition zones of 13 strains isolated from Jiuqu in casein plate medium
從表1可以看出,LB-41D、PDA-41、PDA-61、PDA-82和yD-42這5 株菌所產凝乳圈和水解圈直徑為0,表明這5 株菌不產生凝乳酶。其余8 株菌在酪蛋白平板上都有不同大小的凝乳圈和水解圈。白色凝乳圈大說明菌株產凝乳酶的凝乳活力高,水解圈大說明菌株產凝乳酶蛋白水解活力高。菌株所產凝乳酶蛋白水解活力的大小對干酪質構和特殊風味有著重要的影響,蛋白水解活力高使干酪中蛋白水解過度生成苦味肽而導致制作的干酪有苦味,使消費者難以接受[3-5]。所以在篩選過程中應選取凝乳活力高而蛋白水解活力低的菌株。從有不同大小凝乳圈和水解圈的8 株不同菌株來看,其中LB-51菌株所產凝乳圈直徑最大同時水解圈直徑較小,由此可以初步選擇LB-51菌株為產凝乳酶優(yōu)勢菌。
2.1.2 菌株的復篩
將有白色凝乳圈的8 株菌分別接種于LB、yPD和PDA液體培養(yǎng)基中,在30 ℃、120 r/min條件下恒溫振蕩培養(yǎng)24 h,測定凝乳和蛋白水解活力,結果如表2所示。

表2 菌株在不同培養(yǎng)基中產酶活力Table 2 Rennet and proteolysis activities of 8 strains screened
由表2可知,菌株在LB中產凝乳酶的凝乳活力相對較高,在液體PDA培養(yǎng)基中產凝乳酶的凝乳活力最低。其中LB-51菌株在LB中發(fā)酵24 h時產凝乳酶的凝乳活力可達320 SU/mL,在8 株菌中產凝乳酶的凝乳活力最高,同時LB-51菌株在LB中發(fā)酵時蛋白水解活力相對較低。所以確定LB-51菌株是酒曲中產凝乳酶的優(yōu)勢菌。對于8 株菌株選擇了3 種不同的液體發(fā)酵培養(yǎng)基,只有在LB中產凝乳酶的凝乳活力較為理想;部分菌株在yPD和PDA中產酶活力不高或不產凝乳酶,這與培養(yǎng)基中營養(yǎng)成分和比例有關[26-27],說明這2 種培養(yǎng)基營養(yǎng)成分和比例不適合菌株產凝乳酶。所以3 種液體培養(yǎng)基中選擇LB作為基礎培養(yǎng)基,可通過優(yōu)化其營養(yǎng)成分和比例來進一步提高菌株的產凝乳酶的凝乳活力。
2.2 菌株初步鑒定
2.2.1 形態(tài)學觀察

圖1 LB-51菌株菌落形態(tài)(A)和革蘭氏染色照片(B)Fig. 1 Colony morphology (A) and Gram staining (B) of strain LB-51
將菌株LB-51在LB固體平板上劃線培養(yǎng)48 h后,其菌落為乳白色稍顯微黃,菌落邊緣不整齊,表面粗糙有黏液,不透明。通過革蘭氏染色、芽孢染色和穿刺培養(yǎng)實驗,菌株LB-51為革蘭氏反應為陽性,短桿狀,具有運動性,有芽孢,芽孢中生。
2.2.2 API生化試劑條法
將API生化試劑條法對菌株LB-51的發(fā)酵結果(表3)提交ApiWeb軟件中進行比對鑒定,結果可初步判定菌株LB-51為解淀粉芽孢桿菌(Bacillus amyloliquefaciens)或地衣芽孢桿菌(B. licheniformis)。

表3 LB-51菌株的主要生理學特性Table 3 Physiological characteristics of strain LB-51
2.2.3 菌株16S rDNA序列擴增結果

圖2 菌株LB-51的16S rDNA瓊脂糖凝膠電泳圖Fig. 2 Agarose gel electrophoresis pattern of PCR amplified product of 16S rDNA from strain LB-51
以菌株LB-51基因組DNA為模板,經PCR擴增后產物進行1%瓊脂糖凝膠電泳,結果在約1 500 bp處有一條特異性條帶,結果見圖2。將PCR產物回收純化后進行測序,結果菌株LB-51的16S rDNA序列長度為1 450 bp。
2.2.4 基于16S rDNA序列同源性比對與系統(tǒng)發(fā)育分析

圖3 以16S rDNA序列為基礎的解淀粉芽孢桿菌GSBa-1菌株系統(tǒng)發(fā)育樹Fig. 3 Phylogenetic tree of Bacillus amyloliquefaciens GSBa-1 based on 16S rDNA sequence
將菌株LB-51的16S rDNA基因序列與在GenBank中序列大小相近的已知菌株的相應序列進行比對,然后選取與LB-51序列同源性較高的菌株序列,利用MEGA6.0軟件進行分析,構建系統(tǒng)發(fā)育進化樹。結果如圖3所示,菌株LB-51與解淀粉芽孢桿菌MPA1034(HQ231913.1)在同一分支上,并通過MEGA 6.0軟件中Bootstrap的驗證表明它們具有較高的置信度,且支持率可達100%。結合上述形態(tài)學、生理生化實驗結果可將菌株LB-51確定為解淀粉芽孢桿菌,并進一步將此產凝乳酶菌株命名為解淀粉芽孢桿菌GSBa-1。
2.3 解淀粉芽孢桿菌GSBa-1的生長和產酶活力曲線圖

圖4 解淀粉芽孢桿菌GSBa-1生長(A)和產酶活力(B)曲線Fig. 4 Growth curve (A) and rennet activity curve (B) of Bacillus amyloliquefaciens GSBa-1 as a function of culture time
由圖4A可知,OD600nm值顯示菌株LB-51在液體培養(yǎng)基中0~4 h生長速率緩慢,菌體生物量幾乎不增加,處于遲緩期;在4~12 h時生長速率最快,菌體細胞以幾何級數(shù)速率分裂,處于對數(shù)生長期;在12~24 h時菌體量隨時間變化不大,基本保持平衡,處于穩(wěn)定期;24 h以后菌體量迅速減少,菌體死亡速率超過新生的速率,處于衰亡期,一般是由于營養(yǎng)成分不足和后期代謝產物的增加導致環(huán)境變化引起的[6]。由圖4B可知,菌株GSBa-1產凝乳酶在其對數(shù)生長期內產量很少,隨著發(fā)酵時間延長,產酶量也逐漸增加,在24~60 h之間產酶增加量不明顯;但隨著時間繼續(xù)延長,產酶活力明顯提高,在72 h時達到最大值,凝乳活力為(431.53±15.89) SU/mL,同時蛋白水解活力為(5.05±0.59) U/mL;之后酶活力逐漸降低,蛋白水解活力與凝乳活力變化趨勢基本相同。
2.4 解淀粉芽孢桿菌GSBa-1凝乳酶的凝乳活性評價

圖5 解淀粉芽孢桿菌GSBa-1凝乳酶、凝乳反應和乳清析出Fig. 5 Rennet, curd reaction and whey syneresis from Bacillus amyloliquefaciens GSBa-1
由圖5A可知,菌株GSBa-1凝乳酶粗酶為淺灰色,蓬松棉絮狀。由圖5B可知,相同的酶質量濃度條件下,GSBa-1凝乳酶比商業(yè)酶凝乳反應時間稍長,凝塊結實且富有彈性。由圖5C可知,凝塊收縮且都伴有乳清析出現(xiàn)象,和商業(yè)酶相比,菌株GSBa-1凝乳酶乳清析出反應不明顯。在凝乳反應中,2 mg/mL GSBa-1凝乳酶液凝乳時間為78 s,即凝乳活力為307.69 SU/mL,菌株GSBa-1粗酶單位酶活力為1.54×105SU/g;相同質量濃度條件下商業(yè)凝乳酶凝乳時間為36 s,單位酶活力為3.16×105SU/g。
3 討論與結論
從傳統(tǒng)安全食品宮廷奶酪的凝乳劑(江米酒酒曲)中分離篩選產凝乳酶的優(yōu)良菌株對發(fā)掘傳統(tǒng)飲食文化遺產、豐富產凝乳酶微生物菌源和緩解干酪加工所需凝乳酶緊張的供應狀態(tài)有著重要的理論和實踐意義[28]。國內已初步開展了酒曲中產凝乳酶微生物的分離篩選。劉振民等[29]采用酒藥作為分離源,篩選出高產凝乳酶霉菌菌株M10,并對該菌發(fā)酵產酶條件進行了優(yōu)化研究。滕國新等[30]對酒曲中產凝乳酶微生物進行了分離純化研究,結果表明根霉菌為酒曲中產凝乳酶優(yōu)勢菌。程巧玲等[31]從酒曲中篩選得到一株霉菌、一株酵母菌和兩株細菌,并確定霉菌為產凝乳酶優(yōu)勢菌。本實驗借鑒前人的研究經驗,通過對酒曲中微生物的分離純化,共得到11 株細菌和2 株真菌;采用酪蛋白平板法初篩和不同液體培養(yǎng)基發(fā)酵復篩出一株產凝乳酶優(yōu)勢菌株LB-51。根據形態(tài)學觀察、生理生化實驗和16S rDNA分子生物學鑒定該菌株為解淀粉芽孢桿菌,并命名為解淀粉芽孢桿菌GSBa-1。此實驗結果表明酒曲中存在高產凝乳酶細菌菌株,與前人報道的霉菌是產凝乳酶優(yōu)勢菌株不一致,這可能與酒曲來源及種類有關[29-31]。
液體LB培養(yǎng)基作為實驗菌株GSBa-1適宜的發(fā)酵產凝乳酶培養(yǎng)基,該菌株在此培養(yǎng)基中發(fā)酵產凝乳酶的凝乳活力于72 h時達到最大值,為(431.53±15.89) SU/mL,且蛋白水解活力為(5.05±0.59) U/mL。凝乳酶的C/P值(凝乳活力與蛋白水解活力的比值)是干酪加工中凝固劑的一個重要的效率指標[32]。有研究表明凝乳酶的C/P值在100~200之間時,凝乳效果最佳[30],本實驗菌株GSBa-1所產凝乳酶的C/P值為85.45,與上述比值接近,說明該實驗菌株所產凝乳酶適用于干酪的加工。將該菌株在最大產酶活力時進行凝乳酶的提取并冷凍干燥成凝乳酶凍干粉。通過菌株凝乳酶與商業(yè)凝乳酶做凝乳效果對比分析結果顯示,該菌株凝乳酶與商業(yè)凝乳酶凝乳效果相接近,凍干粉酶活力為1.54×105SU/g與商業(yè)凝乳酶活力(3.16×105SU/g)相差不大,后期可對菌株凝乳酶進行分離純化以獲得更高酶活力的純凝乳酶,并進行酶學特性和相關的凝乳機理研究。此外,分離篩選的純種解淀粉芽孢桿菌GSBa-1來源于酒曲,與同來源于酒曲中的真菌相比,具有發(fā)酵易于控制,產物易于提取分離等優(yōu)勢,更具備產業(yè)化開發(fā)應用的潛力。
[1] 李亮, 吳丹, 宿玲恰, 等. 重組畢赤酵母生產凝乳酶發(fā)酵優(yōu)化[J].食品與生物技術學報, 2016, 35(5): 457-464. DOI:10.3969/ j.issn.1673-1689.2016.05.002.
[2] 杭鋒, 洪青, 王欽博, 等. 凝乳酶的研究進展[J]. 食品科學, 2016, 37(3): 273-279. DOI:10.7506/spkx1002-6630-201603047.
[3] 普燕, 張富春. 干酪用牛凝乳酶替代品的研究進展[J]. 食品與發(fā)酵工業(yè), 2015, 41(5): 227-234. DOI:10.13995/j.cnki.11-1802/ts.201505041.
[4] 潘道東, 韓玲玲. 根霉凝乳酶的分離純化及其酶學特性研究[J]. 中國食品學報, 2011, 11(2): 53-59. DOI:10.3969/ j.issn.1009-7848.2011.02.008.
[5] 宋曦, 甘伯中, 賀曉玲, 等. 天祝放牧牦牛生活環(huán)境土壤中一株產凝乳酶細菌的分離與鑒定[J]. 食品科學, 2009, 30(11): 158-162. DOI:10.3321/j.issn:1002-6630.2009.11.035.
[6] 丁明亮, 歐陽安然, 王望斐, 等. 枯草芽孢桿菌產凝乳酶發(fā)酵條件的優(yōu)化[J]. 食品科學, 2011, 32(3): 156-160.
[7] 高維東, 甘伯中, 丁福軍, 等. 微生物凝乳酶的研究進展[J]. 中國乳品工業(yè), 2009, 37(5): 34-47. DOI:10.3969/j.issn.1001-2230.2009.05.010.
[8] 李學朋, 關明玲, 趙保堂, 等. 米黑毛霉酶凝干酪素生產工藝參數(shù)的優(yōu)化研究[J]. 食品工業(yè)科技, 2016, 37(3): 191-195. DOI:10.13386/ j.issn1002-0306.2016.03.032.
[9] ZHAO X, WANG J, ZHENG Z, et al. Production of a milk-clotting enzyme by glutinous rice fermentation and partial characterization of the enzyme[J]. Journal of Food Biochemistry, 2015, 39(1): 70-79. DOI:10.1111/jfbc.12108.
[10] 韓玲玲, 潘道東. 根霉產凝乳酶的固態(tài)發(fā)酵條件優(yōu)化[J]. 食品科學, 2010, 31(9): 156-160.
[11] 李倬林, 邵淑娟, 李鐵柱, 等. 響應面法優(yōu)化微小毛霉固態(tài)發(fā)酵生產凝乳酶工藝研究[J]. 食品工業(yè)科技, 2012, 33(4): 248-254.
[12] 吳進菊, 徐爾尼, 陳衛(wèi)平, 等. 酒曲根霉F34菌株凝乳酶的初步純化及部分酶學性質的研究[J]. 食品工業(yè)科技, 2008, 29(9): 135-137.
[13] DA SILVA R R, SOUTO T B, DE OLIVEIRA T B, et al. Evaluation of the catalytic specificity, biochemical properties, and milk clotting abilities of an aspartic peptidase from Rhizomucor miehei[J]. Journal of Industrial Microbiology & Biotechnology, 2016, 43(8): 1059-1069. DOI:10.1007/s10295-016-1780-4.
[14] 李建濤, 陳歷俊, 姜鐵民. 響應面法優(yōu)化解淀粉芽孢桿菌發(fā)酵產凝乳酶的工藝條件[J]. 中國乳品工業(yè), 2012, 40(6): 26-30. DOI:10.3969/j.issn.1001-2230.2012.06.007.
[15] 劉振民, 駱承癢. 江米酒乳凝固機理研究[J]. 食品科學, 2000, 21(7): 13-15. DOI:10.3321/j.issn:1002-6630.2000.07.003.
[16] 薛璐, 陳歷俊, 姜鐵民, 等. 江米酒凝乳酶酶學特性的研究[J]. 食品科學, 2008, 29(4): 259-262. DOI:10.3321/j.issn:1002-6630.2008.04.054.
[17] WANG y P, CHENG Q L, AHMED Z, et al. Purification and partial characterization of milk-clotting enzyme extracted from glutinous rice wine mash liquor[J]. Korean Journal of Chemical Engineering, 2009, 26(5): 1313-1318. DOI:10.1007/s11814-009-0225-4.
[18] 滕國新, 李里特. Rhizopus sp. 052凝乳酶的部分酶學性質[J]. 食品與發(fā)酵工業(yè), 2006, 32(7): 12-15. DOI:10.3321/j.issn:0253-990X.2006.07.004.
[19] 吳進菊, 徐爾尼, 張鳳英, 等. 中國曲中凝乳酶高產菌株的篩選及產酶條件的研究[J]. 中國食品學報, 2009, 9(1): 124-129. DOI:10.3969/ j.issn.1009-7848.2009.01.021.
[20] 于振, 李建科, 馬倩倩, 等. 響應面法優(yōu)化紅曲米中凝乳酶高產菌株的發(fā)酵條件[J]. 食品工業(yè)科技, 2012, 33(13): 146-150.
[21] 李子木, 陳強, 趙珂. 酒曲中凝乳酶產生菌的篩選及其培養(yǎng)條件研究[J]. 中國乳品工業(yè), 2007, 35(5): 32-35. DOI:10.3969/ j.issn.1001-2230.2007.05.009.
[22] 姜鐵民, 薛璐, 周偉明, 等. 江米酒凝乳酶的純化及凝乳機制初探[J].食品與發(fā)酵工業(yè), 2006, 32(7): 24-27. DOI:10.3321/j.issn:0253-990X.2006.07.007.
[23] EL-BENDARy M A, MOHARAM M E, ALI T H. Purification and characterization of milk clotting enzyme produced by Bacillus sphaericus[J]. Journal of Applied Sciences Research, 2007, 3(8): 695-699. DOI:10.1007/s11814-009-0225-4.
[24] 薛璐, 姜鐵民, 任發(fā)政, 等. 江米酒凝乳機理的初步研究[J]. 食品與發(fā)酵工業(yè), 2006, 32(9): 37-38. DOI:10.3321/j.issn:0253-990X.2006.09.009.
[25] LI C Q, LIU W C, ZHU P, et al. Phylogenetic diversity of bacteria associated with the marine sponge Gelliodes carnosa collected from the Hainan Island coastal waters of the South China Sea[J]. Microbial Ecology, 2011, 62: 800-812. DOI:10.1007/s00248-011-9896-6.
[26] LIU B L, TZENG Y M. Optimization of growth medium for the production of spores from Bacillus thuringiensis using response surface methodology[J]. Bioprocess Engineering, 1998, 18(6): 413-418. DOI:10.1007/PL00008999.
[27] 陳羽, 馮鎮(zhèn), 張宏偉, 等. 響應面法優(yōu)化芽孢桿菌FC96培養(yǎng)基組分的研究[J]. 食品科技, 2011, 36(6): 30-35.
[28] ZHANG W B, HE X L, LIU H N, et al. Statistical optimization of culture conditions for milk-clotting enzyme production by Bacillus amyloliquefaciens using wheat bran: an agro-industry waste[J]. Indian Journal of Microbiology, 2013, 53(4): 492-495. DOI:10.1007/s12088-013-0391-2.
[29] 劉振民, 劉輝, 駱承庠. 酒藥中凝乳酶菌株篩選及產酶條件研究[J].食品與發(fā)酵工業(yè), 2001, 27(5): 8-11. DOI:10.13995/j.cnki.11-1802/ ts.2001.05.003.
[30] 滕國新, 全慶陽, 王玉林, 等. 傳統(tǒng)清宮乳制品米酒奶(Guan-nai)的微生物學研究[C]//北京食品學會成立二十周年學術論文集. 北京: 北京食品學會, 1999.
[31] 程巧玲, 白小佳, 王艷萍. 江米酒中凝乳酶產生菌的分離及產酶條件的優(yōu)化[J]. 生物工程學報, 2008, 24(6): 999-1003. DOI:10.3321/ j.issn:1000-3061.2008.06.015.
[32] AHMED I A M, BABIKER E E, MORI N. Purification and characterization of milk-clotting enzyme from Solanum dubium seeds[C]//The 5th Annual Conference: Agricultural and Veterinary Research. Khartoum: University of Khartoum Dspace, 2014.
Isolation and Identification of Microbial Strains Producing Rennet from Jiuqu, a Traditional Chinese Fermentation Starter
TENG Junwei, ZHAO Xiao, YANG Yawei, ZHANG Jian, ZHAO Aimei, JIANG Yunyun, LI Liu, ZHENG Zhe, YANG Zhennai*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology & Business University (BTBU), Beijing 100048, China)
Eleven bacterial strains and two fungal strains were isolated from Jiuqu, a traditional Chinese fermentation starter for rice wine. Out of these, one bacterial strain, designated LB-51, capable of producing rennet was screened by the casein plate method and the Arima method. The strain was identified as Bacillus amyloliquefaciens by its morphological characteristics, physiological and biochemical tests (API 50CHB system) and 16S rDNA sequence analysis and species specific gene analysis and named as B. amyloliquefaciens GSBa-1. The rennet and proteolytic activities were (431.53 ± 15.89) SU/mL and (5.05 ± 0.59) U/mL, respectively, after 72 h shaking culture (120 r/min) at 30 ℃ for 72 h in liquid LB medium. The enzyme exhibited high milk-clotting activity and low protein hydrolysis activity. The milk-clotting activity was 1.54 × 105SU/g. B. amyloliquefaciens GSBa-1, an efficient producer and a safe source of rennet activity, is worth further research and development as a candidate strain for industrial production of rennet.
Jiuqu; rennet; isolation and identification; Bacillus amyloliquefaciens
10.7506/spkx1002-6630-201716004
TS252.1
A
1002-6630(2017)16-0023-06
騰軍偉, 趙笑, 楊亞威, 等. 酒曲中產凝乳酶微生物菌株的分離篩選及鑒定[J]. 食品科學, 2017, 38(16): 23-38. DOI:10.7506/spkx1002-6630-201716004. http://www.spkx.net.cn
TENG Junwei, ZHAO Xiao, YANG Yawei, et al. Isolation and identification of microbial strains producing rennet from Jiuqu, a traditional Chinese fermentation starter[J]. Food Science, 2017, 38(16): 23-38. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716004. http://www.spkx.net.cn
2016-11-03
國家自然科學基金面上項目(31371804);北京市百千萬人才工程資助項目(B類);國家自然科學基金青年科學基金項目(31601488);2016年北京工商大學研究生科研能力提升計劃項目;公益性行業(yè)(農業(yè))科研專項(201303085)
騰軍偉(1988—),男,碩士研究生,研究方向為食品生物技術。E-mail:tengjunwei0221@163.com
*通信作者:楊貞耐(1965—),男,教授,博士,研究方向為乳品加工及交叉學科的理論和應用。E-mail:yangzhennai@th.btbu.edu.cn

