枇杷葉科羅索酸抑制人低密度脂蛋白氧化修飾及保護血管內皮細胞氧化損傷作用
李 鋒,李義嘉,李清仙,郭養浩,石賢愛,*
(1.福州大學化學學院,福建 福州 350116;2.福州大學生物科學與工程學院,福建 福州 350116)
枇杷葉科羅索酸抑制人低密度脂蛋白氧化修飾及保護血管內皮細胞氧化損傷作用
李 鋒1,2,李義嘉2,李清仙2,郭養浩2,石賢愛2,*
(1.福州大學化學學院,福建 福州 350116;2.福州大學生物科學與工程學院,福建 福州 350116)
從枇杷葉中提取分離制備科羅索酸,采用體外Cu2+誘導低密度脂蛋白(low density lipoprotein,LDL)氧化損傷的體外化學反應模型及2,2’-偶氮二(2-甲基丙基咪)二鹽酸鹽(2,2’-azobis-2-methyl-propanimidamide dihydrochloride,AAPH)誘導人主動脈內皮細胞(human aortic endothelial cells,HAECs)氧化損傷的細胞模型,考察枇杷葉科羅索酸對LDL氧化過程的抑制作用及對動脈血管內皮細胞氧化損傷的保護作用。體外實驗結果表明,枇杷葉科羅索酸在體外10~100 μmol/L劑量范圍內能有效延長LDL氧化過程中的遲滯期,降低反應動力學曲線的曲線下面積以及降低脂質過氧化物的生成,表明科羅索酸在體外能有效抑制Cu2+誘導的LDL氧化。細胞實驗結果表明,在2~10 μmol/L劑量范圍內能有效降低AAPH所致HAECs的乳酸鹽脫氫酶漏出量,維護細胞結構的完整性;提高受損細胞的超氧化物歧化酶、谷胱甘肽過氧化物酶活性,從而提升內皮細胞抵抗氧化應激的能力;降低細胞處于sub-G1/G0狀態的比例,減少AAPH所致細胞的壞死或凋亡。表明枇杷葉科羅索酸能在細胞水平有效保護HAECs免受AAPH氧化應激損傷。
枇杷葉;科羅索酸;低密度脂蛋白;血管內皮細胞;脂質過氧化
枇杷葉(Folium Eriobotryae)作為一種傳統藥材,在我國民間使用歷史悠久,收載于典籍[1-2]。目前枇杷葉作為一種常見中藥,在臨床仍然廣泛使用,主要用于止咳平喘。研究表明枇杷葉中含有揮發油、三萜類、黃酮類、倍半萜類、氨基酸、糖類、酚苷類及其他有機酸類等化學成分[3-4],其中三萜酸含量最高,是其最主要的生物活性貢獻成分[5]。枇杷中最為典型的幾種三萜酸為熊果酸(ursolic acid)、齊墩果酸(oleanic acid)、科羅索酸(corosolic acid)、山楂酸(maslinic acid)、薔薇酸(euscaphic acid)和委陵菜酸(tormentic acid)等[5-8],其中熊果酸和科羅索酸的含量較高,其他幾種含量較少。科羅索酸作為熊果酸衍生物,又名2α-羥基熊果酸,屬于熊果烷型五環三萜酸(圖1)。近年來,科羅索酸的生物活性得到了深入的研究,研究表明具有抗氧化[9-11]、抗腫瘤[12-14]、降血糖[15-18]、抑制肥胖[19-21]以及抗炎[10,19,22]等藥理活性,引起了人們的廣泛的重視。
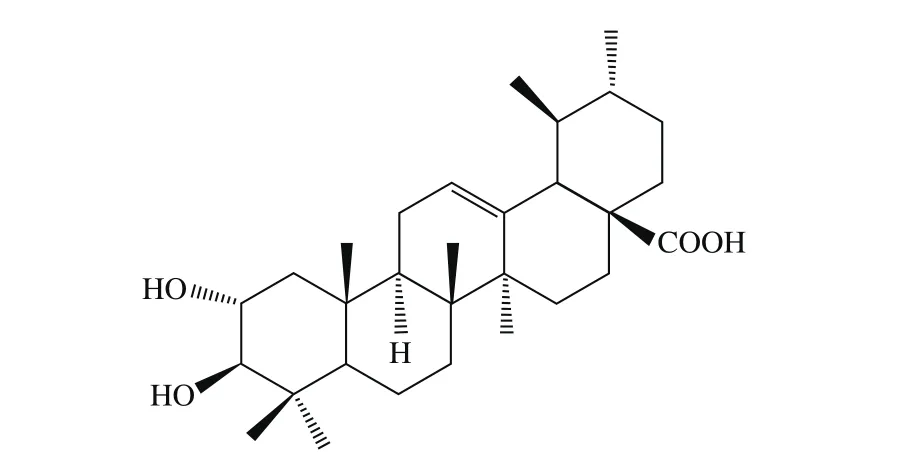
圖1 科羅索酸結構圖Fig. 1 Structure of corosolic acid
低密度脂蛋白(low density lipoprotein,LDL)是主要的血膽固醇運載工具,主要負責從肝向外周輸送膽固醇。LDL在體內易經活性氧(reactive oxygen species,ROS)自由基氧化損傷作用而轉變為氧化型低密度脂蛋白(oxidative low density lipoprotein,ox-LDL),而ox-LDL是致動脈粥樣硬化(atherosclerosis,AS)危險因素,故LDL的氧化損傷在AS的形成和發展中扮演著重要角色[23-24]。目前對科羅索酸抑制LDL氧化及AS形成的研究報道較少,本實驗擬采用體外Cu2+誘導人源LDL氧化損傷模型及2,2’-偶氮二(2-甲基丙基咪)二鹽酸鹽(2,2’-azobis-2-methyl-propanimidamide, dihydrochloride,AAPH)誘導人動脈內皮細胞(human aortic endothelial cells,HAECs)氧化損傷細胞模型,考察枇杷葉科羅索酸對LDL氧化過程的抑制作用及對動脈血管內皮細胞氧化損傷的保護作用。
1 材料與方法
1.1 材料與試劑
枇杷葉藥材 福州市中藥飲片廠。
HAECs細胞株 鼎國生物技術公司;人LDL 上海經科化學科技公司;細胞培養相關試劑(血清、培養基、抗生素及胰酶等) 美國HyClone公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,7-二氯二氫熒光素二乙酸酯(2’,7’-dichlorod ihydrofluorescein diacetate,DCFH-DA) 阿拉丁試劑有限公司;四乙氧基丙烷(1,1,3,3-tetraethoxypropane,TEP)、硫代巴比妥酸(2-thiobarbituric acid,TBA)、2,6-二叔丁基對甲酚(2,6-di-tert-butyl-4-methylphenol,BHT) 上海源葉生物科技公司;碘化丙啶(propidium iodide,PI)單染試劑盒、乳酸脫氫酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GPx)測定試劑盒 南京建成生物工程研究所;其他試劑均為分析純。
1.2 儀器與設備
COULTER EPICS XL型流式細胞儀 美國Beckman公司;二氧化碳培養箱 美國Thermo公司;倒置顯微鏡重慶光電儀器公司;50i型熒光顯微鏡 日本Nikon公司;SpectraMax i3x型熒光酶標儀、U410型超低溫冰箱 美國NBS公司;Z 323K型冷凍離心機 德國Hermle公司。
1.3 方法
1.3.1 枇杷葉科羅索酸的制備
枇杷葉烘干粉碎,按料液比1∶10(m/V)用90%乙醇于45 ℃提取3 次,每次2 h。過濾合并提取液,堿性條件下用活性碳吸附過濾去除葉綠素等非極性色素。脫色液減壓濃縮至浸膏,浸膏用少量乙酸乙酯溶解,上硅膠柱,采用乙酸乙酯/甲醇洗脫體系,收集富含科羅索酸組分。此組分再經C18半制備高效液相色譜(high performance liquid chromatography,HPLC)進一步分離純化,得到較純的枇杷葉科羅索酸樣品,經HPLC測定純度。
1.3.2 LDL的制備
為了避免商品LDL中的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)對后續實驗造成干擾,需通過透析法去除。采用磷酸鹽緩沖液(10 mmol/L、pH 7.4)4 ℃透析24 h,每隔6 h更換一次透析液。二喹啉甲酸(bicinchoninic acid,BCA)法測定蛋白濃度,過濾除菌,4 ℃保存備用。
1.3.3 Cu2+誘導LDL氧化
LDL氧化反應體系為:LDL終質量濃度100 μg pro/mL,CuSO4終濃度10 μmol/L,混合均勻,于37 ℃避光反應,結束時加入等體積含1 mmol/L EDTA和1 mmol/L BHT的混合液終止氧化反應[25]。本實驗中,反應體系中加入不同濃度(10、20、50、100 μmol/L)的枇杷葉科羅索酸考察對LDL氧化過程的抑制效果;體系中不加CuSO4和科羅索酸作為空白對照組,只加CuSO4作為模型誘導組。反應進行中實時測定共軛二烯鍵的形成情況。反應結束后,測定共軛二烯鍵的生產,取樣采用硫代巴比妥酸反應物(thiobarbituric acid reactive substances,TBARS)法分析LDL氧化物水平。
1.3.4 共軛二烯鍵的測定
共軛二烯鍵是LDL氧化的早期產物,采用Xu等[26]方法稍作改動。1 mL LDL溶液(100 μg/mL)與不同濃度枇杷葉科羅索酸樣品混合,對照組同樣條件但不加科羅索酸。體系中加入CuSO4使終濃度為10 μmol/L的啟動氧化反應,分光光度計每10 min測定234 nm波長處吸光度(A),持續4 h,記錄共軛二烯鍵的生產動力學曲線,并計算0~4 h的曲線下面積(area under the curve,AUC0~4h)。
1.3.5 TBARS分析
采用分析TBARS方法測定LDL氧化物[27]。1 mL的LDL溶液(100 mg/mL)與終濃度為10 μmol/L的CuSO4混合均勻,在加入或不加入(對照組)20 μL的不同濃度(10、20、50、100 μmol/L)枇杷葉科羅索酸樣品的情況下進行氧化,37 ℃避光反應4 h。反應體系加入EDTA(終濃度1 mmol/L)終止氧化,分別加入1 mL 20%乙酸和1 mL 0.67% TBA溶液,混合均勻,加熱至95 ℃反應30 min,冷卻至室溫。1 500 r/min離心10 min去除沉淀,取上清液測定532 nm波長處吸光度。10 μmol/L四乙氧基丙烷(1,1,3,3-tetraethoxypropane,TEP)作為標準品,與測定樣品同樣處理。按式(1)計算各組的TBARS值。

1.3.6 細胞培養及處理
HAECs用DMEM培養基(含15% FBS、20 U/mL bFGF、100 U/mL鏈霉素、100 U/mL青霉素),置于5% CO2、37 ℃培養箱中培養,每48 h換液一次。取對數生長期的細胞用0.25%胰酶消化,制備細胞懸液,密度調整至1×105個/mL,每孔100 μL接種于12 孔板,繼續培養24 h,隨后轉換無血清培養基培養4 h。隨機將培養孔分成3 組:空白對照組:不加任何藥物;模型刺激組:用含2 mmol/L AAPH無血清培養基氧化刺激;藥物組:分別用含1、2、5、10 μmol/L科羅索酸和2 mmol/L AAPH無血清培養基處理。每組設3 個復孔,用0.25%胰酶消耗制備細胞懸液用于后續實驗。
1.3.7 MTT法分析細胞存活率
培養板吸去培養基,加入含5 mg/mL MTT的無血清無酚紅培養基,于37 ℃、5% CO2條件繼續培養4 h,吸取MTT溶液,加入DMSO溶解所形成的甲簪晶體,570 nm波長處測定吸光度(A)。按式(2)計算細胞存活率。
1.3.8 細胞ROS水平、LDH漏出量及SOD、GPx活性的測定
細胞ROS含量測定:采用黑壁底透96 孔板培養細胞,藥物處理方法同1.3.6節。棄上清液,磷酸鹽緩沖液(phosphate buffer,PBS)清洗,每孔加入100 μL 10 μmol/L的DCFH-DA熒光染液,37 ℃避光染色30 min。PBS清洗2次,用SpectraMax i3x型熒光酶標儀測定熒光強度,其激發光波長為480 nm,發射光波長為520 nm;以最高組熒光強度為100%,計算其他各組的相對熒光強度。LDH漏出量測定:取細胞培養上清液,按照LDH試劑盒說明書操作,測定LDH活性,表示為U/mL。SOD、GPx活性測定:收集6 孔培養板中細胞,冰浴超聲波破碎,收集蛋白,BCA法測定蛋白濃度,樣品采用SOD和GPx試劑盒測定酶活力。
1.3.9 PI染色流式細胞術檢測細胞周期分布
將處于對數生長期的細胞接種于6 孔培養板中,接種密度為每孔5×105個細胞,組別設置及藥物處理同1.3.6節,培養24 h。吸除培養基,胰蛋白酶消化貼壁細胞,收集106個細胞,PBS洗滌1 次,3 000 r/min離心2 min,棄上清液。按照PI單染試劑盒說明書操作制備染色懸浮細胞,用于FCM分析。200 目尼龍網過濾,流式細胞儀檢測。激發波長488 nm,檢查收集104個細胞。
1.4 數據處理
采用Origin軟件進行單因素方差分析,P<0.05表明差異有顯著性,P<0.01表明差異極顯著。結果用±s表示。
2 結果與分析
2.1 枇杷葉科羅索酸的制備
枇杷葉含有多種五環三萜酸,其中科羅索酸的含量僅次于熊果酸,可達原料干質量的0.8%,但由于和山楂酸互為同分異構體,往往采用常規分離手段很難制備高純度樣品。本實驗采用常壓柱層析結合半制備HPLC方法,得到了較高純度的枇杷葉科羅索酸樣品,經HPLC分析其純度為93.4%(圖2)。
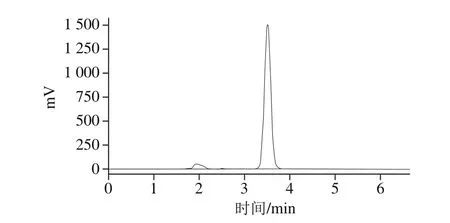
圖2 枇杷葉科羅索酸HPLC圖譜Fig. 2 HPLC prof i le of corosolic acid from Folium Eriobotryae

2.2 枇杷葉科羅索酸對Cu2+誘導LDL氧化的體外抑制作用
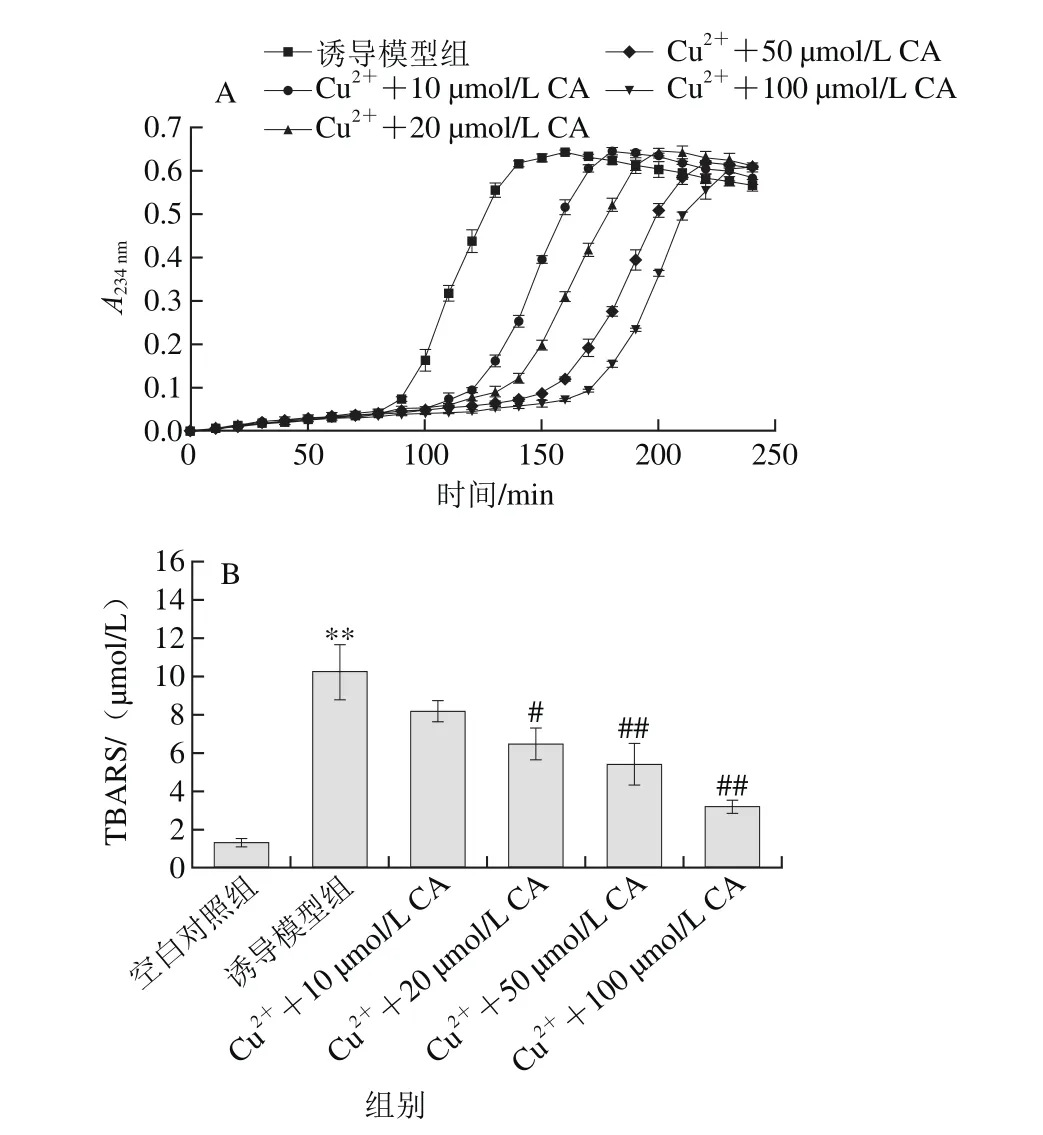
圖3 枇杷葉科羅索酸對Cu2+誘導LDL氧化的抑制作用Fig. 3 Inhibitory effect of corosolic acid on LDL oxidation induced by Cu2+ in vitro
共軛二烯鍵的形成是反映LDL早期氧化階段的標志,而TBARS法分析的是晚期氧化階段的產物,因此本研究分別測定了這兩項指標。如圖3A所示,Cu2+誘導LDL氧化的動力學曲線可明顯分為三階段:延滯期、快速反應期和減速期。Cu2+氧化LDL模型誘導組的延滯期平均為89.3 min,經枇杷葉科羅索酸處理可顯著延長延滯期時間,呈劑量依賴性(表1),10 μmol/L處理延長到117.5 min(P<0.05),而100 μmol/L水平時遲滯期進一步延長(P<0.01);同時科羅索酸也能有效降低Cu2+氧化LDL動力學曲線的AUC(表1),50 μmol/L和100 μmol/L水平時,從誘導模型組的81.0分別降低到42.38和33.89(P<0.01),而在10 μmol/L和20 μmol/L水平時,AUC降低也具有顯著性(P<0.05)。圖3B表明,科羅索酸能顯著降低Cu2+氧化LDL過程中脂質過氧化物的水平,呈劑量依賴性。經過Cu2+氧化誘導后,LDL反應體系中TBARS值顯著增加到約10.3 μmol/L水平,而20 μmol/L科羅索酸能將TBARS值降低到約6.5 μmol/L(P<0.05),100 μmol/L能更進一步降低到3.1 μmol/L水平(P<0.01)。

表1 Cu2+誘導氧化LDL動力學曲線延滯期時間及AUC0-4h比較Table 1 Lag time and AUC0?4hof kinetic curve of LDL oxidation induced by Cu2+
2.3 枇杷葉科羅索酸對細胞活性的影響及對AAPH氧化損傷細胞的保護作用
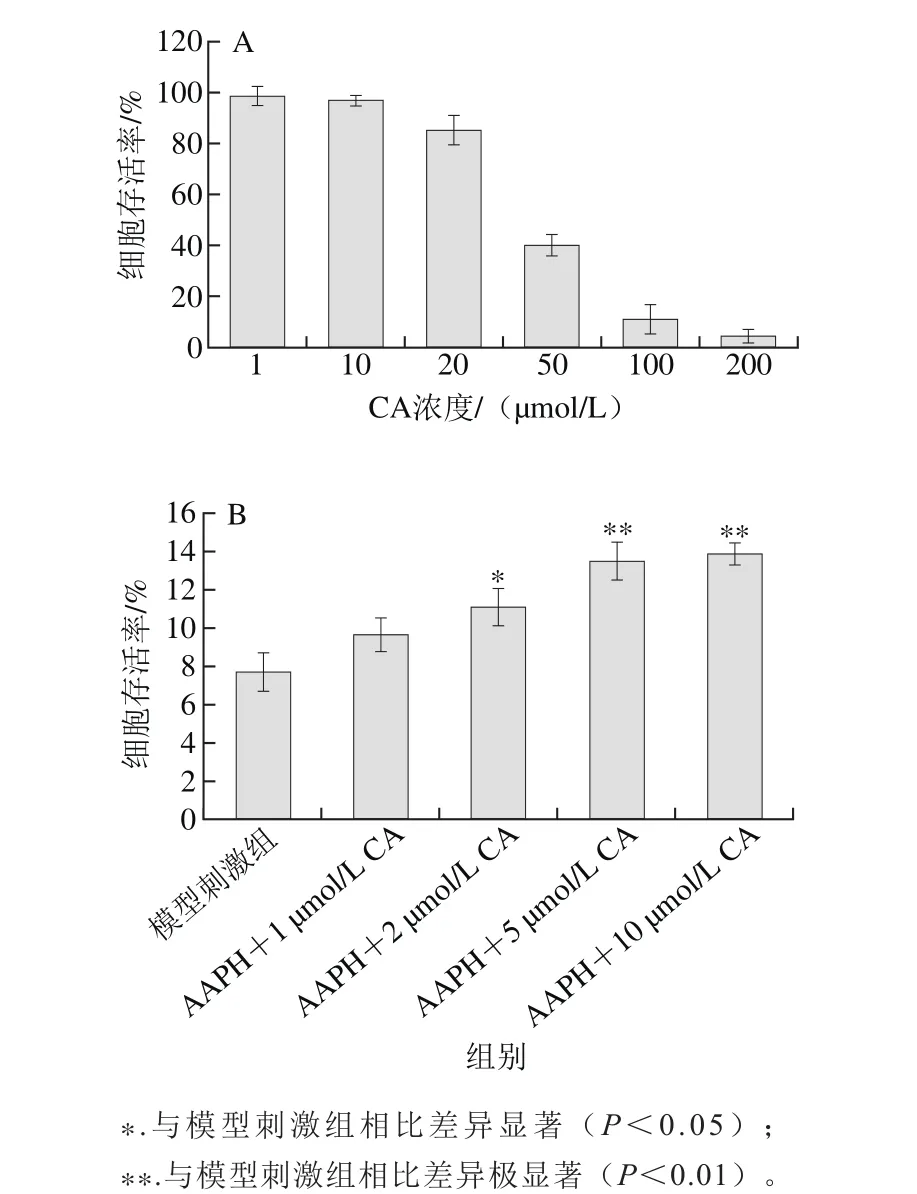
圖4 枇杷葉科羅索酸對正常HAECs的影響(A)及對AAPH所致損傷細胞的保護作用(B)Fig. 4 Corosolic acid effects on normal HAECs (A) and its protective effects on AAPH-induced cell damage (B)
已有研究表明科羅索酸具有一定的抗腫瘤作用,有明顯的細胞毒性作用,本研究在藥物本身不對HAECs產生損傷的前提條件下,考察其對細胞氧化損傷的保護作用,故需要先確定藥物的安全劑量。圖4A表明,隨著劑量的增加,科羅索酸會顯著抑制HAECs的活性。在50 μmol/L及以上濃度時,相對細胞存活率低于40%,抑制作用明顯;而在10 μmol/L及以下濃度時,相對細胞存活率接近100%,無明顯的抑制。故本實驗所設定的科羅索酸的細胞安全劑量上限為10 μmol/L,確定了1、2、5、10 μmol/L 4 個濃度梯度,在此劑量下考察藥物對細胞的保護作用。圖4B表明,與模型刺激組相比,科羅索酸在1 μmol/L劑量下對細胞活性無顯著提高,而在2、5和10 μmol/L劑量下能顯著提高細胞的活性(P<0.05,P<0.01),說明枇杷葉科羅索酸在一定的劑量范圍能有效保護HAECs內皮細胞免受AAPH的氧化損傷作用。
2.4 枇杷葉科羅索酸對AAPH氧化細胞的LDH漏出量、ROS水平及SOD、GPx活性影響
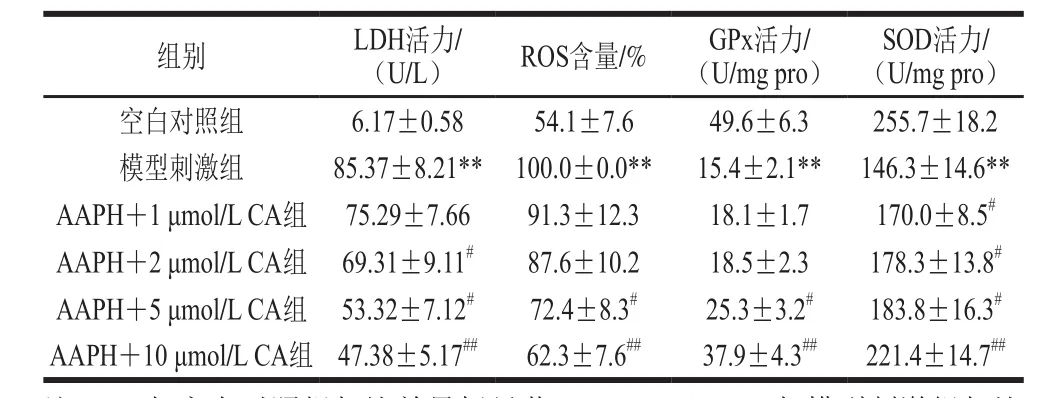
表2 枇杷葉科羅索酸對細胞LDH漏出量、ROS、SOD和GPx水平的影響Table 2 Effects of CA on LDH, ROS, SOD and GPx level in cells suffering from AAPH-induced damage
通過分析培養基中LDH活性來測定細胞LDH的漏出量,從而間接反映出細胞膜所受氧化損傷程度,結果如表2所示。與空白對照組細胞相比,模型刺激組的LDH活性顯著增加,漏出量劇增到85.37 U/L,說明細胞膜受損傷嚴重,而枇杷葉科羅索酸能有效保護細胞膜而降低細胞LDH的漏出量,呈劑量依賴性。細胞ROS水平反映了細胞氧化應激的程度,科羅索酸也能顯著抑制AAPH所致細胞的ROS水平的增加,在2 μmol/L劑量時ROS水平降至87.6%,隨著劑量增加,能進一步降低至62.3%,表明科羅索酸能有效減輕損傷細胞的胞內氧化應激水平。SOD和GPx是機體重要的抗氧化酶,反映了細胞的抗氧化應激狀態,結果表明枇杷葉科羅索酸同樣能提高AAPH所致損傷細胞的SOD、GPx活性,提升細胞的抵抗氧化應激能力。
2.5 枇杷葉科羅索酸對AAPH所致損傷細胞周期分布的影響
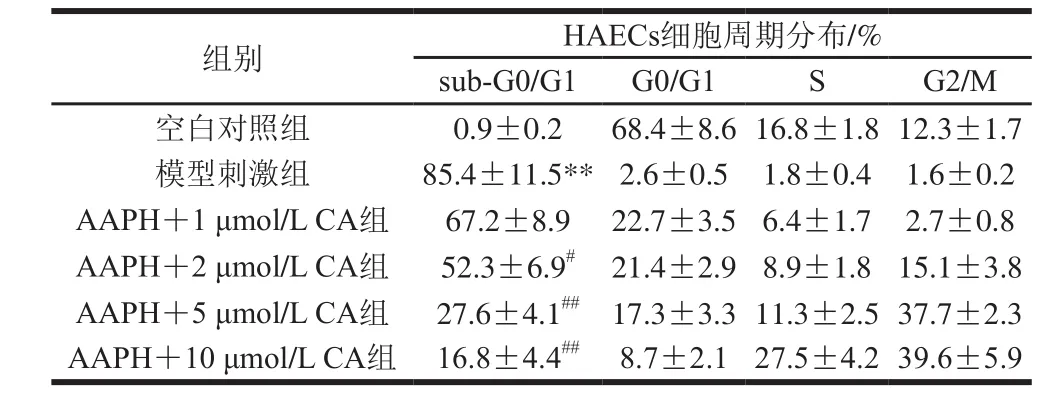
表3 枇杷葉科羅索酸對AAPH所致損傷細胞周期的影響(n=3)Table 3 Effect of corosolic acid on cell cycle (n=3)
PI為著色于核酸的熒光染料,無法通過完整的細胞膜,可以用來反映細胞的受損傷的程度。當細胞壞死或者處于凋亡晚期時,膜通透性變大,PI染料就可以進入膜內與DNA結合將核染成紅色。細胞各個時期DNA含量不同結合熒光染料的量也不同,對于正常細胞,具有完整細胞膜會阻擋PI進入細胞內部,細胞核不著色。
從表3可以看出,AAPH氧化誘導的細胞,sub-G0/G1所占比例平均為85.4%,遠高于空白對照細胞的平均值0.9%(P<0.01),說明細胞受損嚴重,幾乎都處于凋亡或壞死狀態;而經過枇杷葉科羅索酸的處理,能明顯降低sub-G0/G1細胞的比例,1 μmol/L的科羅索酸平均可降低至67.2%,而10 μmol/L時能平均降低至16.8%,說明科羅索酸抑制AAPH所致細胞損傷作用明顯,有效地保護了細胞結構的完整性。
3 討 論
機體ROS所致的LDL氧化損傷過程是致血管內皮細胞損傷的關鍵因素之一[28],其產物ox-LDL能促進內皮細胞及單核細胞分泌黏附分子,易于形成泡沫細胞[29]。LDL在體外易受過渡態金屬離子的誘導作用而被氧化,故本實驗采用體外Cu2+誘導LDL氧化來模擬體內的氧化過程。AAPH是常見的水溶性自由基誘導劑,能在生理條件下分解產生的自由基,從而對細胞產生氧化損傷,且產生自由基的速度可控,因而被認為是研究體內抗氧化的理想模型[30]。故本實驗采用體外Cu2+誘導人源LDL氧化損傷模型及AAPH誘導人動脈內皮細胞HAECs氧化損傷細胞模型,考察枇杷葉科羅索酸對LDL氧化過程的抑制作用及對動脈血管內皮細胞氧化損傷的保護作用。科羅索酸作為一種熊果烷型三萜酸,具有抗氧化及清除自由基的作用[31]。本實驗結果也表明,枇杷葉科羅索酸在體外較低的劑量條件下(10~100 μmol/L)即能有效延長LDL氧化過程中的遲滯期時間,降低反應動力學曲線的AUC以及TBARS值,表明枇杷葉科羅索酸在體外能有效抑制Cu2+誘導的LDL氧化。
細胞正常條件下處于一種氧化/抗氧化平衡狀態,當受外界氧化因子過度刺激時,會打破這種均衡狀態,導致氧化應激增強,抗氧化系統嚴重受損。SOD、GPx是機體重要的抗氧化酶,對維持細胞氧化還原平衡具有重要作用。LDH是較為穩定的蛋白質,存在于絕大多數正常細胞的胞質中,不能分泌到胞外,而一旦細胞膜受損,LDH即被釋放到細胞外;通過檢測細胞培養液中的LDH活性(即LDH的漏出量),可判斷細胞受損的程度[32]。本研究結果表明,在一定的劑量范圍內(2~10 μmol/L),枇杷葉科羅索酸能有效降低AAPH所致HAECs細胞的LDH漏出量,維護細胞膜的完整性;增加受損細胞的SOD、GPx活性,從而提升內皮細胞的抵抗氧化應激的能力;降低處于sub-G0/G1狀態的比例,減少AAPH所致細胞的壞死或凋亡。
綜上所述,枇杷葉科羅索酸在體外能有效抑制Cu2+誘導的人LDL氧化;保護HAECs免受AAPH所致的自由基氧化損傷,維護細胞結構的完整性。其機制有可能是通過增加細胞中諸如SOD、GPx等抗氧化酶而實現,具體的分子機理還需進一步深入研究。本研究表明,枇杷葉科羅索酸有望應用于抗動脈粥樣硬化領域,為枇杷葉的有效利用提供科學依據。
[1] 林玉霖, 林文津, 林力強. 枇杷葉的研究現狀與開發前景[J]. 中藥材, 2006, 29(10): 1111-1114. DOI:10.13863/j.issn1001-4454.2006.10.045.
[2] 曾美怡, 樓之岑, 周夢白. 國產枇杷葉的生藥學研究[J]. 藥學學報, 1955, 3(2): 189-194. DOI:10.16438/j.0513-4870.1955.02.004.
[3] 陳劍, 李維林, 吳菊蘭, 等. 枇杷葉的化學成分研究(Ⅰ)[J]. 中草藥, 2006, 37(11): 1632-1634. DOI:10.3321/j.issn:0253 -2670.2006.11.012.
[4] 呂寒, 于盱, 陳劍, 等. 枇杷葉黃酮類化學成分研究[J]. 中成藥, 2014, 36(2): 329-332. DOI:10.3969/j.issn.1001-1528.2014.02.025.
[5] 陳歡, 陳光, 任紅梅, 等. 枇杷葉中三萜類成分的研究[J]. 北京化工大學學報(自然科學版), 2012, 39(3): 40-45. DOI:10.3969/ j.issn.1671-4628.2012.03.008.
[6] 呂寒, 陳劍, 李維林, 等. 枇杷葉中三萜類化學成分的研究[J]. 中藥材, 2008, 31(9): 1351-1354. DOI:10.3321/j.issn:1001-4454.2008.09.020.
[7] 陳龍勝, 忻旸, 許舒雯. RP-HPLC同時測定枇杷葉中4 種三萜酸[J].中草藥, 2008, 39(9): 1411-1413.
[8] 呂寒, 習超鵬, 陳劍, 等. 不同生長季節枇杷葉中三萜酸成分的含量變化[J]. 中國中藥雜志, 2009, 34(18): 2353-2355.
[9] ALADEDUNYE F A, OKORIE D A, IGHODARO O M. Antiinflammatory and antioxidant activities and constituents of Platostoma africanum P. Beauv.[J]. Natural Product Research, 2008, 22(12): 1067-1073. DOI:10.1080/14786410802264004.
[10] YAMAGUCHI Y, YAMADA K, YOSHIKAWA N, et al. Corosolic acid prevents oxidative stress, inf l ammation and hypertension in SHR/ NDmcr-cp rats, a model of metabolic syndrome[J]. Life Sciences, 2006, 79(26): 2474-2479. DOI:10.1016/j.lfs.2006.08.007.
[11] MIURA T, TAKAGI S, ISHIDA T. Management of diabetes and its complications with banaba (Lagerstroemia speciosa L.) and corosolic acid[J]. Evidence-based Complementary and Alternative Medicine: ECAM, 2012, 2012(2012): 871495. DOI:10.1155/2012/871495.
[12] FUJIWARA Y, TAKAISHI K, NAKAO J, et al. Corosolic acid enhances the antitumor effects of chemotherapy on epithelial ovarian cancer by inhibiting signal transducer and activator of transcription 3 signaling[J]. Oncology Letters, 2013, 6(6): 1619-1623. DOI:10.3892/ ol.2013.1591.
[13] LEE M S, CHA E Y, THUONG P T, et al. Down-regulation of human epidermal growth factor receptor 2/neu oncogene by corosolic acid induces cell cycle arrest and apoptosis in NCI-N87 human gastric cancer cells[J]. Biological and Pharmaceutical Bulletin, 2010, 33(6): 931-937. DOI:10.1248/bpb.33.931.
[14] FUJIWARA Y, KOMOHARA Y, IKEDA T, et al. Corosolic acid inhibits glioblastoma cell proliferation by suppressing the activation of signal transducer and activator of transcription-3 and nuclear factor-kappa B in tumor cells and tumor-associated macrophages[J]. Cancer Science, 2011, 102(1): 206-211. DOI:10.1111/j.1349-7006.2010.01772.x.
[15] FUKUSHIMA M, MATSUYAMA F, UEDA N, et al. Effect of corosolic acid on postchallenge plasma glucose levels[J]. Diabetes Research and Clinical Practice, 2006, 73(2): 174-177. DOI:10.1016/ j.diabres.2006.01.010.
[16] STOHS S J, MILLER H, KAATS G R. A review of the eff i cacy and safety of banaba (Lagerstroemia speciosa L.) and corosolic acid[J]. Phytotherapy Research, 2012, 26(3): 317-324. DOI:10.1002/ptr.3664.
[17] YANG J, LENG J, LI J J, et al. Corosolic acid inhibits adipose tissue inf l ammation and ameliorates insulin resistance via AMPK activation in high-fat fed mice[J]. Phytomedicine, 2016, 23(2): 181-190. DOI:10.1016/j.phymed.2015.12.018.
[18] SIVAKUMAR G, VAIL D R, NAIR V, et al. Plant-based corosolic acid: future anti-diabetic drug?[J]. Biotechnology Journal, 2009, 4(12): 1704-1711. DOI:10.1002/biot.200900207.
[19] YAMADA K, HOSOKAWA M, YAMADA C, et al. Dietary corosolic acid ameliorates obesity and hepatic steatosis in KK-Ay mice[J]. Biological and Pharmaceutical Bulletin, 2008, 31(4): 651-655. DOI:10.1248/bpb.31.651.
[20] AGUIRRE M C, DELPORTE C, BACKHOUSE N, et al. Topical antiinf l ammatory activity of 2α-hydroxy pentacyclic triterpene acids from the leaves of Ugni molinae[J]. Bioorganic & Medicinal Chemistry, 2006, 14(16): 5673-5677. DOI:10.1016/j.bmc.2006.04.021.
[21] SHIH C C, CIOU J L, LIN C H, et al. Cell suspension culture of Eriobotrya japonica regulates the diabetic and hyperlipidemic signs of high-fat-fed mice[J]. Molecules, 2013, 18(3): 2726-2753. DOI:10.3390/molecules18032726.
[22] BANNO N, AKIHISA T, TOKUDA H, et al. Triterpene acids from the leaves of and their anti-inflammatory and antitumor-promoting effects[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(1): 85-90. DOI:10.1271/bbb.68.85.
[23] XU X H, SHAH P K, FAURE E, et al. Toll-like receptor-4 is expressed by macrophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized LDL[J]. Circulation, 2001, 104(25): 3103-3108. DOI:10.1161/hc5001.100631.
[24] JOVINGE S, ARES M P, KALLIN B, et al. Human monocytes/ macrophages release TNF-α in response to ox-LDL[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 1996, 16(12): 1573-1579. DOI:10.1161/01.ATV.16.12.1573.
[25] THILAKARATHNA S H, RUPASINGHE H V, NEEDS P W. Apple peel bioactive rich extracts effectively inhibit in vitro human LDL cholesterol oxidation[J]. Food Chemistry, 2013, 138(1): 463-470. DOI:10.1016/j.foodchem.2012.09.121.
[26] XU B J, YUAN S H, CHANG S K. Comparative studies on the antioxidant activities of nine common food legumes against copperinduced human low-density lipoprotein oxidation in vitro[J]. Journal of Food Science, 2007, 72(Suppl 7): 522-527. DOI:10.1111/j.1750-3841.2007.00464.x.
[27] LIU F, NG T. Antioxidative and free radical scavenging activities of selected medicinal herbs[J]. Life Sciences, 2000, 66(8): 725-735. DOI:10.1016/S0024-3205(99)00643-8.
[28] 潘玉婷, 郭春雨, 馬曉娟, 等. 人參皂苷Rb3對ox-LDL誘導內皮細胞氧化應激與功能障礙的類雌激素樣保護作用[J]. 藥學學報, 2014, 49(10): 1406-1412. DOI:10.16438/j.0513-4870.2014.10.003.
[29] 劉穎琳, 劉耕陶. 丹酚酸-A體外對人血清低密度脂蛋白氧化修飾的抑制作用[J]. 藥學學報, 2002, 37(2): 81-85. DOI:10.3321/ j.issn:0513-4870.2002.02.001.
[30] 陳建平, 李琳, 蘇健裕. 姜黃素的抗氧化及抗腫瘤活性研究[J]. 現代食品科技, 2014, 30(12): 11-15. DOI:10.13982/ j.mfst.1673-9078.2014.12.003.
[31] LIU X, ZHU L, TAN J, et al. Glucosidase inhibitory activity and antioxidant activity of flavonoid compound and triterpenoid compound from Agrimonia Pilosa Ledeb[J]. BMC Complementary and Alternative Medicine, 2014, 14(1): 12. DOI:10.1186/1472-6882-14-12.
[32] FOTAKIS G, TIMBRELL J A. In vitro cytotoxicity assays: comparison of LDH, neutral red, MTT and protein assay in hepatoma cell lines following exposure to cadmium chloride[J]. Toxicology Letters, 2006, 160(2): 171-177. DOI:10.1016/j.toxlet.2005.07.001.
Corosolic Acid from Folium Eriobotryae Inhibits LDL Oxidation and Protects HAECs against Oxidative Damage
LI Feng1,2, LI Yijia2, LI Qingxian2, GUO Yanghao2, SHI Xian’ai2,*
(1. College of Chemistry, Fuzhou University, Fuzhou 350116, China; 2. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350116, China)
In the present study, corosolic acid (CA) was extracted and separated from Folium Eriobotryae. A Cu2+-induced low density lipoprotein (LDL) oxidation model was employed to evaluate the inhibitory effect of CA on LDL oxidation in vitro, and a human aortic endothelial cell (HAEC) model of oxidative damage induced by (2,2’-azobis-2-methylpropanimidamide dihydrochloride, AAPH) was employed to evaluate the protective effect of CA on oxidative damage. In the dose range of 10-100 μmol/L, CA effectively extended the lag time of the Cu2+-induced LDL oxidation process, reduced the area under the oxidation kinetic curve (AUC) and inhibited the generation of lipid peroxide indicating that CA could effectively inhibit LDL oxidation induced by Cu2+. In the cellular experiment at the dose range of 2-10 μmol/L, CA effectively reduced LDH leakage induced by AAPH, maintained the integrity of cell structure, enhanced the activities of antioxidant enzymes such as superoxide dismutase (SOD) and glutathione peroxidase (GPx) and therefore oxidative stress resistance, reduced the proportion of sub-G1/G0 cells and necrosis or apoptosis induced by AAPH. These results demonstrated that CA could elevate cellular antioxidant capacity, maintain the integrity of cellular structure, and ultimately protect HAECs against oxidative stress damage induced by AAPH.
Folium Eriobotryae; corosolic acid; low density lipoprotein(LDL); vascular endothelial cells; lipid peroxidation
10.7506/spkx1002-6630-201715035
TS201.4
A
1002-6630(2017)15-0215-06
李鋒, 李義嘉, 李清仙, 等. 枇杷葉科羅索酸抑制人低密度脂蛋白氧化修飾及保護血管內皮細胞氧化損傷作用[J]. 食品科學, 2017, 38(15): 215-220. DOI:10.7506/spkx1002-6630-201715035. http://www.spkx.net.cn
LI Feng, LI Yijia, LI Qingxian, et al. Corosolic acid from Folium Eriobotryae inhibits LDL oxidation and protects HAECs against oxidative damage[J]. Food Science, 2017, 38(15): 215-220. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201715035. http://www.spkx.net.cn
2016-06-14
國家海洋公益性行業科研專項(201205022)
李鋒(1976—),男,助理研究員,碩士,主要從事天然成分生物活性研究。E-mail:lifeng9676@aliyun.com
*通信作者:石賢愛(1971—),男,教授,博士,主要從事海洋生物工程研究。E-mail:shixa@fzu.edu.cn

