硫利達(dá)嗪通過內(nèi)質(zhì)網(wǎng)應(yīng)激介導(dǎo)DR5表達(dá)上調(diào)增敏TRAIL對(duì)肺癌PC9細(xì)胞的促凋亡效應(yīng)
李娟 汪毅 劉柳 袁媛 鮑揚(yáng)漪
腫瘤壞死因子相關(guān)凋亡誘導(dǎo)配體(tumor necrosis factor-related apoptosis-inducting ligand, TRAIL)屬于TNF超家族,可誘導(dǎo)腫瘤細(xì)胞發(fā)生凋亡。TRAIL可通過與其受體TRAIL-R1 (death receptor 4, DR4)、TRAIL-R2(death receptor 5, DR5)結(jié)合促使靶細(xì)胞發(fā)生凋亡。然而,相當(dāng)數(shù)量的腫瘤細(xì)胞可耐受TRAIL誘導(dǎo)的凋亡而得以存活——針對(duì)此類已發(fā)生TRAIL抵抗的腫瘤細(xì)胞,僅以TRAIL處理無法對(duì)之進(jìn)行殺傷。腫瘤細(xì)胞對(duì)TRAIL發(fā)生耐受的原因是多方面的:腫瘤細(xì)胞表面的DR4、DR5表達(dá)低下或功能異常、TRAIL與DR4、DR5結(jié)合后胞內(nèi)信號(hào)轉(zhuǎn)導(dǎo)受阻、胞內(nèi)抗凋亡蛋白高表達(dá)以及促生存通路活化等因素均能使腫瘤細(xì)胞對(duì)TRAIL發(fā)生原發(fā)(繼發(fā))的抵抗[1]。理解腫瘤細(xì)胞TRAIL抵抗現(xiàn)象的發(fā)生機(jī)制有助于逆轉(zhuǎn)腫瘤細(xì)胞對(duì)TRAIL的耐受;此外,將傳統(tǒng)化療或表觀調(diào)節(jié)類藥物(即增敏劑)與TRAIL處理相聯(lián)合作用于腫瘤細(xì)胞,上調(diào)TRAIL的促凋亡效應(yīng)也是目前TRAIL的研究重點(diǎn)之一。TRAIL治療晚期非小細(xì)胞肺癌[2](non-small cell lung cancer, NSCLC)及轉(zhuǎn)移的結(jié)直腸癌[3]已經(jīng)進(jìn)入II期臨床試驗(yàn),但腫瘤細(xì)胞對(duì)TRAIL的抵抗問題同樣限制了其在臨床上的應(yīng)用。
硫利達(dá)嗪(thioridazine, THZ)為一種多巴胺受體阻滯劑,廣泛應(yīng)用于精神分裂癥的治療,最近其被證實(shí)對(duì)多種腫瘤細(xì)胞具有抗增殖活性[4-7]。本課題組前期實(shí)驗(yàn)證實(shí)[8],THZ可抑制食管癌ECA-109、TE-1細(xì)胞的增殖,且對(duì)食管癌細(xì)胞具有放射處理增敏效應(yīng),其機(jī)制可能與下調(diào)線粒體抗凋亡蛋白Bcl-2、Bcl-xL及抑制PI3K/AKT/mTOR通路活性有關(guān)。據(jù)統(tǒng)計(jì),我國(guó)肺癌患者部分存在表皮生長(zhǎng)因子受體(epidermal growth factor receptor,EGFR)突變,而在晚期肺腺癌患者中,EGFR突變陽性率高達(dá)50%左右[9],臨床試驗(yàn)發(fā)現(xiàn),針對(duì)EGFR突變患者的靶向藥物——EGFR酪氨酸激酶抑制劑(EGFR tyrosine kinase inhibitors, EGFR-TKIs)如吉非替尼等治療在取得療效進(jìn)展的同時(shí)也存在一定程度的耐藥問題[10],因此本實(shí)驗(yàn)以EGFR突變型NSCLC PC9細(xì)胞為研究對(duì)象,觀察THZ對(duì)TRAIL的殺傷增敏效應(yīng)及對(duì)TRAIL抵抗的逆轉(zhuǎn)作用,并探討其可能的作用機(jī)制。
1 材料與方法
1.1 材料
1.1.1 實(shí)驗(yàn)細(xì)胞株 人肺腺癌細(xì)胞株P(guān)C9購買于中國(guó)科學(xué)院上海細(xì)胞庫。
1.1.2 主要藥品與試劑 硫利達(dá)嗪,4-PBA購于美國(guó)Sigma公司;二甲基亞砜(DMSO)、MTT試劑購于美國(guó)Sigma公司;DMEM高糖培養(yǎng)基、1×PBS緩沖溶液購于美國(guó)Hyclone公司;胎牛血清購于浙江天杭生物;Annexin V-FITC/PI雙染細(xì)胞凋亡檢測(cè)試劑盒購于上海貝博生物公司;胰酶、SDS-PAGE凝膠配制試劑盒購于北京碧云天生物公司;重組人TRAIL蛋白(rh-TRAIL)、DR5-PE流式抗體購于美國(guó)eBioscience公司;兔抗人GRP78單抗、p-eIF2α單抗、ATF4單抗、Caspase-3多抗、PARP單抗及小鼠抗人CHOP單抗、Caspase-8單抗、Caspase-9單抗購于美國(guó)Cell Signaling Technology公司;兔抗人DR5單抗購于英國(guó)Abcam公司;兔抗人p-PERK多抗購于美國(guó)Santa Cruz Biotechnology公司;兔二抗及小鼠二抗購于北京中杉金橋公司。
1.2 細(xì)胞培養(yǎng)與藥物保存使用 配制含有10%胎牛血清的DMEM完全培養(yǎng)基,按培養(yǎng)基體積加入雙抗,該培養(yǎng)基用于PC9細(xì)胞培養(yǎng)與傳代。加入培養(yǎng)基后將細(xì)胞置于37oC、5%CO2飽和濕度恒溫培養(yǎng)箱中培養(yǎng)。注意觀察細(xì)胞生長(zhǎng)情況及密度,每天全量換液,當(dāng)細(xì)胞呈對(duì)數(shù)生長(zhǎng)時(shí)用0.25%胰酶消化傳代。THZ以DMSO為溶媒進(jìn)行配制,濃度為0.1 mol/L,為避免藥物的反復(fù)凍融,將其分裝成每管10 μL于-80oC冰箱儲(chǔ)存,使用時(shí)以完全培養(yǎng)基稀釋成需要的濃度,DMSO終濃度須小于0.1%。重組人TRAIL蛋白以去離子水為溶酶進(jìn)行配制,濃度為0.1 mg/mL,分裝為每管10 μL于-20oC保存,使用時(shí)以完全培養(yǎng)基稀釋成需要的濃度。
1.3 THZ和TRAIL單藥或聯(lián)合處理PC9細(xì)胞MTT法實(shí)驗(yàn)步驟 取呈對(duì)數(shù)生長(zhǎng)PC9細(xì)胞,按8×103個(gè)/孔接種于96孔板中,培養(yǎng)至細(xì)胞呈對(duì)數(shù)生長(zhǎng)時(shí),對(duì)照組換液,實(shí)驗(yàn)組每孔更換含不同濃度的THZ(0 μmol/L、10 μmol/L、20 μmol/L、25 μmol/L、30 μmol/L、35 μmol/L、40 μmol/L、45 μmol/L、50 μmol/L)的培養(yǎng)基,各組均設(shè)置3個(gè)副孔和一個(gè)空白孔,培養(yǎng)24 h。為觀察THZ與TRAIL對(duì)細(xì)胞增殖的影響,細(xì)胞給予不同濃度THZ(0 μmol/L、20 μmol/L、25 μmol/L、30 μmol/L)、TRAIL(0 ng/mL、10 ng/mL、50 ng/mL、100 ng/mL)單獨(dú)或聯(lián)合處理,培養(yǎng)24 h后應(yīng)用MTT檢測(cè)THZ對(duì)細(xì)胞生長(zhǎng)狀況的影響,酶標(biāo)儀(490 nm和655 nm雙波長(zhǎng))測(cè)定各孔吸光度值(optical density, OD),絕對(duì)吸光度值=細(xì)胞孔吸光度值-空白孔吸光度值,并計(jì)算細(xì)胞存活率=(實(shí)驗(yàn)組OD值/對(duì)照組OD值)×100%。實(shí)驗(yàn)重復(fù)3次。
1.4 Western blotting檢測(cè)凋亡相關(guān)蛋白、內(nèi)質(zhì)網(wǎng)應(yīng)激關(guān)鍵蛋白的表達(dá) 取對(duì)數(shù)生長(zhǎng)細(xì)胞,按實(shí)驗(yàn)分組更換含THZ培養(yǎng)基,實(shí)驗(yàn)組1:0 μmol/L(對(duì)照組)、25 μmol/L、30 μmol/L、35 μmol/L;實(shí)驗(yàn)組2:0 μmol/L(對(duì)照組)、25 μmol/L THZ聯(lián)合50 ng/mL TRAIL、50 ng/mL TRAIL、1 mmol/L 4-PBA及25 μmol/L THZ聯(lián)合50 ng/mL TRAIL,培養(yǎng)24 h后常規(guī)胰酶消化收集細(xì)胞,計(jì)數(shù)后加入相應(yīng)量的細(xì)胞裂解液后沸水浴裂解提取蛋白。蛋白樣品離心處理后制膠,上樣,電泳,轉(zhuǎn)膜,封閉液室溫封閉1 h,室溫孵育1:1,000一抗1 h,1×TBST洗膜10 min,3遍,室溫孵育1:5,000二抗1 h,1×TBST洗膜10 min,3遍,在PVDF膜表面涂布發(fā)光劑,暗室曝光顯影。Western blotting條帶經(jīng)掃描儀掃描成像后,采用Image J進(jìn)行灰度分析,計(jì)算目的蛋白與β-actin的灰度比值,進(jìn)行下一步統(tǒng)計(jì)分析。實(shí)驗(yàn)重復(fù)3次。
1.5 流式檢測(cè)細(xì)胞表面DR5表達(dá)水平 取處于對(duì)數(shù)生長(zhǎng)期的PC9細(xì)胞,按2×105個(gè)/孔接種于六孔板。常規(guī)培養(yǎng)至細(xì)胞呈對(duì)數(shù)生長(zhǎng)時(shí),按實(shí)驗(yàn)分組更換含培養(yǎng)基,實(shí)驗(yàn)組為:THZ(25 μmol/L)、THZ(25 μmol/L)聯(lián)合4-PBA(1 mmol/L),對(duì)照組加0.1%DMSO培養(yǎng)基,繼續(xù)培養(yǎng)24 h后收集細(xì)胞,PBS洗滌后重懸,DR5抗體孵育,混勻,4oC反應(yīng)30 min,上流式細(xì)胞儀檢測(cè)。實(shí)驗(yàn)重復(fù)3次。
1.6 流式檢測(cè)細(xì)胞凋亡率 取處于對(duì)數(shù)生長(zhǎng)期的PC9細(xì)胞,按2×105個(gè)/孔接種于六孔板。常規(guī)培養(yǎng)至細(xì)胞呈對(duì)數(shù)生長(zhǎng)時(shí),按實(shí)驗(yàn)分組更換含培養(yǎng)基,實(shí)驗(yàn)組為:TRAIL(50 ng/mL)、TRAIL(50 ng/mL)聯(lián)合THZ(25 μmol/L)、4-PBA(1 mmol/L)干預(yù)TRAIL(50 ng/mL)聯(lián)合THZ(25 μmol/L),對(duì)照組加培養(yǎng)基,繼續(xù)培養(yǎng)24 h后收集細(xì)胞,PBS洗滌后重懸,計(jì)數(shù),加入400 μL Annexin V結(jié)合液重懸細(xì)胞,調(diào)節(jié)細(xì)胞密度為1×106個(gè)/mL,加入5 μL Annexin V,再加入10 μL PI,混勻,室溫下避光反應(yīng)15 min,上流式細(xì)胞儀檢測(cè)細(xì)胞凋亡,計(jì)算細(xì)胞凋亡率。實(shí)驗(yàn)重復(fù)3次。
1.7 統(tǒng)計(jì)學(xué)方法 采用SPSS 19.0軟件進(jìn)行統(tǒng)計(jì)分析。實(shí)驗(yàn)數(shù)據(jù)以Mean±SD表示,組間數(shù)據(jù)比較采用單因素方差分析及Dunnett-t檢驗(yàn),顯著性檢驗(yàn)水準(zhǔn)取α=0.05,以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 THZ對(duì)PC9細(xì)胞的增殖抑制作用 MTT結(jié)果顯示,THZ對(duì)PC9細(xì)胞的增殖抑制效應(yīng)呈劑量依賴性,THZ對(duì)PC9細(xì)胞的半數(shù)抑制濃度值(half maximal inhibitory concentration, IC50)為(29.8±1.6)μmol/L。自20 μmol/L起,各實(shí)驗(yàn)組與對(duì)照組相比差異有統(tǒng)計(jì)學(xué)意義(P<0.05)(圖1A)。400倍光鏡下觀察細(xì)胞,實(shí)驗(yàn)組細(xì)胞隨著藥物濃度增加,細(xì)胞數(shù)量減少,貼壁減少,體積縮小,邊緣透亮,漂浮狀細(xì)胞增加(圖1B)。Western blotting結(jié)果顯示隨著THZ濃度增加,Cleaved-caspase-3及Cleaved-caspase-9表達(dá)水平明顯增加(圖1C)。
2.2 MTT檢測(cè)THZ與TRAIL聯(lián)合的協(xié)同指數(shù) THZ聯(lián)合TRAIL能顯著降低細(xì)胞的存活率(圖2),25 μmol/L THZ及50 ng/mL TRAIL聯(lián)合作用于PC9細(xì)胞的CI值為0.623(CI<1)(圖2),表明THZ及TRAIL可協(xié)同抑制PC9細(xì)胞存活率。
2.3 THZ誘導(dǎo)PC9細(xì)胞發(fā)生內(nèi)質(zhì)網(wǎng)應(yīng)激及內(nèi)質(zhì)網(wǎng)應(yīng)激抑制劑4-PBA對(duì)細(xì)胞表面DR5表達(dá)的影響 Western blotting結(jié)果顯示:不同濃度THZ誘導(dǎo)PC9細(xì)胞發(fā)生內(nèi)質(zhì)網(wǎng)應(yīng)激,隨著THZ濃度增加,內(nèi)質(zhì)網(wǎng)應(yīng)激關(guān)鍵蛋白GRP78、CHOP表達(dá)上調(diào)(F=11.45, P=0.001,4; F=12.94, P<0.01),相關(guān)蛋白p-PERK(F=35.61, P<0.01)、p-eIF2α(F=54.26, P<0.01)、ATF4(F=38.04, P<0.01)表達(dá)上調(diào),與對(duì)照組相比,差異有統(tǒng)計(jì)學(xué)意義。流式細(xì)胞術(shù)顯示:25 μmol/L THZ可顯著上調(diào)細(xì)胞表面DR5表達(dá),而4-PBA可抑制THZ對(duì)細(xì)胞表面DR5的上調(diào),差異有統(tǒng)計(jì)學(xué)意義(F=61.19, P<0.01)(圖3)。
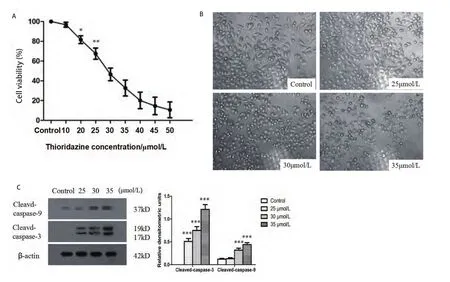
圖1 THZ對(duì)PC9的增殖抑制作用。A:THZ呈:劑量依賴性抑制PC9細(xì)胞增殖。不同濃度THZ(10 μmol/L、20 μmol/L、25 μmol/L、30 μmol/L、35 μmol/L、40 μmol/L、45 μmol/L和50 μmol/L)處理細(xì)胞24 h,MTT檢測(cè)細(xì)胞存活率。B:光鏡觀察THZ對(duì)PC9細(xì)胞形態(tài)影響(×400)。C:不同濃度THZ(25 μmol/L、30 μmol/L、35 μmol/L)處理細(xì)胞24 h后觀察細(xì)胞形態(tài)變化。不同濃度THZ(25 μmol/L、30 μmol/L、35 μmol/L)處理細(xì)胞24 h后,Western blotting檢測(cè)Cleaved-caspase-3及Cleaved-caspase-9表達(dá)情況,*P<0.05, **P<0.01,***P<0.001。Fig 1 The proliferation inhibition effect of THZ on PC9 cells. A: THZ inhibited cell survival of PC9 cells in a dose-dependent manner. Cells were treated with different concentrations of THZ (10 μmol/L, 20 μmol/L, 25 μmol/L, 30 μmol/L, 35 μmol/L, 40 μmol/L, 45 μmol/L and 50 μmol/L) for 24 h, and MTT assays was utilized to measure cell viability. B: Morphologic observation of PC9 cells treated with THZ (×400). C: Cells were treated with different concentrations of THZ (25 μmol/L, 30 μmol/L and 35 μmol/L). After treated with different concentration of THZ (25 μmol/L, 30 μmol/L and 35 μmol/L), expression of Cleaved-caspase-3 and Cleaved-caspase-9 were detected by Western blotting. *P<0.05, **P<0.01,***P<0.001.
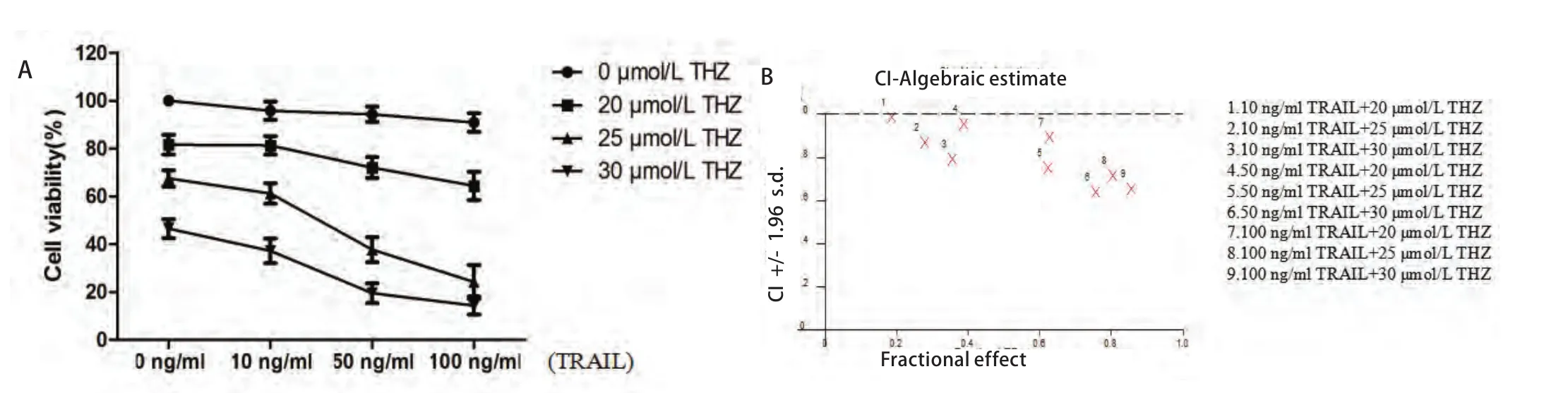
圖2 THZ聯(lián)合TRAIL抑制PC9細(xì)胞增殖 不同濃度THZ(20 μmol/L、25 μmol/L、30 μmol/L)聯(lián)合不同濃度TRAIL(10 ng/mL、50 ng/mL、100 ng/mL)作用于細(xì)胞24 h后,細(xì)胞的存活率(A)及THZ與TRAIL的聯(lián)合指數(shù)(B)。Fig 2 Combination treatment of THZ and TRAIL inhibited cell survival in PC9 cells. Cells were treated with different dose of THZ (20 μmol/L, 25 μmol/L and 30 μmol/L) and different dose of TRAIL (10 ng/mL, 50 ng/mL and 100 ng/mL) for 24 h. Cell viability (A) was measured by MTT assays and combination index (CI) of THZ and TRAIL (B) were calculated.

圖3 THZ誘導(dǎo)PC9細(xì)胞發(fā)生內(nèi)質(zhì)網(wǎng)應(yīng)激。A:THZ誘導(dǎo)細(xì)胞內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)蛋白表達(dá)變化,不同濃度THZ(25 μmol/L、30 μmol/L、35 μmol/L)作用于細(xì)胞24 h后,Western blotting檢測(cè)GRP78、CHOP、p-PERK、p-eIF2α、ATF4表達(dá)水平;B:流式細(xì)胞術(shù)檢測(cè)THZ(25 μmol/L)單獨(dú)或聯(lián)合4-PBA(1 mmol/L)處理PC9細(xì)胞對(duì)細(xì)胞表面DR5表達(dá)的影響。THZ作用于細(xì)胞24 h可上調(diào)細(xì)胞表面DR5表達(dá),而4-PBA聯(lián)合THZ組可顯著抑制細(xì)胞DR5表達(dá)上調(diào)。*P<0.05,**P<0.01, ***P<0.001。Fig 3 ER stress induced by THZ in PC9 cells. A: Expression of ER stress related proteins induced by THZ; B: Cell surface DR5 was detected by flow cytometry of PC9 cells following THZ (25 μmol/L) or combined with 4-PBA (1 mmol/L). After treated with thioridazine 24 h, cell surface DR5 increased significantly in PC9 cells, which can be inhibited by 4-PBA. *P<0.05, **P<0.01, ***P<0.001.
2.4 THZ可增敏TRAIL對(duì)PC9細(xì)胞的殺傷效應(yīng)且4-PBA可抑制此效應(yīng) Western blotting結(jié)果顯示:THZ聯(lián)合TRAIL可顯著增加Cleaved-caspase-8、Cleaved-PARP及DR5表達(dá)水平(圖4A)。流式細(xì)胞術(shù)結(jié)果顯示:THZ聯(lián)合TRAIL組細(xì)胞凋亡率為(32.6±4.7)%,單TRAIL處理組為(3.6±1.3)%,加入了4-PBA的THZ聯(lián)合TRAIL組為(17.3±2.9)%,與對(duì)照組及單獨(dú)TRAIL組相比,THZ聯(lián)合TRAIL組細(xì)胞凋亡率明顯增加,而4-PBA可顯著抑制THZ增敏TRAIL誘導(dǎo)的細(xì)胞凋亡,與THZ聯(lián)合差異有統(tǒng)計(jì)學(xué)意義(F=93.51, P<0.01)(圖4B)。
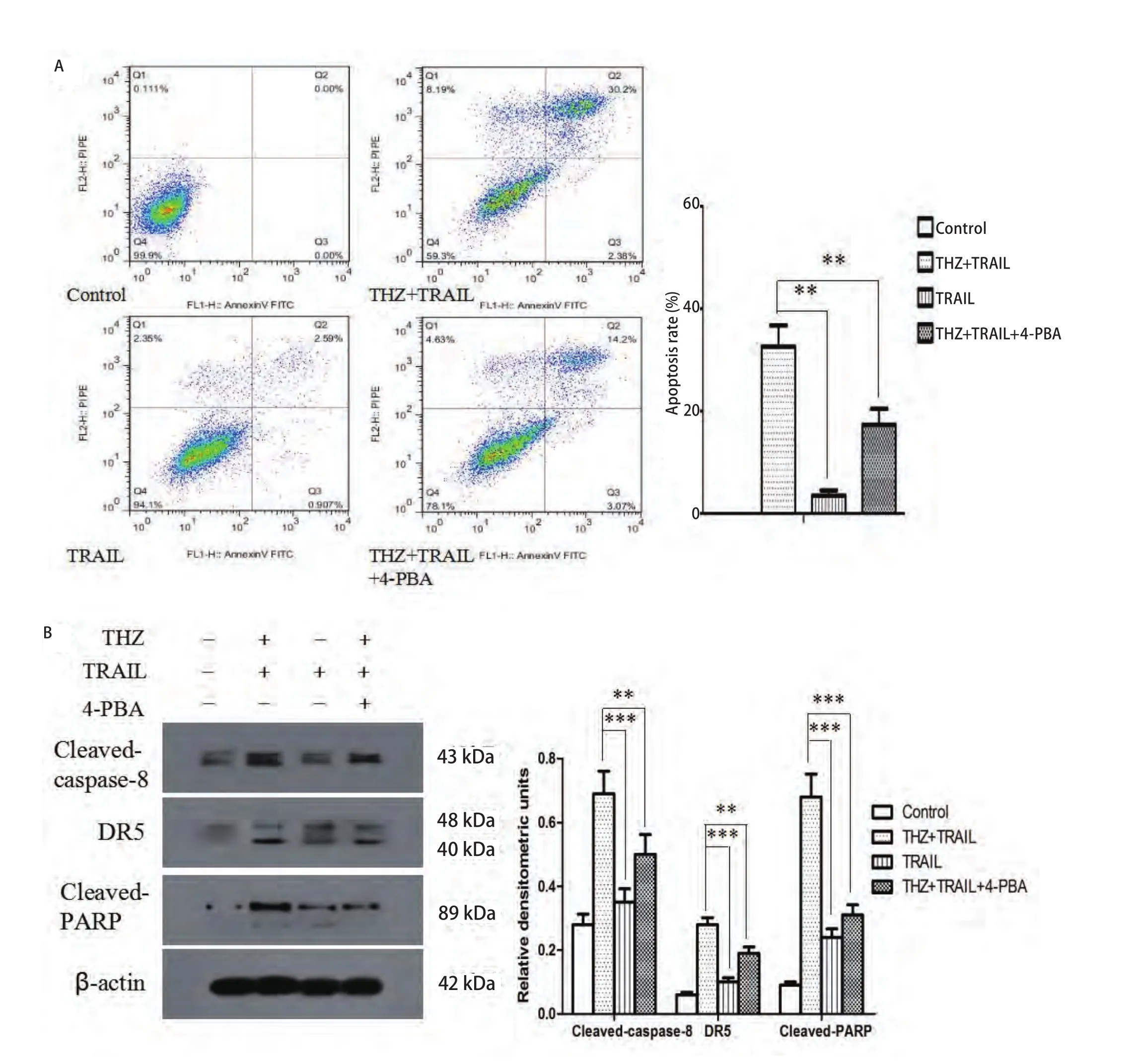
圖4 THZ聯(lián)合TRAIL誘導(dǎo)PC9細(xì)胞凋亡。A:流式細(xì)胞術(shù)檢測(cè)THZ(25 μmol/L)聯(lián)合TRAIL(50 ng/mL)組、TRAIL組、4-PBA(1 mmol/L)及THZ聯(lián)合TRAIL組細(xì)胞凋亡率;B:Western blotting分析各組Cleaved-caspase-8、Cleaved-PARP及DR5表達(dá)水平。**P<0.01, ***P<0.001。Fig 4 Cell apoptosis induced by combination treatment of THZ and TRAIL in PC9 cells. Cells were treated with TRAIL (50 ng/mL) and/or THZ (25 μmol/L) and/or 4-PBA (1 mmol/L) for 24 h. The apoptosis rate (A) and expression of Cleaved-caspase-8, Cleaved-PARP and DR5 (B) of PC9 cells were measured by flow cytometry and Western blotting respectively. **P<0.01, ***P<0.001.
3 討論
自2012年Burgess及Sachlos等發(fā)現(xiàn)THZ可顯著降低人類急性髓細(xì)胞白血病(acute myeloid leukemia, AML)細(xì)胞的增殖與自我更新能力以來[11,12],THZ陸續(xù)被證實(shí)在體內(nèi)外對(duì)多種腫瘤細(xì)胞具有抗增殖活性——包括宮頸癌細(xì)胞、子宮內(nèi)膜癌細(xì)胞[4]、卵巢癌細(xì)胞[5]、乳腺癌細(xì)胞[6]、胃癌細(xì)胞[7]等。本研究組之前證實(shí)15 μmol/L THZ即可顯著誘導(dǎo)食管癌細(xì)胞凋亡及周期阻滯,且可在體內(nèi)外增敏放療的殺傷效應(yīng),其機(jī)制可能與下調(diào)線粒體抗凋亡蛋白Bcl-2、Bcl-xL及抑制PI3K/mTOR通路的激活有關(guān)[8]。THZ可能作為一種抗腫瘤的新藥應(yīng)用于今后的臨床治療。
THZ單獨(dú)處理對(duì)PC9細(xì)胞具有明顯的殺傷效應(yīng),表現(xiàn)為Cleaved-caspase-3、Cleaved-caspase-9表達(dá)水平上升,提示THZ具有顯著的體外抗腫瘤效應(yīng)——這與課題組之前結(jié)果一致[13]。缺血再灌注損傷、氧化應(yīng)激、藥物及放射線處理等因素均可導(dǎo)致內(nèi)質(zhì)網(wǎng)應(yīng)激發(fā)生,由此產(chǎn)生的未(錯(cuò)誤)折疊的蛋白堆積、細(xì)胞蛋白質(zhì)合成減少及內(nèi)質(zhì)網(wǎng)降解功能增強(qiáng)等級(jí)聯(lián)反應(yīng),稱為未折疊蛋白反應(yīng)(unfolded protein response, UPR)[14]。若內(nèi)質(zhì)網(wǎng)應(yīng)激持續(xù)時(shí)相過長(zhǎng)或是強(qiáng)度過高,且應(yīng)激因素?zé)o法消除時(shí),細(xì)胞將因無法及時(shí)去除錯(cuò)誤折疊蛋白而最終啟動(dòng)凋亡途徑[15]。內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)為雙向調(diào)節(jié)反應(yīng),低程度的內(nèi)質(zhì)網(wǎng)應(yīng)激上調(diào)細(xì)胞適應(yīng)能力,保護(hù)細(xì)胞免于凋亡——在腫瘤治療中可表現(xiàn)為腫瘤細(xì)胞對(duì)化療藥物的抵抗性升高,參與化療耐藥的發(fā)生過程。UPR主要由GRP78介導(dǎo),當(dāng)細(xì)胞發(fā)生內(nèi)質(zhì)網(wǎng)應(yīng)激時(shí),感受器IRE1、PERK以及ATF6可與GRP78解離并進(jìn)一步激活各自的信號(hào)通路[16],故GRP78是內(nèi)質(zhì)網(wǎng)應(yīng)激發(fā)生的標(biāo)志性分子。其中,活化的PERK使eIF2α磷酸化,磷酸化的eIF2α能下調(diào)胞內(nèi)蛋白質(zhì)的合成,但能增加ATF4的轉(zhuǎn)錄表達(dá),ATF4表達(dá)能進(jìn)一步誘導(dǎo)CHOP表達(dá),該通路為CHOP表達(dá)所必需的通路[17],而CHOP被認(rèn)為是內(nèi)質(zhì)網(wǎng)應(yīng)激介導(dǎo)的凋亡中的關(guān)鍵分子,GRP78的過表達(dá)將會(huì)抑制CHOP的表達(dá)及凋亡的發(fā)生。研究[18]表明,抑制PERK/eIF2α通路可顯著增強(qiáng)細(xì)胞凋亡作用。本實(shí)驗(yàn)發(fā)現(xiàn),25 μmol/L THZ處理PC9細(xì)胞后GRP78、CHOP表達(dá)水平比對(duì)照組明顯增加,且隨著藥物濃度增加,其表達(dá)水平逐漸增加,提示THZ處理可使PC9細(xì)胞發(fā)生內(nèi)質(zhì)網(wǎng)應(yīng)激,同時(shí)PC9細(xì)胞內(nèi)的p-PERK、p-eIF2α、ATF4表達(dá)水平較對(duì)照組明顯上調(diào),PERK/eIF2α通路被顯著激活。最終上調(diào)CHOP表達(dá),使PC9凋亡過程啟動(dòng)。
TRAIL可表達(dá)于包括活化及靜息B淋巴細(xì)胞、活化的T細(xì)胞、NK細(xì)胞、單核細(xì)胞、巨噬細(xì)胞及樹突狀細(xì)胞在內(nèi)的多種免疫細(xì)胞,是其重要?dú)耘潴w,TRAIL單體蛋白也被證實(shí)可誘導(dǎo)腫瘤細(xì)胞發(fā)生凋亡且,對(duì)正常細(xì)胞(組織)毒性較低。TRAIL與其受體DR4/DR5結(jié)合后可形成死亡誘導(dǎo)信號(hào)復(fù)合體(death inducing signaling complex, DISC),依次激活caspase-8/10、caspase-3啟動(dòng)凋亡發(fā)生——經(jīng)上述途徑凋亡的細(xì)胞稱為I型細(xì)胞。而在某些細(xì)胞中,TRAIL與DR4或DR5結(jié)合后誘導(dǎo)的外源性促凋亡通路尚不足以啟動(dòng)靶細(xì)胞凋亡,尚需線粒體途徑的參與,稱為II型細(xì)胞[19]。腫瘤細(xì)胞可對(duì)TRAIL誘導(dǎo)的凋亡發(fā)生抵抗,其機(jī)制可能與其高表達(dá)誘騙受體(Decoy receptors)繼而競(jìng)爭(zhēng)性抑制DR4和/或DR5有關(guān)。此外,腫瘤細(xì)胞DR4和/或DR5表達(dá)缺失也是TRAIL抵抗發(fā)生的重要因素。耐受TRAIL的腫瘤細(xì)胞在體外能被化療藥物增敏,提示聯(lián)合治療在處理TRAIL抵抗腫瘤細(xì)胞中可能有一定的意義。研究表明,乳腺癌細(xì)胞株發(fā)生TRAIL抵抗與其細(xì)胞膜表面DR4/DR5內(nèi)吞,導(dǎo)致乳腺癌細(xì)胞株表面DR4、DR5缺如關(guān)系密切[20]。槲皮素可通過上調(diào)DR5增敏TRAIL誘導(dǎo)卵巢癌細(xì)胞凋亡[21],TRAIL抵抗腫瘤細(xì)胞中DR5過表達(dá)可重塑TRAIL的敏感性[22]。本實(shí)驗(yàn)流式結(jié)果顯示,50 ng/mL TRAIL與25 μmol/L THZ聯(lián)合處理可顯著降低細(xì)胞存活率,兩藥具有協(xié)同作用,聯(lián)合組細(xì)胞凋亡率明顯增加。其原因可能與THZ顯著增加PC9細(xì)胞表面DR5表達(dá)水平有關(guān)。當(dāng)內(nèi)質(zhì)網(wǎng)應(yīng)激抑制劑4-PBA加入后,THZ誘導(dǎo)的DR5表達(dá)上調(diào)即被終止,繼而降低TRAIL聯(lián)合THZ處理組細(xì)胞的凋亡率。提示THZ協(xié)同增效TRAIL可能是通過激活ER stress而上調(diào)PC9表面DR5表達(dá)引起的。Western blotting結(jié)果也顯示,TRAIL與THZ聯(lián)合組細(xì)胞Cleaved-caspase-8、Cleaved-PARP、DR5表達(dá)水平較對(duì)照組明顯增加,而4-PBA的加入可抑制以上蛋白表達(dá)。
綜上所述,THZ能誘導(dǎo)人肺腺癌PC9細(xì)胞發(fā)生內(nèi)質(zhì)網(wǎng)應(yīng)激,并介導(dǎo)DR5上調(diào),繼而增敏TRAIL對(duì)PC9細(xì)胞的凋亡誘導(dǎo)效應(yīng),因此THZ可能作為一種有潛力的TRAIL增敏劑。本實(shí)驗(yàn)為體外實(shí)驗(yàn),需進(jìn)一步在體內(nèi)驗(yàn)證體外實(shí)驗(yàn)結(jié)果涉及的分子機(jī)制。

