臭氧對葡萄灰霉病的抑制效果
郭宇歡,何 玲*,齊 馨,王宇婷,郭賽賽,楊晨茜
(西北農林科技大學園藝學院,陜西 楊凌 712100)
臭氧對葡萄灰霉病的抑制效果
郭宇歡,何 玲*,齊 馨,王宇婷,郭賽賽,楊晨茜
(西北農林科技大學園藝學院,陜西 楊凌 712100)
研究不同臭氧處理方式對離體及接種在活體葡萄上的灰霉菌的抑制作用,為降低采后葡萄貯藏過程中灰霉病帶來的損失提供理論依據。在(20±1)℃條件下用不同劑量的臭氧(0、30、60、90 μL/L)對離體灰霉菌分別處理不同時間(5、10、15 min),通過測定菌絲生長長度、孢子形成抑制率、孢子細胞膜完整性及掃描電鏡觀察來探究臭氧對其抑制效果。用上述4 種劑量的臭氧分別對接種了灰霉菌的‘紅地球’葡萄處理15 min后(20 ±1) ℃條件下存放5 d。通過測定發病率、病斑直徑及相關酶活性來觀察臭氧對葡萄灰霉病的控制效果。結果表明:在離體實驗中,與對照相比,不同劑量的臭氧對離體灰霉菌處理不同時間后,灰霉菌菌絲的生長均受到了不同程度抑制,隨貯藏時間延長抑制效果逐漸減弱;灰霉菌的產孢子率顯著下降,部分孢子的細胞膜完整性被破壞,臭氧劑量越高、處理時間越長,效果越好。在接種了灰霉菌的活體實驗中,與對照組相比,用60 μL/L和90 μL/L劑量臭氧處理接種灰霉菌的葡萄果實后,灰霉菌在果實上的生長明顯受到抑制;臭氧處理可以使果實丙二醛含量積累減慢,維持較高的抗氧化酶活性。綜合分析,臭氧通過抑制灰霉菌菌絲在葡萄果實上的生長和誘導葡萄果實提高抗性來抵抗灰霉菌的侵染,采用90 μL/L劑量臭氧處理15 min對離體條件下和接種在‘紅地球’葡萄活體上的灰霉菌抑制效果均為最好。
臭氧;‘紅地球’葡萄;灰霉病;貯藏保鮮
葡萄含有豐富的糖、有機酸、蛋白質、礦物質和維生素,具有很高的營養和食療價值。由于葡萄果實多易受病菌浸染而腐爛變質,在貯藏過程中灰霉病發病嚴重,這給鮮食葡萄的貯藏、運輸、銷售等帶來困難,造成了很大的經濟損失[1]。目前,采用二氧化硫熏蒸結合冷藏仍然是降低葡萄貯藏灰霉病的主要方法,但‘紅地球’葡萄對二氧化硫非常敏感,用量稍有不適便會造成傷害,且二氧化硫會在果蔬表面殘留,危害人體健康[2-4]。近年來對葡萄保鮮研究偏向于開發無毒、無害綠色環保的保鮮方式,臭氧是一種高效清潔的殺菌劑,可降解果蔬表面農藥殘留、殺蟲劑[5-6],對果蔬發育、成熟、衰老等代謝過程也有影響[7]。大量研究表明采用臭氧處理可以增強果蔬的采后保鮮效果,如葡萄[8-11]、番木瓜[12]、芒果[13]、圣女果[14]等,但關于臭氧對離體灰霉菌及對葡萄活體接種灰霉菌的抑制效果卻鮮有報道。本實驗旨在探究臭氧處理對離體灰霉菌的抑制作用,對其抑菌機理進行探討,并在葡萄果實上接種驗證,為臭氧處理在葡萄貯藏保鮮中的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
實驗用‘紅地球’葡萄于2015年9月23日采于陜西省周至縣豆家堡村葡萄園中,挑選大小均勻、無機械損傷、無病蟲害果實,采摘當天運回實驗室,存于冷庫備用。病原菌為灰葡萄孢霉,課題組從西北農林科技大學植物保護學院購買,PDA培養基中4℃冰箱保存。
碘化丙啶、磷酸二氫鈉、磷酸氫二鈉、次氯酸鈉、鄰苯二酚、愈創木酚、過氧化氫、檸檬酸、冰醋酸、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三氯乙酸、葡萄糖、瓊脂、硫代巴比妥酸均為國產分析純。
1.2 儀器與設備
XM型臭氧發生器 青島欣美凈化設備有限公司;BX51研究級正置熒光顯微鏡 日本Olympus公司;JSM-6360LV鎢燈絲掃描電子顯微鏡 日本電子株式會社;GT10-1高速臺式離心機 北京時代北利離心機有限公司;MIC-800臭氧濃度檢測儀 深圳市逸云天電子有限公司;SX-500高壓蒸汽滅菌鍋 日本TOMY公司;TU-1901紫外-可見分光光度計 北京普析通用儀器公司;LR250恒溫生化培養箱 上海軋艮儀器設備有限公司;SW-CJ-2FD型雙人單面凈化工作臺 蘇州蘇凈有限公司;MPC-5V300型冰箱 安徽中科都菱公司。
1.3 方法
1.3.1 孢子懸浮液制備
采用Lachhab等[15]的方法,將課題組保存的灰霉菌在PDA培養基上23 ℃培養7 d后,用含0.05% 吐溫-80的無菌水沖洗平板洗下孢子,采用托馬計數池計數,調整孢子懸浮液的孢子濃度為1×106個/mL。
1.3.2 樣品處理
離體實驗:取20 μL菌懸液滴在PDA培養基中心,室溫條件下放置4 h后放入消毒特制密閉箱中(80 cm×55 cm×50 cm),在室溫(20±1)℃空氣濕度為85%的條件下通入臭氧氣體,使箱內的臭氧劑量分別達到30、60、90 μL/L時分別處理5、10、15 min,然后在23 ℃培養箱中培養,以不做任何處理作為對照處理,每天測定一組數據。以5 個培養皿為一個處理,每個處理設置3 個重復,整個實驗重復2 次。
活體接種實驗:果實用2%次氯酸鈉浸泡2 min,無菌水漂洗3 次,晾干后剪下15 粒葡萄果實(保留果梗),無菌接種針在葡萄赤道部刺傷(深度3 mm),滴入10 μL的菌懸液,室溫條件下(20±1)℃放置在上述特制密閉箱中4 h后,分別用30、60、90 μL/L的臭氧處理15 min,以在密閉箱中不通入臭氧為對照處理。每2 d測定一組數據,第8天時測定其發病率、病斑直徑、相關酶活性等指標。每個處理放置15 粒葡萄,設置3 個重復,整個實驗重復2 次。
1.3.3 相關指標測定
1.3.3.1 菌絲生長速率和抑制率的測定
菌絲生長速率測定參照Edwards等[16]的方法。
用十字交叉法統計每天灰霉菌的病斑直徑,用第4天時病斑直徑來計算菌絲生長抑制率。菌絲生長抑制率計算見公式(1)。

1.3.3.2 孢子形成抑制率的測定
參照宋磊[17]的方法。將上述培養5 d后的灰霉菌用直徑為0.6 cm的打孔器在培養皿邊緣補位取3 個菌碟,無菌水洗下孢子并用托馬計數池進行計數,每組處理重復3次,通過公式(2)計算孢子形成抑制率。

1.3.3.3 孢子細胞膜完整性的觀察
采用碘化丙啶染色法[18]。用10 μg/mL的碘化丙啶染液對各處理的孢子懸浮液進行染色,在30 ℃環境中固定10 min,再用磷酸鹽緩沖液漂洗3 次,在熒光顯微鏡下觀察拍照,取3 個視野,統計暗場下顯示紅色的孢子數及明場下觀察到的孢子總數計算平均值,按照公式(3)計算孢子細胞膜完整性的破壞率。

1.3.3.4 灰霉菌菌絲掃描電子顯微鏡觀察
基于臭氧對灰霉菌孢子的完整性觀察,為了進一步研究臭氧對灰霉菌菌絲形態的影響,對灰霉菌菌絲進行掃描電子顯微鏡觀察。用90 μL/L臭氧對灰霉菌處理15 min后,在23 ℃條件下培養7 d形成菌落,取灰霉菌菌絲,參照郭素枝[19]的方法進行制樣并觀察拍照,以不做臭氧處理為對照,整個實驗重復2 次。
1.3.3.5 發病率及病斑直徑測定
每2 d統計病斑直徑及發病率,病斑直徑采用十字交叉法,取平均值;病斑直徑若大于0.5 mm則確定為發病。發病率計算見公式(4)。
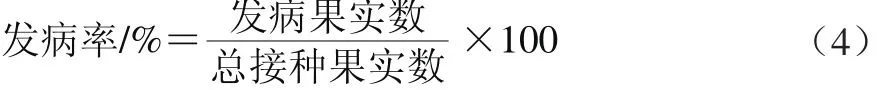
1.3.3.6 過氧化物酶、多酚氧化酶活力和丙二醛含量的測定
過氧化物酶(peroxidase,POD)活力測定:采用愈創木酚法[20];多酚氧化酶(polyphenol oxidase,PPO)活力測定:采用鄰苯二酚比色法[21];丙二醛(malondialdehyde,MDA)含量測定:采用三氯乙酸和硫代巴比妥酸法[22]。
1.4 統計方法
實驗數據采用OriginPro 9.0軟件整理并進行方差分析,用Duncan s作差異顯著性檢驗(P<0.05)。
2 結果與分析
2.1 不同臭氧處理對灰霉菌菌絲生長的抑制
從表1可以看出,在前2 d,與對照處理相比,不同劑量臭氧處理顯著抑制灰霉菌菌絲生長,抑制效果隨著處理時間和劑量的增加而提高。從第3天開始,臭氧處理組之間的差異不顯著(P0.05),但臭氧處理與對照處理之間差異顯著(P<0.05),表明隨時間的延長臭氧處理對灰霉菌菌絲生長的抑制效果會逐漸降低。
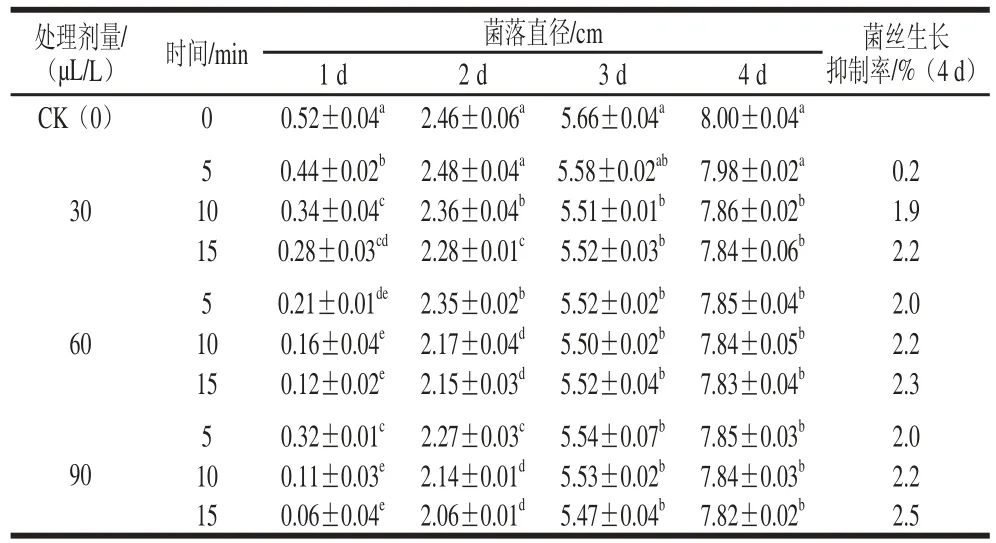
表 1 臭氧處理對灰霉菌菌絲生長的抑制Table 1 Inhibitory effect of ozone on the mycelial growth of Botrytis cinerea
2.2 臭氧處理對灰霉菌孢子形成的抑制作用
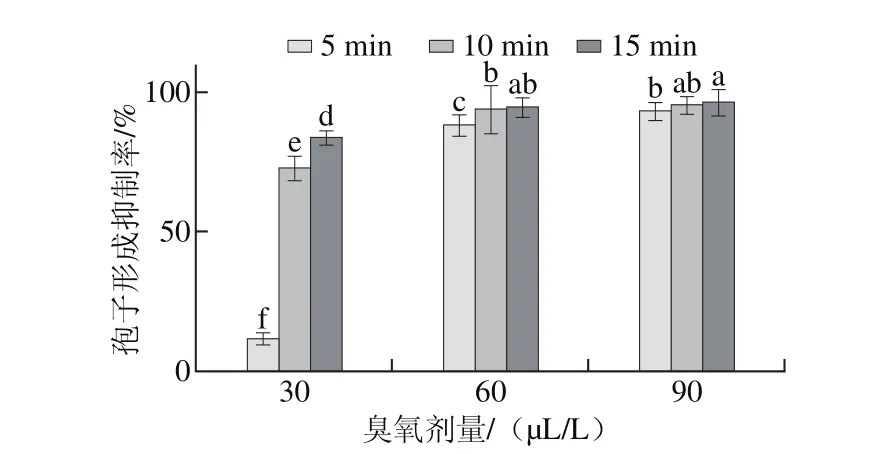
圖 1 臭氧處理對灰霉菌孢子形成的抑制作用Fig. 1 Inhibitory effect of ozone on the formation of Botrytis cinerea spores
如圖1所示,臭氧處理可以抑制灰霉菌孢子的形成,且劑量越高效果越好。當處理時間為5 min時,30、60 μL/L和90μL/L臭氧處理的孢子形成抑制率分別為11.6%、88.3%、93.5%,各處理之間差異顯著(P<0.05);處理10 min和15 min時,60 μL/L和90μL/L處理組抑制率均顯著高于30 μL/L處理組(P<0.05),但二者之間無顯著性差異(P>0.05)。
2.3 臭氧處理對灰霉菌孢子細胞膜完整性的影響


圖 2 臭氧處理對灰霉菌孢子細胞膜完整性的影響Fig. 2 Plasma membrane integrity of Botrytis cinerea after different ozone treatments
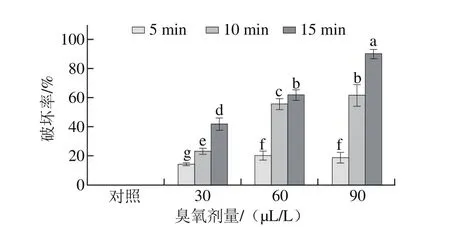
圖 3 不同臭氧處理后灰霉孢子細胞膜完整性的破壞率Fig. 3 Loss rate of the plasma membrane integrity of Botrytis cinerea after ozone treatment
碘化丙啶是一種膜透性熒光染料,它不能穿過完整的活細胞膜,但可以進入細胞膜被破壞的細胞與其DNA結合,而碘化丙啶的最大激發波長為488 nm和630 nm,使細胞膜被破壞的孢子在熒光顯微鏡的紫外光下顯紅色。如圖2所示,隨著臭氧處理劑量增加和處理時間延長,暗場下紅色孢子數量隨之增多。由圖3可知,隨著臭氧劑量增加和處理時間延長,臭氧對灰霉菌孢子細胞膜完整性的破壞率不斷上升,臭氧劑量為90 μL/L處理15 min時,90%的灰霉菌的孢子被殺死,與對照處理及其他處理組差異顯著(P<0.05)。說明臭氧處理會破壞灰霉孢子的細胞膜完整性,且臭氧劑量越高處理時間越長效果越好。
2.4 臭氧處理對灰霉菌菌絲形態的影響

圖 4 臭氧對灰霉菌菌絲處理后掃描電子顯微鏡觀察Fig. 4 Scanning electron microscope observation of Botrytis cinerea mycelia after ozone treatment
如圖4A1、B1所示,與對照組相比,經過臭氧處理后,灰霉菌菌絲密度有明顯的下降;如圖4A2、B2所示,與對照組相比,臭氧處理使灰霉菌菌絲表面出現溝壑。說明臭氧處理對灰霉菌菌絲造成損傷。
2.5 臭氧處理對接種灰霉菌的葡萄發病率及病斑直徑的影響
由圖5A可知,接種灰霉菌后第2天,60 μL/L和90 μL/L臭氧處理發病率顯著低于對照處理(P<0.05),30 μL/L處理與對照差異不顯著(P>0.05);從第4天開始,各臭氧處理發病率均顯著低于對照處理(P<0.05),其中90 μL/L臭氧處理的效果最好,30 μL/L與60 μL/L臭氧處理差異不顯著(P>0.05)。
如圖5B所示,接種灰霉菌后第2天,60 μL/L和90 μL/L臭氧處理病斑直徑顯著小于對照處理(P<0.05),30 μL/L臭氧處理與對照處理相比差異不顯著(P>0.05)。90 μL/L臭氧處理效果最好,在第8天時病斑直徑僅為9.31 mm,顯著低于其他處理(P<0.05)。說明將灰霉菌接種至葡萄果實后,臭氧處理降低了灰霉病發病率和病斑直徑。
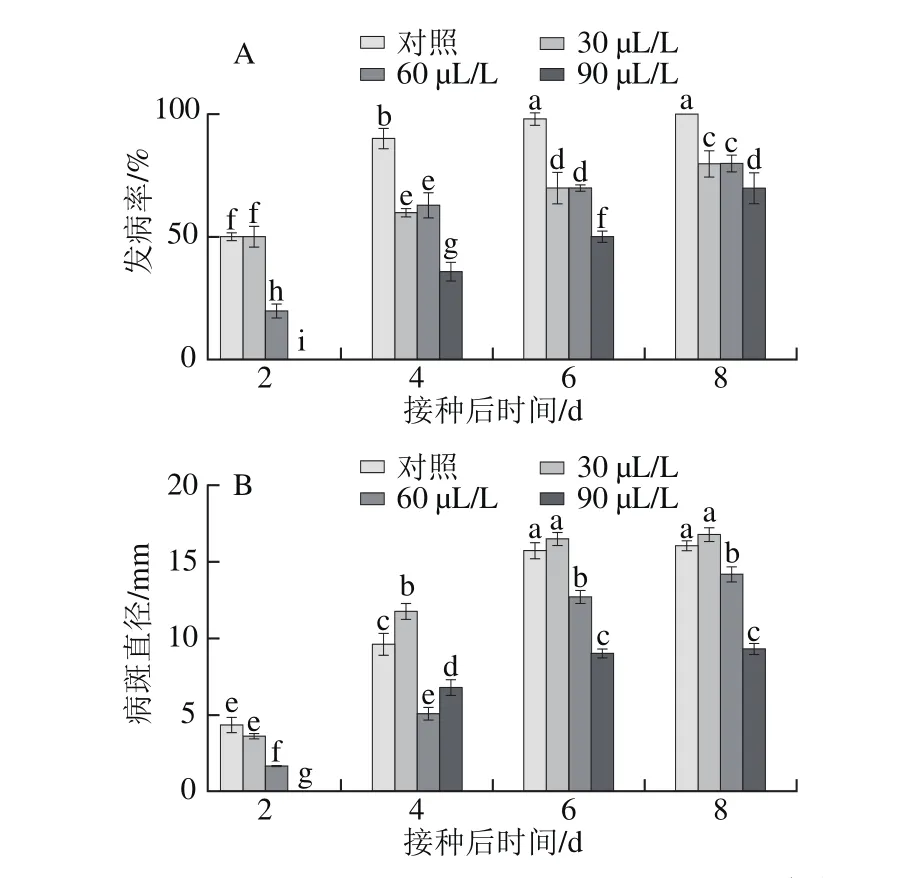
圖 5 不同臭氧處理對‘紅地球’葡萄灰霉病發病率(A)和病斑直徑(B)的影響Fig. 5 Effect of different ozone treatments on gray mold incidence (A) and lesion size (B) in Red Globe grapes
2.6 臭氧處理對接種灰霉菌的葡萄中MDA含量的影響
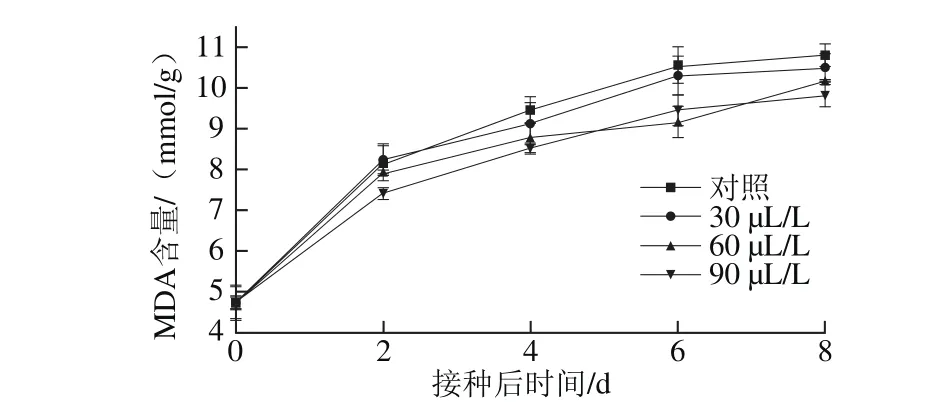
圖 6 不同臭氧處理對‘紅地球’葡萄果實MDA含量的影響Fig. 6 Effect of different ozone treatments on MDA content in Red Globe grapes
如圖6所示,將灰霉菌接種至葡萄果實后,果實內MDA含量不斷上升,這是由于果實受到損傷所致。臭氧處理的MDA含量均低于對照處理,其中第8天90 μL/L臭氧處理MDA含量僅為9.8 mmol/g,顯著低于其他處理組(P<0.05),說明臭氧處理可以降低果實內MDA的積累。
2.7 臭氧處理對接種灰霉菌的葡萄中PPO和POD活性的影響
由圖7A可知,PPO活力呈現出先升高后降低的趨勢,90 μL/L臭氧處理在第4天達到峰值0.68 U/g,顯著高于其他處理(P<0.05),而其他處理均在第6天達到峰值。到第8天時,臭氧處理PPO活力顯著高于對照處理。
由圖7B可知,對照處理與臭氧處理的POD活力先升高后降低,峰值均出現在第4天,60 μL/L和90 μL/L臭氧處理的POD活力在整個過程中顯著高于30 μL/L臭氧處理與對照處理(P<0.05)。90 μL/L臭氧處理的POD活力在第6天時達到了0.446 U/g,顯著高于其他處理(P<0.05)。
以上結果表明,臭氧處理可以使葡萄果實維持較高的PPO和POD活性,有利于果實抵抗灰霉菌的侵染。
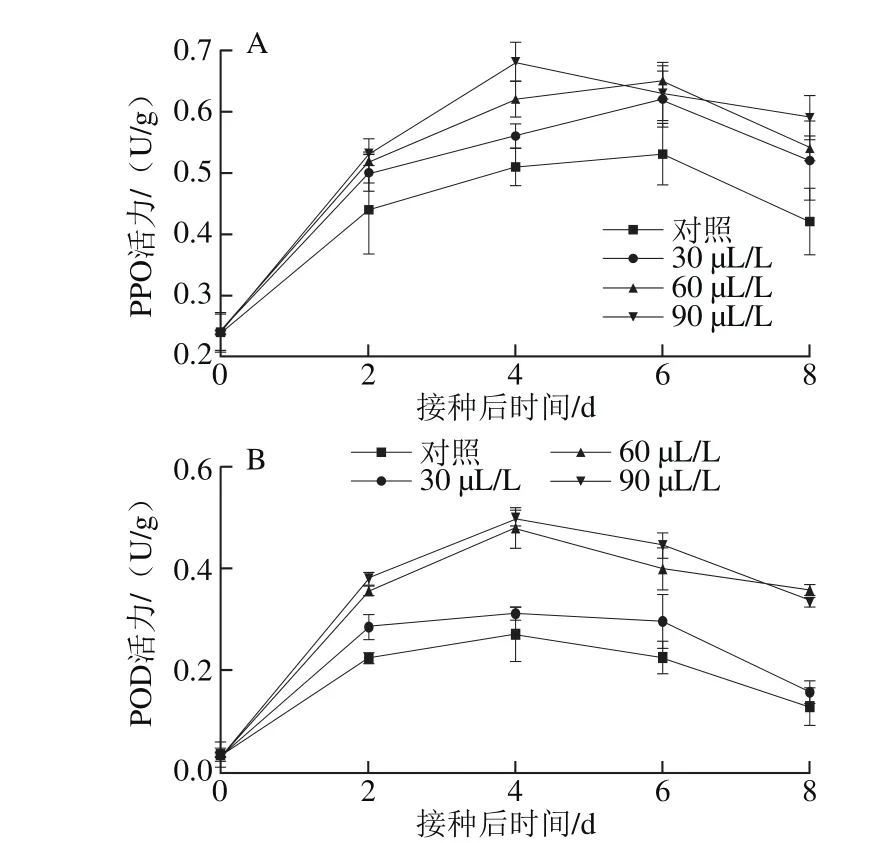
圖 7 不同臭氧處理對‘紅地球’葡萄果實PPO(A)和POD(B)活性的影響Fig. 7 Effect of different ozone treatments on PPO (A) and POD (B) activities in Red Globe grapes
3 討 論
研究不同劑量、不同時間的臭氧處理對離體灰霉菌的抑制效果。結果表明,在臭氧處理后第1天,灰霉菌菌絲的生長均受到了明顯的抑制,臭氧劑量越高,處理時間越長效果越好,可能是由于臭氧處理降低了菌體生長環境中的氧氣含量。碘化丙啶是一種雙鏈DNA染料,其不能透過完整的細胞膜,但可以通過完整性被破壞的細胞膜并以嵌入的方式與雙鏈DNA結合后產生熒光[23]。從碘化丙啶染色的結果可以看出,隨著臭氧劑量增加和處理時間延長,失去細胞膜完整性的孢子數量在不斷上升,而細胞膜完整性的破壞會使細胞內容物外滲誘導細胞死亡[24-25],使灰霉菌萌發的菌絲數量減少且菌絲的生長受到抑制。從第2天開始,各臭氧處理對灰霉菌菌絲生長的抑制效果逐漸降低,可能是臭氧通過在常溫下分解為氧氣后,促進了灰霉菌菌絲的生長。與對照相比,臭氧處理灰霉菌孢子產量顯著下降,90 μL/L臭氧處理灰霉菌菌絲密度降低,是因為臭氧破壞了部分灰霉菌孢子細胞膜完整性。與王倩[26]用一氧化氮處理灰霉菌的結果相似。
在離體實驗中發現臭氧處理15 min對灰霉菌的孢子細胞膜完整性的破壞率最高,因此在活體接種實驗中,處理的時間設定為15 min。結果表明,經不同劑量臭氧處理后,灰霉菌孢子的萌發受到抑制,接種灰霉菌的葡萄果實發病率有所降低。
臭氧處理可以誘導植物分泌植保素如白藜蘆醇等來抵抗外界真菌的侵染[27]。植物組織中的MDA是膜脂過氧化的產物,細胞受到損傷時會積累MDA。經過臭氧處理的果實中MDA含量均低于對照處理,說明臭氧處理可以降低MDA的積累從而增加果實的抗性。PPO可以氧化為酚醛類物質,同時產生對入侵真菌有很強毒性的有色化合物,如奎寧[28]。POD參與氧化自由基的消除反應,在調控細胞內自由基水平的過程中起到重要作用[29-30]。這兩種酶都是植物防御體系中重要的抗氧化酶類。經過臭氧處理的葡萄,PPO和POD活力均高于對照處理,表明臭氧處理可以在一定程度上誘導果實內PPO和POD活力的升高,有利于葡萄在長期貯藏過程中抵抗灰霉菌的侵染。其中效果最好的是90 μL/L臭氧處理,與楊娟俠[31]用二氧化氯對甜櫻桃保鮮的結果相似。在第8天時,灰霉菌在果實上的生長仍受抑制,而離體實驗中,第4天臭氧對灰霉菌的抑制率最高僅為2.5%,可能是臭氧對灰霉菌菌絲生長的抑制作用與果實自身的防御機制協同作用所致,且臭氧處理主要是通過誘導果實產生抗性來抵抗灰霉菌的侵染。間隔進行臭氧處理是否可以提高抑制效果還有待進一步的研究。
4 結 論
臭氧處理能夠抑制離體灰霉菌菌絲的生長,抑制效果逐漸降低。臭氧處理可以破壞部分灰霉菌孢子的細胞膜完整性,抑制孢子的形成并對灰霉菌菌絲造成損傷。對離體灰霉菌效果最好的處理是用90 μL/L臭氧處理15 min。
臭氧處理降低了接種了灰霉菌的葡萄的發病率和病斑直徑,降低了果實MDA含量的積累,維持了較高的PPO和POD活性,提高了葡萄在貯藏過程中抵抗灰霉菌侵染的能力,效果最好的處理是90 μL/L臭氧處理15 min。
[1] 劉亞平. 采前噴布殼聚糖處理和采后適度失水處理對紅地球葡萄保鮮效應研究[D]. 楊凌: 西北農林科技大學, 2012: 1-2.
[2] 安紅梅, 關文強, 劉興華. 紅地球葡萄貯藏效果預測因子初探[J]. 中國農學通報, 2007, 23(9): 176-180. DOI:10.3969/ j.issn.1000-6850.2007.09.040.
[3] 趙飛, 張平, 朱志強, 等. SO2氣態熏蒸結合固態緩釋保鮮劑處理對紅地球葡萄貯藏品質的影響[J]. 食品與發酵工業, 2013, 39(12): 182-186.
[4] 高海燕, 劉鄰渭. 葡萄采后貯運SO2傷害的研究進展[J]. 食品與發酵工業, 2005, 31(5): 153-157. DOI:10.3321/j.issn:0253-990X.2005.05.038.
[5] ONG K C, CASH J N, ZABIK M J, et al. Chlorine and ozone washes for pesticide removed from apples and processed apple sauce[J]. Food Chemistry, 1996, 5(2): 153-160. DOI:10.1016/0308-8146(95)00097-6.
[6] 王秋芳, 喬勇進, 陳召亮, 等. 臭氧處理對巨峰葡萄品質與生理生化的影響[J]. 果樹學報, 2010(1): 63-68.
[7] 黎繼烈, 彭湘蓮, 鐘海雁, 等. 臭氧保鮮處理對金橘采后生理的影響[J]. 中國食品學報, 2007, 7(3): 112-115. DOI:10.3969/ j.issn.1009-7848.2007.03.020.
[8] 武杰, 朱飛. 臭氧處理對不同成熟度葡萄保鮮效果[J]. 食品工業科技, 2012, 33(17): 359-362.
[9] PALOU L, CRISOSTO C H, SMILANICK J L, et al. Effects of continuous 0.3 ppm ozone exposure on decay development and physiological responses of peaches and table grapes in cold storage[J]. Postharvest Biology and Technology, 2002, 24: 39-48. DOI:10.1016/ S0925-5214(01)00118-1.
[10] LAUREANO J, GIACOSA S, SEGADE S R, et al. Effects of continuous exposure to ozone gas and electrolyzed water on the skin hardness of table and wine grape varieties[J]. Journal of Texture Studies, 2016, 47(1): 40-48. DOI:10.1111/jtxs.12158.
[11] MARTíNEZ-LüSCHER J, SáNCHEZ-DíAZ M, DELROT S, et al. Ultraviolet-B alleviates the uncoupling effect of elevated CO2and increased temperature on grape berry (Vitis vinifera cv. Tempranillo) anthocyanin and sugar accumulation[J]. Australian Journal of Grape and Wine Research, 2016, 22(1): 87-95. DOI:10.1111/ajgw.12213.
[12] ONG M K, ALI A. Antifungal action of ozone against Colletotrichum gloeosporioides and control of papaya anthracnose[J]. Postharvest Biology and Technology, 2015, 100: 113-119. DOI:10.1016/ j.postharvbio.2014.09.023.
[13] 滕建文, 曾文謹, 霍峰巖, 等. 芒果的臭氧保鮮研究[J]. 食品科技, 2008, 29(8): 233-235. DOI:10.3969/j.issn.1005-9989.2008.08.069.
[14] 田華, 韓慢慢, 陳樂玲. 圣女果保鮮技術研究進展[J]. 食品工業科技, 2016, 37(7): 396-400. DOI:10.13386/j.issn1002-0306.2016.07.068.
[15] LACHHAB N, SANZANI S M, BAHOUAOUI M A, et al. Effect of some protein hydrolysates against gray mould of table and wine grapes[J]. European Journal of Plant Pathology, 2016, 144: 821-830. DOI 10.1007/s10658-015-0749-x.
[16] EDWARDS S G, SEDDON B. Mode of antagonism of Brevibacillus brevis against Botrytis cinerea in vitro[J]. Journal of Applied Microbiology, 2001, 9: 652-659. DOI:10.1046/j.1365-2672.2001.01430.x.
[17] 宋磊. BIT對灰霉菌的抑制作用及機理[D]. 西安: 西北大學, 2010: 24-25.
[18] ZHANG Z Q, QIN G Z, LI B Q, et al. Effect of cinnamic acid for controlling gray mold on table grape and its possible mechanisms of action[J]. Current Microbiology, 2015, 71: 396-402. DOI:10.1007/ s00284-015-0863-1.
[19] 郭素枝. 掃描電鏡技術及其應用[M]. 廈門: 廈門大學出版社, 2006: 74-96.
[20] 陳建勛, 王曉峰. 植物生理學實驗[M]. 廣州: 華南理工大學出版社, 2006: 74.
[21] 孫群, 胡景江. 植物生理學研究技術[M]. 楊凌: 西北農林科技大學出版社, 2006: 172-174.
[22] 曹健康, 姜微波, 趙玉梅. 果蔬采后生理生化實驗指導[M]. 北京: 中國輕工業出版社, 2007: 154-156.
[23] 胡夢裳, 張云艷, 萬建美, 等. 不同濃度的碘化丙啶染色對細胞周期分布的影響[J]. 激光雜志, 2015, 36(1): 144-147. DOI:10.14016/ j.cnki.jgzz.2015.01.144.
[24] MANN C L, CIDLOWSKI J A. Glucocorticoids regulate plasma membrane potential during rat thymocyte apoptosis in vivo and in vitro[J]. Endocrinology, 2001, 142: 421-429.
[25] QIN G Z, ZONG Y Y, CHEN Q L, et al. Inhibitory effect of boron against Botrytis cinerea on table grapes and its possible mechanisms of action[J]. International Journal of Food Microbiology 2010, 138: 145-150.
[26] 王倩. 一氧化氮對采后病原真菌Botrytis cinerea的生長發育影響及機制研究[D]. 合肥: 安徽農業大學, 2013: 18-22.
[27] SARIG, P, ZAHAVI T, ZUTKHI Y, et al. Ozone for control of postharvest decay of table grapes caused by Rhizopus stolonifer[J]. Physiological and Molecular Plant Pathology, 1996, 48: 403-415.
[28] CAMPOS-VARGAS R, SALTVEIT M E. Involvement of putative chemical wound signals in the induction of phenolic metabolism in wounded lettuce[J]. Plant Physiology, 2002, 114: 73-84. DOI:10.1034/ j.1399-3054.2002.1140111.x.
[29] NYOCHEMBENG L M, BEYL C A, PACUMBABA R P. Peroxidase activity, Isozyme patterns and electrolyte leakage in roots of cocoyam infected with Pythium myriotylum[J]. Journal of Phytopathology, 2007, 155: 454-461. DOI:10.1111/j.1439-0434.2007.01257.x.
[30] LACAN D, BACCOU J. High levels of antioxidant enzymes correlate with delayed senescence in nonnetted muskmelon fruits[J]. Planta, 1998, 204: 377-382. DOI:10.1007/s004250050269.
[31] 楊娟俠. 二氧化氯對甜櫻桃 紅燈 和 布魯克斯 貯藏保鮮效果研究[D].泰安: 山東農業大學, 2011: 25-26.
Effect of Ozone on Controlling Gray Mold in Grapes
GUO Yuhuan, HE Ling*, QI Xin, WANG Yuting, GUO Saisai, YANG Chenxi
(College of Horticulture, Northwest A & F University, Yangling 712100, China)
The aim of this study is to provide theoretical support for reducing the loss of grapes caused by Botrytis cinerea during storage. Botrytis cinerea was exposed to ozone at different concentrations (0, 30, 60 and 90 μL/L) for different times (5, 10 and 15 min), and then stored at (20 ± 1) ℃. The mycelial diameter, the formation of Botrytis cinerea spores and plasma membrane integrity were analyzed to explore the inhibitory effect of ozone on Botrytis cinerea. In a second experiment, postharvest Red Globe grapes were inoculated with Botrytis cinerea and exposed to four different concentrations of ozone for 15 min, and then stored at (20 ± 1) ℃ for 5 days. The incidence, lesion size and related enzymes activities were measured to evaluate the inhibitory effect of ozone on controlling gray mold in postharvest grapes. The results indicated that compared with the control group, the growth of Botrytis cinerea was inhibited by ozone but the effect decreased gradually over storage time. Ozone could concentration-dependently and time-dependently damage the integrity of the plasma membrane of Botrytis cinerea and reduce conidia germination. On the other hand, the growth of Botrytis cinerea in grapes was strongly inhibited by ozone at concentrations of 60 and 90 μL/L. Meanwhile, ozone could inhibit the accumulation of malondialdehyde (MDA) content and help maintain higher levels of antioxidant enzyme activities. Taken together, this study suggested that ozone was effective against gray mold in postharvest Red Globe grapes by inhibiting the growth of the pathogen and inducing host resistance and the best effect was observed at a concentration of 90 μL/L and 15 min treatment.
ozone; Red Globe grapes; gray mold; storage and preservation
10.7506/spkx1002-6630-201717044
S663.4
A
1002-6630(2017)17-0273-06
郭宇歡, 何玲, 齊馨, 等. 臭氧對葡萄灰霉病的抑制效果[J]. 食品科學, 2017, 38(17): 273-278. DOI:10.7506/spkx1002-6630-201717044. http://www.spkx.net.cn
GUO Yuhuan, HE Ling, QI Xin, et al. Effect of ozone on controlling gray mold in grapes[J]. Food Science, 2017, 38(17): 273-278. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717044. http://www.spkx.net.cn
2016-07-04
楊凌示范區科技計劃項目(2014NY-44)
郭宇歡(1991—),男,碩士研究生,研究方向為園藝產品采后生理與貯藏保鮮。E-mail:mmmdddpo@sohu.com *通信作者:何玲(1965—),女,副教授,博士,研究方向為果蔬加工及園藝產品采后貯藏保鮮。E-mail:heliurui@nwsuaf.edu.cn

