嘉陵江流域不同土地利用類型土壤微生物功能多樣性特征
楊秉珣, 劉 泉, 董廷旭
(綿陽師范學院 資源環境工程學院, 四川 綿陽621000)
嘉陵江流域不同土地利用類型土壤微生物功能多樣性特征
楊秉珣, 劉 泉, 董廷旭
(綿陽師范學院 資源環境工程學院, 四川 綿陽621000)
基于2013—2015年對嘉陵江流域中游(四川段)不同土地利用類型(混交林、草甸、針葉林、闊葉林、灌叢和裸地)土壤生境的調查分析數據,利用Biolog微平板法和磷脂脂肪酸甲酯法(FAMEs)系統研究了土壤微生物多樣性群落特征。不同土地利用類型土壤養分和有效養分基本表現為混交林>闊葉林>針葉林>灌叢>草甸>裸地。不同土地利用類型土壤微生物群落代謝平均顏色變化率(AWCD)隨培養時間延長而逐漸增加,土壤微生物群落代謝活性依次是混交林>闊葉林>針葉林>灌叢>草甸>裸地。土壤微生物對不同種類碳源的利用強度存在較大差異,碳水化合物和羧酸類碳源是不同土地利用類型土壤微生物的主要碳源,其次為氨基酸類、酚酸類和聚合物類,胺類碳源的利用率最小。土壤微生物群落的物種豐富度指數(H)、均勻度指數(E)、優勢度指數(Ds)和碳源利用豐富度指數(S)總體趨勢為混交林最高,針葉林和闊葉林次之,裸地最低,優勢度指數在不同土地利用類型差異并不顯著(p>0.05)。主成分分析結果表明,從31個因素中提取的與碳源利用相關的主成分1,主成分2分別能解釋變量方差的65.154%和81.047%,在主成分分離中起主要貢獻作用的是胺類和氨基酸類碳源;土壤微生物多樣性指數與土壤養分之間呈正相關,與pH值呈負相關,而土壤全碳和全氮含量對土壤微生物多樣性貢獻較大,這是造成土壤微生物群落功能多樣性差異的主要原因。H,E和S與土壤養分各指標的相關系數絕對值均高于Ds,說明了土壤養分對土壤微生物群落優勢度指數的影響作用較小。
嘉陵江流域; 土地利用; 土壤微生物; 土壤養分
土壤是生態系統中的重要組成部分,作為一種重要的自然資源維持著陸地生態系統健康,在生態系統的物質循環和能量流動方面起著重要作用[1-2];土壤養分在養分的分解和轉化過程中起著主導作用,影響著土壤生態系統中能量流動和物質循環,并且能夠反映出土壤質量及健康狀況等[3-5];土壤微生物參與土壤有機質分解、腐殖質形成、土壤養分轉化和循環等過程,是土壤生物化學特征的重要組成部分,在評價土壤肥力、環境監測、土地利用等方面有廣泛的作用[6-9]。近年來,碳素利用法通常用Biolog微平板來實現,其理論依據是Biolog代謝多樣性類型的變化與群落組成。Biolog對功能微生物群落變化較為敏感的指標,廣泛應用于評價土壤微生物群落的功能多樣性,也可以用于估價土壤微生物群落代謝多樣性和功能多樣性的研究[10-12]。
四川嘉陵江流域地貌類型復雜多變,是我國土地利用類型多樣化的重要區域,長期以來受到自然和高強度人類活動的影響,山洪暴發、泥石流災害以及水質污染等問題日益突出,尤其是嚴重的水土流失使其生態系統相當脆弱[13-14]。自1998年長江特大洪水災害以來,該流域的生態環境逐漸引起人們重視。土地利用是人類活動和自然作用相結合的過程,隨著該流域人口增長和經濟的發展,嘉陵江流域人口與土地矛盾越顯突出,土地墾殖系數居高不下。不同土地利用類型可以改變土壤的物理、化學和生物學特性及土壤的環境狀況[15-16]。合理的土地利用方式可以改善土壤結構,增強土壤對外界環境變化的抵抗力,而不合理的土地利用方式則會導致土壤質量下降,加速侵蝕,導致土壤退化[15-16]。當前了解微生物功能多樣性信息對于我們明確不同環境中微生物群落的作用具有重要的意義,可以為控制和優化微生物群落結構,強化微生物群落代謝功能提供理論指導。現階段的研究比較重視用分子生物學方法分析微生物群落的功能多樣性。但是,分子生物學方法要求的勞動強度大、耗時長、技術含量較高,難以在較短的時間內分析較多的樣品。而以Biolog-ECO微孔板碳源利用為基礎的定量分析技術為描述微生物群落功能多樣性提供了一種更為簡便、快速的方法,并已被廣泛應用于比較和評價不同類型的土壤微生物群落結構[9-10]。鑒于此,本文以四川嘉陵江中下游流域為研究對象,連續3 a的數據分析不同土地利用類型土壤養分和土壤微生物多樣性差異,對該區域不同土地利用類型的管理提供科學理論依據,為該流域的綜合治理和生態環境的監測評估提供科學依據。
1 材料與方法
1.1 研究區概況
嘉陵江(102°35′36″—109°01′08″E,29°17′30″—34°28′11″N)是長江水系中流域面積最大的支流,發源于秦嶺南麓,向西南流經陜西、甘肅、四川、重慶4省,于重慶市匯入長江,全長1 120 km,流域面積1.598×105km2,屬亞熱帶季風氣候,年均降水1.494×1011m3,水土流失較為嚴重,侵蝕面積占到52.14%,是長江各大支流中水土流失較嚴重的區域,整個流域由嘉陵江干流、渠江和涪江3大水系構成。嘉陵江流域的地貌類型復雜多樣,地層以中生界侏羅系紅色巖層分布最廣。土壤類型主要有黃壤土、紫色土、水稻土、沖積土、潮土和紅壤等。流域大部分地區屬亞熱帶濕潤季風氣候,四季分明,雨水充沛,年內降水主要集中在5—10月,其中7—9月降水量可占全年的50%以上,上游年降水量600~800 mm,中下游約1 000 mm,多年平均徑流量約7×1010m3。由于復雜的地貌類型、充沛的降水和易侵蝕的土壤等自然環境及強烈的農業生產活動,嘉陵江中下游地區則是長江流域的重點土壤侵蝕地區和環境保護區域。
1.2 試驗設計
根據嘉陵江流域特點和植被劃分原則,采用《中國植被圖集》的劃分標準,將整個流域內的植被景觀劃分為針葉林、混交林、闊葉林、灌叢、草甸、裸地6類,布設6×3=18個樣地(面積由植被類型決定)。數據為2013年和2015年的9月中旬連續3 a的平均值(定點采樣),根據其植被劃分,每個植被類型選取3個樣地,每個樣地布設5個樣方,為了保證取樣的一致性,所取樣的土壤坡度均小于5°,同時保證其海拔和生境基本一致,對于草本和裸地,每個樣地面積50 m×50 m,每個樣地按“S”曲線設置5個1 m×1 m樣方。采用四分法在每個樣方內取樣(保留1 kg左右),采用五點取樣法,取樣深度為0—20 cm混合土樣(除去表層的枯落物層),充分混勻后用無菌塑料袋4℃保溫箱保存,并迅速帶回實驗室內分析測定,所取土樣分為2份,一份新鮮土樣過40目篩后測定土壤酶活性,一份自然風干(20 d)去除碎片和部分根后過80目篩后測定土壤養分。
1.3 土壤養分測定
一部分土壤樣品經自然風干20 d后,去除植物根系等雜物過2 mm篩。土壤pH值采用電極電位法(2.5∶1水土比浸提液);全碳和全氮含量采用元素分析儀;速效磷采用NaHCO3浸提—鉬銻抗比色法;堿解氮采用NaOH—H3BO3法;有效鉀和全鉀采用乙酸銨浸提—火焰光度計法[17]。
1.4 土壤微生物群落功能多樣性
土壤微生物群落功能多樣性可以用Shannon多樣性指數、McIntosh指數和Simpson指數來表征。在計算Simpson指數時,將數據擴大1 000倍,以防止出現負數。采用Biolog-Eco 溫育72 h 的數據進行多樣性分析。在無菌條件下,稱取相當于烘干質量10 g的土壤,加入90 ml無菌0.145 mol/L的NaCl溶液,搖床震蕩30 min,樣品稀釋1 000倍,用BIOLOG排槍取100 μl 接種于ECO板上,初次讀數后,于25℃恒溫培養,每隔12 h于波長590 nm的BIOLOG儀器上讀數,共培養216 h。然后用0.85%NaCl無菌溶液稀釋至10~3倍接種于Biolog-Eco微孔板中,在(25±1)℃暗箱培養。在溫育過程中,每隔24 h用酶標儀在590 nm下讀取吸光值。
Biolog-Eco微平板中31種單一碳源的反應程度,即土壤微生物對單一碳源的利用能力,采用平均每孔顏色變化率(Average well color development,AWCD)來描述。AWCD值較大表示土壤微生物具有較高的碳源利用能力和微生物豐度,AWCD的計算公式為[18-19]:
AWCD=∑[(Ci-R)/31]
式中:Ci為第i孔的吸光值;R為對照孔的吸光值。對(Ci-R)<0的孔,計算中記為0,即(Ci-R)≥0。
土壤微生物群落功能多樣性分析采用Shannon-Wiener指數、Simpson指數、豐富度指數和McIntosh指數表征[18-19]。
AWCD=∑(Ci-Ri)/n
式中:Ci為每個有培養基孔的吸光值;Ri為對照孔的吸光值;n為培養基孔數,Biolog-Eco板n值為31。
H=-∑Pi(lnPi)
式中:Pi為第i孔的相對吸光值與所有整個微平板的相對吸光值總和的比值,計算公式:
Pi=(Ci-Ri)/∑(Ci-Ri)
S=被利用碳源的總數(吸光值≥0.25所有微孔的總和)
Ds=1-∑Pi
主成分分析采用培養96 h后的光密度值,提取兩個主因子進而分析不同土地利用類型土壤利用碳源的結構。利用Excel 2003和SPSS 13.00軟件對數據進行分析,單因素方差進行分析(One-way ANOVA),顯著性分析采用LSD法。
2 結果與分析
2.1 不同土地利用類型土壤養分特征
由圖1可知,嘉陵江流域不同土地利用類型土壤養分具有明顯差異,不同土地利用類型土壤全碳依次表現為:混交林>闊葉林>針葉林>灌叢>草甸>裸地,混交林和闊葉林差異并不顯著(p>0.05),顯著高于其他植被類型(p<0.05),而裸地則顯著低于其他植被類型(p<0.05);全氮依次表現為:混交林>闊葉林>針葉林>草甸>灌叢>裸地,混交林顯著高于其他植被類型(p<0.05),針葉林、闊葉林、灌叢和草甸之間差異并不顯著(p>0.05),而裸地則顯著低于其他植被類型(p<0.05);全鉀依次表現為:混交林>闊葉林>針葉林>灌叢>草甸>裸地,混交林顯著高于其他植被類型(p<0.05),針葉林和闊葉林之間差異并不顯著(p>0.05),而裸地則顯著低于其他植被類型(p<0.05);堿解氮依次表現為:混交林>闊葉林>針葉林>灌叢>草甸>裸地,混交林、針葉林和闊葉林顯著高于其他植被類型(p<0.05),而裸地則顯著低于其他植被類型(p<0.05);速效磷依次表現為:闊葉林>混交林>針葉林>灌叢>草甸>裸地,混交林和闊葉林之間差異不顯著(p>0.05),顯著高于其他植被類型(p<0.05),而裸地則顯著低于其他植被類型(p<0.05);有效鉀依次表現為:混交林>闊葉林>針葉林>灌叢>草甸>裸地,混交林和闊葉林顯著高于其他植被類型(p<0.05),針葉林、灌叢和草甸之間差異不顯著(p>0.05),而裸地則顯著低于其他植被類型(p<0.05)。
2.2 不同土地利用類型土壤微生物群落代謝平均顏色變化率
不同土地利用類型土壤開始培養后每隔24 h測定AWCD值,得到AWCD隨時間的動態變化圖(圖2),由圖可知,隨著培養時間的延長,不同土地利用類型土壤微生物碳源利用總體上呈逐漸增加的趨勢,培養起始的24 h內AWCD變化不明顯,針葉林、混交林和闊葉林土壤微生物碳源利用在培養24~72 h內AWCD快速增長,此時微生物活性旺盛,72 h后增長緩慢,192 h后急劇增長;灌叢和草甸土壤微生物碳源利用在培養72 h后急劇增長,并且增長幅度逐漸變大;在培養48 h以前,不同土地利用類型土壤微生物碳源利用基本相一致,在48 h以后,相同時間針葉林、混交林和闊葉林土壤微生物碳源利用顯著高于灌叢、草甸和裸地,而灌叢和草甸土壤微生物碳源利用基本相似;相同時間土壤微生物碳源利用大致表現為針葉林>闊葉林>混交林>灌叢>草甸>裸地,局部有所波動。
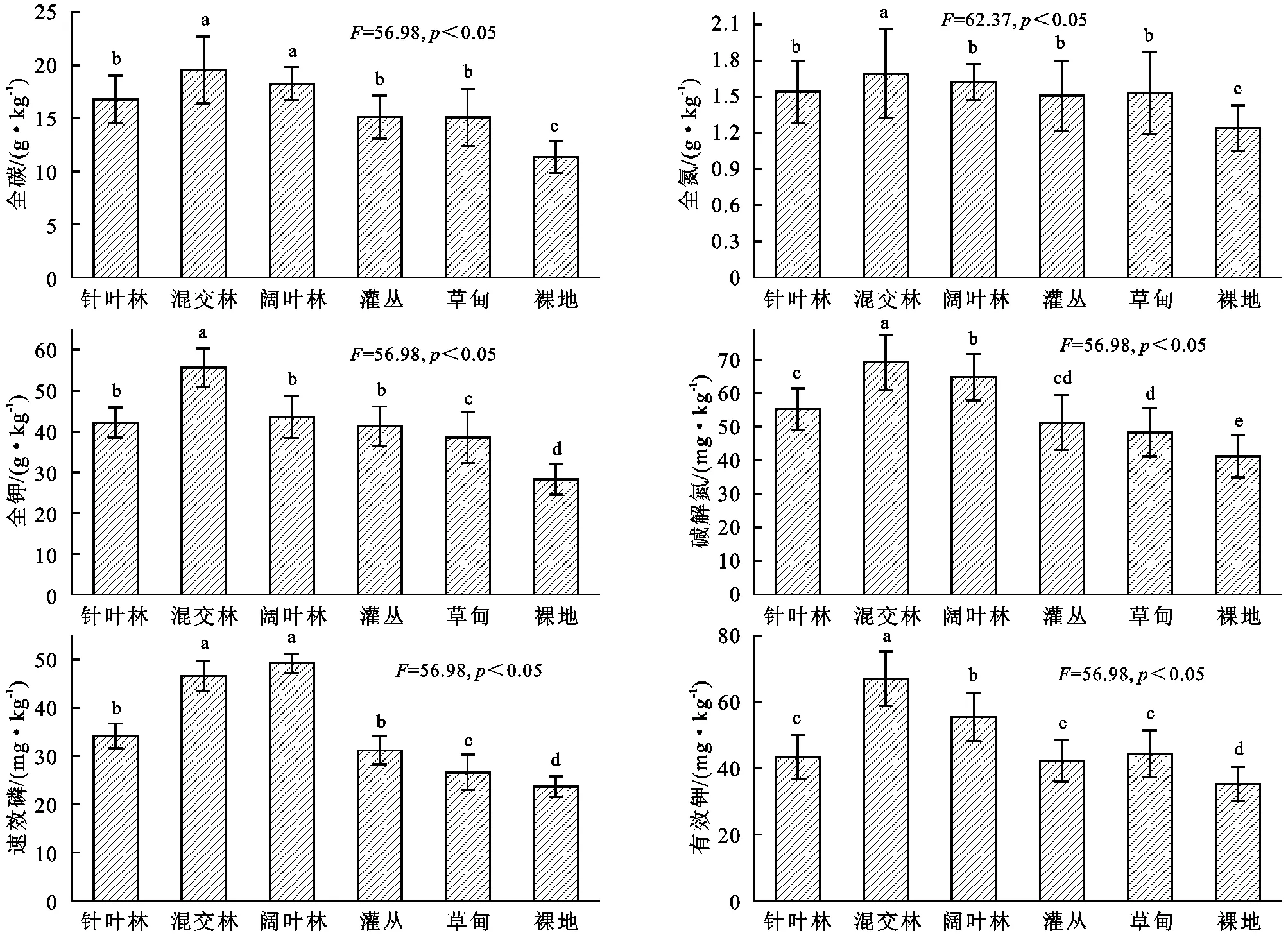
圖1土地利用類型土壤養分特征

圖2不同土地利用類型土壤微生物群落代謝平均顏色變化率
2.3 不同土地利用類型土壤微生物對碳源利用強度
根據不同土地利用類型土壤微生物碳源利用情況,綜合考慮其變化趨勢,選取光密度增加較快的120 h的AWCD值進行土壤微生物群落代謝多樣性的分析,按化學基團的性質將ECO板上的31種碳源分成6類:氨基酸類、碳水化合物類、羧酸類、聚合物、胺類、酚酸類,6類碳源均呈現出隨著培養時間的延長,微生物利用碳源的量逐漸增加的趨勢。將每類碳源的AWCD取平均值,其結果見表2。由表2可知,土壤微生物對不同種類碳源的利用強度存在較大差異。不同土地利用類型土壤微生物對6種不同碳源的利用率表現大致相同,即混交林>闊葉林>針葉林>灌叢>草甸>裸地,混交林利用率最高,裸地利用率最低。不同土地利用類型對氨基酸類利用率變化范圍為0.32~0.72,對碳水化合物類利用率變化范圍為0.53~1.36,對羧酸類利用率變化范圍為0.43~1.39,對聚合物類利用率變化范圍為0.38~0.69,對胺類利用率變化范圍為0.08~0.27,對碳水化合物類利用率變化范圍為0.38~0.86。總體而言,碳水化合物和羧酸類碳源是不同土地利用類型土壤微生物的主要碳源,其次為氨基酸類、酚酸類和聚合物類,胺類碳源的利用率最小。

表1 不同土地利用類型土壤微生物對碳源利用強度
注:同列不同小寫字母表示差異顯著(p<0.05)。
2.4 不同土地利用類型土壤微生物群落多樣性
微生物群落多樣性指數可用來指示土壤微生物群落利用碳源的程度,根據培養第96 h的AWCD值計算土壤微生物群落的物種豐富度指數(H)、均勻度指數(E)、優勢度指數(Ds)和碳源利用豐富度指數(S)。結果表明,不同土地利用類型土壤微生物群落功能多樣性指數存在一定差異,不同土地利用類型土壤微生物物種豐富度指數(H)變化范圍為1.62~3.25,依次表現為混交林>闊葉林>針葉林>灌叢>草甸>裸地,闊葉林和針葉林差異不顯著(p>0.05),顯著高于灌叢、草甸和裸地(p<0.05);均勻度指數(E)變化范圍為0.43~0.89,依次表現為混交林>闊葉林>針葉林>灌叢>草甸>裸地,其中混交林、闊葉林和針葉林差異不顯著(p>0.05),顯著高于灌叢、草甸和裸地(p<0.05);優勢度指數(Ds)變化范圍為0.76~0.86,其中不同土地利用類型土壤微生物優勢度指數(Ds)差異均不顯著(p>0.05);碳源利用豐富度指數(S)變化范圍為5.6~26.7,依次表現為針葉林>混交林>闊葉林>灌叢>草甸>裸地,其中針葉林和混交林差異不顯著(p>0.05),其他補貼土地利用類型碳源利用豐富度指數差異均顯著(p<0.05)。
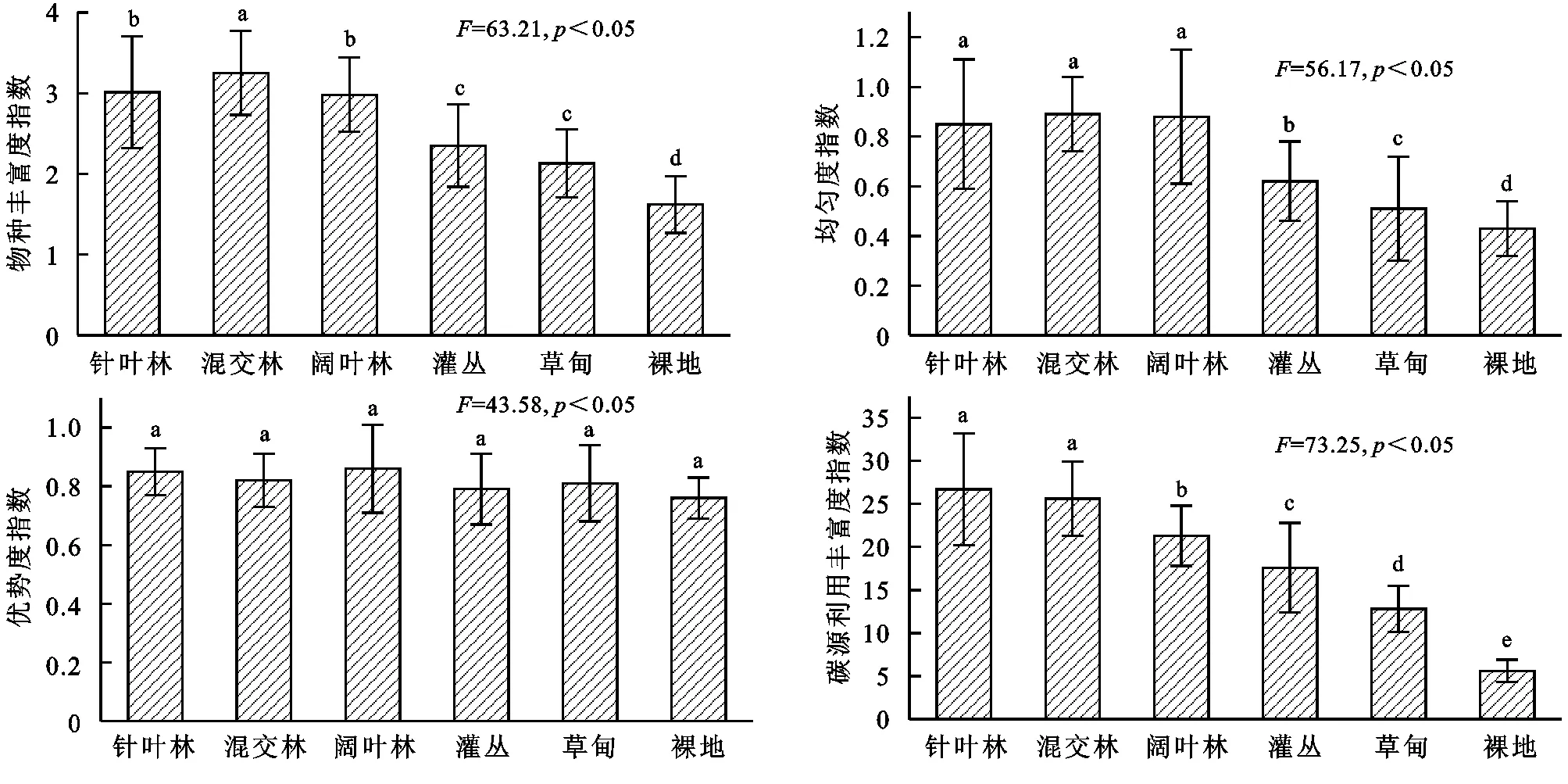
圖3不同土地利用類型土壤微生物群落多樣性
2.5 不同土地利用類型土壤微生物群落碳源利用類型的主成分分析
為了進一步了解不同土地利用類型根區土壤微生物群落功能的差異,對31種碳源的利用情況進行主成分(PC)分析(PCA),采用培養第120 h時間點的數據,提取出4個主成分,主成分1,主成分2分別能解釋變量方差的65.154%和81.047%,前3個主成分累積貢獻率達到93.841%,因此第一主成分、第二主成分和第三主成分為本文所要解釋的主成分。主成分分析結果顯示:31個碳源在3個主成分上的載荷值(表2),初始載荷因子反映主成分與碳源利用的相關系數,載荷因子越高表示碳源對主成分的影響越大。由表3可知與第一主成分具有較高相關性的碳源有23種,其中,羧酸類化合物有5種,多聚化合物有3種,碳水化合物有7種,芳香化合物1種,氨基酸3種,胺類化合物2種;第二主成分利用碳水化合物4種,氨基酸1種,共5種碳源;與第三主成分具有較高相關性的碳源僅有2種,碳水化合物1種,氨基酸1種;在主成分分離中起主要貢獻作用的是胺類和氨基酸類碳源。
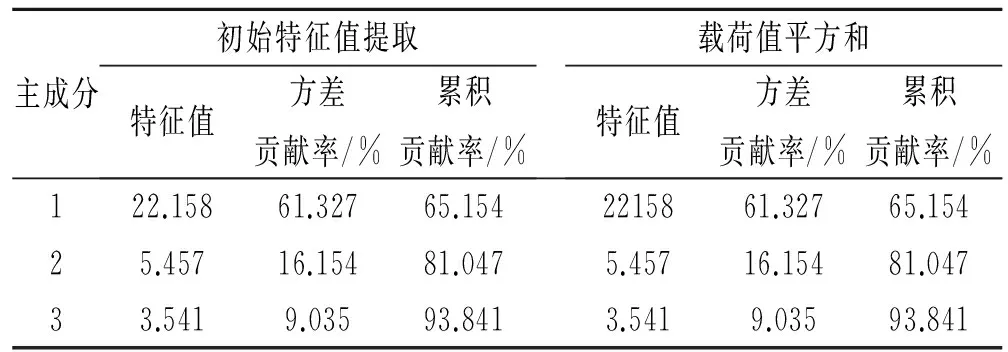
表2 方差分解主成分提取分析
2.6 土壤養分與微生物多樣性之間相關性
土壤養分為土壤微生物的重要碳源和氮源,為探討土壤養分與土壤微生物群落多樣性之間的關系,進行土壤養分與微生物群落多樣性相關性分析(表4)。結果表明,土壤微生物群落功能多樣性各指標與土壤pH值之間存在負相關關系,與土壤養分等均呈正相關關系,其中,土壤微生物群落功能多樣性各指標均與土壤有效養分呈極顯著正相關(p<0.01);物種豐富度指數(H)、均勻度指數(E)和碳源利用豐富度指數(S)與土壤養分各指標的相關系數絕對值均高于優勢度指數(Ds),說明土壤養分對土壤微生物群落優勢度指數的影響作用較小。

表3 31種碳源的主成分載荷因子

表4 土壤養分與微生物多樣性之間相關性
注:*,**分別表示在0.05,0.01水平上差異顯著。
3 討論與結論
平均顏色變化率(AWCD)是反映土壤微生物活性,即利用單一碳源能力的一個重要指標,在一定程度上反映了土壤中微生物種群的數量和結構特征[18]。AWCD值越大,表明細菌密度越大、活性越高;反之,細菌密度越小、活性越低。分析不同土地利用類型土壤微生物群落的代謝活性發現,不同土地利用類型土壤微生物活性呈現一致的變化趨勢,在整個培養過程中,裸地、草甸和灌叢土壤微生物對Biolog-ECO板中碳源的代謝能力明顯低于混交林、闊葉林和針葉林,分析其可能的原因是:喬木林土壤中存在著與Biolog-ECO板中碳源物質高度協調的微生物(其養分含量較高),植物殘體和根系分泌物數量都很多,導致進入土壤的新鮮有機物質顯著增加,這大大刺激了土壤微生物的生長和繁殖,進而代謝活性顯著提高[20-21]。因此,在微生物生長的溫度范圍內,隨著溫度升高,生長速度加快,代謝活性增強。與草甸和灌叢相比,喬木是自然植被條件下長期自然選擇的結果,形成了較和諧、平衡的微生態環境,而且人為干擾少,植被種類豐富,每年產生大量凋落物,豐富了微生物所需的營養物質來源,因而其土壤微生物活性明顯高于灌叢、草甸和裸地。由此可見,地上部植被歸還土壤有機物的多寡可能是土壤微生物群落代謝活性的影響因素之一,其土壤微生物群落代謝活性較低,碳源利用能力相對較弱[20-21]。本研究中土壤微生物對不同種類碳源的利用強度存在較大差異,混交林土壤微生物群落對6類碳源的利用率最高,灌木居中,裸地最低,不同土地利用類型土壤微生物對6類碳源的優先利用順序雖存在差異,而土壤養分與土壤微生物多樣性的變化趨勢相一致。總體而言,碳水化合物和羧酸類碳源是不同土地利用類型土壤微生物的主要碳源,其次為氨基酸類、酚酸類和聚合物類,胺類碳源的利用率最小。
根據培養第96 h時的AWCD值計算土壤微生物群落的Simpson指數、Shannon-Wiener指數、豐富度指數和McIntosh指數。Shannon-Wiener指數反映了微生物群落物種變化度和差異度,較高的Shannon-Wiener指數代表微生物種類多且分布均勻,該值混交林最高,表明混交林植物的土壤微生物群落種類最多且較均勻,并且不同土地利用類型土壤微生物群落功能多樣性指數存在一定的差異。
碳源利用類型的主成分分析結果表明:不同土地利用類型土壤微生物群落代謝功能多樣性有顯著差異,受影響最大的碳源主要是羧酸類和聚合物類,而這些碳源與根系分泌物關系密切,說明羧酸類和聚合物類的根系分泌物對微生物群落功能有較大影響。而根系分泌物起到了直接或間接的作用,這些物質對微生物和植株具有自毒作用而導致其積累[22-23]。土壤養分為土壤微生物的重要碳源和氮源,為探討土壤養分與土壤微生物群落多樣性之間的關系,進行了土壤養分與微生物群落多樣性相關性分析(表4)。結果表明,土壤微生物群落功能多樣性各指標與土壤pH值之間存在負相關關系,與土壤養分等均呈正相關關系,其中,土壤微生物群落功能多樣性各指標均與土壤有效養分呈極顯著正相關(p<0.01);物種豐富度指數(H)、均勻度指數(E)和碳源利用豐富度指數(S)與土壤養分各指標的相關系數絕對值均高于優勢度指數(Ds),說明了土壤養分對土壤微生物群落優勢度指數的影響作用較小。由此可知,土壤養分和土壤pH值與微生物群落功能多樣性密切相關,其中土壤pH值對土壤微生物群落功能多樣性貢獻為負,土壤養分對土壤微生物群落功能多樣性貢獻為正,這是造成不同土地利用類型土壤微生物群落多樣性差異的重要原因,其中有機質和全氮是土壤微生物的主要養分來源。綜上所述,土壤本底因子、植物種類組成和覆蓋度均影響土壤微生物活性和群落功能多樣性,深入研究這些因素對土壤健康、生物肥力培育及土壤可持續利用具有重要的理論和實踐意義。
[1] Westerdahl B. Biological Control of Plant-Parasitic Nematodes: Soil ecosystem management in sustainable agriculture, second edition[J]. Soil Science Society of America Journal, 2015,79(3):972.
[2] Soil ecology and ecosystem services[M]. Oxford: Oxford University Press, 2012.
[3] DeLuca T H, Gundale M J, MacKenzie M D, et al. Biochar effects on soil nutrient transformations[J]. Biochar for Environmental Management: Science, Technology And Implementation, 2015,2:421-454.
[4] Prendergast-Miller M T, Duvall M, Sohi S P. Biochar-root interactions are mediated by biochar nutrient content and impacts on soil nutrient availability[J]. European Journal of Soil Science, 2014,65(1):173-185.
[5] Mukai M, Aiba S, Kitayama K. Soil-nutrient availability and the nutrient-use efficiencies of forests along an altitudinal gradient on Yakushima Island, Japan[J]. Ecological Research, 2016,31(5):719-730.
[6] Berthrong S T, Buckley D H, Drinkwater L E. Agricultural management and labile carbon additions affect soil microbial community structure and interact with carbon and nitrogen cycling[J]. Microbial Ecology, 2013,66(1):158-170.
[7] Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences, 2012,109(52):21390-21395.
[8] Lauber C L, Ramirez K S, Aanderud Z, et al. Temporal variability in soil microbial communities across land-use types[J]. The ISME Journal, 2013,7(8):1641-1650.
[9] Barberán A, Bates S T, Casamayor E O, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities[J]. The ISME Journal, 2012,6(2):343-351.
[10] Sradnick A, Murugan R, Oltmanns M, et al. Changes in functional diversity of the soil microbial community in a heterogeneous sandy soil after long-term fertilization with cattle manure and mineral fertilizer[J]. Applied Soil Ecology, 2013,63:23-28.
[11] Lange M, Habekost M, Eisenhauer N, et al. Biotic and abiotic properties mediating plant diversity effects on soil microbial communities in an experimental grassland[J]. PLoS One, 2014,9(5):e96182.
[12] Paula F S, Rodrigues J L M, Zhou J, et al. Land use change alters functional gene diversity, composition and abundance in Amazon forest soil microbial communities[J]. Molecular Ecology, 2014,23(12):2988-2999.
[13] 齊師杰,張行南,夏達忠,等.嘉陵江流域土地利用/覆被變化特征及其驅動力分析[J].長江科學院院報,2013,30(1):1-7.
[14] 許炯心,孫季.嘉陵江流域年徑流量的變化及其原因[J].山地學報,2007,25(2):153-159.
[15] 仙巍,邵懷勇,周萬村.嘉陵江中下游地區土地利用格局變化的動態監測與預測[J].水土保持研究,2005,12(2):61-64.
[16] 劉瑞民,楊志峰,丁曉雯,等.土地利用/覆蓋變化對長江上游非點源污染影響研究[J].環境科學,2006,27(12):2407-2414.
[17] 王國梁,劉國彬.黃土丘陵區紙坊溝流域植被恢復的土壤養分效應[J].水土保持通報,2002,22(1):1-5.
[18] Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences, 2012,109(52):21390-21395.
[19] Lauber C L, Ramirez K S, Aanderud Z, et al. Temporal variability in soil microbial communities across land-use types[J]. The ISME Journal, 2013,7(8):1641-1650.
[20] Zak D R, Holmes W E, White D C, et al. Plant diversity, soil microbial communities, and ecosystem function:are there any links[J]. Ecology, 2003,84(8):2042-2050.
[21] Yao H, Jiao X, Wu F. Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity[J]. Plant and Soil, 2006,284(1/2):195-203.
[22] Frey S D, Knorr M, Parrent J L, et al. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J]. Forest Ecology and Management, 2004,196(1):159-171.
[23] Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil, 1995,170(1):75-86.
VariationofSoilNutrientsandMicrobialCommunityDiversityofDifferentLandUseTypesintheJialingRiver,SichuanProvince
YANG Bingxun, LIU Qua, DONG Tingxu
(SchoolofResourcesandEnvironmentalEngineering,MianyangNormalUniversity,Mianyang,Sichuan621000,China)
We present a comprehensive analysis of soil nutrients and soil microbial community diversity of different land use types in Jialing River from 2013 to 2015, based on the soil habitat, the structure and function of soil microbial community were studied by using Biolog plate and phospholipid fatty acid methyl ester (FAMEs), respectively. The results are as follows. The soil nutrients of different land use types decrease in the order: mingled forest>broad-leaved forest>coniferous forest>shrub>meadow>bare land. There were significant differences in functional diversity of microbial communities of different land use types. The average well color development (AWCD), which directly reflects microbial activity and functional diversity, increased and then decreased with the order: mingled forest>broad-leaved forest>coniferous forest>shrub>meadow>bare land. The carbon sources mostly used by soil microbes were carbohydrates and carboxylic acids, followed by amino acids, phenolic acids and polymers, the lowest was amines. The Simpson index, Shannon-Wiener index, richness index and McIntosh index of different land use types showed the sequence: mingled forest>broad-leaved forest>coniferous forest>shrub>meadow>bare land. Principal component analysis identified two factors in relation to carbon sources, they explained 65.154% and 81.047% of the variation, respectively. The carbon sources used by soil microbial communities were different among different land use types. Amino acids and amides were the two main carbon sources separating the two principal component factors. Correlation analysis showed that soil microbial diversity index was significantly or very significantly positively correlated with soil nutrients, and was negatively correlated with pH value, the soil nutrients had the more positive contribution to soil microbial diversity and soil pH value had the negative contribution, which were the reason for variation of soil microbial community diversity of different land use types in Jialing River.
Jialing River; land use types; soil microbial community diversity; soil nutrients
2016-10-01
:2016-10-18
四川省生態重點實驗室開放項目“基于GIS的龍門山北段區域土地利用景觀格局演變及其生態效應評價”
楊秉珣(1975—),男,四川綿陽人,講師,研究方向:文地理與土地利用。E-mail:13990198977@163.com
董廷旭(1968—),男,四川彭州人,博士,教授,碩士生導師,研究方向:土壤學、土地利用與生態環境等。E-mail:Dong_zx@126.com
S154.3;X144
:A
:1005-3409(2017)05-0014-07

