黃顙魚20β-羥基類固醇脫氫酶Ⅰ和Ⅱ基因特征分析和表達模式研究
尹 盼 李英文 王雅琴 劉智皓
(重慶師范大學生命科學學院, 重慶市高校動物生物學重點實驗室, 重慶 401331)
黃顙魚20β-羥基類固醇脫氫酶Ⅰ和Ⅱ基因特征分析和表達模式研究
尹 盼 李英文 王雅琴 劉智皓
(重慶師范大學生命科學學院, 重慶市高校動物生物學重點實驗室, 重慶 401331)
為探討20β-羥基類固醇脫氫酶Ⅰ和Ⅱ(20β-HSDⅠ/Ⅱ)在黃顙魚中的基因特征和表達模式, 研究從黃顙魚中克隆了這2個基因的全長cDNA。對魚類2個20β-HSD的系統進化分析和共線性分析結果發現, 20β-hsd基因的復制可能不是TSGD的結果。序列對比結果表明, 魚類2個20β-HSD可能具有相似的空間結構, 結合相似的輔酶和底物, 但催化產物可能有差異。黃顙魚2個20β-hsd基因均表達于多個組織, 其中20β-hsdⅠ主要表達于精巢、卵巢、頭腎和腎臟中, 而20β-hsdⅡ則高表達于精巢、卵巢、心臟、頭腎、腎臟、腸、垂體和肝臟。季節表達模式的研究發現, 在繁殖季節(5月)的黃顙魚精巢中, 20β-hsdⅠ的表達相對較低, 而20β-hsdⅡ高表達。對黃顙魚雄性成魚注射人絨毛膜促性腺激素(hCG)(1000 IU/kg體重)后, 20β-hsd Ⅰ的表達先顯著升高,隨后迅速顯著下調; 而20β-hsdⅡ的表達則持續顯著上升。上述結果表明, 黃顙魚20β-hsdⅠ和20β-hsdⅡ在hCG處理下表達模式存在較大差異。
黃顙魚; 20β-HSD; 復制基因; cDNA克隆; 表達模式; hCG處理
20β-羥基類固醇脫氫酶(20β-hydroxysteroid dehydrogenase, 20β-HSD)是SDR超家族的一員, 也被稱為3α, 20β-HSD、3α/β, 20β-HSD、羰基還原酶(Carbonyl reductase)和短鏈脫氫酶[1,2]等。20β-HSD能在NADPH的存在下, 參與一大類羰基化合物(如: 外源化合物、內源前列腺素和多種類固醇激素)的降解[3,6]。在對豬的研究中發現, 20β-HSD表達于新生豬的精巢中, 參與類固醇激素水平的調節[7]。雞的20β-HSD與11β-HSD共表達, 能調節糖皮質激素對腸中Na+的吸收[8]。對大鼠的研究發現, 20β-HSD不僅參與類固醇激素的降解, 還對乙酰苯磺酰環己脲(降壓藥)和口服降血糖藥物的降解起重要作用[9]。
在硬骨魚類中, 二羥黃體酮(17α, 20β-dihydroxy-4-pregnen-3-one, DHP)是主要的孕激素, 在魚類卵母細胞的成熟中扮演重要角色; 而20β-HSD則是DHP合成的關鍵酶[4,5]。另外, 20β-HSD還參與魚類的排精[10]。在魚類生殖周期的大多數時期, DHP均維持低水平, 但在排精前, DHP水平則顯著升高[11,15]。研究還發現, 在魚類配子成熟過程中, 促性腺激素能上調20β-hsd的表達[3,5,14,15], 表明20β-HSD受下丘腦/垂體/性腺(HPG)軸的調控。由于輻鰭魚類特有的基因組倍增事件(Teleost Specific Genome Duplication, TSGD)[16], 使其基因組中含有大量的平行進化同源基因, 其中也包括多種類固醇合成酶基因, 如cyp19、cyp17等[17,21]。然而, 在除鮭鱒類[14,22,23]以外的所有脊椎動物的基因組中, 迄今為止均只發現一個20β-hsd (20β-hsd Ⅱ)[8,9,24]。
本研究首次在硬骨魚類中分離到了由2個不同基因編碼的20β-HSD, 并在黃顙魚中克隆了上述復制基因的全長cDNA。為進一步了解20β-hsd復制基因的進化、表達和調控模式, 本研究對魚類2個20β-hsd基因進行了系統發生分析、共線性分析, 并研究了黃顙魚上述基因的組織表達模式、季節表達模式和hCG對其的調控, 為深入研究其功能和表達調控奠定了基礎。
1 材料與方法
1.1 樣本采集與處理
實驗所用黃顙魚雌雄性成魚購自重慶盤溪水產市場。解剖雌雄黃顙魚成魚各組織(T. 精巢、O.卵巢、H. 心臟、S. 脾臟、HK. 頭腎、K. 腎臟、I.腸、P. 垂體、B. 腦、M. 肌肉、L. 肝臟), 迅速放入液氮中速凍, –80℃保存備用。
1.2 總RNA提取和第一鏈cDNA的合成
根據TRIzol (Invitrogen)說明書, 從黃顙魚成魚提取性腺總RNA, 并測定其濃度。取1 μg總RNA,經gDNA Eraser (TaKaRa)去除基因組DNA后, 按PrimeScript RT reagent Kit (TaKaRa)說明書合成第一鏈cDNA。
1.3 引物設計
根據GenBank (http://www.ncbi.nlm.nih.gov)上公布的斑點叉尾(Ictalurus punetaus)和革胡子鯰(Clarias gariepinus)等20β-hsd Ⅰ的cDNA序列, 在其保守區域設計引物(本實驗所用引物見表 1、序列號見表 2)。
1.4 黃顙魚20β-hsdⅠcDNA的克隆
利用已合成的第一鏈cDNA在PCR擴增儀(Bio-Rad ⅠQ5)上擴增中間片段(20β-hsd Ⅰ F/R)。擴增條件為: 94℃ 3min, 35個循環的94℃ 30s, 52℃ 30s, 72℃ 30s, 72℃延伸7min。擴增片段在1% 的瓊脂糖凝膠上電泳, 溴化乙錠(EB)染色后, 在凝膠成像系統上分析。目的片段用膠回收試劑盒(Geneview)純化后亞克隆入pMD19-T載體(TaKaRa), 隨后轉化到大腸桿菌DH5α中, 經藍白斑篩選后, 將陽性克隆送上海英駿公司(Invitrogen)測序。
根據測序驗證后的中間片段序列設計RACE引物(20β-hsd Ⅰ FR/RR), 擴增黃顙魚20β-hsd ⅠcDNA的5′和3′末端, 步驟參照SMARTTMRACE cDNA Amplification kit (Clontech)說明書進行。根據測序得到5′序列和3′序列進行拼接, 并進行Endto-End PCR擴增驗證(20β-hsd Ⅰ F0/R0)。所用引物見表 1。
1.5 黃顙魚20β-HSD Ⅰ序列的同源性分析
根據已獲得的20β-hsd Ⅰ全長cDNA序列, 應用DNAStar和Clustal X軟件推導其氨基酸序列并進行多重序列對比分析。用Mega5.0軟件構建系統進化樹, 進化樹中的數值表示隨機進行1000次計算的重復率, 代表該進化樹的可靠性。分析所用脊椎動物20β-HSD氨基酸序列均從GenBank下載, 序列號見表 2。
1.6 黃顙魚20β-hsd Ⅰ和Ⅱ的組織表達模式
根據TRIzol (Invitrogen)說明書, 用–80℃保存備用的黃顙魚各組織提取總RNA。取1 μg總RNA,用gDNA Eraser (TaKaRa)去除基因組DNA后, 合成第一鏈cDNA。用基因特異性引物(20β-hsdⅠ QF/ QR和20β-hsd Ⅱ QF/QR)研究黃顙魚20β-hsdⅠ和Ⅱ在黃顙魚各組織中的表達模式, 并以β-actin (βactin F/R)(252 bp)作為內參。含質粒和蒸餾水為模板擴增的產物分別作為陽性和陰性對照。擴增條件為: 為94℃ 3min, 25(目的基因)和20(β-actin)個循環的94℃ 30s, 60℃ 30s, 72℃ 30s, 72℃延伸7min。PCR產物在1%的瓊脂糖凝膠上電泳, EB染色后在凝膠成像系統上進行拍照、分析。

表 1 引物序列Tab. 1 The primer sequences
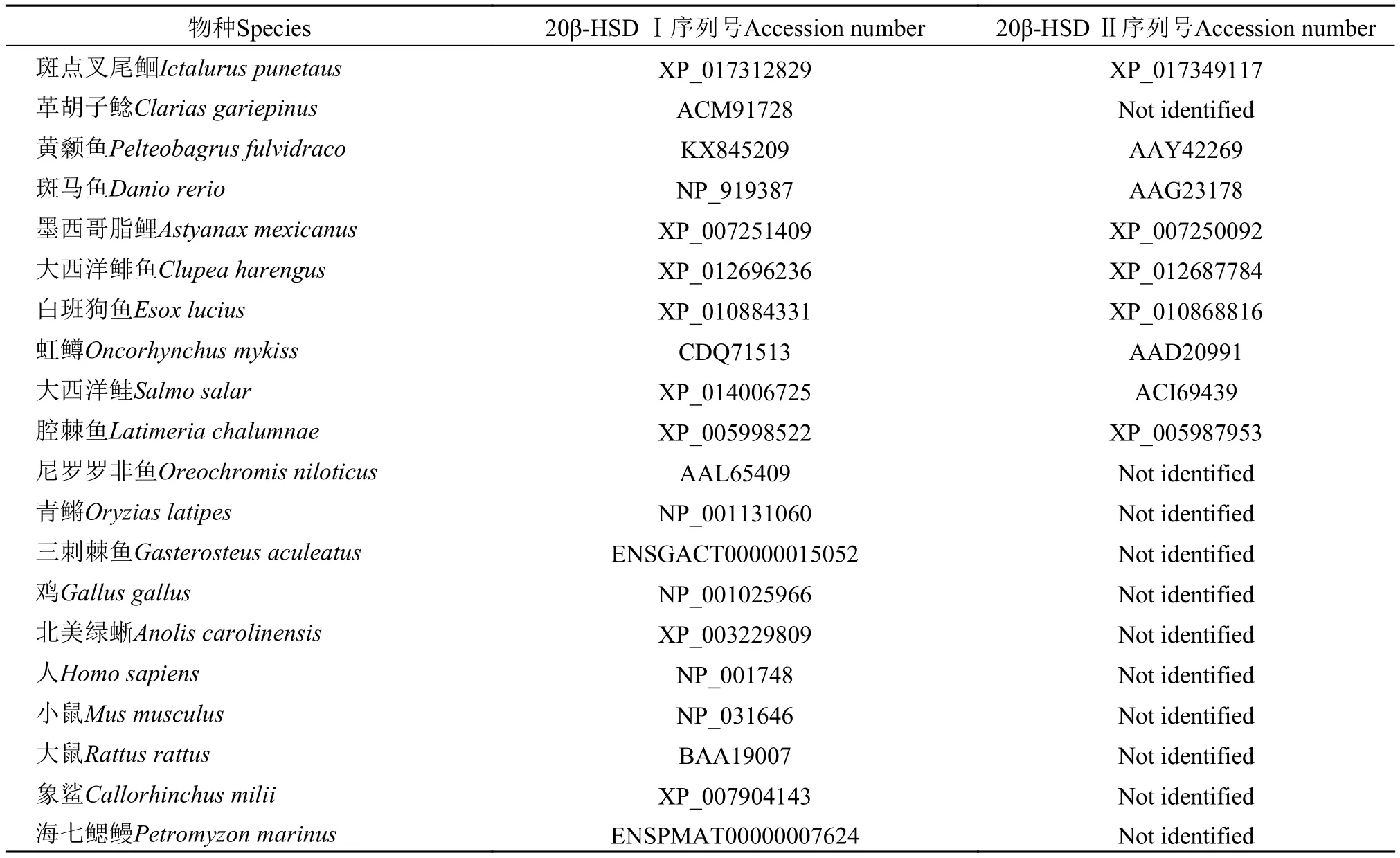
表 2 物種及其序列號Tab. 2 The species and corresponding accession numbers
1.7 季節表達模式和hCG調控的研究
在2016年的1、5、7和11月分別收集黃顙魚雄性成魚6尾, 作為6個平行樣, 取其精巢, 加1.0 mL TRIzol (Invitrogen)于玻璃勻漿器中勻漿, 提取總RNA, 用1%瓊脂糖凝膠電泳檢測RNA樣品的完整性, 并用Nano-Drop 2000核酸蛋白檢測儀測定總RNA樣品的純度和濃度, A260/280在1.8—2.0。總RNA置于–80℃保存備用。
在2016年的5月, 收集黃顙魚雄魚108尾, 分為2組(對照組和hCG處理組)。對照組雄魚注射0.5 mL生理鹽水, 處理組按照1000 IU/kg體重注射hCG (生理鹽水配制)。在注射后的3h、6h和9h后, 取對照組和處理組黃顙魚(各6尾)精巢, 加1.0 mL TRIzol (Invitrogen)于玻璃勻漿器中勻漿, 提取總RNA, 用1%瓊脂糖凝膠電泳檢測RNA樣品的完整性, 并用Nano-Drop 2000核酸蛋白檢測儀測定總RNA樣品的純度和濃度, A260/280在1.8—2.0。總RNA置于–80℃保存備用。
取1 μg總RNA按照PrimeScript RT reagent Kit (TaKaRa)說明書去除基因組DNA, 并進行反轉錄。合成的第一鏈cDNA稀釋5倍后于–20℃保存備用。用在線引物設計軟件(https://www.ncbi.nlm.nih.gov/ tools/primer-blast/)設計目的基因(20β-hsdⅠ和20βhsdⅡ)和管家基因(β-actin)的定量PCR引物(所用引物見表 1)。定量PCR反應包含0.3 μmol/L引物、1×Sybr Green master mix (TaKaRa)、2 μL cDNA,反應體積20 μL。定量PCR反應參數為: 預變性95℃ 30s, 40 個循環的95℃ 5s, 60℃ 30s。反應時,同時做陰性對照并檢測熔解曲線, 以保證每個樣品中僅有一個PCR產物, 且cDNA未受污染。本研究所用引物的擴增介于96.3%—105.1%。目的基因與β-actin的相對表達量用2–ΔΔCt的方法進行計算[25]。
1.8 數據處理
結果用SPSS 13.10軟件(SPSS, Chicago, ⅠL, USA)進行差異比較, P<0.05, 差異顯著。柱形圖用GraphPad Prism 6 (San Diego, CA)進行繪制。
2 結果
2.1 多重序列對比分析
采用RT-PCR和RACE的方法克隆得到黃顙魚20β-hsd Ⅰ (KX845209)全長cDNA序列, 推導的黃顙魚20β-HSD Ⅰ氨基酸序列中含有20β-HSD保守的7個結構域, 分別為:Ⅰ. 輔酶結合區及中心β折疊維持區;Ⅱ. 輔酶結合的腺嘌呤環及腺嘌呤環穩定區;Ⅲ. 中心β折疊穩定區;Ⅳ. 部分活性位點;Ⅴ. 底物結合位點; Ⅵ. 催化位點; Ⅶ. 煙堿環氨甲酰基結合位點[14]。多重序列對比發現, 魚類20β-HSD Ⅰ和Ⅱ均具有脊椎動物SDR超家族保守的7個結構域, 其中結構域Ⅰ、Ⅱ、Ⅲ、Ⅴ和Ⅶ在20β-HSDⅠ和Ⅱ中均高度保守, 而結構域Ⅳ和Ⅵ在20β-HSDⅠ和Ⅱ之間有一定差異(圖 1)。
2.2 系統發生分析
系統發生分析結果表明, 脊椎動物20β-HSD明顯分為2支(圖 2)。一支為海七鰓鰻(無頜類), 另一支則分為2個不同的20β-HSD拷貝(20β-HSD Ⅰ和Ⅱ)。20β-HSD Ⅰ類群分為輻鰭魚類、肉鰭魚類、四足類和軟骨魚類(象鯊); 而20β-HSD Ⅱ類群則分為2支: 輻鰭魚類和肉鰭魚類。
在輻鰭魚類和肉鰭魚類均含有2個20β-HSD拷貝, 而四足類、軟骨魚類和無頜類僅含有1個20β-HSD拷貝(圖 2)。進一步分析發現, 20β-HSD Ⅱ僅存在于較為原始的輻鰭魚類種群[如: 骨鰾魚類(Otocephala)和原棘鰭總目(Protacanthopterygii)魚類]和肉鰭魚類中, 而20β-HSD Ⅰ則存在于幾乎所有的脊椎動物類群。
2.3 共線性分析
共線性分析結果表明, 魚類(包括軟骨魚類)和四足類20β-hsd Ⅰ所在染色體區段的基因組成和定位具有高度的保守性(圖 3A)。其中, morc3、setd4和dopey2均為20β-hsd Ⅰ基因的臨近基因。同時分析發現, 不同魚類20β-hsd Ⅰ所在染色體區段上的基因發生了方向的轉變或重排, 如: 墨西哥脂鯉runx1和dopey2基因發生了丟失; 與人的基因方向相比, 斑馬魚runx1、itsn1和cryzl1基因的方向發生了顛倒(圖 3A)。魚類20β-hsd Ⅱ所在染色體區段的基因組成和基因方向也具有高度的保守性(圖 3B), 而b9d2、tgfb1和iptkca基因則是20β-hsd Ⅱ的臨近基因。不同魚類20β-hsd Ⅱ所在染色體區段上的基因也發生了方向的轉變或重排, 如: 在斑馬魚和墨西哥脂鯉中, iptkca位于20β-hsd Ⅱ下游, 而在腔棘魚中, iptkca則位于20β-hsd Ⅱ上游。此外, 斑馬魚和墨西哥脂鯉的kcnk12l和sdhaf1在染色體上的順序也發生了互換。然而, 魚類20β-hsd Ⅰ和20β-hsd Ⅱ所在染色體區段之間毫無相似之處(圖 3B)。

圖 1 黃顙魚與其他魚類2種20β-HSD多重序列比對分析Fig. 1 Multiple alignment of 20β-HSD between yellow catfish and other fish羅馬數字Ⅰ—Ⅶ. 魚類20β-HSD保守的7個結構域Roman numerals. Seven motifs of 20β-HSDs conserved in fish

圖 2 黃顙魚與其他脊椎動物20β-HSD的系統進化樹
2.4 組織表達分布
組織表達模式的研究結果表明, 黃顙魚20β-hsdⅠ主要表達于精巢、卵巢、頭腎和腎臟中, 在腸中有微弱表達; 而20β-hsd Ⅱ高表達于精巢、卵巢、心臟、頭腎、腎臟、腸、垂體和肝臟中, 在肌肉中有微弱表達(圖 4)。
2.5 季節表達模式
季節表達模式的結果表明, 黃顙魚20β-hsdⅠ在精巢中的表達5月最低, 而在11月達到峰值(圖5A)。而20β-hsd Ⅱ在精巢中的表達在5月達到峰值, 而在7月顯著降低(P<0.05), 隨后在11月又顯著上升(圖 5B)。
2.6 hCG的調控
20β-hsd Ⅰ的表達在hCG注射后3h顯著上調, 6h后與對照組相比沒有顯著差異, 而在9h后則顯著下調(圖 6A)。20β-hsd Ⅱ的表達在hCG注射后3—9h均顯著上調, 且呈明顯的時間依賴性(圖 6B)。
3 討論
3.1 魚類2個20β-hsd基因的復制和進化
在魚類的進化中, 輻鰭魚類發生過一次特有的基因組倍增事件(TSGD), 多數的基因都有2個或多個拷貝。20β-HSD是合成DHP的關鍵酶[20]。然而,多數脊椎動物(包括魚類)的基因組中只存在1個20β-hsd基因[7,9,26]。本研究從魚類分離了由2個不同基因編碼的20β-HSD。由于新分離的魚類20β-HSD與其他脊椎動物20β-HSD具有較近的親緣關系, 命名為20β-HSD Ⅰ; 而另一個20β-HSD則命名為20β-HSD Ⅱ。進一步研究發現, 所有脊椎動物的20β-hsd Ⅰ和魚類的20β-hsd Ⅱ均分別具有顯著的共線性, 表明上述基因所在的染色體區段在進化中相對保守。有研究發現, 由于輻鰭魚類特有的TSGD, 與四足類相比, 輻鰭魚類具有大量的復制基因[28,29]。基因組復制會產生平行進化同源基因, 這些基因在染色體上的定位和與臨近基因的位置極為相似[27]。然而, 盡管脊椎動物的20β-hsd Ⅰ和魚類的20β-hsd Ⅱ均分別具有顯著的共線性, 但同一物種的2個20β-hsd基因所在染色體區段的臨近基因卻截然不同。這一結果表明, 魚類20β-hsd復制基因的產生可能并非TSGD的結果。

圖 3 魚類20β-HSD Ⅰ (A)和20β-HSD Ⅱ (B)的共線性分析Fig. 3 Syntenic analysis of fish 20β-HSD Ⅰ (A) and 20β-HSD Ⅱ (B)

圖 4 20β-hsd Ⅰ和20β-hsd Ⅱ在黃顙魚各組織中的表達

圖 5 20β-hsd Ⅰ (A)和20β-hsd Ⅱ (B)在黃顙魚精巢中的季節表達模式Fig. 5 The seasonal expression patterns of 20β-hsd Ⅰ (A) and 20β-hsd Ⅱ (B) in the testis of Pelteobagrus fulvidracoa, b, c, d, 差異顯著(P<0.05); N=6a, b, c and d, were significantly different (P<0.05); N=6
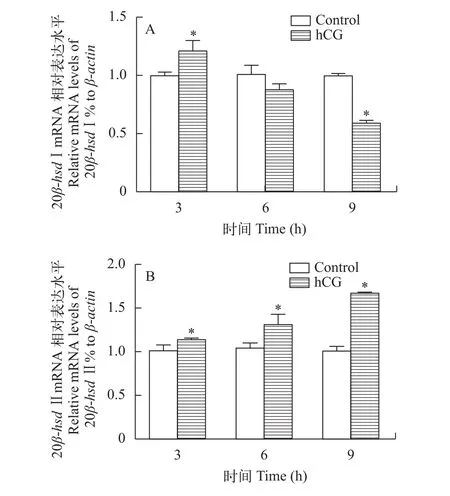
圖 6 hCG對黃顙魚精巢中20β-hsd Ⅰ (A)和20β-hsd Ⅱ (B)表達的調控Fig. 6 Regulation of hCG on the expressions of 20β-hsd Ⅰ (A) and 20β-hsd Ⅱ (B) in the testis of Pelteobagrus fulvidraco星號, 差異顯著(P<0.05); N=6Asterisks, significantly different (P<0.05); N=6
有趣的是, 肉鰭魚類中的腔棘魚也含有2個20βhsd基因, 而且腔棘魚20β-hsd Ⅰ和20β-hsd Ⅱ還分別與脊椎動物20β-hsd Ⅰ和魚類20β-hsd Ⅱ具有顯著的共線性。而TSGD則發生于輻鰭魚類和肉鰭魚類(包括腔棘魚、肺魚和四足類)分化之后[29,30]。根據以上研究結果推測, 魚類20β-hsd基因的復制可能早于輻鰭魚類和肉鰭魚類的分化。更有趣的是, 象鯊(軟骨魚類)20β-hsd Ⅰ在進化樹上也與脊椎動物20β-hsd Ⅰ聚為一支。同時, 象鯊20β-hsd Ⅰ還與脊椎動物20β-hsd Ⅰ具有高度保守的共線性。因此,盡管本研究未能在象鯊的基因組中分離到20β-hsdⅡ基因, 我們仍有理由推測, 魚類20β-hsd基因的復制可能早于軟骨魚類和硬骨魚類的分化。
此外, 本研究還發現20β-hsd Ⅰ基因幾乎存在于所有的輻鰭魚類(包括骨鰾魚類和真骨魚類)。而20β-hsd Ⅱ僅存在于骨鰾魚類(如: 大西洋鯡、斑馬魚、斑點叉尾、墨西哥脂鯉、虹鱒、大西洋鮭和白斑狗魚)、鮭鱒類(虹鱒和大西洋鮭)和原棘鰭總目(白斑狗魚), 不存在于新真骨魚類(Neoteleostei) (如: 羅非魚、鱈、青鳉、三刺棘魚、東方鲀、河鲀)、四足類和軟骨魚類。因此我們推測, 20β-hsdⅡ 基因在上述進化類群中可能發生了獨立的次生性丟失。
序列分析發現, 魚類2個20β-HSD均具有SDR超家族的7個保守結構域[31—33], 且具有較高的相似性, 表明這2種蛋白在結構上較為保守[34]。其中, 參與構象維持、底物結合和輔酶結合的結構域(Ⅰ、Ⅱ、Ⅲ、Ⅴ和Ⅶ)在2種20β-HSD中的相似性最高(71%—100%)。但作為催化活性位點的結構域Ⅳ和Ⅵ, 其相似性較低(不超過60%)。因此, 我們推測, 魚類2個20β-HSD可能具有相似的空間結構, 能結合相似的底物和輔酶, 但催化的產物可能有一定差異。
3.2 黃顙魚2個20β-hsd基因的表達模式和調控
20β-hsd Ⅰ和Ⅱ在黃顙魚各組織中均呈泛表達模式, 與其他的相關研究結果相似[3,14,22,34]。這種泛表達模式的意義尚不明確。20β-hsd mRNA在非性腺組織的表達表明其可能具有多種不同的功能。在哺乳類, 20β-HSD參與多種化合物(比如: 類固醇激素、前列腺素)的代謝[35,36]。在魚類中, 20βhsd還在鰓和腎間組織表達, 表明其可能參與合成DHP, 并作為性外激素釋放[37,38]。而黃顙魚20β-hsdⅡ在其他非性腺組織中也有微弱表達, 表明其可能還有其他未知的功能[3]。
在魚類雌性, 卵母細胞在成熟誘導激素(Maturation inducing hormone, MIH)的作用下發生成熟。在多種魚類中, DHP都是最主要的MIH, 而20β-HSD則在DHP的合成中起重要作用[23,34,39]。在魚類雄性, 20β-HSD主要定位于未加尾(早期)的生殖細胞中。在革胡子鯰中, 20β-hsd主要表達于間質細胞和早期生殖細胞[15]。在雄性香魚(Plecoglossus altivelis)和革胡子鯰精巢的成熟期, 20β-hsd的表達均顯著上調[14,15,34]。上述證據均表明20β-HSD與魚類的性腺和配子成熟密切相關。
另一方面, 20β-hsd表達的上調受到垂體分泌的促性腺激素(Gonadotropin, GtH)的精密調控[3,14,15]。在魚類性成熟的起始階段, 下丘腦分泌的促性腺激素釋放激素(GnRH)刺激垂體分泌GtH, 隨后作用于卵巢或精巢, 刺激20β-hsd的表達, 導致DHP水平的急劇上升和配子的成熟[14]。hCG誘導2h后, 羅非魚性腺中20β-hsd的表達顯著上升, 并促進卵母細胞成熟[3]。而在鲇形目魚類, hCG在精巢和卵巢中均能激活20β-hsd Ⅱ的上調[14,15]。
本研究發現, 在黃顙魚的繁殖周期中, 黃顙魚20β-hsd Ⅰ的表達呈先下降, 再上升的趨勢, 其表達水平在5月降到最低, 而在11月升到最高。相反, 20β-hsd Ⅱ的表達在5月達到峰值, 隨后7月顯著降低, 在11月再次上升。眾所周知, 黃顙魚是周年性產卵魚類, 繁殖季節在5—6月[40]。黃顙魚20β-hsdⅡ在5月的高表達與其繁殖期高度吻合, 表明20βhsd Ⅱ與黃顙魚的精巢成熟和排精緊密相關。相反, 盡管hCG處理3h后20β-hsd Ⅰ的表達顯著上調,但隨后其表達持續下降; 而20β-hsd Ⅱ的表達在hCG處理后持續顯著上調, 呈顯著的時間依賴性,與其他的報道結果完全一致[14]。結合魚類2個20β-HSD蛋白序列的差異性、黃顙魚20β-hsd Ⅰ、Ⅱ的表達模式和調控模式的差異, 我們推測: 黃顙魚20β-HSD Ⅰ和Ⅱ在精巢中的功能可能有一定的差異。其中, 20β-HSD Ⅱ可能參與DHP的合成, 而20β-HSD Ⅰ的功能還需進一步深入研究。
綜上所述, 本研究首次從魚類分離了2個20βhsd基因。系統發生和共線性分析結果暗示, 魚類20β-hsd復制基因可能早于軟骨魚類和硬骨魚類的分化。依據黃顙魚2個20β-hsd基因表達模式和調控模式的研究結果, 我們推測: 20β-HSD Ⅱ可能參與DHP的合成, 而20β-HSD Ⅰ的功能尚不明確。
[1]Sugiyama T, Ohnoa S, Ghoshb D, et al. 3α/β, 20β-Hydroxysteroid dehydrogenase (porcine testicular carbonylreductase) also has a cysteine residue that is involved in binding of cofactor NADPH [J]. Journal of Steroid Biochemistry & Molecular Biology, 2004, 88(4): 393—398
[2]Persson B, Jornvall H. Short-chain dehydrogenases/reductases (SDR): the 2002 update [J]. Chemico-Biological Interactions, 2003, 143—144(1): 247—253
[3]Senthilkumaran B, Sudhakumari C C, Chang X T, et al. Ovarian carbonyl reductase-like 20beta-hydroxysteroid dehydrogenase shows distinct surge in messenger RNA expression during natural and gonadotropin-induced meiotic maturation in Nile tilapia [J]. Biology of Reproduction, 2003, 67(4): 1080—1086
[4]Nagahama Y, Yamashita M. Regulation of oocyte maturation in fish [J]. Development, Growth & Differentiation, 2008, 50(S1): s195—s219
[5]Sreenivasulu G, Senthilkumaran B. New evidences for the involvement of 20beta-hydroxysteroid dehydrogenase infinal oocyte maturation of air-breathing catfish [J]. General Comparative Endocrinology, 2009, 163(3): 259—269
[6]Senthilkumaran B. Recent advances in meiotic maturation and ovulation: comparing mammals and pisces [J]. Frontiers in Bioscience (Landmark Edition), 2011, 16: 1898—1914
[7]Ohno S, Nakajin S, Shinoda M. 20 beta-hydroxysteroid dehydrogenase of neonatal pig testis: 3 alpha/beta-hydroxysteroid dehydrogenase activities catalyzed by highly purified enzyme [J]. The Journal of Steroid Biochemistry and Molecular Biology, 1991, 38(6): 787—794
[8]Bryndová J, Klusonová P, Kucka M, et al. Cloning and expression of chicken 20-hydroxysteroid dehydrogenase [J]. Journal of Molecular Endocrinology, 2006, 37(3): 453—462
[9]Takada H, Otagiri M, Imamura Y. 20beta-hydroxysteroid dehydrogenase catalyzes ketone-reduction of acetohexamide, an oral antidiabetic drug, in liver microsomes of adult male rats [J]. The Journal of Pharmacology and Experimental Therapenrics, 1998, 287(2): 504—507
[10]Miura T, Yamauchi K, Takahashi H, et al. The role of hormones in the acquisition of sperm motility in salmonid fish [J]. The Journal of Experimental Zoology, 1992, 261(3): 359—363
[11]Kusakabe M, Nakamura I, Evans J, et al. Changes in mRNAs encoding steroidogenic acute regulatory protein, steroidogenic enzymes and receptors for gonadotropins during spermatogenesis in rainbow trout testes [J]. The Journal of Endocrinology, 2006, 189(3): 541—554
[12]Schulz R W, de Fran?a L R, Lareyre J J, et al. Spermatogenesis in fish [J]. General and Comparative Endocrinology, 2010, 165(3): 390—411
[13]Scott A P, Sumpter J P, Stacy N. The role of the maturation inducing steroid, 17α, 20β-dihydroxy-4-pregnen-3-one in male fishes: a review [J]. Journal of Fish Biology, 2010, 76: 183—224
[14]Zhuo Q, Zhang Y, Huang W, et al. Cloning, characterization, sequence analysis and expression patterns in vivo of testicular 20β-hydroxysteroid dehydrogenase cDNA in yellow catfish (Pelteobagrus fulvidraco) [J]. Comparative Biotechemistry and Physiology. Part B, Biochemistry Molecular Biology, 2011, 159(3): 171—182
[15]Sreenivasulu G, Senthilkumaran B, Sridevi P, et al. Expression and immunolocalization of 20β-hydroxysteroid dehydrogenase during testicular cycle and after hCG induction, in vivo in the catfish, Clarias gariepinus [J]. General and Comparative Endocrinology, 2012, 175(1): 48—54
[16]Ohno. Evolution by Gene Duplication [M]. S. Springer-Verlag, 1970, 300—305
[17]Chiang E F, Yan Y L, Guiguen Y, et al. Two Cyp19 (P450 aromatase) genes on duplicated zebrafish chromosomes are expressed in ovary or brain [J]. Molecular Biology and Evolution, 2001, 18(4): 542—550
[18]Kwon J Y, McAndrew B J, Penman D J. Cloning of brain aromatase gene and expression of brain and ovarian aromatase genes during sexual differentiation in genetic male and female Nile tilapia Oreochromis niloticus [J]. Molecular Reproduction and Development, 2001, 59(4): 359—370
[19]Liu Z, Wu F, Jiao B, et al. Molecular cloning of doublesex and mab-3-related transcription factor 1, forkhead transcription factor gene 2, and two types of cytochrome P450 aromatase in Southern catfish and their possible roles in sex differentiation [J]. The Journal of Endocrinology, 2007, 194(1): 223—241
[20]Zhou L Y, Wang D S, Kobayashi T, et al. A novel type of P450c17 lacking the lyase activity is responsible for C21-steroid biosynthesis in the fish ovary and head kidney [J]. Endocrinology, 2007a, 148(9): 4282—4291
[21]Zhou L Y, Wang D S, Shibata Y, et al. Characterization, expression and transcriptional regulation of P450c17-I and -II in the medaka, Oryzias latipes [J]. Biochemical and Biophysical Research Communications, 2007b, 362(3): 619—625
[22]Guan G, Tanaka M, Todo T, et al. Cloning and expression of two carbonyl reductase-like 20beta-hydroxysteroid dehydrogenase cDNAs in ovarian follicles of rainbow trout (Oncorhynchus mykiss) [J]. Biochemical and Biophysical Research Communications, 2009, 255(1): 123—128
[23]Wang Y, Ge W. Cloning of zebrafish ovarian carbonyl reductase-like 20 beta-hydroxysteroid dehydrogenase and characterization of its spatial and temporal expression [J]. General and Comparative Endocrinology, 2002, 127(3): 209—216
[24]Ohno S, Nakajin S, Shinoda M. Ontogeny of testicular steroid dehydrogenase enzymes in pig (3 alpha/beta-, 20 alpha- and 20 beta-): evidence for two forms of 3 alpha/beta-hydroxysteroid dehydrogenase [J]. The Journal of Steroid Biochemistry and Molecular Biology, 1992, 42(1): 17—21
[25]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔctmethod [J]. Methods, 2001, 25: 402—408
[26]Pramanick K, Kundu S, Paul S, et al. Changes in plasma steroid levels during oocyte development in Indian shad, Tenualosa ilisha (Hamilton, 1822): role of gonadotropins on in vitro steroid production and development of oocyte maturational competence [J]. Animal Reproductive Science, 2013, 141(3—4): 177—188
[27]Geraldo M T, Valente G T, Braz A S, et al. The discovery of Foxl2 paralogs in chondrichthyan, coelacanth and tetrapod genomes reveals an ancient duplication in vertebrates [J]. Heredity (Edinb), 2013, 111(1): 57—65
[28]Donoghue P C, Purnell M A. Genome duplication, extinction and vertebrate evolution [J]. Trends in Ecology & Evolution, 2005, 20(6): 312—31
[29]Meyer A, Van de Peer Y. From 2R to 3R: evidence for a fish-specific genome duplication (FSGD) [J]. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, 2005, 27(9): 937—945
[30]Meyer A, Schartl M. Gene and genome duplications in vertebrates: the one-to-four (-to-eight in fish) rule and the evolution of novel gene functions [J]. Current Opinion Cell Biology, 1999, 11(6): 699—704
[31]Bailey T L, Baker M E, Elkan C P. An artificial intelligence approach to motif discovery in protein sequences: application to steriod dehydrogenases [J]. The Journal of Steroid Biochemistry and Molecular Biology, 1997, 62(1): 29—44
[32]Oppermann U, Filling C, Hult M, et al. Short-chain dehydrogenases/reductases (SDR): the 2002 update [J]. Chenmico-biological Interactions, 2003, 143—144: 247—253
[33]Persson B, Kallberg Y, Oppermann U, et al. Coenzymebased functional assignments of short-chain dehydrogenases/reductases (SDRs) [J]. Chenmico-biological Interactions, 2003, 143(143—144): 271—278
[34]Tanaka M, Nakajin S, Kobayashi D, et al. Teleost ovarian carbonyl reductase-like 20beta-hydroxysteroid dehydrogenase: potential role in the production of maturation-inducing hormone during final oocyte maturation [J]. Biology of Reproduction, 2002, 66(5): 1498—1504
[35]Penning T M. Molecular endocrinology of hydroxysteroid dehydrogenases [J]. Endocrine Reviews, 1997, 18(3): 281—305
[36]Takada H, Uchida A, Kamizono R, et al. Further studies on 20beta-hydroxysteroid dehydrogenase with carbonyl reductase-like activity present in liver microsomes of male rats [J]. Life Sciences, 2000, 67(17): 2075—2082
[37]Ebrahimi M, Scott A P, Kime D E. Extragonadal production of 17, 20-dihydroxy-4-pregnen-3-ones in vitro in cyprinid fish [J]. General and Comparative Endocrinology, 1996, 104(3): 296—303
[38]Kime D E, Ebrahimi M. Synthesis of 17, 20α- and 17, 20β-dihydroxy-4-pregnen-3-ones, 11-ketotestosterone and their conjugates by gills of teleost fish [J]. Fish Physiology and Biochemistry, 1997, 17(1—6): 117—121
[39]Espey L L, Yoshioka S, Russell D, et al. Characterization of ovarian carbonyl reductase gene expression during ovulation in the gonadotropin-primed immature Rat [J]. Biology of Reproduction, 2000, 62(2): 390—397
[40]Yin H B, Jia Z H, Yao D X, et al. Sex differentiation in Pelteobagrus fulvidraco [J]. Chinese Journal of Zoology, 2008, 43(6): 103—108 [尹洪濱, 賈中賀, 姚道霞, 等. 黃顙魚性腺分化的組織學觀察. 動物學雜志, 2008, 43(6): 103—108]
CHARACTERATION OF THE DUPLICATED 20β-HSD GENES IN PELTEOBAGRUS FULVIDRACO AND THEIR EXPRESSION PATTERNS AND REGULATIONS
YIN Pan, LI Ying-Wen, WANG Ya-Qin and LIU Zhi-Hao
(Chongqing Key Laboratory of Animal Biology, College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
Maturation inducing hormone (MIH) plays pivotal roles in gamete maturation, ovulation and spermiation of fish. In most teleost species, 17α, 20β-dihydroxy-4-pregnen-3-one (DHP) is the major MIH. The steroidogenic enzyme, named 20β-hydroxysteroid dehydrogenase (20β-HSD), is responsible for DHP production in several teleost species. To date, only one copy of 20β-hsd has been characterized in vertebrates, including fish. In this study, two copies of 20βhsd genes were identified in genomes of several fish species. Phylogenetic and syntenic analyses revealed that the duplication of 20β-hsd gene may not result from the teleost specific genome duplication (TSGD). Multiple-alignment results indicated that these two enzymes might possess similar spatial structures and co-enzyme/substrate binding motifs, whereas, their catalytic activities might differ. The duplicated copy of 20β-hsd was further cloned from yellow catfish (Pelteobagrus fulvidraco). Tissue distribution results showed that, 20β-hsd Ⅰ mRNA was mainly expressed in testis, ovary, head kidney and kidney, while 20β-hsd Ⅱ mRNA was mainly located in testis, ovary, heart, head kidney, kidney, intestine, pituitary and liver. Seasonal expression results revealed that, lower 20β-hsd Ⅰ expression and higher 20β-hsd Ⅱ expression were observed in male fish during reproductive time window (in May). Three hours after injection of hCG (1000 IU/kg body weight), the expression of 20β-hsd Ⅰ was up-regulated and then suppressed significantly, while the expression of 20β-hsd Ⅱ was up-regulated in a time dependent manner in male fish. These results demonstrated the differential regulation pattern of 20β-hsd Ⅰ and 20β-hsd Ⅱ in response to hCG.
Pelteobagrus fulvidraco; 20β-HSD; Duplicated gene; cDNA cloning; Expression pattern; hCG treatment
Q173
A
1000-3207(2017)05-0963-09
10.7541/2017.120
2016-11-05;
2017-04-16
重慶市科委項目(cstc2016jcyjA0133); 重慶市教委項目(KJ130622和KJ1600308); 重慶師范大學校級項目(12XLB005和13XLZ08)資助 [Supported by the Natural Science Foundation Project of CQ CSTC (cstc2016jcyjA0133); Ministry of Education Project of CQ (KJ130622, KJ1600308); the Key Project of the CQNU (12 XLB005, 13XLZ08)]
尹盼(1991—), 女, 重慶渝北人; 碩士研究生; 主要研究方向為動物學。E-mail: panyin123@yahoo.com
劉智皓(1979—), E-mail: minenut@163.com

