BD926對骨髓源性未成熟樹突狀細胞增殖及吞噬作用的影響*
蘇志偉,楊 苗,楊 凱,徐 燦,彭 旭,段佳毅,冷 瀟,,王衍堂,△
1. 成都醫學院 生物醫學系(成都 610500);2. 成都醫學院基礎醫學院 免疫教研室(成都 610500)
·論著·
BD926對骨髓源性未成熟樹突狀細胞增殖及吞噬作用的影響*
蘇志偉1,楊 苗2,楊 凱1,徐 燦1,彭 旭1,段佳毅1,冷 瀟1,2,王衍堂1,2△
1. 成都醫學院 生物醫學系(成都 610500);2. 成都醫學院基礎醫學院 免疫教研室(成都 610500)
目的研究苯并噻唑類衍生物BD926對小鼠骨髓源性未成熟樹突狀細胞(immature dendritic cells, imDCs)增殖及吞噬作用的影響。方法分離小鼠骨髓源性單核細胞誘導imDCs,借助PE/Annexin V凋亡檢測試劑盒、CFSE細胞增殖試劑盒以及FITC-葡聚糖,應用流式細胞術檢測BD926對imDCs在粒細胞-巨噬細胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)刺激下的細胞存活、細胞增殖以及吞噬作用的影響。結果與PBS組相比,25 、5 、1 μM 的BD926處理imDCs后,其細胞增殖水平降低,差異有統計學意義(P<0.05);高、中、低3個劑量組BD926處理后,imDCs與PBS組相比,細胞存活差異無統計學意義 (P>0.05);高、中、低3個劑量組BD926處理后,imDCs與PBS組相比,吞噬作用差異無統計學意義 (P>0.05)。結論BD926在體外可明顯抑制GM-CSF刺激的imDCs增殖作用,對imDCs的細胞存活和吞噬作用則無明顯影響。
苯并噻唑類衍生物;未成熟樹突狀細胞;細胞增殖;吞噬作用;凋亡
樹突狀細胞(dendritic cells, DCs) 起源于骨髓多功能造血干細胞(multiple hematopoietic stem cell, MHSCs),是機體內最強大的專職抗原遞呈細胞(antigen presenting cells, APC),能高效激活幼稚T細胞,在誘導T細胞介導的免疫應答以及T細胞相關的免疫耐受過程中存在極為重要的作用[1]。DCs作為連接天然免疫和獲得性免疫的橋梁,近期研究[2]提示,其在自身免疫性疾病發病中的作用愈發重要。DCs攝取自身抗原,經加工后呈遞并激活外周幼稚T細胞,其分泌的細胞因子如IL-6、IL-12、IL-23和TGF-β等亦是誘導Th1和Th17細胞分化的關鍵要素[3-4]。DCs的細胞表面分子表型、成熟度和細胞因子功能的異質性是免疫反應和免疫耐受實現動態平衡的重要因素。成熟DCs(mature dendritic cells, mDCs)表達高豐度的共刺激分子,分泌大量T細胞活化相關的細胞因子(如IL-6、IL-12、IL-18、IL-23等),選擇性激活并誘導各亞型T細胞分化,進而產生免疫反應。未成熟樹突狀細胞(immature dendritic cells, imDCs)表達低水平的MHC分子以及CD40、CD80和CD86等共刺激分子,但具有較強的吞噬、遷移能力以及增殖特性[5]。
苯并噻唑類衍生物是一類芳香族雜環化合物,既往研究主要集中于腫瘤[6-7]與細菌感染[8],但其免疫抑制活性相關的研究尚未見報道。本研究合成篩選出一組苯并噻唑衍生物,可明顯抑制小鼠和人的T細胞增殖。其中,以BD750活性最高,該化合物通過抑制IL-2誘導的STAT5磷酸化在2μM濃度下,即可有效抑制T細胞增殖[9]。盡管BD750在體外具有較好的免疫抑制活性,但其體內免疫抑制作用一般,其原因可能是BD750難溶于水,吸收緩慢,達不到有效的血藥濃度。通過對BD750進行化學修飾等結構改造,合成其新的水溶性衍生物BD926,發現BD926亦能明顯抑制T細胞增殖,且相關分子機制與BD750相似,亦是作用于STAT5磷酸化信號通路[10]。而過去研究[11-12]已證實,粒細胞-巨噬細胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)通過誘導STAT5活化,在單核細胞、巨噬細胞以及DCs等髓系免疫細胞的增殖、活化和成熟方面存在關鍵作用。因此,本研究擬觀察BD926處理的小鼠骨髓源性的imDCs,在GM-CSF刺激后,其存活、增殖和吞噬相關的細胞功能是否發生改變。探討BD926是否因其對STAT5磷酸化的抑制作用,干擾小鼠骨髓來源imDCs在GM-CSF刺激后的細胞活動,從而為水溶性苯并噻唑類衍生物BD926在后續動物體內干預自身免疫性疾病發病提供更為豐富的體外實驗數據。
1 材料與方法
1.1實驗材料
1.1.1 實驗動物 6~8周齡雄性SPF級C57BL/6小鼠(北京維通利華),飼養于成都醫學院科研實驗中心SPF動物房。實驗動物使用許可證號:SYXK(川)2015-196,室溫20 ~ 26 ℃,相對濕度40%~70%,光暗周期(12 h/12 h)。
1.1.2 主要實驗試劑 rmGM-CSF購買于美國Peprotech公司;LPS購買于美國Sigma公司;FITC-Dextran(40 000 MW)購買于美國Sigma公司;PE Annexin V Apoptosis Detection Kit I購買于美國BD Pharmingen公司;CellTrace CFSE Cell Proliferation Kit購買于美國Invitrogen公司。
1.2實驗方法
1.2.1 小鼠骨髓源性imDCs純化分離及受試藥物
取雄性C57BL/6小鼠(6~8周齡),行頸椎脫臼,處死后,放入75%酒精,浸泡消毒3 min。無菌條件下,分離股骨,放入冰浴中的無血清RPMI-1640培養基中。70% 酒精浸泡消毒2 min, 預冷的無血清RPMI-1640培養基洗滌2次。剪掉股骨末端骨骺,借助1 mL注射器,吸取PBS緩沖液對骨髓腔反復沖洗,收集沖洗后的細胞懸液,40 μm孔徑細胞篩網(美國BD Falcon)過濾。離心(300 g/min, 5 min),棄上清,加入紅細胞裂解液去除紅細胞,PBS洗滌,離心(300 g/min, 5 min),收集細胞。細胞計數,調整細胞密度(1×106個/mL),并重懸于RPMI-1640培養基(10%胎牛血清)中,接種至100 mm平皿,加入rmGM-CSF 20 ng/mL,5%CO2孵箱,37 ℃培養。細胞培養24 h換液,吸棄含未貼壁細胞及細胞碎片的培養液。加入新的RPMI-1640完全培養基,吹打收集輕微黏附貼壁細胞,調整細胞密度(1×106個/mL),重新接種于24孔細胞培養板,培養條件同前。
本實驗的受試藥物苯并噻唑類衍生物BD926 [sodium 2-(benzo[d]thiazol-2-yl)-4,5,6,7-tetrahydro-2H-indazol-3-olate, C14H12N3NaOS, MW: 293.3],是在之前已報道的小分子化合物BD750 [2-(2-benzothiazoleyl)-4,5,6,7-tetrahydro-2H-indazol-3-ol, C14H13N3OS, MW: 271.3]的結構基礎上進行化學修飾優化后得到的水溶性衍生物(圖1)[9]。
1.2.2 劑量設計 本研究設5個實驗組,每組設2復孔,劑量設計如下所示(表1)。

圖1 水溶性苯并噻唑類衍生物BD926的合成

GM-CSFBD926CP690550PBS陰性對照組20ng/mL--BD926低劑量組20ng/mL1μM-BD926中劑量組20ng/mL5μM-BD926高劑量組20ng/mL25μM-CP690550陽性對照組20ng/mL-1μM
1.2.3 流式細胞術檢測BD926對imDCs細胞存活的影響 在細胞培養第2天,重新接種于24孔培養板的imDCs(細胞密度1×106個/mL),在加入20 ng/mL的GM-CSF以及實驗設計的各劑量組藥物后,繼續培養48 h。培養結束后,按PE/Annexin V凋亡檢測試劑盒說明書進行染色,應用BD公司Accuri C6分析型流式細胞進行檢測。
1.2.4 流式細胞術檢測BD926對imDCs細胞增殖的影響 在細胞培養第2天,自100 mm平皿收集的輕微黏附貼壁細胞。細胞計數,調整細胞密度(1×106個/mL)。加入CFSE溶液(2 M),孵育10 min(37 ℃),每2 min吹打混勻;加入含5% 胎牛血清的PBS緩沖液(預冷)中止染色,離心(300 g/min, 5 min),收集細胞,PBS緩沖液重復洗滌兩次。調節細胞密度為1×106個/mL,接種于24孔培養板的imDCs,加入20 ng/mL的GM-CSF以及實驗設計的各劑量組藥物后,繼續培養48 h。培養結束后,收集細胞,PBS洗滌后上機檢測。
1.2.5 流式細胞術檢測BD926對imDCs細胞吞噬作用的影響 在細胞培養第2天,接種于24孔培養板的imDCs(細胞密度1×106個/mL),在加入20 ng/mL的GM-CSF以及實驗設計的各劑量組藥物后,繼續培養48 h。收集細胞并調整細胞密度至1×106個/mL,重新接種于24孔培養板。加入FITC-Dextran終濃度為1 mg/mL,37 ℃,孵育60 min,預冷PBS洗滌2次后,上機檢測imDCs對抗原的攝取能力。
1.3統計學方法
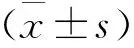
2 結果
2.1BD926對imDCs細胞存活的影響
BD926高、中、低3個劑量組干預后的imDCs在培養48 h后,其細胞存活率與PBS陰性對照組相比,差異無統計學意義(P>0.05);細胞凋亡率(Annexin V陽性細胞比率)與PBS陰性對照組相比,差異無統計學意義(P>0.05)(圖2)。
2.2BD926對imDCs細胞增殖的影響
BD926高、中、低3個劑量組干預后的imDCs在培養48 h后,其細胞增殖與PBS陰性對照組相比,增殖指數降低,差異有統計學意義(P<0.05);且BD926對GM-CSF誘導的imDCs細胞增殖的抑制作用存在一定劑量依賴關系。此外,1 μM CP690 550對imDCs的細胞增殖亦有抑制作用,差異有統計學意義(P<0.05)(圖3)。
2.3BD926對imDCs吞噬作用的影響
BD926高、中、低3個劑量組干預后的imDCs,對Dextran的攝取能力與PBS陰性對照組相比,差異無統計學意義(P>0.05);此外,1 μM CP690 550干預后的imDCs對Dextran的攝取能力與PBS陰性對照組相比,差異無統計學意義(P>0.05)(圖3)。

圖2 BD926對骨髓源性imDCs細胞活性的影響注:A. PI/Annexin V雙染后,流式細胞術檢測imDCs凋亡率;B. 定量分析存活細胞及Annexin V陽性細胞比率

圖3 BD926對骨髓源性imDCs細胞增殖及吞噬作用的影響
注:A. CFSE標記后,流式細胞術檢測imDCs增殖率;B. 流式細胞術檢測imDCs對Dextran的吞噬作用;C. 定量分析細胞增殖指數及Dextran陽性細胞比率;與PBS陰性對照組比較,**P<0.05
3 討論
具有免疫抑制活性的小分子化合物在移植免疫和自身免疫等領域的臨床用藥中顯現其日益重要的地位。2012年,美國食品藥品管理局(FDA)批準輝瑞公司開發的Jak抑制劑CP690 550用于治療甲氨喋呤療效不佳或不耐受的中至重度活動性類風濕關節炎(RA)成人患者。本研究小組篩選出新型苯并噻唑類衍生物BD750,其化學結構與當前進入臨床階段的小分子免疫抑制劑如CP690 550、雷帕霉素、環孢霉素A及FK506等存在明顯差異,表明BD750是一種全新的免疫抑制劑[13]。在體外實驗研究中,進一步明確BD750通過阻斷STAT5信號通路完全抑制T細胞增殖[9]。而其經過化學修飾結構改造后得到的水溶性衍生物BD926,也表現相似的體外活性以及分子機制[10]。因此,BD926具有成為新型STAT5信號通路抑制劑的潛力,其作為先導化合物,通過將來持續的優化改造,有望成為應用于對抗移植排異以及自身免疫性疾病的免疫抑制藥物。在后續的體內實驗中,將著重研究苯并噻唑類衍生物BD926對不同的自身免疫疾病動物模型的發病及疾病活動的干預作用。由于STAT5信號通路廣泛存在于機體不同的細胞類型,具有重要的生理學意義[6]。因此,BD926進入機體后,對T細胞以外的其他細胞,尤其是其他免疫細胞的細胞功能的影響也非常值得關注。
在本研究中,探討了苯并噻唑類衍生物BD926對骨髓源性imDCs增殖及吞噬作用的影響,結果顯示,1 μM BD926在體外即可明顯抑制骨髓源性imDCs在GM-CSF刺激后的細胞增殖作用,而在25 μM的藥物作用濃度下能基本實現對imDCs增殖的完全抑制。但高、中、低3個劑量組的BD926對imDCs的存活和吞噬作用則無明顯影響。imDCs因其增殖能力、吞噬功能、趨化作用、細胞形態以及活化分子和共刺激因子等細胞表面標記的表達方面與mDCs均存在明顯差異。但imDCs在吞噬攝取外來或自身抗原并加工呈遞活化幼稚T細胞,以及在受到抗原刺激后分化成熟并分泌大量的炎性細胞因子在T細胞相關反應中,存在不可或缺的作用,是連接固有免疫與獲得性免疫之間的重要橋梁[14]。近期研究[15]發現,imDCs因其與mDCs在成熟度和功能上的差異,在誘導機體免疫耐受等方面亦存在不可或缺的作用 。因此,BD926對imDCs細胞擴增、存活和吞噬方面的影響,在藥物調節機體的免疫反應過程中亦不容忽視。本研究為水溶性苯并噻唑類衍生物BD926在后續動物體內干預自身免疫性疾病發病提供更為堅實和豐富的體外實驗數據。
[1]Minton K. Dendritic cells: Choosing the right presentation[J]. Nat Rev Immunol, 2011, 11(12): 804.
[2]Ganguly D, Haak S, Sisirak V,etal. The role of dendritic cells in autoimmunity[J]. Nat Rev Immunol, 2013, 13(8): 566-577.
[3]Reis e Sousa C. Dendritic cells in a mature age[J]. Nat Rev Immunol, 2006, 6(6): 476-483.
[4]Mohammad M G, Hassanpour M, Tsai V W,etal. Dendritic cells and multiple sclerosis: disease, tolerance and therapy[J]. Int J Mol Sci, 2012, 14(1): 547-562.
[5]Ardavín C. Origin, precursors and differentiation of mouse dendritic cells[J]. Nat Rev Immunol, 2003, 3(7): 582-590.
[6]Wang Z, Shi X H, Wang J,etal. Synthesis, structure-activity relationships and preliminary antitumor evaluation of benzothiazole-2-thiol derivatives as novel apoptosis inducers[J]. Bioorg Med Chem Lett, 2011, 21(4): 1097-1101.
[7]Chakraborty M, Jin K J, Glover S A,etal. Characterization of the 4-(benzothiazol-2-yl)phenylnitrenium ion from a putative metabolite of a model antitumor drug[J]. J Org Chem, 2010, 75(15): 5296-5304.
[8]Aridoss G, Amirthaganesan S, Jeong Y T. Synthesis, crystal and antibacterial studies of diversely functionalized tetrahydropyridin-4-ol[J]. Bioorg Med Chem Lett, 2010, 20(7): 2242-2249.
[9]Liu Y, Yang T, Li H,etal. BD750, a benzothiazole derivative, inhibits T cell proliferation by affecting the JAK3/STAT5 signalling pathway[J]. Br J Pharmacol, 2013, 168(3): 632-643.
[10] Liu Y, Lai Y, Li H,etal. A novel water-soluble benzothiazole derivative BD926 inhibits human activated T cell proliferation by down-regulating the STAT5 activation[J]. Eur J Pharmacol, 2015, 761: 36-43.
[11] Litherland S A, Xie T X, Grebe K M,etal. Signal transduction activator of transcription 5 (STAT5) dysfunction in autoimmune monocytes and macrophages[J]. J Autoimmun, 2005, 24(4): 297-310.
[12] Lehtonen A, Matikainen S, Miettinen M,etal. Granulocyte-macrophage colony-stimulating factor (GM-CSF)-induced STAT5 activation and target-gene expression during human monocyte/macrophage differentiation[J]. J Leukoc Biol, 2002, 71(3): 511-519.
[13] Ghoreschi K, Gadina M. Jakpot! New small molecules in autoimmune and inflammatory diseases[J]. Exp Dermatol, 2014, 23(1): 7-11.
[14] Villarino A V, Kanno Y, Ferdinand J R,etal. Mechanisms of Jak/STAT signaling in immunity and disease[J]. J Immunol, 2015, 194(1): 21-27.
[15] Zhou Y, Leng X, Luo S,etal. Tolerogenic Dendritic Cells Generated with Tofacitinib Ameliorate Experimental Autoimmune Encephalomyelitis through Modulation of Th17/Treg Balance[J]. Journal of Immunology Research, 2016, 2016:1-13.
TheEffectofBD926ontheProliferationandPhagocytosisofMurineBoneMarrow-DerivedImmatureDendriticCells
SuZhiwei1,YangMiao2,YangKai1,XuCan1,PengXu1,DuanJiayi1,LengXiao1, 2,WangYantang1, 2△.
1.SchoolofBiomedicalSciences,ChengduMedicalCollege,Chengdu610083,China;2.DepartmentofImmunology,SchoolofBasicMedicalSciencesofChengduMedicalCollege,Chengdu610083,China
ObjectiveTo study the effect of the Benzothiazole derivative BD926on the proliferation and phagocytosis of murine bone marrow-derived immature dendritic cells (imDCs).MethodsImDCs were isolated and induced from murine bone marrow-derived mononuclear cells. The flow cytometry (FCM) was used to detect the effect of BD926on the cell survival, proliferation and phagocytosis of imDCs upon the stimulation of GM-CSF with the help of PE/Annexin V Apoptosis Detection Kit, CellTrace CFSE Cell Proliferation Kit and FITC-dextran.ResultsCompared with the PBS group, the cell proliferation of imDCs treated by BD926of25μM,5μM and1μM respectively were significantly reduced in a concentration-dependent manner (P<0.05), while the survival and phagocytosis of imDCs treated by BD926of the high, medium and low dosage respectively were not statistically different from those of imDCs in the PBS group (P>0.05).ConclusionThe Benzothiazole derivative BD926can suppress the proliferation of imDCs stimulated by GM-CSF in vitro, and it has no obvious effect on the survival and phagocytosis of imDCs.
Benzothiazole derivative; Immature dendritic cells; cell proliferation; Phagocytosis; Apoptosis
http://kns.cnki.net/kcms/detail/51.1705.R.20170901.1059.014.html
10.3969/j.issn.1674-2257.2017.04.011
國家自然科學基金資助項目(No: 81202363);國家級大學生創新創業訓練計劃項目(No:201513705005);發育與再生四川省重點實驗室研究基金(No:SYS16-002)
:王衍堂,E-mail: yt-wang@hotmail.com
R392.5
A
△

