轉錄組分析棒狀鏈霉菌F613-1高產克拉維酸的分子基礎
覃榮活付加芳宗工理王志宇曹廣祥
(1. 濟南大學山東省醫學科學院醫學與生命科學學院,濟南 250022;2. 山東省醫藥生物技術研究中心,濟南 250062)
轉錄組分析棒狀鏈霉菌F613-1高產克拉維酸的分子基礎
覃榮活1,2付加芳2宗工理2王志宇2曹廣祥1,2
(1. 濟南大學山東省醫學科學院醫學與生命科學學院,濟南 250022;2. 山東省醫藥生物技術研究中心,濟南 250062)
旨在探究S. clavuligerus工業菌株高產克拉維酸(CA)的分子基礎。采用轉錄組高通量測序,對比標準菌株和高產CA的工業菌株F613-1之間的基因轉錄水平差異,結合菌株表型差異進行綜合分析。結果表型比較顯示,F613-1在固體培養基中生長速度、氣生菌絲形態、孢子形成等方面與標準菌株存在差異。液體搖瓶培養中,菌體生長速度無明顯變化,但F613-1的糖消耗量顯著降低,同時CA產量比ATCC27064提高約11.7倍。轉錄組分析顯示,F613-1中CA基因簇及其途徑特異性調控基因的表達量顯著升高,其副產物全霉素基因簇的表達量顯著下降;CA合成原料精氨酸和3-磷酸甘油醛代謝相關基因的轉錄水平發生顯著變化,精氨酸合成代謝基因上調,而3-磷酸甘油醛分解代謝基因下調;ABC轉運系統中80多個基因的轉錄水平也發生明顯變化,其中42個顯著上調,38個顯著下調。工業生產菌株高產克拉維酸的主要原因是CA基因簇及其調控基因表達量的升高、相關副產物基因簇的沉默及CA合成原料精氨酸和3-磷酸甘油醛的積累。
棒狀鏈霉菌;工業菌株;轉錄組;克拉維酸
克拉維酸(Clavulanic acid,CA)是一種高效的β-內酰胺酶抑制劑,廣泛應用于臨床治療β-內酰胺類抗生素耐藥菌的感染[1]。棒狀鏈霉菌(Streptomyces clavuligerus)是CA的工業生產菌株,但是S. clavuligerus除合成CA外同時也合成頭霉素C、全霉素和多種5S克拉維烷類物質,其中克拉維烷和CA具有共同的前期合成途徑,與CA競爭前體物質[2],這些副產物不僅影響CA產量的提高同時也增加了純化工藝的難度。
S. clavuligerus ATCC27064的基因組草圖已經完成測序[3,4],CA的生物合成途徑和基因簇也已基本闡明[5-7]。S. clavuligerus中3個基因簇與CA合成有關,分別是CA基因簇(CA gene cluster)、克拉維烷基因簇(Clavam gene cluster)和旁系同源基因簇(Paralogue gene cluster),CA基因簇和克拉維烷基因簇位于基因組,而旁系同源基因簇位于pSCL4質粒[8]。CA基因簇中ceaS2、bls2、pah2、cas2、oat2、oppA1、oppA2、cad、cyp、fd、gcas、orf12和orf16,克拉維烷基因簇中cas1和旁系同源基因簇中ceaS1、bls1、pah1、oat1都參與了CA的合成,cas1、ceaS1、bls1、pah1和oat1是CA基因簇中相應基因的同源基因[9]。
CA合成分為早期途徑和晚期途徑,早期途徑以精氨酸和3-磷酸甘油醛(G3P)為起始原料,在Ceas1/Ceas2、Bls1/Bls2、Pah1/Pah2、Cas1/Cas2等酶的作用下形成中間體克拉維胺酸(Clavaminic acid),晚期途徑在Gcas、Cad、Cyp和Fd等酶的作用下將克拉維胺酸轉化為CA[9]。克拉維胺酸是CA和克拉維烷合成途徑的分支點,部分克拉維胺酸在Gcas的催化下進入CA晚期途徑,另一部分克拉維胺酸在Cvm1等克拉維烷合成酶的催化下形成多種5S克拉維烷產物[2]。CA基因簇上游緊挨著頭霉素C基因簇,研究顯示頭霉素C基因簇中ccaR編碼一個途徑特異性調控因子CcaR,正調控CA合成的早期途徑基因ceas2、bls2、pah2和cas2,以及調控基因claR,而claR正調控晚期途徑基因oppA1、cad和cyp[10,11]。
S. clavuligerus F613-1是CA的工業生產菌株,在發酵罐中CA發酵水平達到為4.87 g/L[12]。我們前期完成了F613-1菌株的全基因組測序[13],對全基因組測序數據比較分析顯示:與標準菌株ATCC27064相比,F613-1丟失了pSCL1、pSCL2和pSCL3等3個質粒,以及pSCL4質粒的1.1 Mb DNA序列,但是CA基因簇、克拉維烷基因簇和旁系同源基因簇中不存在大規模的基因突變和缺失現象,僅存在數個SNP,這些SNP可能不是F613-1高產CA的主要原因。本研究擬通過轉錄組測序比較分析F613-1和ATCC27064在轉錄水平的差異,分析CA合成原料精氨酸及G3P代謝相關基因、CA及其多種副產物合成及調控相關基因,以及ABC轉運系統基因的變化情況,以期在轉錄水平闡明F613-1高產CA的分子機制,為進一步通過基因工程方法提高工業菌株CA產量提供依據。
1 材料與方法
1.1 材料
1.1.1 菌株 S. clavuligerus工業生產菌株F613-1和標準菌株ATCC27064。
1.1.2 培養條件 固體培養:將孢子涂布于BSCA培養基(含1.5%麥芽提取物、0.3%胰蛋白胨、0.4%葡萄糖、2%瓊脂粉,pH7.5)上,25℃培養10 d收集孢子。液體發酵培養:按106個/mL的接種量將孢子接種于TSB(OXOID)培養基中,25℃、250 r/min培養48 h得到種子液,然后按5%接種量轉接至發酵培養基(2.0%大豆超細粉,1.2%玉米淀粉,0.5%酵母提取物,0.08%磷酸氫二鉀,pH8.0),25℃、250 r/min。
1.2 方法
1.2.1 固體培養表型比較 將F613-1和ATCC27064的孢子分別稀釋至106個/mL,各取10 μL孢子懸液劃線接種到同一個BSCA平板的兩側,25℃培養,觀察生長情況變化。
1.2.2 發酵液總糖、還原糖和生物量測定 取培養好的發酵液10 mL,12 000 r/min,4℃,離心10 min,沉淀去除殘液后稱重計算生物量,上清經0.22 μm過濾后進行糖含量檢測。濾液適當稀釋后直接進行還原糖含量檢測,總糖先經鹽酸完全水解,然后用氫氧化鈉中和,適當稀釋后測定糖含量。糖含量檢測采用DNS(二硝基水楊酸)比色法進行。
1.2.3 發酵液的HPLC檢測 取1.2.2中發酵液離心獲得的上清,經0.22 μm過濾后進行HPLC檢測。儀器為安捷倫1260,色譜柱為Diamonsil 5 μm C18(250×4.6 mm),柱溫40℃,檢測波長為230 nm,進樣量20 μL。流動相A為0.05 mol/L 磷酸二氫鈉(磷酸調pH至4.0),流動相B為等體積的甲醇和流動相A混合。洗脫條件:0-4 min為100% A;4-15 min,A由100%逐漸降至50%,B由0%逐漸提高到50%;15-18 min,保持50% A和50% B;流速1 mL/min。
1.2.4 轉錄組測序與分析 鏈霉菌總RNA采用TRIzol(Ambion)抽提法提取,檢驗合格后去除rRNA和片段化處理,然后逆轉錄合成cDNA,連接上接頭后進行PCR擴增并純化,構建PE100文庫。PE100文庫質檢合格后上機測序,高通量測序采用illumina Hiseq2500平臺(廣州瑞博生物)。原始測序數據先進行去接頭序列和低質量序列等處理獲得高質量數據,然后用參考基因S. clavuligerus ATCC27064(NZ_CM001015.1)進行比對。
轉錄組數據采用Tophat2軟件對測序數據覆蓋區域及覆蓋深度等做綜合評估[14];用Audics軟件對基因表達進行差異分析[15],通過差異倍數(|log2FoldChange|>1)和顯著水平(q-value<0.001)兩個水平挑選出樣本間差異表達的基因。KEGG代謝通路分析中差異基因的顯著性閾值設為P<0.05。
2 結果
2.1 F613-1和ATCC27064的固體培養表型比較
每隔24 h觀察并記錄F613-1和ATCC27064在BSCA平板上的生長情況,結果表明與ATCC27064相比,F613-1的生長速度和產孢速度較慢(圖1-A),在BSCA培養上不產色素而ATCC27064合成紫紅色的色素(圖1-B)。此外,F613-1氣生菌絲較為疏松,產孢(孢子為灰色)數量明顯減少(圖1-C和D),在培養后期易與培養基脫離。

圖1 F613-1與ATCC27064在BSCA培養基上培養表型對比圖
2.2 F613-1和ATCC27064的液體發酵情況比較
本研究分別收集F613-1和ATCC27064搖瓶發酵72、96、120和144 h 等4個時間點的發酵液,分別進行總糖、還原糖和生物量測定,并用HPLC檢測發酵液中CA和非CA物質的合成情況。結果(圖2-A)顯示,F613-1與ATCC27064在各時間點的生物量相近(數據未顯示),還原糖含量變化趨勢也無明顯差異,但F613-1的總糖消耗速度明顯降低,說明F613-1的糖利用和轉化能力可能優于ATCC27064。HPLC分析(圖2-B)顯示,F613-1發酵144 h時CA產量達到3.86 g/L,CA峰面積占總峰面積的67.68%,CA產量比ATCC27064提高了約11.7倍,CA峰面積占總峰面積的比例提高了約3.6倍,這表明F613-1的代謝流發生變化,使CA合成量增加而副產物合成量相對減少。
2.3 F613-1和ATCC27064整體轉錄水平比較
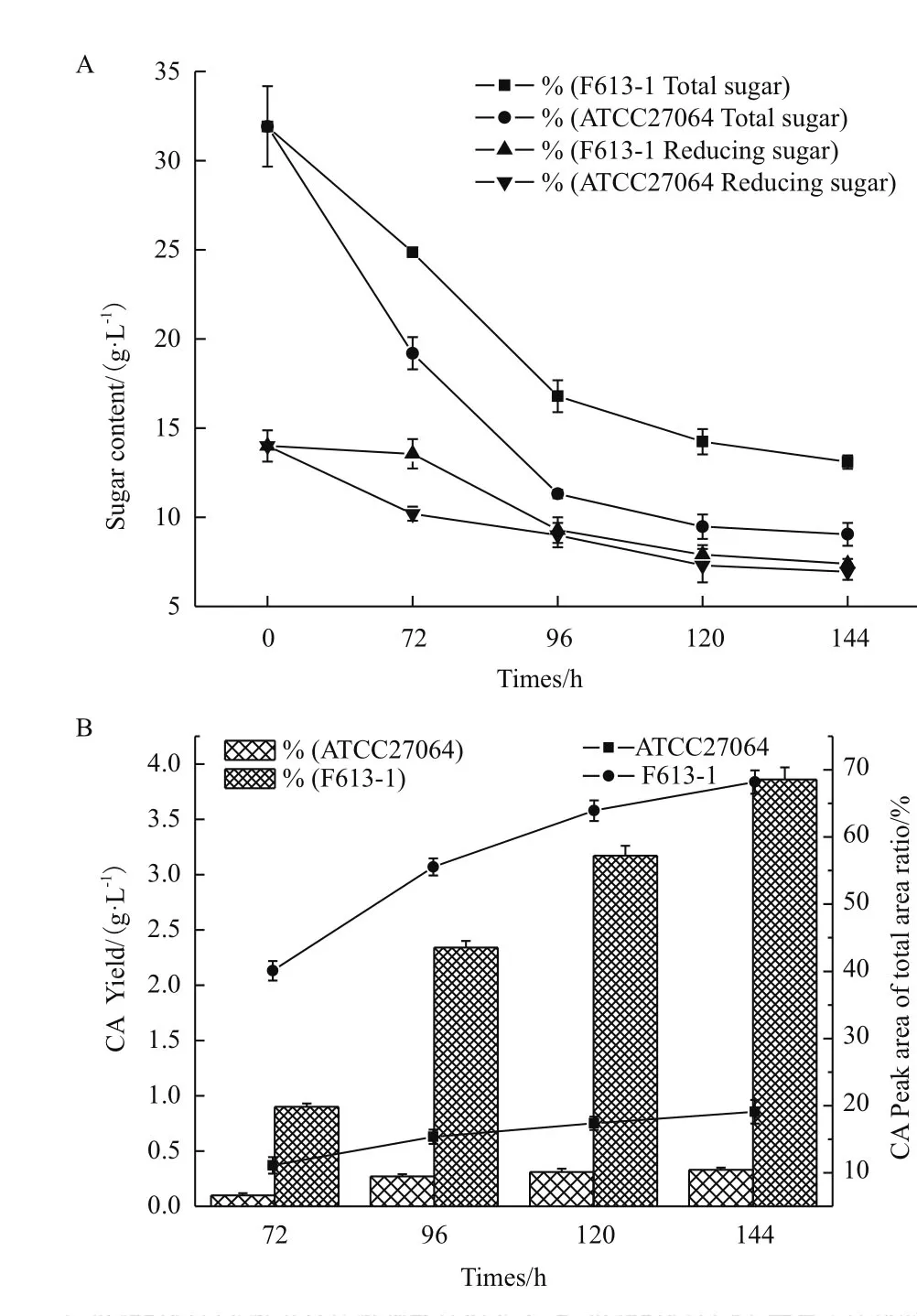
圖2 F613-1與ATCC27064搖瓶發酵參數對比圖
本研究收集了液體發酵72 h(CA合成高峰期)的F613-1和ATCC27064菌絲體,提取總RNA并構建文庫,用illuminaHiseq2500 測序平臺進行測序,測序方式為PE100。測序數據經過質量篩選,F613-1一共得到15 854 608個有效mRNA信息,基因覆蓋率為95.26%;ATCC27064一共得到17 798 172個有效mRNA信息,基因覆蓋率為96.11%。通過Audics軟件分析基因轉錄水平差異,從樣本間基因差異火山圖(圖3)可以看出ATCC27064和F613-1之間存在統計意義上的顯著差異。與ATCC27064相比較,F613-1菌株共有798個基因的表達量明顯發生改變,其中211個基因表達量顯著升高,587個基因表達量顯著下降,說明F613-1高產CA的變化可能是由部分基因的轉錄水平變化引起。
2.4 CA相關次級代謝產物合成基因簇的轉錄水平變化
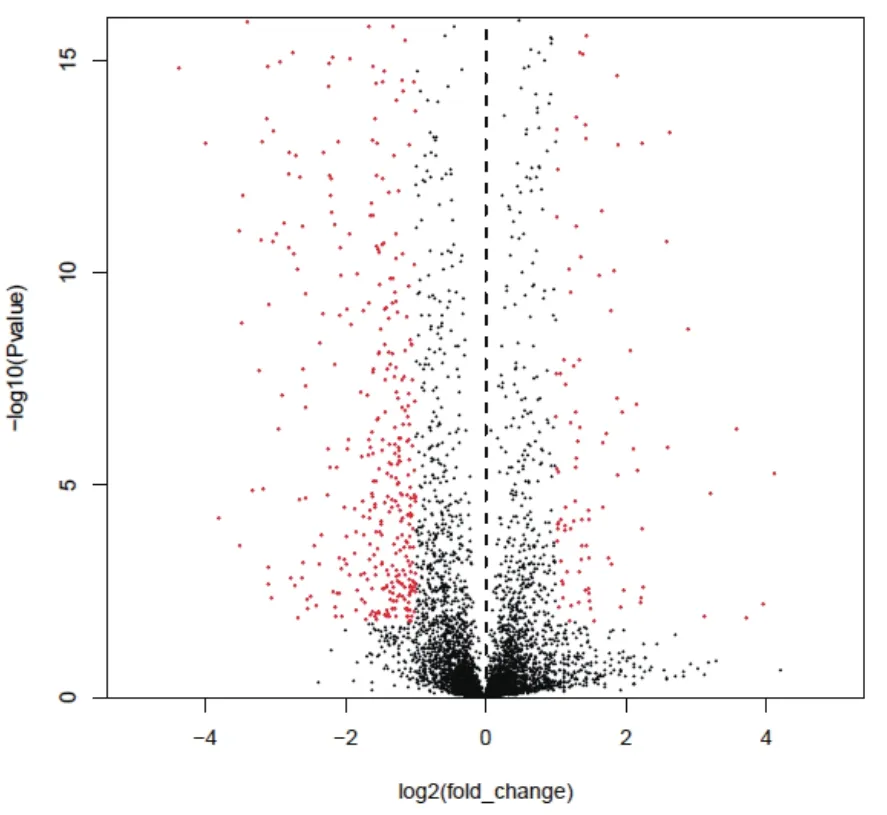
圖3 F613-1和ATCC27064樣本間基因差異分析火山圖
差異分析顯示,F613-1中CA基因簇的大部分基因都上調了2-4倍(表1),其中CA的途徑特異性正調控基因claR上調2.83倍,CA早期途徑的關鍵合成基因cas2、pah2和bls2,以及晚期途徑的關鍵合成基因fd、cyp和cad變化最為明顯,差異倍數達到3-4倍。此外,CA基因簇上游的頭霉素C基因簇同樣也整體上調了2-4倍,其中正調控頭霉素C和CA合成途徑的ccaR基因上調2.21倍(表1)。與此同時,旁系同源基因簇整體上調2-3倍,其中與CA合成相關的基因ceaS1、pah1、bls1、oat1均上調2-3倍,但克拉維烷正調控基因cvm7P無明顯變化,而克拉維烷基因簇整體轉錄水平也無明顯變化,這可能是F613-1大量合成CA而克拉維烷水平較低的原因。全霉素合成基因整體下調4-230倍,個別基因幾乎不表達(表1),已有研究表明全霉素是CA合成的競爭性途徑,說明全霉素基因簇沉默是F613-1高產CA的原因之一。總體來看,F613-1菌株中次級代謝產物合成基因簇的基因表達變化使得前體物質更多的流向CA合成途徑。
2.5 CA合成原料精氨酸和G3P代謝途徑基因的表達變化
精氨酸和G3P是CA合成途徑的兩個起始物質。基于KEGG生物學通路數據庫的生物通路富集分析發現,精氨酸生物合成通路中多個基因出現連續上調,包括從谷氨酸鹽到鳥氨酸(argA、argB、argC/ARG56、argD、argE、argJ),N-乙酰-L瓜氨酸到瓜氨酸(argE),及尿素循環途徑中從鳥氨酸到精氨酸(argI/ argF、argG、argA、argH)的基因(圖4-A)。這些基因轉錄水平的大幅上調可能使F613-1積累更多的精氨酸,促進CA合成。
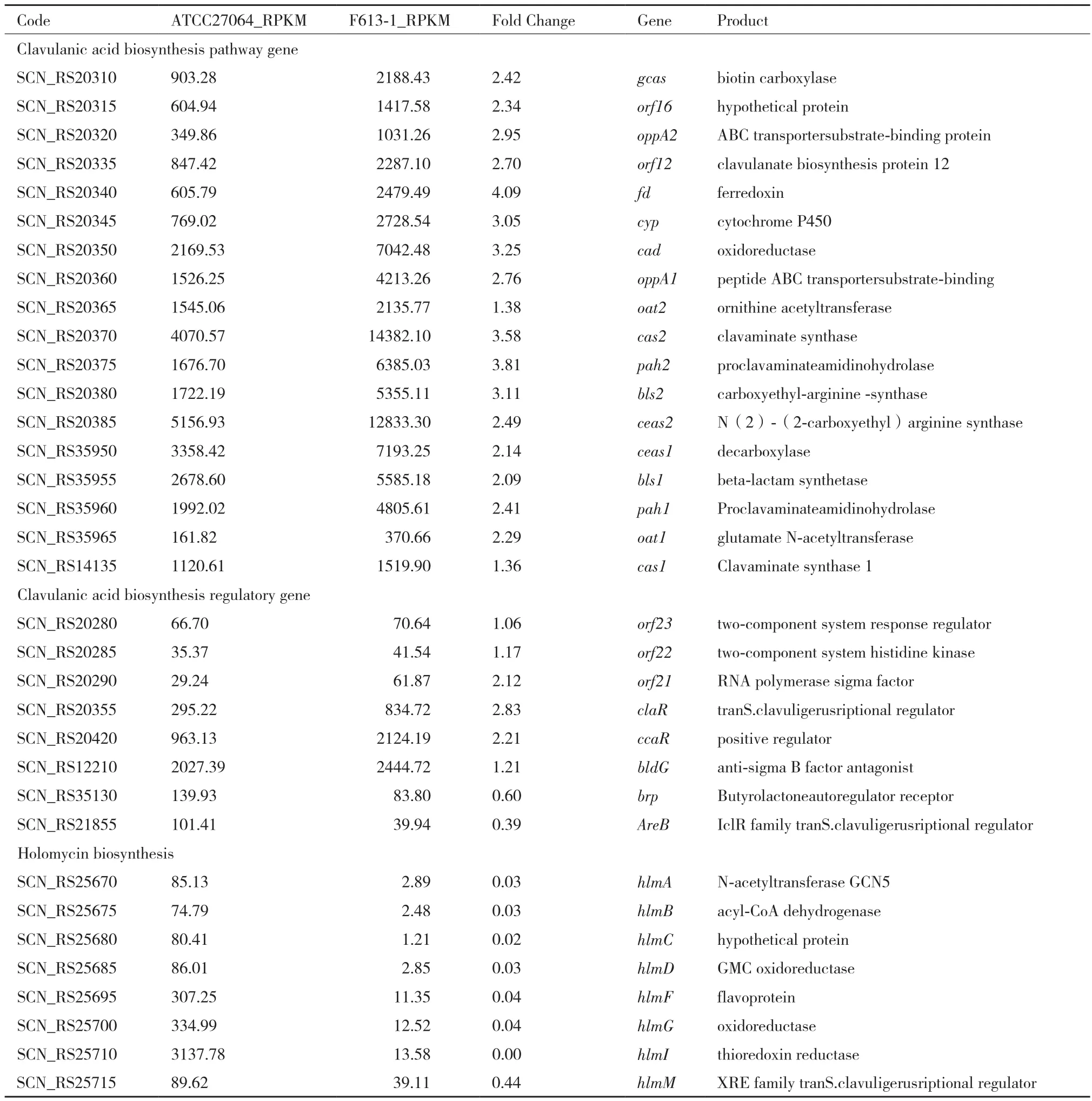
表1 F613-1與ATCC27064中CA合成基因,CA合成調控基因,全霉素合成基因的表達差異比較
G3P既是CA合成途徑的起始物質(圖4-B),同時也是糖酵解途徑和磷酸戊糖途徑的重要中間產物。分析顯示,F613-1菌株中糖酵解途徑中果糖1,6-二磷酸酶(fbp)下調2.3倍,減弱了果糖1,6-二磷酸的糖異生反應,有利于G3P合成;同時磷酸丙糖異構酶(tpiA)和G3P脫氫酶(gapA)表達上調,差異倍數分別為2.2倍和2.3倍,有利于甘油代謝產物轉化為G3P;此外丙酮酸脫氫酶復合酶系均下調2-4倍,使得糖酵解產物丙酮酸去路受阻(圖4-C);另一方面,檸檬酸循環途徑中檸檬酸合酶及亞基分別下調2.4倍和6.1倍,α-酮戊二酸脫氫酶E2組件(sucB)下調4.2倍,進一步減少了丙酮酸的消耗,有利于G3P積累(圖4-D)。
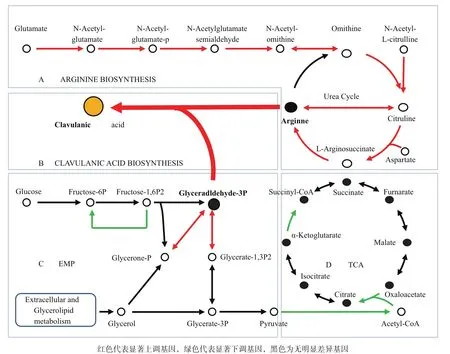
圖4 F613-1中精氨酸生物合成途徑基因及G3P代謝途徑基因表達差異圖
2.6 ABC轉運系統基因的表達變化
S. clavuligerus中存在眾多ABC轉運系統基因,分析顯示F613-1中有多達80個ABC轉運系統相關基因(ABC轉運蛋白、ABC轉運體透性酶、ABC轉運體底物結合蛋白、ABC轉運體ATP結合蛋白及ATP酶等)表達水平發生顯著變化,占總差異基因的10%,其中42個顯著上調,38個顯著下調。通過差異基因KEGG代謝通路分析,找到了12個功能明確的ABC轉運系統差異表達基因,其中包括負責氨基酸、糖、磷脂和金屬離子轉運的ABC轉運系統(圖5)。
3 討論
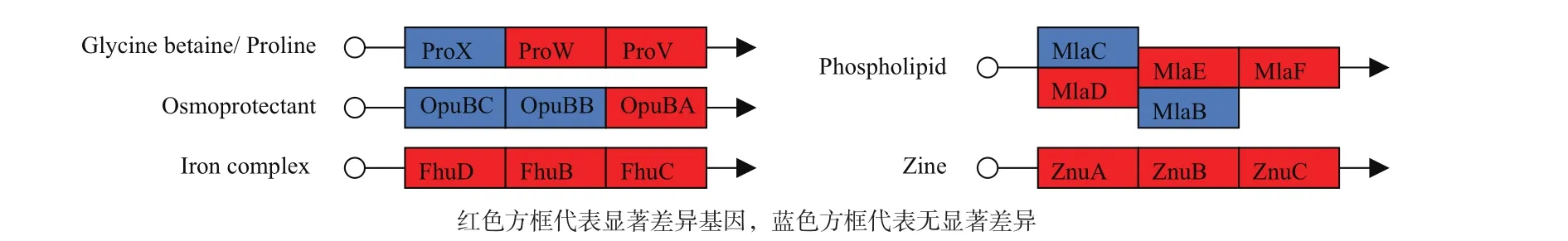
圖5 F613-1與ATCC27064部分ABC轉運系統基因表達變化情況及其功能示意圖
在S. clavuligerus工業菌株育種的早期,提高CA產量的方法主要以傳統的隨機誘變篩選為主,但隨著CA生物合成途徑的逐步闡明,越來越多的基因工程及反向代謝工程育種方法已經應用到S. clavuligerus菌株改造中。超表達CA合成通路基因及調控基因(如claR、ccaR、cas2等)是已被證明有效的提高CA產量的基因工程方法[16]。本研究的轉錄組數據顯示工業菌株F613-1中CA合成基因的表達量雖然整體上調,但是上調幅度并不是很大,特別是合成途徑幾個關鍵的基因如ceas1(上調2.14倍)、ceas2(上調2.49倍)和gcas(上調2.42倍)仍然存在進一步提升的空間。其中ceas1/ceas2編碼CA合成途徑的起始酶,催化精氨酸和G3P合成羧乙酰精氨酸[N2-(2-carboxyethyl)arginine][17],gcas是CA合成途徑的關鍵基因,該基因編碼N-甘氨酰-克拉維胺酸合成酶(N-glycyl-clavaminic acid synthetase),是CA前體克拉維胺酸轉入CA合成分支途徑的關鍵基因[18]。另一種提高CA產量的策略是阻斷副產物的生物合成途徑。CA、頭霉素C和克拉維烷都屬于β-內酰胺類次級代謝產物,三者合成途徑屬于競爭關系。研究表明敲除頭霉素C合成關鍵基因lat,使CA產量顯著提高[19-20]。本研究中F613-1的頭霉素C基因簇明顯上調,且lat上調幅度接近3倍,不利于CA的合成,因此在基因工程改造中可以敲除F613-1菌株的lat基因。克拉維烷是CA前體的直接競爭者,研究顯示調控基因cvm7P正調控克拉維烷的合成基因,對CA合成基因無影響[21],而F613-1中cvm7P轉錄水平無顯著變化,因此敲除F613-1菌株的cvm7P基因可能有助于提高CA產量。此外,研究表明全霉素的合成受精氨酸和CA途徑后期中間產物的影響,說明全霉素與CA也可能存在競爭關系[22],因此本研究中F613-1全霉素合成基因的沉默有可能會促進CA的合成。
CA的調控基因中除claR和ccaR變化比較明顯外,CA基因簇末端的一個編碼σ因子的基因(orf21)也上調了2.12倍(表1)。文獻報道顯示,orf21可上調CA早期合成基因ceas2和cas2及調控基因ccaR的轉錄[23]。文獻報道雙組分調控系統orf22/orf23可以正調控claR進而提高CA產量[24],但是本研究顯示F613-1中orf22/orf23的轉錄水平無顯著變化(表1)。此外,CA合成途徑的正調控因子bldG[25]也在F613-1中無顯著變化(表1)。因此,orf21、orf22/orf23和bldG等調控基因也可以作為提高F613-1 CA產量的改造靶點。
Townsend等[26]用同位素標記法研究了氨基酸對CA合成的影響,發現在CA合成過程中鳥氨酸和精氨酸比其它氨基酸更易被利用,且CA噁唑環結構直接來源于尿素循環。鳥氨酸和精氨酸是尿素循環中兩種重要的氨基酸,研究發現鳥氨酸可抑制S. clavuligerus中頭霉素C的合成[27]。本研究發現F613-1中由谷氨酸鹽起經鳥氨酸到精氨酸代謝途徑的基因整體表達上調,明顯有利于CA合成。由于谷氨酸成本更加經濟,因此在F613-1發酵中可以采用谷氨酸替代鳥氨酸和精氨酸作為CA前體添加劑。
甘油是CA工業發酵常用的添加前體[28],其衍生物G3P是CA合成的限速因素[29-30]。Medema等[31]通過轉錄組分析另一株CA高產菌株S. clavuligerus DS48802發現,與ATCC27064相比,DS48802中甘油攝取及轉化到G3P的基因明顯上調,同時三羧酸循環中順烏頭酸酶和檸檬酸合酶基因表達下降,這使得G3P積累并有利于流向CA合成途徑。本研究中F613-1的甘油耐受能力顯著高于ATCC27064,與G3P合成相關的基因上調而G3P分解基因下調進而積累G3P,與文獻報道一致,但是甘油轉運及代謝基因(包括甘油轉運蛋白基因RS04225/RS03030,甘油激酶基因RS04230/RS03035,α-甘油磷酸脫氫酶基因RS04235/RS21895)的轉錄水平無明顯變化。此外,F613-1中丙酮酸氧化降解途徑受阻雖然有利于G3P積累,但另一方面也減弱了細胞能量供應,影響F613-1的生長速度。因此,通過提高F613-1中甘油轉運和G3P合成基因的表達,將有可能改善F613-1生長狀況并進一步提高CA產量。
磷酸鹽、硫酸鹽、脂肪酸、Fe3+等也是發酵過程中影響CA產量的重要因素[32-33],這些物質都是ABC轉運系統的底物,F613-1中ABC轉運系統基因的表達差異可能影響S. clavuligerus對這些物質的吸收,進而促進CA的合成。此外,本研究還發現S. clavuligerus中唯一的溶菌酶基因(RS20110)在F613-1中上調了5倍,我們推測過量表達的溶菌酶可能增加細胞壁通透性,有利于細胞攝取營養物質進而促進CA合成。因此,改造工業菌株的營養物質轉運系統和細胞膜通透性也可能是提高CA產量的靶點之一。
4 結論
CA是S. clavuligerus的次級代謝產物,工業菌株F613-1具有較高的CA合成能力,并且克拉維烷等副產物合成量較低。本研究表明F613-1中CA生物合成途徑的合成基因及調控基因的整體上調是其高產CA的主要原因;精氨酸生物合成通路基因的顯著上調以及G3P代謝途徑基因的表達變化也直接促進了CA生成;全霉素合成基因的大幅下調可能使更多的前體物質流向CA合成途徑。此外,大量ABC轉運基因差異表達也可能對CA產生起到重要影響。
[1]Saudagar PS, Survase SA, Singhal RS. Clavulanic acid:A review[J]. Biotechnol Adv, 2008, 26(4):335-351.
[2]Jensen SE. Biosynthesis of clavam metabolites[J]. J Ind Microbiol Biotechnol, 2012, 39(10):1407-1419.
[3]Medema MH, Trefzer A, Kovalchuk A, et al. The sequence of a 1. 8-mb bacterial linear plasmid reveals a rich evolutionary reservoir of secondary metabolic pathways[J]. Genome Biol Evol, 2010, 2(1):212-224.
[4]Song JY, Jeong H, Yu DS, et al. Draft genome sequence of Streptomyces clavuligerus NRRL 3585, a producer of diverse secondary metabolites[J]. J Bacteriol, 2010, 192(23):6317-6318.
[5] Thirkettle JE, Baldwin JE, Edwards J, et al. The origin of the β-lactam carbons of clavulanic acid[J]. J Chem Soc, Chem Commun, 1997, 28(11):1025-1026.
[6]Miller MT, Bachmann BO, Townsend CA, et al. The catalytic cycle of beta-lactam synthetase observed by x-ray crystallographic snapshots[J]. Proc Natl Acad Sci U S A, 2002, 99(23):14752-14757.
[7]Caines ME, Sorensen JL, Schofield CJ. Structural and mechanistic studies on N(2)-(2-carboxyethyl)arginine synthase[J]. Biochem Biophys Res Commun, 2009, 385(4):512-517.
[8]Liras P, Gomez-Escribano JP, Santamarta I. Regulatory mechanisms controlling antibiotic production in Streptomyces clavuligerus[J]. J Ind Microbiol Biotechnol, 2008, 35(7):667-676.
[9]Song JY, Jensen SE, Lee KJ. Clavulanic acid biosynthesis and genetic manipulation for its overproduction[J]. Appl Microbiol Biotechnol, 2010, 88(3):659-669.
[10]Paradkar AS, Aidoo KA, Jensen SE. A pathway-specific transcriptional activator regulates late steps of clavulanic acid biosynthesis in Streptomyces clavuligerus. [J]. Mol Microbiol, 1998, 27(4):831-843.
[11] 朱碧銀, 洪文榮. 棒狀鏈霉菌控制抗生素合成的調節機制[J].中國抗生素雜志, 國外醫藥抗生素分冊, 2010, 31(6):271-278.
[12]Jin X, Cao G, Zhang X, et al. Studies on the formation and synthetic mechanism of related substance G in potassium clavulanate production[J]. Braz J Pharm Sci, 2015, 51(1):77-83.
[13]Cao G, Zhong C, Zong G, et al. Complete genome sequence of Streptomyces clavuligerus F613-1, an industrial producer of clavulanic acid[J]. Genome Announc, 2016, 4(5):e01020-16.
[14]Trapnell C, Pachter L, Salzberg SL. TopHat:discovering splice junctions with RNA-Seq[J]. Bioinformatics, 2009, 25(9):1105-1111.
[15]Gao D, Kim J, Kim H, et al. A survey of statistical software for analysing RNA-seq data[J]. Hum Genomics, 2010, 5(1):56-60.
[16]Hung TV, Malla S, Park BC, et al. Enhancement of clavulanic acid by replicative and integrative expression of ccaR and cas2 in Streptomyces clavuligerus NRRL3585[J]. J Microbiol Biotechnol, 2007, 17(9):1538-1545.
[17]Tahlan K, Anders C, Jensen SE. The paralogous pairs of genes involved in clavulanic acid and clavam metabolite biosynthesis are differently regulated in Streptomyces clavuligerus[J]. J Bacteriol, 2004, 186(18):6286-6297.
[18]Jensen SE, Paradkar AS, Mosher RH, et al. Five additional genes are involved in clavulanic acid biosynthesis in Streptomyces clavuligerus[J]. Antimicrob Agents Chemother, 2004, 48(1):192-202.
[19]舒楊, 何建勇, 田威, 等. 棒狀鏈霉菌中lat基因的置換與克拉維酸的選擇性生產[J]. 沈陽藥科大學學報, 2005, 22(1):62-66.
[20]Wang YH, Jing CF, Tao MF, et al. Effect of lat disruption on clavulanic acid production[J]. Acta microbiologica Sinica, 2005, 45(4):500-503.
[21]Tahlan K, Anders C, Wong A, et al. 5S clavam biosynthetic genes are located in both the clavam and paralog gene clusters in Streptomyces clavuligerus[J]. Chem Biol, 2007, 14(2):131-142.
[22]De LFA, Lorenzana LM, Martín JF, et al. Mutants of Streptomyces clavuligerus with disruptions in different genes for clavulanic acid biosynthesis produce large amounts of holomycin:possible crossregulation of two unrelated secondary metabolic pathways[J]. J Bacteriol, 2002, 184(23):6559-6565.
[23]Jnawali HN, Liou K, Sohng JK. Role of σ-factor(orf21)in clavulanic acid production in Streptomyces clavuligerus NRRL3585[J]. Microbiol Res, 2011, 166(5):369-379.
[24]Song JY, Kim ES, Kim DW, et al. A gene located downstream of the clavulanic acid gene cluster in Streptomyces clavuligerus ATCC 27064 encodes a putative response regulator that affects clavulanic acid production[J]. J Ind Microbiol Biotechnol, 2009, 36(2):301-311.
[25]Bignell DR, Tahlan K, Colvin KR, et al. Expression of ccaR, encoding the positive activator of cephamycin C and clavulanic acid production in Streptomyces clavuligerus, is dependent on bldG[J]. Antimicrob Agents Chemother, 2005, 49(4):1529-1541.
[26]Townsend CA, Ho MF. Biosynthesis of clavulanic acid:origin of the C5 Unit[J]. J Am Chem Soc, 1985, 107(4):1065-1066.
[27] Romero J, Liras P, Martin JF. Utilization of ornithine and arginine as specific precursors of clavulanic acid[J]. Appl Environ Microbiol, 1986, 52(4):892-897.
[28]Ser HL, Law JW, Chaiyakunapruk N, et al. Fermentation conditions that affect clavulanic acid production in Streptomyces clavuligerus:a systematic review[J]. Front Microbiol, 2016, 7(856):522.
[29]Ives PR, Bushell ME. Manipulation of the physiology of clavulanic acid production in Streptomyces clavuligerus[J]. Microbiology, 1997, 143(Pt 11):3573-3579.
[30]Khaleeli N, Li RF, Townsend CA. Origin of the β-Lactam carbons in clavulanic acid from an unusual thiamine pyrophosphatemediated reaction[J]. J Am Chem Soc, 1999, 121(39):9223-9224.
[31]Medema MH, Alam MT, Heijne WH, et al. Genome-wide gene expression changes in an industrial clavulanic acid overproduction strain of Streptomyces clavuligerus[J]. Microb Biotechnol, 2011, 4(2):300-305.
[32]Large KP, Ison AP, Williams DJ. The effect of agitation rate on lipid utilization and clavulanic acid production in Streptomyces clavuligerus[J]. J Biotechnol, 1998, 63(2):111-119.
[33] 蔣順進, 楊亞勇, 王惠青. 克拉維酸發酵工藝的優化研究[J].中國抗生素雜志, 2004, 29(6):335-337.
(責任編輯 朱琳峰)
Characterization of Clavulanic Acid High-yield Streptomyces clavuligerus Industrial Strain by Transcriptome Analysis
QIN Rong-huo1,2FU Jia-fang2ZONG Gong-li2WANG Zhi-yu2CAO Guang-xiang1,2
(1. School of Medicine and Life Sciences,University of Jinan-Shandong Academy of Medical Sciences,Ji’nan 250022;2. Shandong Medicinal Biotechnology Center,Ji’nan 250062)
This work aims to explore the molecular mechanism of clavulanic acid(CA)high-yield Streptomyces clavuligerus industrial strain. Transcriptome high-throughput sequencing was performed to compare the differential gene expressions between standard strain ATCC27064 and high-yield industrial strain F613-1,and comprehensive analysis was carried out combined with the phenotypic differences between them. The phenotypic results showed that F613-1 grew differently in growth rate,aerial mycelium morphology and spore formation in solid medium,compared with the standard strain. In the liquid culture,the growth rate of the two strains demonstrated no difference,but the sugar consumption of F613-1 significantly decreased,and the CA yield was 11.7 times higher than that of ATCC27064.Transcriptome analysis indicated that the expressions of both CA cluster genes and pathway-specific regulatory genes significantly increased;while the expressions of holomycin(CA by-product)cluster genes significantly decreased. On the other hand,the transcriptional levels of genes associated with arginine and glyceradldehyde-3P(raw materials for CA synthesis)metabolic pathways changed significantly,i.e.,up-regulated for arginine and down-regulated for glyceradldehyde-3P. Besides,the expressions of over80 genes involved in ABC transport system obviously changed,and 42 remarkably up-regulated and 38 down-regulated. The main reason of F613-1 highly produces clavulanic acid possibly lies in the increased transcription of CA cluster genes and relative regulatory genes,the silence of cluster genes involved in CA by-products,and the accumulation of arginine and alyceradldehyde-3P.
Streptomyces clavuligerus;industrial strain;transcriptome;clavulanic acid
10.13560/j.cnki.biotech.bull.1985.2017-0275
2017-04-07
山東省自然科學基金項目(ZR2016CP04),山東省醫學科學院醫藥衛生科技創新工程(201604)
覃榮活,男,碩士,研究方向:微生物與生化藥物;E-mail:qinronghuo@139.com
曹廣祥,男,副研究員,研究方向:微生物與生化藥物;E-mail:caozhong0402@163.com

