實時熒光定量PCR檢測急性髓系白血病miR?125b的表達及臨床應用
王語欣 楊冬琴 周靜東 林江 姚東明 楊靜 錢震 楊磊 錢軍★
實時熒光定量PCR檢測急性髓系白血病miR?125b的表達及臨床應用
王語欣1楊冬琴1周靜東1林江2姚東明2楊靜1錢震1楊磊1錢軍1★
目的采用實時熒光定量聚合酶鏈反應(real?time quantitative polymerase chain reaction,qPCR)法檢測急性髓系白血病(acute myeloid leukemia,AML)中微小 RNA?125b(microRNA?125b,miR?125b)轉錄本含量,初步評價其在AML臨床診斷中的意義。方法建立擴增miR?125b轉錄本的SYBR Green I染料法qPCR,對miR?125b轉錄本克隆質粒進行擴增,評價其在AML診斷中的特異性、重復性和靈敏性。并對69例AML患者的骨髓單個核細胞標本進行初步檢測并評價其臨床相關性。結果該方法能定量檢測骨髓標本中miR?125b的表達水平,熔解曲線呈單峰,在108~103copies/μL范圍內有良好的線性關系(R2=0.999)并且檢測重復性良好。結果顯示69例AML患者中miR?125b表達水平明顯高于25例對照組,差異有顯著統計學意義(P=0.001)。在初發AML的不同亞型中,M3型的miR?125b表達水平高于其他亞型,差異有統計學意義(P<0.05)。miR?125b表達水平與非M3型AML患者的年齡、性別、外周血白細胞計數、血小板計數、血紅蛋白含量、FAB分型、核型分組之間均無相關性(P>0.05)。4例初診AML患者在獲得完全緩解后miR?125b表達水平均較治療前有所降低。結論所建立的實時熒光定量PCR方法能敏感、特異地檢測骨髓單個核細胞標本中miR?125b的表達水平,為進一步臨床應用研究奠定了方法學基礎。miR?125b異常高表達是AML中的一個常見分子事件,檢測其表達可能有助于AML患者的輔助診斷和疾病狀態監測。
實時熒光定量PCR;miR?125b;急性髓系白血病
急性髓系白血病(acute myelocytic leukemia,AML)是起源于髓系祖細胞的一類造血系統惡性克隆性疾病。其表現為白細胞在骨髓等造血組織中大量增殖,使正常造血功能混亂,導致兇險的感染、出血、器官浸潤等,嚴重危害人類生命健康。微小RNA(microRNA,miRNA)廣泛存在于從線蟲到人類的多種真核生物中,近年來因發現其參與多種重要生物學過程如調控個體發育、細胞代謝、增殖、分化和凋亡等而備受關注[1?2]。miR?125b 是miR?125家族成員之一,大量研究表明miR?125b功能多樣,在實體腫瘤中既可起抑癌基因的作用,也可以起促癌基因的作用[3?5],miR?125b 在多種血液系統惡性腫瘤中表達異常,在白血病的發生和發展中起到十分重要的作用。比如miR?125b在伴有染色體異常的骨髓異常增生綜合癥、AML和急性淋巴細胞性白血病中異常高表達[6?8];miR?125b可通過抑制多種靶基因加速誘導AML發生、發展等[9]。因此,研究結果提示miR?125b與白血病發病機制關系密切,具有非常重要的臨床意義和應用前景。而尋找一種靈敏度高、操作簡便且成本低廉的檢測方法是目前miR?125b應用于臨床研究亟需解決的問題。本研究采用SYBR Green I實時熒光定量 PCR(real?time quantitative polymerase chain reaction,qPCR)技術檢測 miR?125b在 AML患者骨髓標本中的表達水平,初步探討miR?125b在AML臨床診斷和預后判斷中的意義。
1 材料與方法
1.1 研究對象
69例AML患者均來自江蘇大學附屬人民醫院接受住院治療的初診病例,所有患者診斷分型按照法、美、英分型系統(French?American?British classification systems,FAB)和 WHO 2008版標準[10?11];其中 AML 正常核型 24 例、AML 伴t(8;21)6例、AML伴t(15;17)14例、AML伴+8染色體異常3例、AML伴?5/5q?染色體異常1例、AML伴復雜核型9例、其他核型類型9例、無資料3例。FAB分型中M1型5例、M2型27例、M3型14例、M4型15例、M5型8例。對照組25例為非惡性血液病患者(缺鐵性貧血及免疫性血小板減少性紫癜)。本研究經醫院倫理委員會批準,所有研究對象均已簽署知情同意書。
1.2 方法
1.2.1 骨髓單個核細胞(bone marrow mononucle?ar cells,BMMNCs)的分離、RNA提取和逆轉錄
全部患者均于初診時抽取骨髓10 mL,肝素抗凝,用Ficoll密度梯度離心法分離BMMNCs,應用mirVana miRNA試劑盒提取總RNA(Ambion,美國),經紫外分光光度法測定計算提取的總RNA含量及濃度,-80℃保存備用。逆轉錄總體系共20μL,含蒸餾水 14μL、緩沖液 4μL、RNA 1μL、逆轉錄酶 1μL(MiScript Reverse Transcription Kit,Qiagen公司,catalog no.218061)。反應條件為:① 37℃1 h,②95℃5min,隨后4℃保持。
1.2.2 qPCR
引物設計采用Primer Premier 5.0軟件,miR?125b 引物序列上游為 5′?CCCTGAGACCCTA?ACTTGTG?3′,下游引物為miRNA通用下游引物。U6作為內參管家基因,其上游引物為5′?GT?GCTCCCTGCTTCGGCAGCACATATAC?3′,下游引物為 5′?AAAAATATGGAACGCTTCACGAAT TTG?3′,引物由上海華大基因科技有限公司合成。反應在ABI 7500擴增儀(ABI,美國)上進行,擴增條件為94℃預變性15min,94℃變性15 s、55℃退火30 s、70℃延伸30 s,共40個循環,熔解曲線程序為 95℃ 15 s、60℃ 60 s、95℃ 15 s、60℃ 15 s。選取miR?125b與U6表達ΔCT值最小的1例對照標本作為對照。miR?125b表達采用如下公式:NmiR ?125b=(EmiR ?125b)△ CTmiR ?125b(control?sample)÷(EU6)△CTU6(control?sample),PCR 擴增效率 E=10(?1/slope);ΔCT指對照與標本之間miR?125b和U6循環閾值(CT)值的差異。
1.2.3 標準曲線的制作
重組miR?125b質粒作為陽性模板:用凝膠回收試劑盒(Axygen,美國)將擴增產物純化回收,miR?125b全序列與pMD?19?T克隆載體(Takara,日本)連接過夜重組載體,隨后重組質粒轉化,通過質粒DNA小量試劑盒(Axygen,美國)提取質粒,測序鑒定(上海華大基因科技有限公司);從108copies/μL開始進行10倍稀釋,建立陽性模板梯度,進行qPCR擴增檢測。擴增后根據擴增曲線設定統一閾值,然后根據其濃度及各濃度對應的Ct平均值繪制標準曲線。
1.2.4 統計學分析
應用SPSS 20.0軟件進行統計學分析,分類變量之間的差異統計采用卡方檢驗或Fisher確切概率法;連續性變量之間的差異統計使用Kruskal?Wallis(多組間比較)或Mann?WhitneyU檢驗(兩組間比較)。miR?125b表達在AML中的診斷價值采用接收者操作特征曲線(receiver operating charac?teristic,ROC)及曲線下面積(area under the ROC curve,AUC)進行評價;所有分析均設定P值為雙側分布,以P<0.05為差異具有統計學意義。
2 結果
2.1 qPCR法的靈敏度、重復性、特異性和擴增效率
檢測miR?125b陽性模板的擴增曲線S型(圖1)。解離曲線分析顯示擴增產物為單一熔解峰。在 108~103copies/μL 的范圍內 Ct值和不同濃度miR?125b質粒呈良好線性關系,標準曲線相關度(R2)為 0.999,標準曲線的斜率(slope)為-3.422。制作成標準曲,重復性良好(圖1)。同樣,U6質粒陽性模板標準曲線重復性良好,R2=0.998,slope=-3.298。對不同濃度miR?125b質粒和U6質粒分別擴增6次,在108~103copies/μL的范圍內重復性良好(表1)。
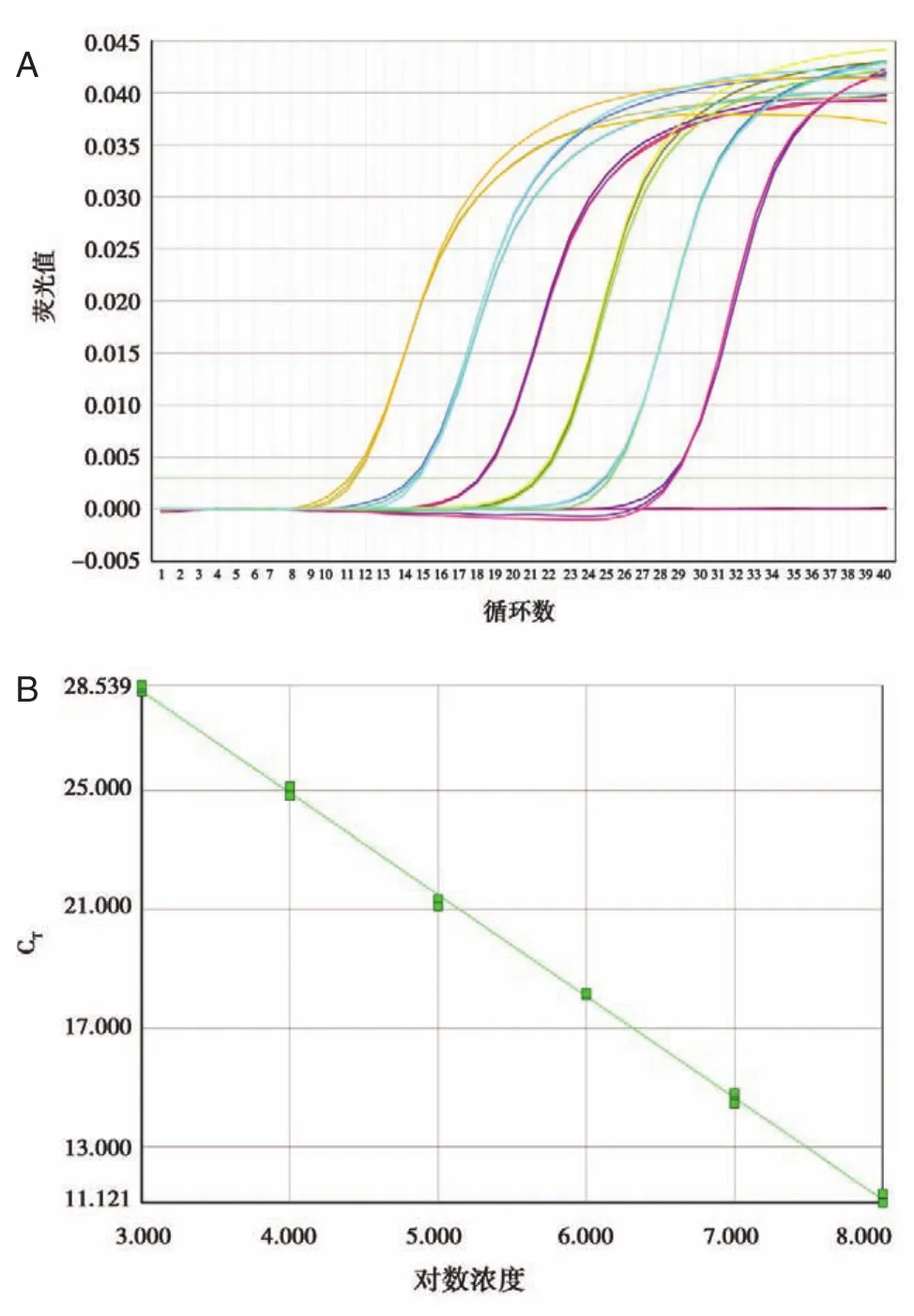
圖1 不同濃度miR?125b重組質粒qPCR熒光擴增結果及其標準曲線Figure 1 Fluorescence amplification and standard curve of recombinant miR?125b plasmid in different concentrations
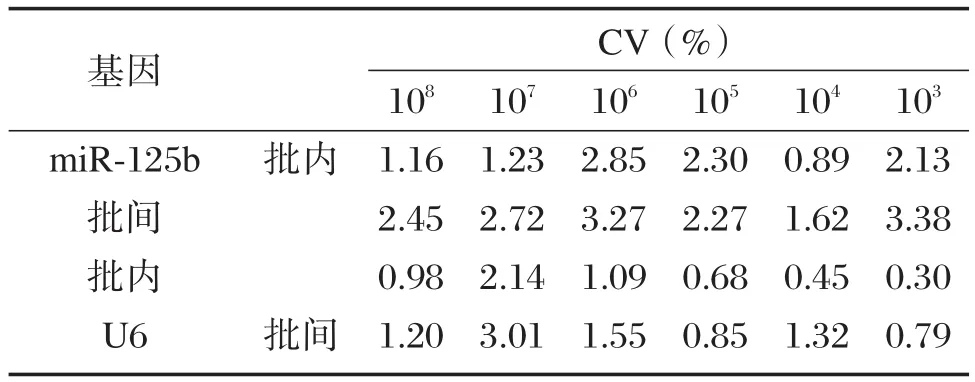
表1 不同濃度miR?125b和U6基因擴增6次的變異系數Table l Coefficient of variation of amplification of 6 times on different concentrations of miR?125b andU6genes
2.2 qPCR法檢測AML患者中miR?125b的表達情況
25例對照組和69例AML患者標本均可見擴增曲線,但表達程度不同(圖2)。25例對照的NmiR?125b為0.03%~100%(中位0.68%),AML患者標本的 NmiR?125b為 0.03%~6983.49%(中位 5.12%)。與對照組相比,AML患者miR?125b表達水平較對照組顯著上調(P=0.001)。進一步分析miR?125b在FAB分型中不同亞型的表達水平差異,發現miR?125b在各個亞型中的表達水平均高于對照組,而其中miR?125b在M3型中表達水平最高且差異有統計學意義(P<0.05)(圖3)。
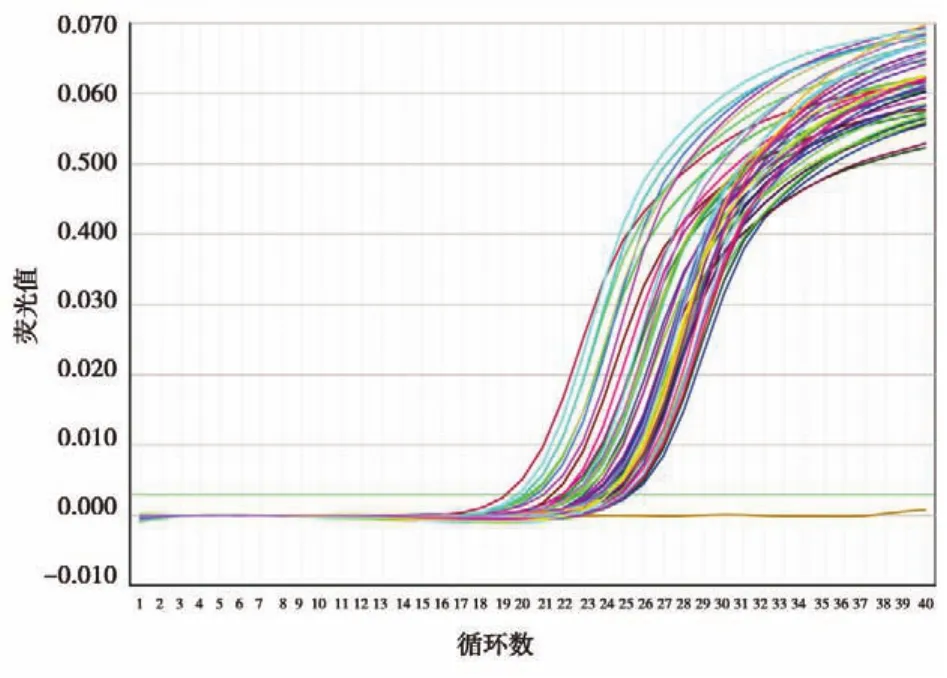
圖2 部分AML患者及對照組骨髓標本中miR?125b熒光定量PCR擴增曲線Figure 2 PCR amplification curve of miR?125b in part of bone marrow of AML patients and controls
2.3 miR?125b表達的鑒別診斷意義
應用ROC曲線評估miR?125b可否作為AML患者輔助診斷的一個潛在標記。結果顯示miR?125b表達水平可作為鑒別對照組與研究組的參考標志(AUC=0.723,95%置信區間為0.619~0.827,P=0.001)。在 miR?125b 表達水平為 4.7%時,診斷AML的敏感性和特異性分別為53%和92%(圖4)。
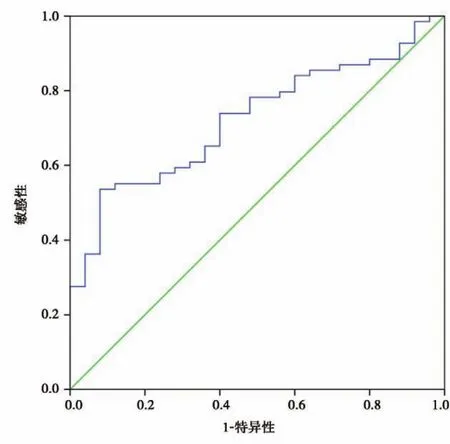
圖4 miR?125b表達水平輔助診斷AML的ROC曲線Figure 4 ROC curve analysis through using miR?125b for discriminating AML patients
2.4 miR?125b的表達與臨床參數相關性
本研究以ROC曲線cut?off值為界將總體AML患者分為miR?125b低表達組與高表達組。miR?125b高表達組與低表達組的性別、年齡、血小板計數差異均無統計學意義(P>0.05),而miR?125b高表達組的患者外周血白細胞計數、血紅蛋白量與原始細胞計數低于miR?125b低表達組(P<0.05)。miR?125b高、低表達組間的FAB分型、不同核型以及染色體危險程度分型比較差異均有統計學意義(P<0.05)。其中,在M1?M5不同亞型中,M3亞型中miR?125b高表達的頻率顯著高于其他亞型分組[93%(13/14)與44%(24/55),P<0.001]。在非M3型AML患者中,結果顯示miR?125b基因的表達水平與年齡、性別、血紅蛋白量、外周血白細胞計數、血小板計數、染色體分組等均無統計學意義(P>0.05)(表2)。
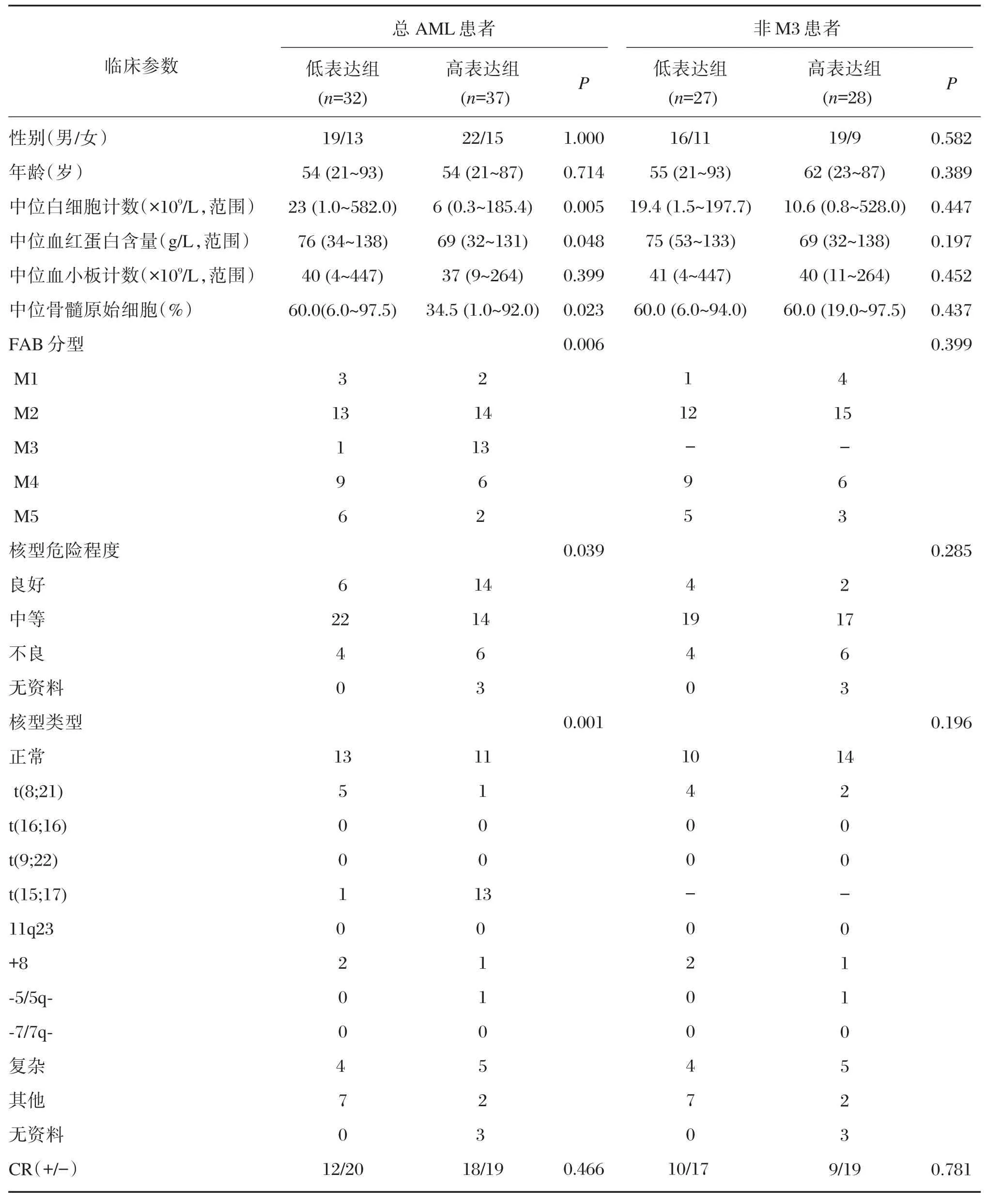
表2 總AML患者與非M3AML患者中miR?125b表達水平與臨床資料分析Table 2 Comparison of clinical characteristics of miR?125b expression between whole AML and non?M3 patients
2.5 miR?125b表達在AML隨訪中的意義
對miR?125b表達水平較高的4例初診AML患者的骨髓標本進行治療前后的檢測,結果顯示,患者病情獲得完全緩解后的miR?125b表達水平較治療前均明顯下降(圖5)。
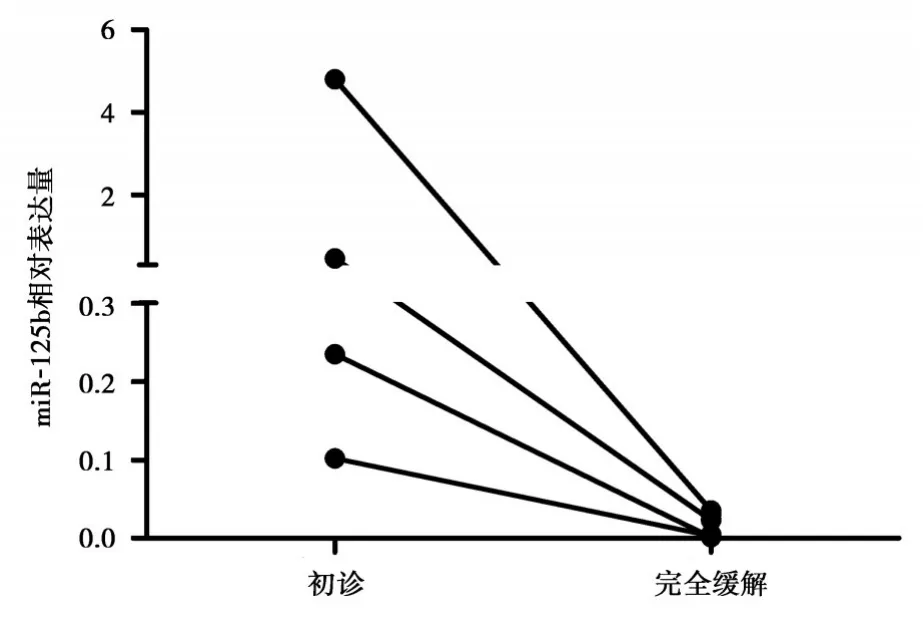
圖5 4例AML患者治療前后miR?125b表達的變化Figure 5 The levels of miR?125b expression of 4 patients in the AML patients before and after complete remission
3 討論
miRNAs轉錄后的調節功能影響著機體各種重要的生理和病理活動過程,其表達變化通常與各種疾病的發生發展密切相關。已有研究報道miR?125b參與白血病的發生發展,在伴有染色體異常和基因突變的AML中表達增高且其表達水平與疾病狀態有關[12?13]。這些重要研究提示miR?125b可能有助于今后AML的診斷與病情監測。
要將miRNAs作為疾病診斷的生物學標志物,需要建立標準而規范的提取方法和檢測方法。隨著miRNAs在腫瘤發生發展中的重要性被逐漸重視,miRNAs的檢測技術也取得了快速發展,主要包括有傳統的表達文庫克隆、Northern blot和逆轉錄聚合酶鏈反應(reverse transcription PCR,RT?PCR),還包括基因芯片技術、高通量測序等新型技術。其中RT?PCR以其特異性強、靈敏度高、快速便捷、價格低廉等優點,被認為是目前定量檢測miRNAs的金標準[14?15]。本研究運用 SYBR Green I染料標記技術建立的一種qPCR方法對骨髓標本中miR?125b進行定量檢測。該方法無需設計探針,引物設計相對容易,操作簡便,成本低廉,適用于推廣應用[16]。本研究結果表明SYBR Green I qPCR檢測miR?125b方法具有良好的特異性、重復性和靈敏性。本文采用相對定量法,可用于檢測骨髓標本中miR?125b的表達水平。數據分析顯示,69例AML患者中miR?125b表達水平高于對照組(P=0.001)。同時在AML不同亞型中miR?125b表達水平存在差異,其中M3型miR?125b表達水平遠高于其他亞型,提示miR?125b異常高表達與急性早幼粒細胞白血病(acute promyelocytic leukemia,APL)密切相關。這與 Zhang[17?18]、Li等[19]的研究結果一致。有報道稱,miR?125b可以干擾人類CD34+細胞分化,抑制白血病細胞NB4和HL60向末端(粒系和單核系)分化,揭示了miR?125b在APL抑制分化功能[6]。在非M3型AML患者中,miR?125b高低表達組與AML亞型、血液學參數和完全緩解率均無相關性(P>0.05)。ROC曲線分析表明miR?125b表達對于AML具有中等診斷價值。
同時,我們對4例AML患者進行了監測,發現緩解后miR?125b表達水平較治療前明顯下降,提示miR?125b表達可能作為一個分子標志用于疾病狀態的監測。但同時本研究病例數較少,ROC曲線分析顯示敏感性和特異性不高,因此用miR?125b診斷、鑒別診斷及評價疾病的預后仍需進一步研究。
綜上所述,本研究建立的SYBR Green I qPCR檢測miR?125b是一種簡便、可靠、準確、快速的高通量定量檢測方法,易于臨床實驗室推廣應用,有助于大樣本的臨床研究。miR?125b異常高表達是AML中的一個常見分子事件,檢測其表達可能有助于AML患者的輔助診斷和疾病狀態監測。
[1]Yates LA,Norbury CJ,Gilbert RJ.The long and short of microRNA[J].Cell,2013,153(3):516?519.
[2]Esquela?Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(4):259?269.
[3]Iorio MV,Ferracin M,Liu CG,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65(16):7065?7070.
[4]Huang L,Luo J,Cai Q,et al.MicroRNA?125b sup?presses the development of bladder cancer by targeting E2F3[J].Int J Cancer,2011,128(8):1758?1769.
[5]Li Q,Han Y,Wang C,et al.MicroRNA?125b pro?motes tumor metastasis through targeting tumor protein 53?induced nuclear protein 1 in patients with non?small?cell lung cancer[J].Cancer Cell Int,2015,15:84.
[6]Bousquet M,Quelen C,Rosati R,et al.Myeloid cell differentiation arrest by miR?125b?1 in myelodysplastic syndrome and acute myeloid leukemia with the t(2;11)(p21;q23)translocation[J].J Exp Med,2008,205(11):2499?2506.
[7]Sonoki T,Iwanaga E,Mitsuya H,et al.Insertion of microRNA?125b?1,a human homologue of lin?4,into a rearranged immunoglobulin heavy chain gene locus in a patient with precursor B?cell acute lymphoblastic leukemia[J].Leukemia,2005,19(11):2009?2010.
[8]Chapiro E,Russell LJ,Struski S,et al.A new recur?rent translocation t(11;14)(q24;q32) involving IGH@and miR?125b?1 in B?cell progenitor acute lym?phoblastic leukemia[J].Leukemia,2010,24(7):1362?1364.
[9]Enomoto Y,Kitaura J,Shimanuki M,et al.MicroR?NA?125b?1 accelerates a C?terminal mutant of C/EB?Palpha(C/EBPalpha?C(m))?induced myeloid leuke?mia[J].Int J Hematol,2012,96(3):334?341.
[10]Bennett JM,Catovsky D,Daniel MT,et al.Proposed revised criteria for the classification of acute myeloid leukemia.A report of the French?American?British Co?operative Group[J].Ann Intern Med,1985,103(4):620?625.
[11]Vardiman JW,Thiele J,Arber DA,et al.The 2008 revision of the World Health Organization(WHO)classification of myeloid neoplasms and acute leuke?mia:rationale and important changes[J].Blood,2009,114(5):937?951.
[12]Shaham L,Binder V,Gefen N,et al.MiR?125 in nor?mal and malignant hematopoiesis[J].Leukemia,2012,26(9):2011?2018.
[13]謝晶晶,陳捷,翁丹丹.微小R?125b在初發急性髓系白血病中的表達情況及臨床意義[J].中國衛生檢驗雜志,2016,26(10):1433?1435.
[14]王勤熙,姚見兒,顧國浩.microRNAs的定量分析技術及其應用[J].臨床檢驗雜志,2012,30(9):650?652.
[15]鄧開鳳,戴盛明.實時熒光定量PCR檢測血清/血漿microRNAs臨床應用前的準備[J].分子診斷與治療雜志,2015,7(3):211?216.
[16]葉燕,申嫻娟,鞠少卿.微小RNA檢測方法的研究進展[J].中華檢驗醫學雜志,2013,36(8):689?692.
[17]Zhang H,Luo XQ,Feng DD,et al.Upregulation of microRNA?125b contributes to leukemogenesis and in?creases drug resistance in pediatric acute promyelocytic leukemia[J].Mol Cancer,2011,10:108.
[18]Zhang H,Luo XQ,Zhang P,et al.MicroRNA pat?terns associated with clinical prognostic parameters and CNS relapse prediction in pediatric acute leukemia[J].PLoS One,2009,4(11):e7826.
[19]Li Z,Lu J,Sun M,et al.Distinct microRNA expres?sion profiles in acute myeloid leukemia with common translocations[J].Proc Natl Acad Sci USA,2008,105(40):15535?15540.
Detection and clinical application of miR?125b in acute myeloid leukemia by real?time fluorescence quantitative PCR
WANG Yuxin1,YANG Dongqin1,ZHOU Jingdong1,LIN Jiang2,YAO Dongming2,YANG Jing1,QIAN Zhen1,YANG Lei1,QIAN Jun1★
(1.Department of Hematology,Affiliated People's Hospital of Jiangsu University,Zhenjiang,Jiangsu,China,212002;2.Laboratory Center,Affiliated People's Hospital of Jiangsu University,Zhenjiang,Jiangsu,China,212002)
ObjectiveTo evaluate the method of real?time quantitative polymerase chain reaction(qPCR)for detecting miR?125b transcript in patients with acute myeloid leukemia(AML)and further investigate the characteristics and clinical implication of miR?125b in AML.MethodsThe reaction system and reaction condition of qPCR with SYBR Green I was established to detect the expression of miR?125b to evaluate its specificity,repeatability and sensitivity in AML diagnosis.Afterwards,the samples of bone marrow mononuclear cells from 69 AML patients were evaluated.ResultsThe method can detect the expressionlevel of miR?125b in AML patients.The melting curve showed a single peak,the PCR products was specific,a good linear relationship in the range of 108copies/μL to 103copies/μL(R2=0.999),and the detection was repeatable.The expression level of miR?125b in 69 AML patients was significantly higher than those in 25 controls(P=0.001).In different subtypes of AML,the expression level of miR?125b in M3 was higher than that in other subtypes,and the difference was statistically significant(P<0.05).There was no correlation between the expression ofmiR?125b and the age,gender,peripheralblood leucocytecounts,plateletcount,hemoglobincontent,FAB classifications and karyotypes(P>0.05)in non?M3 AML patients.The levels of miR?125b expression of 4 patients in the observation group decreased after complete remission.ConclusionsThe SYBR Green I qPCR for miR?125b was a sensitive,reliable quantitative assay,and it can be used in the diagnosis of AML and the disease therapy evaluation.The increased?expression of miR?125b may be a common molecular event in AML,and detecting its expression level could be used for auxiliary diagnosis and monitoring disease.
Real?time quantitative PCR;miR?125b;Acute myeloid leukemia
作者單位:1.江蘇大學附屬人民醫院血液科,江蘇,鎮江212002
2.江蘇大學附屬人民醫院中心實驗室,江蘇,鎮江212002
國家自然基金項目(81270630);江蘇省六大人才峰會項目(2015?WSN?115);鎮江市社會發展項目(SH2015058);江蘇大學臨床醫學科學發展基金會項目(JLY20140018)
★通訊作者:錢軍,E?mail:qianjun0007@hotmail.com