以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價綜述
馮劉欣 張抗懷 劉 娜 王 娜 康力敏 蔡 艷
以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價綜述
馮劉欣 張抗懷 劉 娜 王 娜 康力敏 蔡 艷
目的 對以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價研究進行總結探討。方法 利用Embase 和 Medline數據庫,遴選自2000年以來發表的相關文獻。結果 共4項研究納入分析,均使用決策分析模型比較急性冠狀動脈綜合征(ACS)患者傳統抗血小板治療(全部患者使用氯吡格雷、普拉格雷或替格瑞洛)與個體化抗血小板治療方案的成本-效果(效用)。個體化方案以高血小板活性(high on-treatment platelet reactivity,HTPR)為指標,HTPR患者使用普拉格雷或替格瑞洛,非 HTPR患者使用氯吡格雷。相比傳統方案,個體化抗血小板方案為優勢(dominant)或最具成本-效果方案。基線研究結果受藥物成本、心血管源性死亡率及HTPR患者比例等因素影響。結論相比傳統抗血小板治療,ACS患者以血小板活性為指導的個體化抗血小板治療具有更好的成本-效果(效用)。
氯吡格雷;普拉格雷;替格瑞洛;個體化抗血小板治療;血小板活性;成本-效果;急性冠狀動脈綜合征
二聯抗血小板治療(阿司匹林和一種P2Y12受體抑制劑)對急性冠狀動脈綜合征(ACS)患者和經皮冠狀動脈介入治療(PCI)術后患者預防缺血性事件發生具有重要臨床意義[1]。氯吡格雷是目前臨床應用最廣泛的口服P2Y12受體抑制劑,但30~40%患者對其低反應或無反應,即存在氯吡格雷抵抗現象[2]。此現象與患者基因差異、生活環境、種族、臨床病癥(高血壓、糖尿病、慢性腎病等)、藥物間相互作用等因素有關[3]。研究發現,血小板高反應性(high on-treatment platelet reactivity,HTPR)與PCI術后臨床缺血性不良反應事件(尤其為非致死性心肌梗死和支架血栓)發生有顯著性關聯[4]。
相比氯吡格雷,普拉格雷和替格瑞洛是新型P2Y12受體抑制劑,能克服氯吡格雷治療后的HTPR現象,并能有效降低缺血性事件發生率[5]。因此,以血小板活性指標為指導的抗血小板治療是一種可能的個體化抗血小板治療方案,患者可依據血小板活性高低選擇P2Y12受體抑制劑(氯吡格雷、普拉格雷或替格瑞洛)。但普拉格雷和替格瑞洛有潛在高出血風險,且尚處在專利保護期,其價格遠高于氯吡格雷仿制藥。此外,個體化治療方案將引入血小板活性測量成本,以上因素均可能對抗血小板治療方案的醫療成本及臨床效果帶來影響。因此,本研究旨在對以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價研究進行總結探討。
1 材料與方法
本研究通過Embase和Medline數據庫,查詢自 2000年以來發表的文獻,搜索關鍵詞包括“clopidogrel”“prasugrel”“ticagrelor”“platelet reactivity”“platelet function”“cost-effectiveness”和“QALY”。篩選原則為以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價研究,對研究目標人群、研究角度、主要臨床結果測量指標不做限定。
2 結果
共 4項研究符合遴選條件納入本研究綜述,每項研究的基線情況見表1。每項研究均通過構建決策分析模型(決策樹/Markov模型)模擬ACS患者的抗血小板治療方案,包括傳統抗血小板治療方案(全部患者使用氯吡格雷、普拉格雷、替格瑞洛)和個體化抗血小板治療方案。個體化治療方案中,每例患者均接受血小板活性測試,HTPR患者使用普拉格雷或替格瑞洛,非 HTPR患者使用氯吡格雷。直接醫療成本和增量成本效果比(incremental costeffectiveness ratio,ICER)是每項研究的主要結果評價指標。ICER主要為每避免一個不良反應事件增加的成本或每提高一個質量調整壽命年(quality-adjusted life-years,QALY)增加的成本。
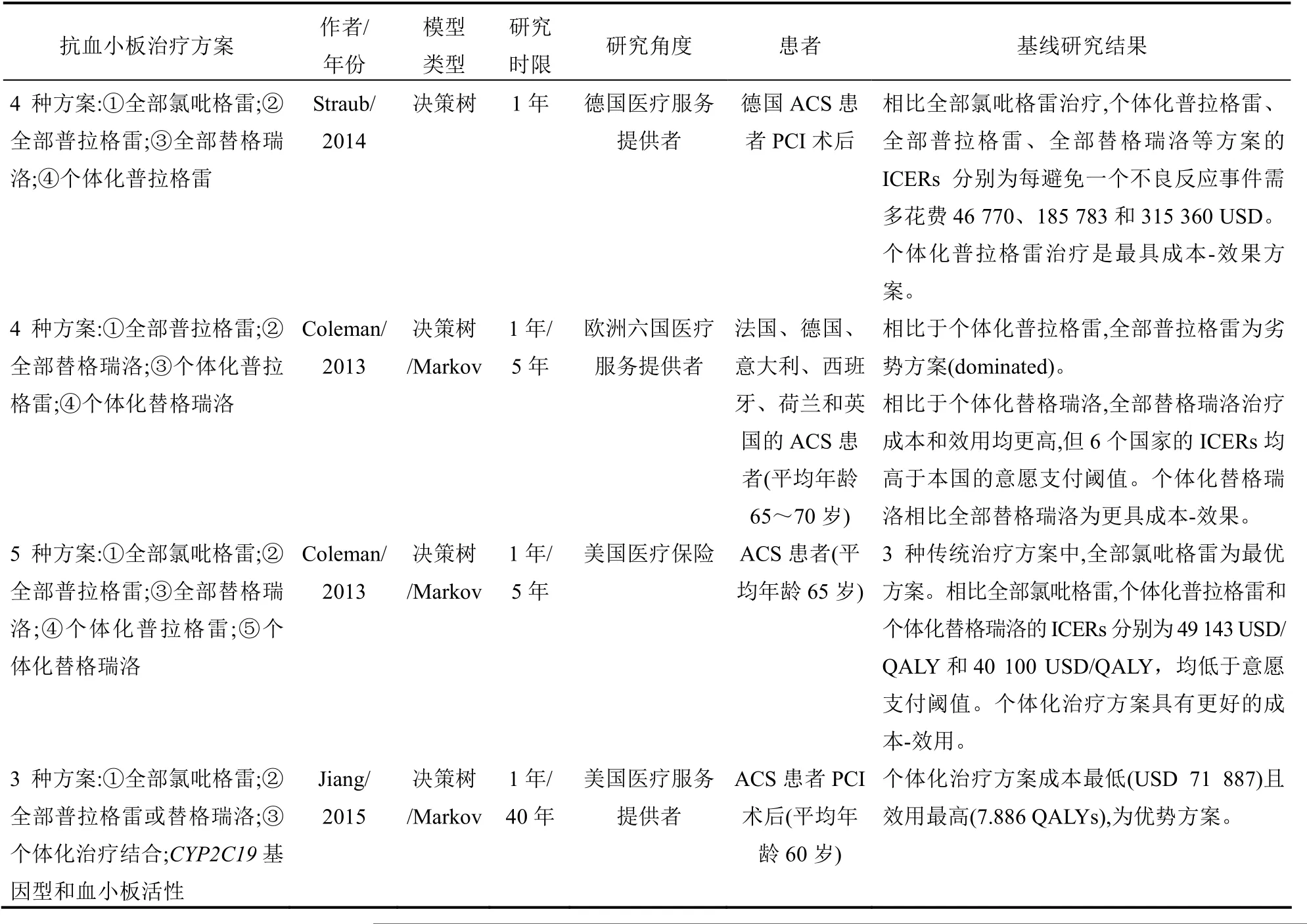
表1 以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價研究
Straub等[6]利用決策樹模型模擬了德國 ACS患者PCI術后的4種抗血小板治療方案,每種方案模擬10 000例患者,研究時限為1年。其中3種方案為全部患者使用氯吡格雷(75 mg/次,1次/d),全部患者使用普拉格雷(10 mg/次,1次/d),或全部患者使用替格瑞洛(90 mg/次,2次/d);另一種方案為個體化普拉格雷。在個體化方案中,每例患者利用Multiplate analyse進行血小板活性測試,HTPR患者使用普拉格雷,其余患者使用氯吡格雷。支架血栓、心血管源性病死及出血事件是主要的治療終點指標。直接醫療成本和不良反應事件發生總數是研究評價指標。基線結果發現,全部替格瑞洛方案的心血管源性病死人數最少,全部普拉格雷方案的支架血栓人數最少,個體化普拉格雷治療的出血人數最少。總體來說,全部氯吡格雷治療花費最低(1059 USD),但伴隨最多的不良反應事件總數(N=742)。相比全部氯吡格雷,個體化普拉格雷、全部普拉格雷、全部替格瑞洛的 ICER分別為每避免一個不良反應事件需增加成本46 770、185 783和315 360 USD。由于個體化普拉格雷每避免一個不良反應事件增加的成本最低,因此個體化普拉格雷治療的成本-效果最好。敏感性分析發現,不良反應事件處理的醫療成本越高,個體化普拉格雷的成本-效果越好。
Coleman等[7]利用決策分析模型開展了一項成本-效用分析,評價歐洲6國(法國、德國、意大利、西班牙、荷蘭和英國)ACS患者(平均年齡65~70歲)抗血小板治療方案。研究共模擬了4種抗血小板治療方案:兩種個體化治療(個體化普拉格雷和個體化替格瑞洛)和兩種傳統治療(全部患者使用普拉格雷10 mg/次,1次/d;全部患者使用替格瑞洛90 mg/次,2次/d)。在兩種個體化治療方案中,每個患者利用VerifyNow P2Y12進行血小板活性測試,HTPR患者使用普拉格雷或替格瑞洛,其余患者使用氯吡格雷。二聯抗血小板治療的臨床終點事件包括非致死性心肌梗死、非致死性卒中、出血、哮喘、病死。5年直接醫療成本和 QALYs是此研究的結果評價指標。6個國家的研究結果均表明,相比個體化普拉格雷,全部普拉格雷成本高效用低,為劣勢方案;相比個體化替格瑞洛,全部替格瑞洛治療效用高且成本高,但6個國家的ICER(全部替格瑞洛與個體化替格瑞洛)均高于本國的意愿支付(willingness-to-pay,WTP)閾值。因此,個體化替格瑞洛相比全部替格瑞洛方案更具成本-效果。單因素敏感性分析發現,基線結果的穩定性主要受替格瑞洛藥價及患者心血管源性病死率的影響。經10 000次Monte Carlo模擬的概率敏感性分析進一步支撐了此研究的基線結果,即個體化抗血小板治療方案(個體化普拉格雷和個體化替格瑞洛)相比傳統治療方案(全部普拉格雷和全部替格瑞洛)為優選方案。
Coleman等[8]進行了另外一項研究,研究人群為美國ACS患者(平均年齡65歲),研究角度為美國第三方醫療保險。此研究模型包括5種抗血小板治療方案:全部患者使用氯吡格雷(75 mg/次,1次/d)、全部患者使用普拉格雷(10 mg/次,1次/d)、全部患者使用替格瑞洛(90 mg/次,2次/d),及兩種個體化治療方案(個體化普拉格雷和個體化替格瑞洛)。兩種個體化方案中,每個患者也利用VerifyNow P2Y12進行血小板活性測試。臨床研究結果和成本-效用評價指標與上述歐洲6國研究一致。基線結果表明,全部替格瑞洛效用最高(3.478 QALYs)但成本最高(32 865 USD)。相比全部氯吡格雷,全部普拉格雷和全部替格瑞洛的ICER分別為96 261 USD/QALY和61 651 USD/QALY,均超過了研究的WTP閾值(50 000 USD/QALY)。因此,在3種傳統治療方案中,全部氯吡格雷為最優方案。相比全部氯吡格雷,個體化普拉格雷和個體化替格瑞洛的ICER(分別為49 143 USD/QALY和40 100 USD/QALY)均低于WTP閾值,所以兩種個體化治療方案具有更好的成本-效用。鑒于個體化替格瑞洛的 ICER低于個體化普拉格雷的ICER,個體化替格瑞洛在5種方案中屬于最具成本-效用的方案。單因素敏感性分析表明,如果替格瑞洛相對氯吡格雷的病死率比值比低于0.72或替格瑞洛的藥物成本低于2700 USD/年,全部替格瑞洛則變為最優方案。概率敏感性分析發現,相比全部氯吡格雷,個體化替格瑞洛、個體化普拉格雷、全部替格瑞洛、全部普拉格雷分別有 52%、40%、23%和2%的概率具有更好的成本-效用(使用WTP閾值50 000 USD/QALY)。
Jiang等[9]使用決策分析模型模擬了 ACS患者(平均年齡60歲)PCI術后三種抗血小板治療方案:全部患者使用氯吡格雷(75 mg/次,1次/d),全部患者使用新型P2Y12受體抑制劑(普拉格雷每次10 mg,1次/d,或替格瑞洛每次90 mg,2次/d),結合CYP2C19基因型和血小板活性兩個指標的個體化抗血小板治療。在個體化方案中,所有患者進行CYP2C19基因型檢測,非CYP2C19功能缺失型基因(CYP2C19*2-*8)攜帶者使用氯吡格雷(75 mg/次,1次/d)。中間型代謝者(攜帶一個功能缺失型基因)首先使用225 mg氯吡格雷,24~48 h內利用VerifyNow P2Y12對血小板活性進行測量。非HTPR的中間型代謝者將繼續使用225 mg氯吡格雷(1次/d),而 HTPR的中間型代謝者及弱代謝者(攜帶兩個功能缺失型基因)則使用新型P2Y12受體抑制劑(普拉格雷或替格瑞洛)。該研究中,每個患者先接受1年二聯抗血小板治療(決策樹模型中),臨床終點事件包括非致死性心肌梗死、非致死性卒中、心血管源性死亡及出血。1年后所有生存者進入Markov模型中,健康轉換狀態包括缺血性心臟病、心肌梗死、心肌梗死后及死亡,循環周期為1年,循環期限為40年。此研究以美國醫療服務提供者為研究角度,將直接醫療成本和QALY作為成本-效用評價指標。基線結果顯示:相比兩個傳統治療方案,以CYP2C19基因型和血小板活性為指導的個體化治療效用最高(7.886 QALYs)且成本最低(USD 71 887),為優勢方案(dominant)。單因素敏感性分析發現,中間型代謝者中HTPR患者的比例和CYP2C19功能缺失型基因攜帶者的比例為影響基線結果的兩個因素。10 000次Monte Carlo模擬的概率敏感性分析發現:當WTP閾值為50 000 USD/QALY時,此研究中個體化治療方案、全部氯吡格雷、全部新型P2Y12受體抑制劑(普拉格雷或替格瑞洛)為最優方案,概率分別為96.64%、3.34%和0.02%。
3 討論
本研究總結了以血小板活性為指導的個體化抗血小板治療方案的藥物經濟學評價研究。雖然每個研究中血小板活性測試儀器、決策分析模型結構、研究角度、臨床結果及藥物經濟學評價指標不同,但基線研究結果一致發現:對于ACS患者而言,個體化抗血小板治療(個體化普拉格雷或個體化替格瑞洛)比傳統抗血小板治療(全部患者氯吡格雷、普拉格雷或替格瑞洛)更具成本-效果(效用)。敏感性分析發現,藥物成本,新型P2Y12受體抑制劑相對氯吡格雷的心血管源性病死率比值比及 HTPR患者的比例等因素,對基線結果的穩定性有一定影響。
除血小板活性指標外,CYP2C19基因多態性也能反映氯吡格雷治療個體反應差異性,因為氯吡格雷代謝受CYP2C19基因型影響[10]。但CYP2C19基因多態性只能解釋5%~12%的氯吡格雷抵抗現象,而血小板活性比CYP2C19基因多態性更能綜合反映氯吡格雷的個體反應差異性[11]。之前的研究表明,ACS患者以CYP2C19基因型為指導的個體化抗血小板治療方案比傳統抗血小板方案成本-效果好[12],此結果與本研究結果一致,共同支持個體化治療(以CYP2C19基因型或/和以血小板活性為指導)是ACS患者抗血小板治療的優選方案。
目前尚無大型前瞻性臨床試驗證明以血小板活性為指導的個體化抗血小板治療能產生較好的臨床療效[11],失敗的原因主要與研究人群的納入、HTPR患者使用的治療方案、臨床治療終點的選擇、血小板活性的測量及 HTPR的界定等因素有關。決策分析模型模擬的個體化治療方案雖然不能直接應用于臨床實踐,但能夠為臨床試驗研究者篩選較優的、成本-效果好的臨床試驗設計方案,進而在未來的臨床試驗中進行檢驗。本研究納入的四項藥物經濟學評價均利用決策分析模型模擬了不同的抗血小板治療方案,個體化方案中HTPR患者均使用新型P2Y12受體抑制劑(普拉格雷或替格瑞洛),而非雙倍劑量的氯吡格雷(150 mg),因為已有研究表明 150 mg的氯吡格雷不足以克服HTPR[13]。此外,4項研究模擬的患者均為ACS患者,為高風險人群,血小板活性的高低與 PCI術后臨床缺血性事件的發生關系更為密切。
當前以血小板活性為指導的個體化抗血小板方案均以HTPR為指標將患者分為兩組(HTPR患者和非HTPR患者)。但非HTPR患者中包括部分低血小板活性(low on-treatment platelet reactivity,LTPR)患者,LTPR患者伴隨潛在的高出血風險[4],此部分人群可能需要考慮其他抗血小板治療方案來降低出血風險,從而促進更精細化的個體化抗血小板治療(以HTPR和LTPR雙向指標為指導)。此外,目前還沒有已發表的類似藥物經濟學評價從我國的醫療角度開展研究,圍繞我國ACS患者的個體化抗血小板治療方案,其臨床實際效果及成本-效果方面的研究亟待加強。
[1]Franchi F,Angiolillo DJ.Novel antiplatelet agents in acute coronary syndrome[J].Nat Rev Cardiol,2015,12(1):30-47.
[2]Scott SA,Sangkuhl K,Stein CM,et al.Clinical Pharmacogenetics Implementation Consortium guidelines for CYP2C19 genotype and clopidogrel therapy:2013 update[J].Clin Pharmacol Ther,2013,94(3):317-323.
[3]Mega JL,Simon T.Pharmacology of antithrombotic drugs: an assessment of oral antiplatelet and anticoagulant treatments[J]. Lancet,2015,386(9990):281-291.
[4]Brar SS,ten Berg J,Marcucci R,et al.Impact of platelet reactivity on clinical outcomes after percutaneous coronary intervention a collaborative meta-analysis of individual participant data[J].J Am Coll Cardiol,2011,58(19):1945-1954.
[5]Aradi D,Kirtane A,Bonello L,et al.Bleeding and stent thrombosison P2Y12-inhibitors:collaborative analysis on the role of platelet reactivity for risk stratification after percutaneous coronary intervention[J].Eur Heart J,2015,36(27):1762-1771.
[6]Straub N,Beivers A,Lenk E,et al.A model-based analysis of the clinical and economic impact of personalising P2Y12-receptor inhibition with platelet function testing in acute coronary syndrome patients[J].Thromb Haemost,2014,111(2):290-299.
[7]Coleman CI,Limone BL.Universal versus platelet reactivity assay-driven use of P2Y12 inhibitors in acute coronary syndrome patients: cost-effectiveness analyses for six European perspectives[J].Thromb Haemost,2014,111(1):103-105.
[8]Coleman CI,Limone BL.Cost-effectiveness of universal and platelet reactivity assay-driven antiplatelet therapy in acute coronary syndrome[J].Am J Cardiol,2013,112(3):355-362.
[9]Jiang M,You JH.CYP2C19 genotype plus platelet reactivityguided antiplatelet therapy in acute coronary syndrome patients:a decision analysis[J].Pharmacogenet Genomics,2015,25(12):609-617.
[10]Mega JL,Close SL,Wiviott SD,et al.Cytochrome P-450 polymorphisms and response to clopidogrel[J].N Engl J Med,2009,360(4):354-362.
[11]Siller-Matula JM,Trenk D,Schr?r K,et al.How to improve the concept of individualised antiplatelet therapy with P2Y12 receptor inhibitors-is an algorithm the answer[J].Thromb Haemost,2015,113(1):37-52.
[12]Jiang M,You JH.You,Review of pharmacoeconomic evaluation of genotype-guided antiplatelet therapy[J].Expert Opin Pharmacother,2015,16(5):771-779.
[13]Alexopoulos D,Dimitropoulos G,Davlouros P,et al.Prasugrel overcomes high on-clopidogrel platelet reactivity post-stenting more effectively than high-dose (150-mg) clopidogrel the importance of CYP2C19*2 genotyping[J].JACC Cardiovasc Interv,2011,4(4):403-410.
Review on pharmacoeconomic evaluation of personalized antiplatelet therapy guided by platelet reactivity
Feng Liuxin Zhang Kanghuai Liu Na Wang Na Kang Limin Cai Yan
Objective This study aims to review pharmacoeconomic evaluation on personalized antiplatelet therapy guided by on-treatment platelet reactivity.Methods Published literature since 2000 was searched on Embase and Medline databases.Results Four studies that satisfied selection criteria were reviewed.All of four studies designed decision analytic modelling to compare the cost-effectiveness of traditional antiplatelet treatment(universal clopidogrel,prasugrel,or ticagrelor) versus personalized antiplatelet approaches in patients with acute coronary syndrome (ACS).For personalized treatment,ACS patients were categorized into two groups:patients with high on-treatment platelet reactivity (HTPR)
prasugrel or ticagrelor,whist non-HTPR patients received clopidogrel.Four studies consistently found personalized antiplatelet therapy was dominant or cost-effective compared to traditional strategies.One-way sensitivity analysis found the drug cost,hazard ratio of cardiovascular death of prasugrel or ticagrelor versus clopidogrel, and the prevalence of HTPR were the influential parameters of base-case results.Conclusion Personalized antiplatelet therapy guided by platelet reactivity was preferred over universal antiplatelet strategies for ACS patients.
Clopidogrel;Prasugrel;Ticagrelor;Personalized antiplatelet therapy;Platelet reactivity;Cost-effectiveness;Acute coronary syndrome
10.12010/j.issn.1673-5846.2017.09.061
西安交通大學第二附屬醫院,陜西西安 710003
國家自然科學基金青年項目(編號:81603175)
馮劉欣(1988-),碩士學位,初級藥師。研究方向:臨床藥學
蔡艷,Email:caiyan029@163.com

