肝細(xì)胞肝癌腫瘤微環(huán)境中功能耗竭CD8+T細(xì)胞脂代謝特征的觀察
沈 琦, 卓樂(lè)盈, 劉芳銘, 張苗苗, 王 晗, 劉衛(wèi)仁, 武多嬌*
1.復(fù)旦大學(xué)附屬中山醫(yī)院實(shí)驗(yàn)研究中心,上海 2000322.溫州醫(yī)科大學(xué),溫州 325035
·論著·
肝細(xì)胞肝癌腫瘤微環(huán)境中功能耗竭CD8+T細(xì)胞脂代謝特征的觀察
沈 琦1, 卓樂(lè)盈2, 劉芳銘1, 張苗苗1, 王 晗1, 劉衛(wèi)仁1, 武多嬌1*
1.復(fù)旦大學(xué)附屬中山醫(yī)院實(shí)驗(yàn)研究中心,上海 2000322.溫州醫(yī)科大學(xué),溫州 325035
目的: 探討肝細(xì)胞肝癌(hepatocellular carcinoma,HCC)腫瘤微環(huán)境中CD8+T細(xì)胞耗竭與脂代謝的關(guān)系。方法: 利用流式細(xì)胞分析、實(shí)時(shí)細(xì)胞能量代謝檢測(cè)儀、實(shí)時(shí)PCR等方法檢測(cè)HCC和癌旁組織中CD8+T細(xì)胞脂代謝及功能相關(guān)蛋白或基因的表達(dá);在此基礎(chǔ)上分析其功能和脂代謝的關(guān)系。結(jié)果: HCC浸潤(rùn)的CD8+T細(xì)胞具有以下特征:功能耗竭(干擾素-γ減少、程序性死亡分子-1表達(dá)升高);多個(gè)脂肪酸合成酶表達(dá)下調(diào),脂肪酸含量下降;線粒體結(jié)構(gòu)、功能受損(P<0.05)。結(jié)論: HCC中浸潤(rùn)的功能耗竭CD8+T細(xì)胞具有脂肪酸代謝異常特征。
肝細(xì)胞肝癌;CD8+T細(xì)胞;代謝;功能耗竭;微環(huán)境
腫瘤微環(huán)境在腫瘤發(fā)生、發(fā)展過(guò)程中有至關(guān)重要的作用[1]。細(xì)胞毒性CD8+T淋巴細(xì)胞是腫瘤特異性適應(yīng)性免疫反應(yīng)的關(guān)鍵細(xì)胞,攻擊表面上具有主要組織相容性Ⅰ類(lèi)復(fù)合物的腫瘤相關(guān)抗原肽的腫瘤細(xì)胞。CD8+T細(xì)胞在與其腫瘤靶標(biāo)相互作用后,可通過(guò)干擾素-γ(IFN-γ)依賴(lài)性機(jī)制殺傷腫瘤細(xì)胞。腫瘤微環(huán)境抑制因素的持續(xù)存在最終導(dǎo)致浸潤(rùn)C(jī)D8+T細(xì)胞喪失殺傷腫瘤的能力,成為耗竭性細(xì)胞,導(dǎo)致腫瘤的免疫逃逸[1]。逆轉(zhuǎn)CD8+T細(xì)胞耗竭(T cell exhaustion),恢復(fù)其抗腫瘤活性是腫瘤免疫治療的重要策略之一。CD8+T細(xì)胞耗竭的特征是具有免疫抑制作用的分子,包括程序性死亡分子-1(PD-1)、細(xì)胞毒性T淋巴細(xì)胞抗原4(CTLA-4)、淋巴細(xì)胞活化基因3(LAG-3)等在細(xì)胞上表達(dá)上調(diào),具有抑制CD8+T細(xì)胞活化和效應(yīng)的功能。因此,研究CD8+T細(xì)胞功能障礙的機(jī)制至關(guān)重要,也是下一步設(shè)計(jì)聯(lián)合多靶點(diǎn)腫瘤免疫治療策略的關(guān)鍵。
目前已有文獻(xiàn)[2-3]提示,CD8+T細(xì)胞功能耗竭與其代謝異常密切相關(guān),無(wú)論是在慢性淋巴細(xì)胞性脈絡(luò)叢腦膜炎病毒(LCMV)感染或黑素瘤小鼠模型中,耗竭的CD8+T細(xì)胞過(guò)表達(dá)共抑制分子的同時(shí)都呈現(xiàn)出廣泛的代謝和生物能量缺陷的特點(diǎn)。科學(xué)家在小鼠肉瘤模型中發(fā)現(xiàn)腫瘤細(xì)胞掠取T細(xì)胞營(yíng)養(yǎng),導(dǎo)致哺乳動(dòng)物雷帕霉素靶蛋白(mTOR)活性和糖酵解能力減弱、效應(yīng)因子IFN-γ分泌減少,促進(jìn)了腫瘤進(jìn)展[4]。結(jié)果提示腫瘤浸潤(rùn)的CD8+T細(xì)胞代謝異常與微環(huán)境中腫瘤細(xì)胞營(yíng)養(yǎng)競(jìng)爭(zhēng)導(dǎo)致組織中可獲取的葡萄糖等營(yíng)養(yǎng)物質(zhì)減少有關(guān)。
前期研究[5]表明,Toll樣受體9(TLR9)激活的漿細(xì)胞樣樹(shù)突狀細(xì)胞發(fā)生代謝重組,脂肪酸氧化增強(qiáng)是該類(lèi)細(xì)胞活化并分泌大量Ⅰ型干擾素的能量基礎(chǔ);過(guò)氧化物酶體增殖物激活受體α(PPARα)介導(dǎo)了這一分解代謝過(guò)程。另外有研究[6-7]發(fā)現(xiàn),黑素瘤中效應(yīng)性T細(xì)胞特異性缺失乙酰輔酶A羧化酶1(ACC1,脂肪酸合成的限速酶),其功能會(huì)受損,細(xì)胞數(shù)量也顯著減少;而給予ACC1缺陷型細(xì)胞補(bǔ)充外源性脂肪酸,可以恢復(fù)其功能。
在肝炎、肝硬化等致病因素反復(fù)刺激下,肝細(xì)胞肝癌(hepatocellular carcinoma,HCC)被認(rèn)為是典型的“微環(huán)境腫瘤”。根治性手術(shù)切除目前是HCC治療首選。然而,由于術(shù)后高復(fù)發(fā)轉(zhuǎn)移率等原因,近十年來(lái)HCC生存率并未得到明顯改善。本研究從代謝角度探討HCC微環(huán)境中CD8+T細(xì)胞耗竭的代謝特征,為后續(xù)研究奠定基礎(chǔ)。
1 材料與方法
1.1 標(biāo)本及組織病理 選取復(fù)旦大學(xué)附屬中山醫(yī)院肝外科2016年6月至2016年10月經(jīng)手術(shù)切除的HCC標(biāo)本20例,另取癌旁3 cm以上的肝組織標(biāo)本20例作為對(duì)照組。HCC標(biāo)本組中,10例進(jìn)行免疫組織化學(xué)染色,具體步驟如下:石蠟包埋的組織切成5 μm切片,進(jìn)行免疫組織化學(xué)染色。抗人CD8抗體 (賽默飛公司,貨號(hào)RB-9009-P0)孵育,蘇木精復(fù)染。使用ImagePro Plus 軟件(美國(guó)Media Cybernetics公司,V6.0)在高倍鏡視野下,每張切片隨機(jī)選擇5個(gè)視野,比較癌和癌旁CD8抗體陽(yáng)性的細(xì)胞數(shù)目。本研究獲得醫(yī)院倫理委員會(huì)批準(zhǔn),所有患者均知情同意并簽署知情同意書(shū)。
1.2 單細(xì)胞懸液制備 20例HCC標(biāo)本中有10例癌和癌旁組織分別制備單細(xì)胞懸液,步驟如下:在超凈臺(tái)中,將組織放入裝有消化液的培養(yǎng)皿中,用眼科剪切成0.5~1.0 mm3。剪碎的組織放入燒瓶中,加入5~10 mL Ⅳ型膠原酶消化液,以及青霉素及鏈霉素雙抗100 U/mL,置于37℃水浴磁力攪拌器中振蕩消化,連續(xù)觀察0.5~1 h,直至組織碎塊彌散開(kāi)為止。消化組織液用200目不銹鋼濾網(wǎng)過(guò)濾。收集上述液體,1 800 r/min離心5 min,收集細(xì)胞沉淀,用Hanks液洗滌2次。
1.3 細(xì)胞實(shí)時(shí)能量代謝特征檢測(cè) 分選癌旁和腫瘤組織內(nèi)CD8+T細(xì)胞(CD3+CD8+TCRβ+CD45RO+CD62L-),簡(jiǎn)述步驟如下:(1)如上述獲取細(xì)胞懸液;(2)進(jìn)行抗體染色:CD3(FITC,克隆號(hào)HIT3a),CD8+(PE,克隆號(hào)HIT8a),TCRβ+(PE-cy7,克隆號(hào)3C10),CD45RO+(Percp,克隆號(hào)UCHL1),CD62L-(APC-cy7,克隆號(hào)DREG-56),上述流式抗體都購(gòu)自Biolegend公司;(3)抗體染色4℃孵育30 min后使用流式緩沖液清洗,緩沖液為含2%胎牛血清(Gibco公司)的磷酸鹽緩沖液(PBS);(4)清洗后細(xì)胞移入流式上樣管,調(diào)整管中的細(xì)胞密度至(7~9)×106/mL,過(guò)濾細(xì)胞,避光置冰上運(yùn)至分選室;(5)上機(jī)檢測(cè)并設(shè)定分選條件,選取85 μmol/L噴嘴,調(diào)整分選關(guān)鍵參數(shù)及設(shè)門(mén),分選細(xì)胞后上機(jī)回測(cè),檢測(cè)純度。
細(xì)胞實(shí)時(shí)能量檢測(cè)儀(安捷倫公司,Seahorse XF96)檢測(cè)細(xì)胞有氧呼吸O2消耗速率(OCR)、細(xì)胞外酸化率(ECAR)、細(xì)胞儲(chǔ)備呼吸能力(SRC)等指標(biāo);其中,OCR代表細(xì)胞線粒體氧化磷酸化水平;ECAR代表糖酵解水平;SRC代表細(xì)胞在應(yīng)激及壓力狀態(tài)下生存的能力。具體方法如下:將T細(xì)胞 (1.5×105細(xì)胞/孔)移入特殊的96孔檢測(cè)培養(yǎng)板中,置入XF96細(xì)胞能量代謝實(shí)時(shí)測(cè)定儀檢測(cè)。在線粒體能量測(cè)試中,首先測(cè)定基線OCR,然后依次測(cè)量加入1 μmol/L寡霉素(oligomycin,ATP合成酶抑制劑)、1.5 μmol/L氟羰基氰化物苯腙(FCCP,離子載體)和100 nmol/L 魚(yú)藤酮(rotenone,電子轉(zhuǎn)運(yùn)鏈抑制劑)及1 μmol/L抗霉素A(antimycin A,電子轉(zhuǎn)運(yùn)鏈抑制劑)后的OCR。上述試劑來(lái)自于線粒體壓力測(cè)試盒內(nèi)的配套試劑(安捷倫公司,貨號(hào)103015-100)。
1.4 線粒體特征觀察 單細(xì)胞懸液用Mitotracker Green(賽默飛公司,貨號(hào)M7514)、Mitotracker Red(賽默飛公司,貨號(hào)M22425)等探針染色后,流式細(xì)胞儀檢測(cè)線粒體質(zhì)量、膜電位等指標(biāo)。
1.5 流式細(xì)胞儀檢測(cè) 應(yīng)用Bodipy探針(賽默飛公司,貨號(hào)D3922)、葡萄糖轉(zhuǎn)運(yùn)蛋白Glut1抗體(R&D公司,貨號(hào)MAB1418)標(biāo)記染色等方法在流式細(xì)胞儀(BD公司, FACSAriaTMⅢ)上測(cè)量細(xì)胞脂質(zhì)含量及葡萄糖轉(zhuǎn)運(yùn)蛋白表達(dá)水平;同樣用抗體標(biāo)記法檢測(cè)癌旁和腫瘤組織內(nèi)CD8+T細(xì)胞IFN-γ(Biolegend公司,克隆號(hào)GIR-94)、PD-1(Biolegend公司,克隆號(hào)EH12.2H7)表達(dá)水平。
細(xì)胞流式表面抗體染色步驟如下:(1)用PBS洗滌細(xì)胞,1 500 r/min離心5~10 min,棄上清,計(jì)數(shù);(2)取適量含1%胎牛血清的流式緩沖液,按照比例加入抗體,4℃避光孵育細(xì)胞半小時(shí);(3)1 500 r/min離心5~10 min,棄上清;(4)用1%胎牛血清的流式緩沖液洗滌細(xì)胞,1 500 r/min離心5~10 min,棄上清。重復(fù)洗滌后加入適量流式緩沖液混勻,上機(jī)檢測(cè)。
1.6 Real-time PCR檢測(cè) 流式細(xì)胞儀(BD公司, FACSAriaTMⅢ)分選HCC癌及癌旁的CD8+T細(xì)胞,提取核酸后進(jìn)行Real-time PCR(羅氏公司,LightCycler○R96 Instrument,貨號(hào)05815916001)檢測(cè)脂肪酸合成相關(guān)的基因表達(dá)水平,具體方法如前所述[5]。
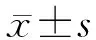
2 結(jié) 果
2.1 免疫組化染色結(jié)果 結(jié)果(圖1)表明:癌組織平均高倍視野中CD8抗體表達(dá)陽(yáng)性的細(xì)胞數(shù)低于癌旁組織[(3.4±0.8)vs(6.5±1.2),P<0.05 ]。
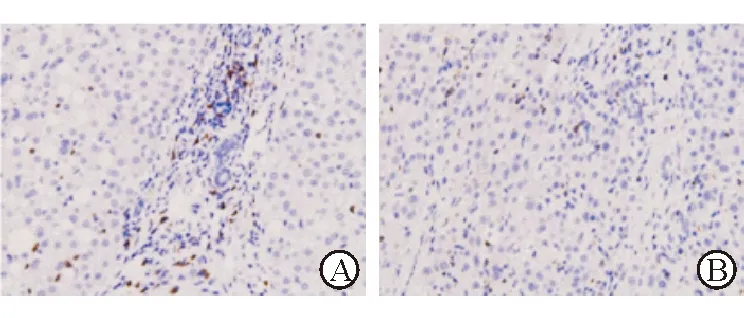
圖1 HCC腫瘤組織及癌旁正常組織CD8抗體染色
A:癌旁正常組織;B:癌組織. Original magnification:×200
2.2 流式細(xì)胞儀檢測(cè) 結(jié)果(圖2)表明:腫瘤組織中CD8+T細(xì)胞數(shù)量少于癌旁組織(P=0.05),且效應(yīng)分子IFN-γ表達(dá)減少[(13.2±3.6)%vs(5.4±2.1)%,P<0.05],共抑制分子PD-1、CD8+T細(xì)胞的表達(dá)增加[(9 800±1 660)vs(7 000±1 260),P<0.05],提示腫瘤組織內(nèi)CD8+T細(xì)胞功能耗竭。
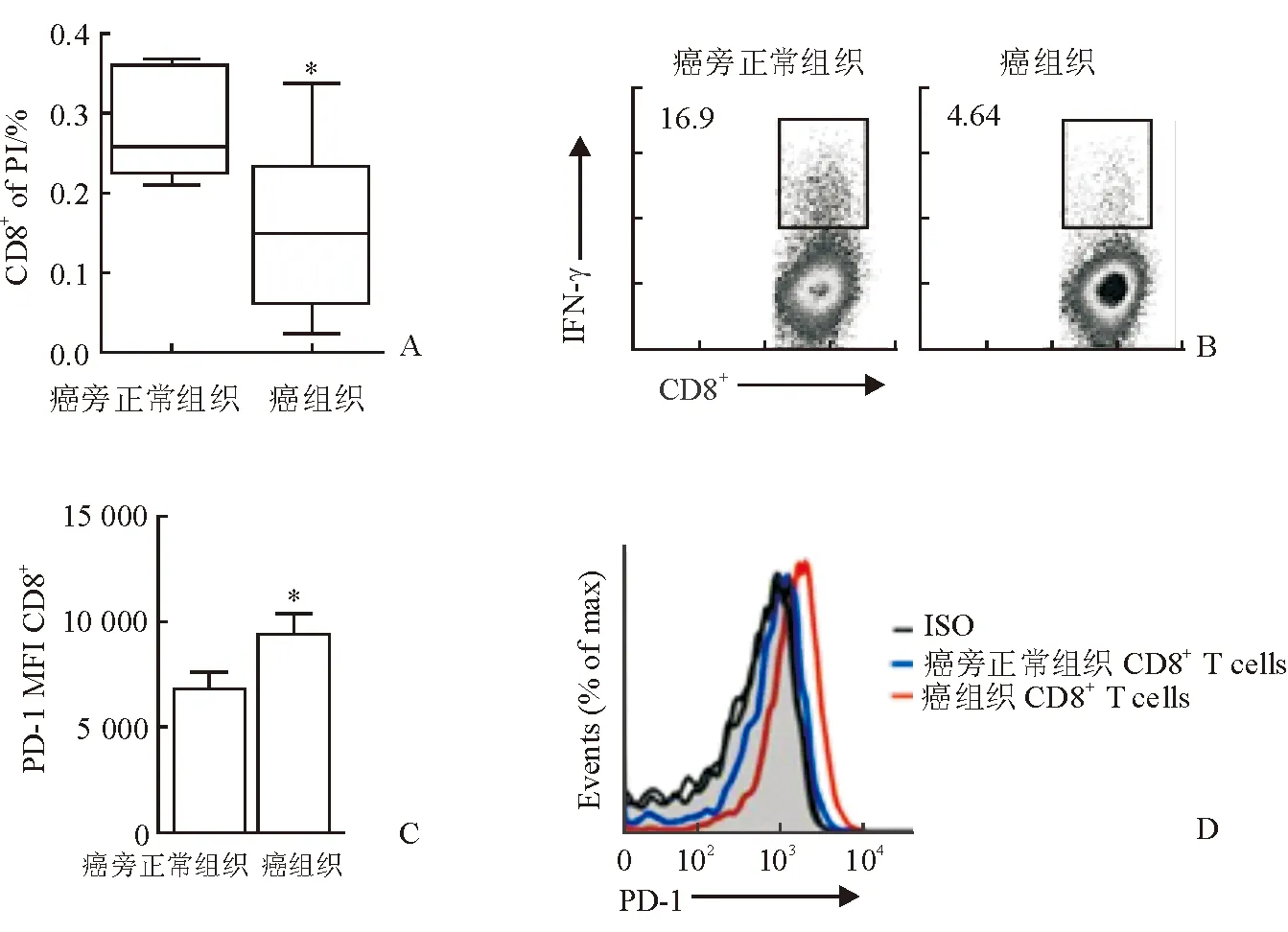
圖2 CD8+T細(xì)胞效應(yīng)分子及共抑制分子表達(dá)
A:CD8+T細(xì)胞數(shù)量;B:流式細(xì)胞儀檢測(cè)CD8+T細(xì)胞IFN-γ表達(dá);C,D:流式細(xì)胞儀檢測(cè)CD8+T細(xì)胞PD-1表達(dá).*P<0.05
2.3 代謝特征改變 結(jié)果(圖3)表明:兩組間Glut1表達(dá)無(wú)顯著改變,說(shuō)明腫瘤內(nèi)浸潤(rùn)的CD8+T細(xì)胞從環(huán)境中攝取葡萄糖的活動(dòng)未受到抑制;但腫瘤組織中的CD8+T細(xì)胞較癌旁細(xì)胞內(nèi)脂質(zhì)含量減少,表現(xiàn)為Bodipy脂質(zhì)探針平均熒光強(qiáng)度減弱[(5 120±1 060)vs(2 200±1 260),P<0.05]。
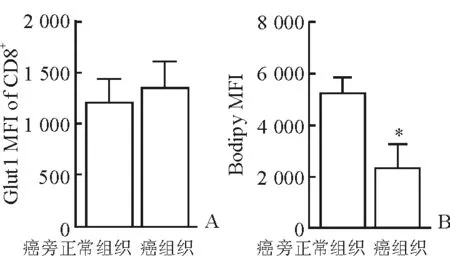
圖3 CD8+T細(xì)胞代謝特征
A:葡萄糖轉(zhuǎn)運(yùn)蛋白Glut1表達(dá);B:Bodipy染色顯示脂質(zhì)含量
2.4 線粒體特征改變 結(jié)果(圖4)表明:腫瘤內(nèi)浸潤(rùn)的CD8+T細(xì)胞線粒體電位下降[(8 100±960)vs(6 200±1 060),P<0.05)],伴隨ATP產(chǎn)量下降(P<0.05)、氧化磷酸化下降(P<0.001)。
2.5 基因表達(dá)改變 Real-time PCR檢測(cè)顯示,腫瘤內(nèi)浸潤(rùn)的CD8+T細(xì)胞ATP-檸檬酸裂解酶(ACLY)、脂肪酸合酶(FASN)基因表達(dá)下調(diào)(P<0.01,圖5)。
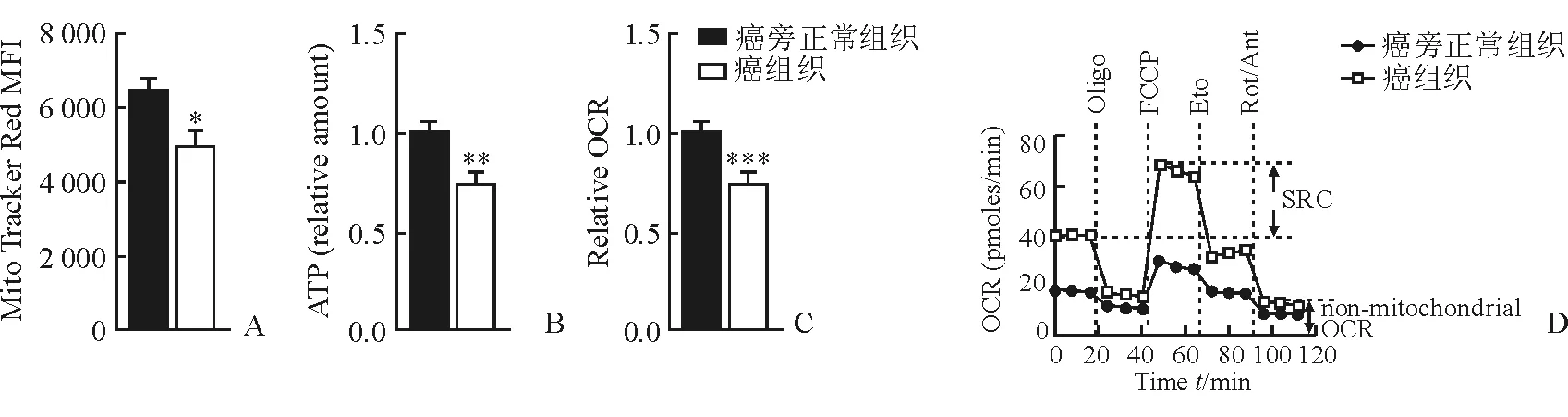
圖4 CD8+T細(xì)胞線粒體及實(shí)時(shí)能量代謝特征
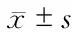
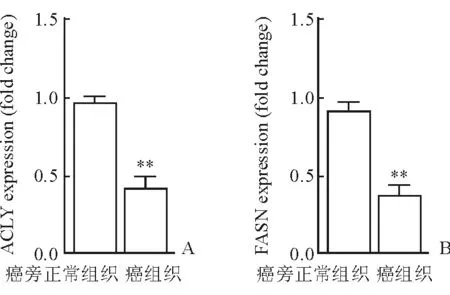
圖5 HCC腫瘤內(nèi)浸潤(rùn)的CD8+T細(xì)胞脂肪酸合成相關(guān)酶表達(dá)
3 討 論
脂肪酸代謝與細(xì)胞的功能密切相關(guān)。首先,脂肪酸和甾醇的合成是細(xì)胞增殖必需的原料。脂肪酸合成途徑即細(xì)胞內(nèi)脂質(zhì)合成過(guò)程,可利用其他幾種代謝途徑的中間產(chǎn)物作為原料,例如糖酵解、三羧酸循環(huán)和磷酸戊糖途徑。脂肪酸可以與糖酵解衍生的丙三醇縮合產(chǎn)生多種三酰基甘油和磷脂的組合,這是許多細(xì)胞結(jié)構(gòu)的關(guān)鍵組分[8]。其次,合成的脂肪酸除了是細(xì)胞膜結(jié)構(gòu)的關(guān)鍵組成部分,還可在線粒體或過(guò)氧化物酶體中進(jìn)行氧化,產(chǎn)生許多具有重要生理功能的代謝中間產(chǎn)物,包括乙酰輔酶A、尼克酰胺腺嘌呤二核苷酸(NADH)和還原型黃素二核苷酸(FADH2)。另外,脂肪酸氧化產(chǎn)生大量單一棕櫚酸酯分子(ATP,哺乳動(dòng)物細(xì)胞中的主要脂肪酸),ATP的完全β-氧化具有產(chǎn)生超過(guò)100個(gè)ATP分子的潛力[9],是細(xì)胞供能的重要方式。
雖然已有部分文獻(xiàn)[10-12]報(bào)道了脂肪酸代謝與免疫細(xì)胞的功能活化密切相關(guān),但研究非常有限,且主要聚焦在脂肪酸氧化與病毒感染的動(dòng)物模型上。本研究在人HCC標(biāo)本中發(fā)現(xiàn)腫瘤浸潤(rùn)的CD8+T細(xì)胞比癌旁組織中CD8+T細(xì)胞數(shù)目減少且功能受損。這類(lèi)T細(xì)胞在腫瘤殺傷功能異常的同時(shí),表現(xiàn)出了代謝異常的特征,包括脂肪酸含量以及脂肪酸氧化和氧化磷酸化水平下降(氧耗率和儲(chǔ)備呼吸能力SRC下降)、產(chǎn)能減少(ATP產(chǎn)生減少、線粒體膜電位下降)。胞內(nèi)脂肪酸含量直接影響細(xì)胞脂肪酸氧化及氧化磷酸化水平,而脂肪酸氧化是免疫細(xì)胞生成ATP的關(guān)鍵方式;并且脂質(zhì)是組成細(xì)胞膜結(jié)構(gòu)的重要組成部分,脂肪酸從頭合成減少會(huì)影響含膜結(jié)構(gòu)細(xì)胞器的功能,如線粒體功能。線粒體功能可直接影響T細(xì)胞分化及免疫應(yīng)答[13]。本研究發(fā)現(xiàn),HCC中浸潤(rùn)的CD8+T細(xì)胞SRC減少,代表了細(xì)胞線粒體呼吸能力損傷[14]。另外,脂質(zhì)是細(xì)胞增殖所必需的材料,脂質(zhì)減少可顯著妨礙細(xì)胞增殖和信號(hào)轉(zhuǎn)導(dǎo),這可部分解釋腫瘤內(nèi)浸潤(rùn)的CD8+T細(xì)胞數(shù)目比癌旁組織少。因此本研究中觀察到HCC中CD8+T細(xì)胞脂肪酸含量下降可能是細(xì)胞產(chǎn)能及效應(yīng)功能受抑制的重要原因之一。
其次,本研究發(fā)現(xiàn)HCC中耗竭的CD8+T細(xì)胞脂肪酸從頭合成的酶ACLY、FASN表達(dá)下降。由于HCC組織樣本中CD8+T細(xì)胞分選所得數(shù)量有限,目前還不能進(jìn)行免疫印跡實(shí)驗(yàn)檢測(cè)這些基因的蛋白水平。脂肪酸從頭合成酶的表達(dá)主要由固醇調(diào)節(jié)元件結(jié)合蛋白(SREBPs)控制。SREBPs可能是HCC浸潤(rùn)的CD8+T細(xì)胞代謝重組的關(guān)鍵調(diào)控因子。SREBPs是3個(gè)基本螺旋-環(huán)-螺旋-亮氨酸拉鏈轉(zhuǎn)錄因子家族。SREBPs與其靶基因的啟動(dòng)子中的固醇調(diào)節(jié)元件(SRE)和一些E盒序列結(jié)合。目前已知蛋白激酶B/哺乳動(dòng)物靶蛋白雷帕霉素復(fù)合物1(AKT/mTORC1)與SREBPs構(gòu)成信號(hào)轉(zhuǎn)導(dǎo)軸,誘導(dǎo)SREBPs核聚集,連接了致癌信號(hào)傳導(dǎo)和脂質(zhì)代謝。AKT/mTORC1-SREBP軸及其下游基因是否在HCC中耗竭的CD8+T細(xì)胞代謝中起關(guān)鍵調(diào)控作用目前尚不清楚,有待進(jìn)一步探討。
綜上所述,本研究發(fā)現(xiàn)了HCC內(nèi)浸潤(rùn)的功能耗竭的CD8+T細(xì)胞具有線粒體功能受損、脂肪酸代謝異常的特征。HCC中CD8+T細(xì)胞脂肪酸從頭合成減少,可通過(guò)影響線粒體膜結(jié)構(gòu)、限制了脂肪酸氧化等機(jī)制,導(dǎo)致線粒體結(jié)構(gòu)和功能受損,最終削弱CD8+T細(xì)胞分泌IFN-γ等腫瘤殺傷功能。目前關(guān)于脂代謝與CD8+T細(xì)胞的研究還遠(yuǎn)不夠深入,下一步可通過(guò)細(xì)胞及動(dòng)物實(shí)驗(yàn)進(jìn)一步驗(yàn)證脂代謝異常與T細(xì)胞功能異常的關(guān)系,繼而探討靶向干預(yù)CD8+T細(xì)胞脂代謝異常能否重激活T細(xì)胞的腫瘤殺傷作用。
[ 1 ] HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5):646-674.
[ 2 ] WHERRY E J, HA S J, KAECH S M, et al. Molecular signature of CD8+T cell exhaustion during chronic viral infection[J]. Immunity, 2007, 27(4):670-684.
[ 3 ] SCHARPING N E, MENK A V, MORECI R S, et al. The tumor microenvironment represses T cell mitochondrial biogenesis to drive intratumoral T cell metabolic insufficiency and dysfunction[J]. Immunity, 2016, 45(2):374-388.
[ 4 ] CHANG C H, QIU J, O'SULLIVAN D, et al. Metabolic competition in the tumor microenvironment is a driver of cancer progression[J]. Cell, 2015, 162(6):1229-1241.
[ 5 ] WU D, SANIN D E, EVERTS B, et al. Type 1 interferons induce changes in core metabolism that are critical for immune function[J]. Immunity, 2016, 44(6):1325-1336.
[ 6 ] LEE J, WALSH M C, HOEHN K L, et al. Regulator of fatty acid metabolism, acetyl coenzyme a carboxylase 1, controls T cell immunity[J]. J Immunol, 2014, 192(7):3190-3199 .
[ 7 ] YANG W, BAI Y, XIONG Y, et al. Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism[J]. Nature, 2016, 531(7596):651-655.
[ 8 ] MOON J S, LEE S, PARK M A, et al. UCP2-induced fatty acid synthase promotes NLRP3 inflammasome activation during sepsis[J]. J Clin Invest, 2015, 125(2):665-680.
[ 9 ] NOMURA M, LIU J, ROVIRA I I, et al. Fatty acid oxidation in macrophage polarization[J]. Nat Immunol, 2016, 17(3):216-217.
[10] WANG C, YOSEF N, GAUBLOMME J, et al. CD5L/AIM regulates lipid biosynthesis and restrains Th17 cell pathogenicity[J]. Cell, 2015,163(6):1413-1427.
[11] ANGELIN A, GIL-DE-GMEZ L, DAHIYA S, et al. Foxp3 reprograms T cell metabolism to function in low-glucose, high-lactate environments[J]. Cell Metab, 2017,25(6):1282-1293, e7.
[12] PAN Y, TIAN T, PARK C O, et al. Survival of tissue-resident memory T cells requires exogenous lipid uptake and metabolism[J]. Nature, 2017, 543(7644):252-256.
[13] BUCK M D, O′SULLIVAN D, KLEIN GELTINK R I, et al. Mitochondrial dynamics controls T Cell fate through metabolic programming[J]. Cell, 2016, 166(1):63-76.
[14] R?HRIG F, SCHULZE A. The multifaceted roles of fatty acid synthesis in cancer[J]. Nat Rev Cancer, 2016, 16(11):732-749.
[本文編輯] 葉 婷, 賈澤軍
Lipid metabolic characteristics of functionally exhausted CD8+T cells in tumor microenvironment of hepatocellular carcinoma
SHEN Qi1, ZHUO Le-ying2, LIU Fang-ming1, ZHANG Miao-miao1, WANG Han1, LIU Wei-ren1, WU Duo-jiao1*
1. Department of Experimental Research Center, Zhongshan Hospital, Fudan University, Shanghai 200032, China2. Wenzhou Medical University, Wenzhou 325035, Zhejiang, China
Objective: To explore the lipid metabolic characteristics of functionally exhausted CD8+T cells in tumor microenvironment of hepatocellular carcinoma (HCC).Methods: By using flow cytometry analysis and real-time PCR to detect the functions and lipid metabolism-related proteins and genes expression of CD8+T cells in HCC and peri-tumor tissues, then the relationship between function and lipid metabolism was analyzed.Results: The infiltrated CD8+T cells in HCC have the following characteristics: functional exhaustion (decreased interferon-γ secretion and up regulated programmed death molecule-1 expression); down regulated expression of multiple fatty acid synthases, and the decreased content of intracellular fatty acids; impaired mitochondrial structure and function (P<0.05).Conclusions: Fatty acid metabolism abnormalities are the characteristics of exhausted CD8+T cell infiltrated in HCC.
hepatocellular carcinoma; CD8+T cells; metabolism; functional exhaustion; microenvironment
R 735.7
A
2017-07-22 [接受日期] 2017-08-19
上海市浦江人才計(jì)劃(17PJD006),上海市衛(wèi)計(jì)委科研項(xiàng)目(201740101). Supported by Pujiang Talent Plan of Shanghai (17PJD006) and Project of Shanghai Municipal Health Planning Commission (201740101).
沈 琦,技師. E-mail: shen.qi@zs-hospital.sh.cn
*通信作者(Corresponding author). Tel: 021-64040731, E-mail: wu.duojiao@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20170621

