信號轉導及轉錄激活蛋白4對脂多糖所致小鼠急性肺損傷的影響
劉 歆, 吳曉丹
1.福建省老年醫院呼吸內科,福州 3500002.復旦大學附屬中山醫院呼吸內科,上海 200032
·論著·
信號轉導及轉錄激活蛋白4對脂多糖所致小鼠急性肺損傷的影響
劉 歆1,2, 吳曉丹2*
1.福建省老年醫院呼吸內科,福州 3500002.復旦大學附屬中山醫院呼吸內科,上海 200032
目的: 探討信號轉導及轉錄激活蛋白4(signal transducer and activator of transcription 4, STAT4)在細菌表面分子脂多糖(LPS)所致急性肺損傷(ALI)中的作用及可能機制。方法: 建立STAT4基因敲除小鼠模型,采用LPS誘導小鼠肺損傷并觀察肺組織病理變化及血氣分析變化,流式細胞儀分析外周血骨髓源性抑制細胞(MDSC)和調節性CD4+CD25+Treg細胞的變化情況,瑞氏染色觀察肺部炎癥細胞浸潤情況。結果: 在LPS誘導的肺損傷模型中,STAT4基因敲除小鼠肺組織損害較野生型小鼠肺損傷減輕,動脈血氧合指數(PaO2/FiO2)高,病理評分降低,肺濕/干重比降低,外周血MDSC和CD4+CD25+Treg升高,肺部炎性細胞總數增加,中性粒細胞浸潤增加(P<0.05)。結論: STAT4可加重LPS誘導的肺損傷,可能與MDSC及CD4+CD25+Treg細胞在外周血的比例升高有關。
信號轉導及轉錄激活蛋白4;脂多糖;肺損傷
急性肺損傷(ALI)是各種直接和間接致傷因素導致的肺泡上皮細胞及毛細血管內皮細胞損傷,導致慢性肺間質及肺泡水腫,患者發生低氧性呼吸功能不全。其發展至嚴重階段被稱為急性呼吸窘迫綜合征(ARDS),是ICU中最常見的致死病因之一[1]。一項對1994年至2006年國際上正式發表的72項ALI/ARDS臨床研究的薈萃分析[2]表明,11 426例ALI/ARDS患者的病死率為43%。我國上海市15家成人ICU中,2001年3月至2002年3月ARDS病死率也達68.5%[3]。目前認為,固有免疫應答過強是導致ALI/ARDS患者早期死亡的主要原因,而適應性免疫應答被抑制是患者晚期死亡的重要原因。
信號轉導及轉錄激活蛋白(signal transducer and activator of transcription, STAT)是一類具有信號轉導和轉錄調控功能的蛋白質家族,主要存在于胞質中。STAT由Janus激酶(JAK)激活,被激活后可以介導多種基因表達,同時也可抑制轉錄,廣泛參與多種細胞的存活、生長和分化,在多種生理病理過程中起著關鍵作用[4]。現已發現,多種細胞因子可激活STAT信號通路,調節骨髓源性抑制細胞(MDSC)的生成和運動[5-7]。MDSC由髓系來源的未分化成熟的具有異質性的細胞組成,其中包括樹突狀細胞、巨噬細胞和粒細胞等。MDSC主要表達CD11b+Gr-1+,是具有免疫抑制功能的細胞群,各種炎癥因子能誘導MDSC的產生、運動和活化,從而抑制機體免疫細胞以保持正常固有和特異性免疫功能[8]。鑒于MDSC對機體發揮固有免疫和適應性免疫有重要的影響,其被視為探討肺損傷機制和探索相關干預策略的重要靶標。新的研究[9]發現,LPS刺激可使肺MDSC細胞聚集,參與肺內炎癥反應的調節。
STAT4是STAT家族的新型成員之一,受IL-12的分泌調控,在機體抗炎過程中發揮重要作用[10]。LPS刺激后STAT4基因表達上調[11-12]。目前,STAT4信號對MDSC成熟及免疫抑制功能的作用仍缺乏研究,在調節Treg細胞中發揮何種作用尚不清楚。因此,本研究建立STAT4基因敲除小鼠模型,探討STAT4基因敲除小鼠對LPS所致的肺損傷是否有抵抗作用及外周血MDSC、CD4+CD25+Treg細胞數量變化、肺部中性粒細胞和單核細胞比例在LPS刺激STAT4基因敲除小鼠中發生的變化。
1 材料與方法
1.1 實驗動物來源及分組 BALB/c背景的野生型小鼠和STAT4基因敲除(STAT4-/-)小鼠,雄性,8~12周,體質量20~24 g。實驗動物購自復旦大學醫學院動物部,SPF級。飼養過程符合國家標準,通過復旦大學醫學院動物部倫理審批。動物分為4組:野生型小鼠+0.9%氯化鈉液;野生型小鼠+LPS;STAT4-/-小鼠+0.9%氯化鈉液;STAT4-/-小鼠+LPS。
1.2 小鼠肺損傷模型的制備 每組小鼠各6只,選用5%水合氯醛7.2 mL/kg經腹腔注射麻醉。將麻醉后的小鼠固定于塑料平板上,然后將平板傾斜放置,經氣管內給予LPS(5 mg/kg),給藥后立即左右搖動平板,使LPS均勻分布于左右兩肺。對照組按相同方法給予同等劑量0.9%氯化鈉液。12 h后將小鼠麻醉,取血、肺臟、脾臟,備用。
1.3 動脈血氣分析 LPS(5 mg/kg)刺激12 h后,將小鼠麻醉,左心室采血。血氣分析儀測定動脈血氧分壓(PaO2),并計算氧合指數(PaO2/FiO2),評估肺的呼吸功能障礙。
1.4 支氣管肺泡灌洗液收集 將2 mL量程注射器針頭拔下,吸入1 mL PBS,經小鼠支氣管反復沖洗3次,回收率不低于85%,此為肺泡灌洗液。收集的肺泡灌洗液1 000 r/min離心10 min,下層沉淀用于細胞涂片,瑞氏染色進行白細胞分類計數。滴加瑞氏染液染3 min,并使標本被其中甲醛所固定;加等量pH 6.4磷酸鹽緩沖液(或等量超純水)輕輕晃動玻片,均勻靜置5 min;水洗、吸干、油鏡下觀察。組織細胞胞質紅色,細胞核藍色或紫色。計數每個視野中中性粒細胞數、單核細胞數、總白細胞數。
1.5 肺濕重/干重比 LPS(5 mg/kg)刺激12 h后,將每組小鼠左側肺組織結扎取出,分別記錄濕重后置于烘箱中69℃烘烤,72 h后取出,記錄其干重,計算濕重/干重比。肺組織濕/干重比反映了肺組織水腫的嚴重程度,比值越大,炎癥水腫程度越重。
1.6 肺組織形態學觀察 將取出的左肺置于10%甲醛中固定后,制作石蠟切片,經H-E染色進行肺組織病理學評分。根據肺泡和間質水腫程度、中性粒細胞浸潤程度、出血程度進行評分,具體評分標準見表1。該評分能從組織學上反映小鼠經不同處理后肺損傷程度。

表1 肺損傷評分標準
1.7 流式細胞儀分析外周血中免疫細胞變化 流式細胞檢測外周血中CD11b+Gr-1+髓系細胞、CD4+CD25+Treg細胞數量變化和STAT4缺失對CD11b+Gr-1+髓系細胞分化的影響。紅細胞裂解液搖床上裂解15 min,離心1 200 r/5 min,收集沉淀,流式抗體CD11b、Gr1、CD4、CD25(BD,美國)孵育1 h,重懸離心,用流式儀(BD,美國)進行檢測。
1.8 熒光定量real time-PCR TRIzol法提取小鼠肺臟組織中RNA,反轉錄cDNA。STAT4 F:5′-CCA GGT CTG TGA TTG GCT CT-3′,R:5′-ACA TCC AGA GGA CCC CTT CC-3′;GAPDH F: 5′-TGC ACC ACC AAC TGC TTA GC-3′,R:5′-GGC ATG GAC TGT GGT CAT GAG-3′。應用SYBR熒光定量方法測定小鼠LPS刺激后STAT4的mRNA相對表達水平。
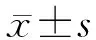
2 結 果
2.1 各組小鼠肺組織濕/干重比的比較 LPS刺激后,STAT4-/-小鼠較WT小鼠肺損傷減輕;LPS刺激12 h后,STAT4-/-小鼠肺濕/干重比低于WT小鼠。在無LPS刺激的條件下,STAT4-/-與野生型小鼠肺濕/干重比差異無統計學意義。WT小鼠LPS刺激后肺濕/干重比較LPS刺激前升高;STAT4-/-小鼠刺激后肺濕/干重比與LPS刺激前差異無統計學意義(圖1)。
2.2 各組小鼠氧合指數的比較 動脈血氣分析結果顯示,LPS刺激后STAT4-/-小鼠和WT小鼠氧合指數較LPS刺激前均減小,提示LPS對肺功能有急性損害作用。LPS刺激后,STAT4-/-氧合指數大于WT小鼠,說明STAT4-/-小鼠可抵抗部分LPS誘導的肺損傷(圖2)。

圖1 各組小鼠肺組織濕/干重比

圖2 LPS刺激12 h后小鼠氧合指數變化
2.3 各組小鼠肺組織H-E染色結果的對比 LPS刺激后,WT和STAT4-/-小鼠肺間質增厚,肺泡融合成肺大泡,炎性細胞浸潤明顯,肺泡滲出明顯,肺組織結構被破壞(圖3)。與WT小鼠相比,STAT4-/-小鼠肺組織病理評分減小,損傷較WT組小鼠減輕,差異有統計學意義(P<0.05,圖4)。

圖3 各組小鼠肺組織H-E染色結果

圖4 小鼠肺組織病理評分
2.4 各組小鼠肺泡灌洗液瑞氏染色結果 中性粒細胞在STAT4-/-小鼠肺組織中升高。白細胞總計數、中性粒細胞計數在LPS刺激后較刺激前增加,差異有統計學意義(P<0.05);單核細胞計數較前略有增加,但差異無統計學意義。LPS刺激后,STAT4-/-小鼠較WT小鼠白細胞、中性粒細胞計數增加,差異有統計學意義(P<0.05),單核細胞未見差異(圖5)。瑞氏染色表明,中性粒細胞增多,但無法區分成熟的中性粒細胞和未成熟的中性粒細胞;中性粒細胞總數增加提示未成熟的CD11b+Ly6G+細胞可能增加。

圖5 STAT4-/-和野生型小鼠肺泡灌洗液白細胞分類計數結果
A:瑞氏染色;B:瑞氏染色統計淋巴細胞數量柱形圖;C:瑞氏染色統計中性粒細胞數量柱形圖;D:瑞氏染色統計單核細胞數量柱形圖. Original magnification: ×1 000(A).*P<0.05,**P<0.01
2.5 不同細胞亞群的流式細胞儀檢測結果 全血流式細胞儀檢測結果(圖6)顯示:在沒有LPS刺激的情況下,STAT4-/-細胞與野生型差異無統計學意義;LPS刺激后,STAT4-/-小鼠的CD11b+Gr1+MDSC細胞較野生型增加,差異有統計學意義(P<0.05);在CD11b+細胞中,以CD11b+Ly6G+粒系的MDSC變化為主;小鼠外周血中CD4+CD25+Treg細胞增加,差異有統計學意義(P<0.05)。

圖6 全血流式細胞儀檢測結果
3 討 論
LPS誘導氣道損害,炎癥因子釋放,是肺損傷最直接的誘發因素。研究[13]表明,炎癥因子可激活巨噬細胞、樹突狀細胞等使STAT4表達增高。LPS誘導產生的IFN-α信號在促進STAT4表達升高中具有重要作用,STAT4這一依賴IFN-α信號可能與Th1細胞占優勢相關[14]。本實驗驗證了LPS可通過增加STAT4表達水平誘導肺損傷。
應用STAT4基因敲除小鼠模型,本研究進一步明確了STAT4信號通路在LPS所致肺損傷中起重要作用,STAT4基因敲除可減輕LPS導致的肺損傷。血中CD11b+Gr-1+MDSC在STAT4基因敲除小鼠中增加,以粒系增加為主,Treg細胞在STAT4基因敲除小鼠LPS刺激后也產生明顯變化,這提示STAT4通過調節MDSC和Treg細胞誘發肺損傷。
MDSC具有多種生物學功能,以促進腫瘤細胞的增殖和轉移為典型生物學特征。根據MDSC細胞表型,將其分為粒系(Ly6G+Ly6C-)和單核系(Ly6G-Ly6C+)兩種。研究[15]證明,粒系和單核系MDSC在炎癥反應過程中發揮不同或相反的生物學功能。在LPS刺激的外周血MDSC變化中,STAT4基因敲除主要引起粒系MDSC,即不完全成熟的中性粒細胞變化。但是,粒系MDSC升高后如何進一步保護LPS所誘發的肺損傷尚未完全闡明。Matsukawa等[16]指出,在STAT4基因敲除小鼠體內,中性粒細胞趨化因子MIP-2、角化蛋白趨化物KC明顯減低,髓過氧化物酶也有降低的趨勢,這可能是STAT4基因敲除保護肺組織免受損傷的潛在機制。
LPS刺激后,CD11b+Gr-1+MDSC細胞遷移增加。De Wilde等[17]的研究也指出,LPS刺激后CD11b+Gr-1+MDSC細胞劇增,這些MDSC細胞分泌的IL-10增加。IL-10大量分泌提示Th1細胞反應較為強烈,可進一步加劇炎癥反應[18],進而誘導MDSC和Treg變化;Treg細胞又可分泌IL-10,進一步加重LPS誘導的肺損傷。在STAT4基因敲除小鼠中,這一免疫調控通路被破壞,LPS誘導的肺損傷減輕。本研究中,CD4+CD25+Treg細胞增加,與研究[19]結論一致。這表明STAT4-/-小鼠或可通過調節Treg細胞來抑制LPS誘導的免疫反應,即通過調節MDSC比例和分化來調控LPS誘導的肺損傷。MDSC根據其具有抑制T細胞免疫應答的能力而命名。CD11b、Gr1表達雙陽性是這類細胞的表面分子特征。本研究中,LPS刺激后,STAT4敲除小鼠的MDSC中的粒系MDSC(CD11b+Ly6G+)升高,提示生物體內LPS通過STAT4信號通路調節MDSC的分化來加重肺損傷。
綜上所述,本研究提示STAT4基因敲除可能通過促進血中CD11b+Gr-1+MDSC的聚集來抑制LPS導致的肺部炎癥損傷。其中,MDSC通過增加肺部Treg細胞,發揮該細胞的免疫抑制作用。MDSC可能通過STAT4信號通路調節Treg細胞,進而減輕急性肺損傷。降低STAT4表達水平有望成為治療細菌性肺損傷的潛在靶點。MDSC與Treg細胞之間是否存在關聯尚不明確,有待下一步研究。
[ 1 ] MASON C, DOOLEY N, GRIFFITHS M. Acute respiratory distress syndrome[J]. Clin Med (Lond), 2016,16(Suppl 6):s66-s70.
[ 2 ] ZAMBON M, VINCENT J L. Mortality rates for patients with acute lung injury/ARDS have decreased over time[J]. Chest, 2008,133(5):1120-1127.
[ 3 ] LU Y, SONG Z, ZHOU X, et al. A 12-month clinical survey of incidence and outcome of acute respiratory distress syndrome in Shanghai intensive care units[J]. Intensive Care Med, 2004,30(12):2197-2203.
[ 4 ] TAKEDA K, AKIRA S. STAT family of transcription factors in cytokine-mediated biological responses[J]. Cytokine Growth Factor Rev, 2000,11(3):199-207.
[ 5 ] WAIGHT J D, NETHERBY C, HENSEN M L, et al. Myeloid-derived suppressor cell development is regulated by a STAT/IRF-8 axis[J]. J Clin Invest, 2013, 123(10):4464-4478.
[ 6 ] RéBé C, VéGRAN F, BERGER H, et al. STAT3 activation: a key factor in tumor immunoescape[J]. JAKSTAT, 2013,2(1):e23010.
[ 7 ] YAN D, YANG Q, SHI M, et al. Polyunsaturated fatty acids promote the expansion of myeloid-derived suppressor cells by activating the JAK/STAT3 pathway[J]. Eur J Immunol, 2013,43(11):2943-2955.
[ 8 ] PARKER K H, BEURY D W, OSTRAND-ROSENBERG S. Myeloid-derived suppressor cells: critical cells driving immune suppression in the tumor microenvironment[J]. Adv Cancer Res, 2015,128:95-139.
[ 9 ] RAY P, ARORA M, POE S L, et al. Lung myeloid-derived suppressor cells and regulation of inflammation[J]. Immunol Res, 2011,50(2-3):153-158.
[10] WURSTER A L, TANAKA T, GRUSBY M J. The biology of Stat4 and Stat6[J]. Oncogene, 2000,19(21):2577-2584.
[11] PNIEWSKA E, SOKOLOWSKA M, KUPRYS'-LIPIN'SKA I, et al. Exacerbating factors induce different gene expression profiles in peripheral blood mononuclear cells from asthmatics, patients with chronic obstructive pulmonary disease and healthy subjects[J]. Int Arch Allergy Immunol, 2014,165(4):229-243.
[12] FU C, JIANG L, XU X, et al. STAT4 knockout protects LPS-induced lung injury by increasing of MDSC and promoting of macrophage differentiation[J]. Respir Physiol Neurobiol, 2016,223:16-22.
[13] FRUCHT D M, ARINGER M, GALON J, et al. Stat4 is expressed in activated peripheral blood monocytes, dendritic cells, and macrophages at sites of Th1-mediated inflammation[J]. J Immunol, 2000,164(9):4659-4664.
[14] KAMEZAKI K, SHIMODA K, NUMATA A, et al. The role of Tyk2, Stat1 and Stat4 in LPS-induced endotoxin signals[J]. Int Immunol, 2004,16(8):1173-1179.
[15] WANG H, ZHAO Q, HUANG Z, et al. Variation of subsets of myeloid derived suppressor cells and their ratio in septic mice[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2016,28(2):147-152.
[16] MATSUKAWA A, KAPLAN M H, HOGABOAM C M, et al. Pivotal role of signal transducer and activator of transcription (Stat)4 and Stat6 in the innate immune response during sepsis[J]. J Exp Med, 2001,193(6):679-688.
[17] DE WILDE V, VAN ROMPAEY N, HILL M, et al. Endotoxin-induced myeloid-derived suppressor cells inhibit alloimmune responses via heme oxygenase-1[J]. Am J Transplant, 2009,9(9):2034-2047.
[18] MOLLAZADEH H, CICERO A F G, BLESSO C N, et al. Immune modulation by curcumin: the role of interleukin-10[J]. Crit Rev Food Sci Nutr, 2017.
[19] D’ALESSIO F R, TSUSHIMA K, AGGARWAL N R, et al. CD4+CD25+Foxp3+Tregs resolve experimental lung injury in miceand are present in humans with acute lung injury[J]. J Clin Invest, 2009,119(10):2898-2913.
[本文編輯] 廖曉瑜, 賈澤軍
Effect of STAT4 on LPS induced acute lung injury of mice
LIU Xin1,2, WU Xiao-dan2*
1. Department of Respiratory Medicine, Gerontal Hospital of Fujian Province, Fuzhou 350000, Fujian, China2. Department of Respiratory Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To discuss the effect of signal transducer and activator of transcription 4 (STAT4) in bacteria-lipopolysaccharide (LPS) induced acute lung injury (ALI) on mice.Methods: Mice with gene STAT4 knocked out (STAT4-/-) were used. In the models of LPS induced ALI model, arterial blood gas analysis was utilized, and change of myeloid-derived suppressor cells (MDSCs) and regulator CD4+CD25+Treg cells were observed using flow cytometry. Pulmonary inflammatory cells were analyzed by Wright stain.Results: In the models of LPS induced ALI, lung injury was alleviated in STAT4-/-mice compared to wild type (WT) mice. PaO2/FiO2was higher, histological score was lower, lung wet/dry ratio decreased, MDSCs and CD4+CD25+Treg cells were increased, total number of inflammatory cells and neutrophils were higher in STAT4-/-mice compared to WT mice (P<0.05).Conclusions: Deficiency of STAT4 could alleviate LPS induced ALI. The potential mechanism may be associated with increased ratios of MDSCs and CD4+CD25+Treg cells in the blood.
signal transducer and activator of transcription 4; lipopolysaccharide; lung injury
R 655.3
A
2017-07-21 [接受日期] 2017-08-17
國家自然科學基金(81500058),上海市衛生和計劃生育委員會課題(15GWZK0102),上海市公共衛生三年行動計劃重點學科建設項目傳染病與衛生微生物學(2016/01-2017/12),福建省自然科學基金面上項目(2017J01140). Supported by National Natural Science Foundation of Youth Science Fund Project (81500058), Shanghai Municipal Health and Family Planning Commission (15GWZK0102), Shanghai City Public Health Three-Year Action Plan for Key Discipline Construction of Infectious Diseases and Health Microbiology (2016/01-2017/12) , and Natural Science Foundation Project of Fujian Province (2017J01140).
劉 歆,碩士,主治醫師. E-mail: liuxinxigua@163.com
*通信作者(Corresponding author). Tel: 021-64041990, E-mail: follow_the_line@163.com
10.12025/j.issn.1008-6358.2017.20170616

