二氫楊梅素通過STAT3/Bcl-2信號通路促進HNSCC細胞自噬和凋亡
王滿英, 丁小軍, 孫 揚, 余優成
復旦大學附屬中山醫院口腔科, 上海 200032
·短篇論著·
二氫楊梅素通過STAT3/Bcl-2信號通路促進HNSCC細胞自噬和凋亡
王滿英, 丁小軍*, 孫 揚, 余優成
復旦大學附屬中山醫院口腔科, 上海 200032
目的: 探討二氫楊梅素(DHM)對人頭頸鱗癌(HNSCC)細胞增殖及凋亡的影響。方法: 分別用不同濃度(12.5、25、50 μmol/L)DHM處理人HNSCC SCC-25細胞6、12、24 h,用流式細胞儀檢測SCC-25細胞凋亡情況;用細胞免疫熒光法觀察SCC-25細胞中自噬小體產生情況;Western 印跡法檢測SCC-25凋亡和自噬標志物的表達。結果: 12.5、25、50 μmol/L的DHM處理24 h后,SCC-25細胞凋亡逐漸增加;細胞中凋亡標志物CL-PARP、Bax、CL-casp3逐漸增加,Bcl-2逐漸減少(P<0.05)。12.5、25、50 μmol/L的DHM處理24 h后,SCC-25細胞自噬逐漸增強;自噬標志指標p-STAT3表達上調,LC3Ⅱ/LC3Ⅰ的比值逐漸加大,Beclin 1增加,p62逐漸減少(P<0.05)。抑制自噬能促進DHM誘導的SCC-25細胞凋亡,細胞凋亡標志物CL-PARP、Bax增加,Bcl-2減少(P<0.05)。結論: DHM能誘導HNSCC細胞凋亡及自噬,其機制與STAT3相關信號通路有關;抑制自噬能促進DHM誘導的HNSCC細胞凋亡。
頭頸鱗狀細胞癌;二氫楊梅素;凋亡;自噬
頭頸部鱗狀細胞癌(head and neck squamous cell carcinoma,HNSCC)是世界范圍內第六大常見的癌癥,每年新增病例約600 000例[1]。盡管隨著分子生物學和細胞生物學技術的不斷發展,HNSCC的診斷和治療方法也在不斷進步,然而近30年來并未明顯提高HNSCC患者的生存率[1]。其原因在于HNSCC易遠處轉移、局部區域復發,且對現階段化療方案的耐藥性較高[2]。
二氫楊梅素(dihydromyricetin,DHM),又名蛇葡萄素,其化學名為3,5,7,3’,4’,5’-六羥基2,3雙氫黃酮醇,是一種天然的黃酮類化合物,廣泛存在于葡萄科蛇葡萄屬植物中[3]。近年來,大量研究表明DHM對人肝癌、人乳腺癌、卵巢癌、肺癌細胞等具有較強的體外抑制作用[4-9],DHM的抗腫瘤活性作用不斷得到重視。本研究通過分析DHM對HNSCC細胞凋亡及自噬的影響,初步探討DHM抗HNSCC的機制,以期為HNSCC的臨床治療提供新的靶點,提高療效。
1 材料與方法
1.1 材 料 SCC-25細胞株購買于中國科學院上海生命科學研究院細胞資源中心。DMEM培養基購買于美國Gibco公司,胎牛血清購買于杭州四季青生物工程材料有限公司;DHM購買于美國Selleck公司 ;CL-PARP、Bcl-2、Bax、LC3、Beclin 1、p62、兔抗人STAT3、p-STAT3抗體購買于美國CST公司,鼠抗人GAPDH抗體購買于英國Abcam公司;3-MA、ATG5-siRNA購買于美國Santa公司;Caspase-3試劑盒購自碧云天生物有限公司。
1.2 細胞培養 SCC-25細胞接種在胎牛血清(體積濃度為10%)并含100 U/L青霉素、100 mg/L鏈霉素的新鮮DMEM培養液中培養,培養條件為37℃、飽和濕度、5% CO2[10]。
1.3 流式細胞學分析 選取對數生長期的SCC-25細胞制成單細胞懸液,接種于12孔板,密度為每孔2×105/mL。培養24 h 后,分別加入含有12.5、25、50 μmol/L DHM的培養液,于離心管251.55×g離心10 min,棄上清,加入固定液(預冷的75%乙醇)1 mL,4℃過夜。第2天轉移至5 mL EP管中,111.8×g離心10 min,棄上清。用標記凋亡細胞的異硫氰酸熒光素(fluorescein isothiocyanate,FITC)標記膜聯蛋白Ⅴ或標記壞死細胞的熒光染料碘化丙啶處理后,4℃避光條件下靜置2 h,置于流式細胞儀進行檢測。每組重復3個樣本,重復實驗3次。
1.4 Western 印跡法檢測凋亡指標 取對數生長期的SCC-25細胞,消化后以每孔2 mL的量接種于6孔板中,細胞密度為(2.0~3.0)×106/mL。培養條件為37℃、5%CO2。培養24 h后,分別加入12.5、25、50 μmol/L的DHM,培養 6、12、24 h后,提取細胞總蛋白,Western 印跡法檢測凋亡指標(CL-PARP、Bcl-2、Bax)及自噬指標(LC3、Beclin 1、p62)蛋白的表達。用Image J 軟件掃描各條帶進行半定量分析,以上述目的蛋白電泳條帶灰度值與內參照GAPDH條帶灰度值的比值作為各蛋白的相對表達水平。實驗重復3次。
1.5 酶法檢測caspase-3活性 細胞加入自噬的抑制劑3-MA和敲除自噬成膜特異性基因ATG5處理后,加入50 μmol/L的DHM處理24 h后,胰酶消化,并用細胞裂解液裂解,離心取上清,按照碧云天說明書進行caspase-3活性的檢測[11]。
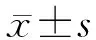
2 結 果
2.1 DHM誘導SCC-25細胞凋亡 12.5、25、50 μmol/L 的DHM處理SCC-25細胞24 h后,細胞凋亡率分別為6.00%、24.93%及38.17%(圖1A)。Western 印跡檢測發現,CL-PARP、Bax、CL-casp3隨著DHM濃度的增加而增加,Bcl-2則隨著DHM濃度的增加而減少(P<0.05,圖1B)。用50 μmol/L的DHM分別處理SCC-25細胞6、12、24 h后,CL-PARP、Bax及CL-casp3逐漸增加,而Bcl-2逐漸減少(P<0.05,圖1C)。
2.2 DHM誘導SCC-25細胞自噬 免疫熒光檢測結果顯示,培養 24 h后,LC3陽性細胞數隨DHM濃度的增加而增加(P<0.05,圖2A)。Western 印跡檢測發現,隨著DHM濃度的增加或時間的延長,LC3Ⅱ/LC3Ⅰ的比值逐漸加大,Beclin 1增加,而p62逐漸減少(P<0.05,圖2B、2C)。
2.3 DHM通過靶向影響STAT3促進SCC-25細胞自噬 Western 印跡結果表明,培養24 h后,隨著DHM濃度的增加,磷酸化STAT3蛋白逐漸增加(P<0.05, 圖3A)。DHM 50 μmol/L處理SCC-25細胞6、12、24 h后,p-STAT3表達逐漸增加(P<0.05, 圖3B)。用STAT3的特異性抑制劑NSC74859抑制SCC-25細胞中p-STAT3的表達24 h后,再用50 μmol/L的DHM處理SCC-25細胞24 h,結果發現,細胞自噬水平下降(LC3Ⅱ/LC3Ⅰ比值下降),細胞凋亡水平升高(CL-PARP、Bax的表達增加,Bcl-2表達降低;P<0.05, 圖3C)。
2.4 抑制自噬顯著增強DHM引起的SCC-25細胞凋亡 通過使用自噬的抑制劑3-MA和敲除自噬成膜特異性基因ATG5觀察自噬抑制后對凋亡的影響。50 μmol/L的 DHM處理SCC-25細胞后,細胞中的caspase-3活性增強;3-MA和ATG5 si-RNA處理后,caspase-3活性進一步增強(P<0.05,圖4)。
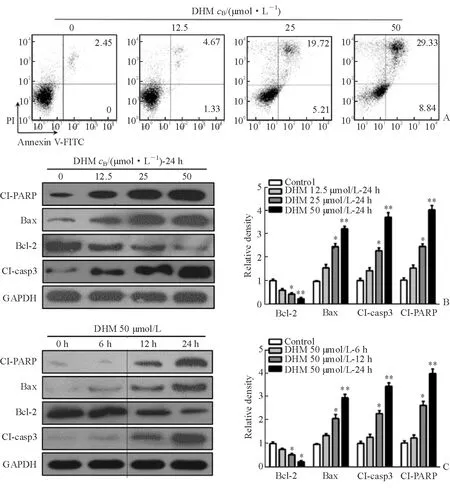
圖1 DHM誘導SCC-25細胞凋亡
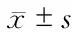
3 討 論
部分癌癥患者對化療藥物不敏感或耐受,因此,亟需發現一些潛在的治療癌癥的藥物。DHM有多種生物學效應[12-16],如抗毒性、抗腫瘤及抗乙醇中毒活性。但是,DHM抗腫瘤的具體機制目前尚不清楚。研究[17]顯示,DHM可以通過p53相關信號通路促進人類胃癌細胞凋亡。研究[18]發現,在人類肝癌細胞中,DHM通過p53/Bcl-2信號通路協同萘達鉑的殺腫瘤效應。本研究中,DHM可以誘導SCC-25細胞自噬及凋亡,凋亡相關蛋白CL-PARP、Bcl-2、Bax、Cl-casp3及自噬相關蛋白LC3、Beclin 1、p62表達改變,且p-STAT3表達增加。
細胞自噬普遍存在于真核細胞中[19]。自噬在生物體存活中起著雙刃劍的作用:一方面細胞可以通過自噬吸取能量來維持細胞正常的新陳代謝;另一方面,自噬可以導致細胞死亡。本研究中,首先用3-MA抑制細胞的自噬過程,再用DHM處理腫瘤細胞,發現細胞中caspase-3活性增強;然后,在基因水平上沉默自噬過程中起決定作用的ATG5基因,再用DHM處理腫瘤細胞,發現細胞中caspase-3的活性也增強。結果說明,在HNSCC細胞中,DHM引起的細胞自噬對腫瘤細胞起保護作用。
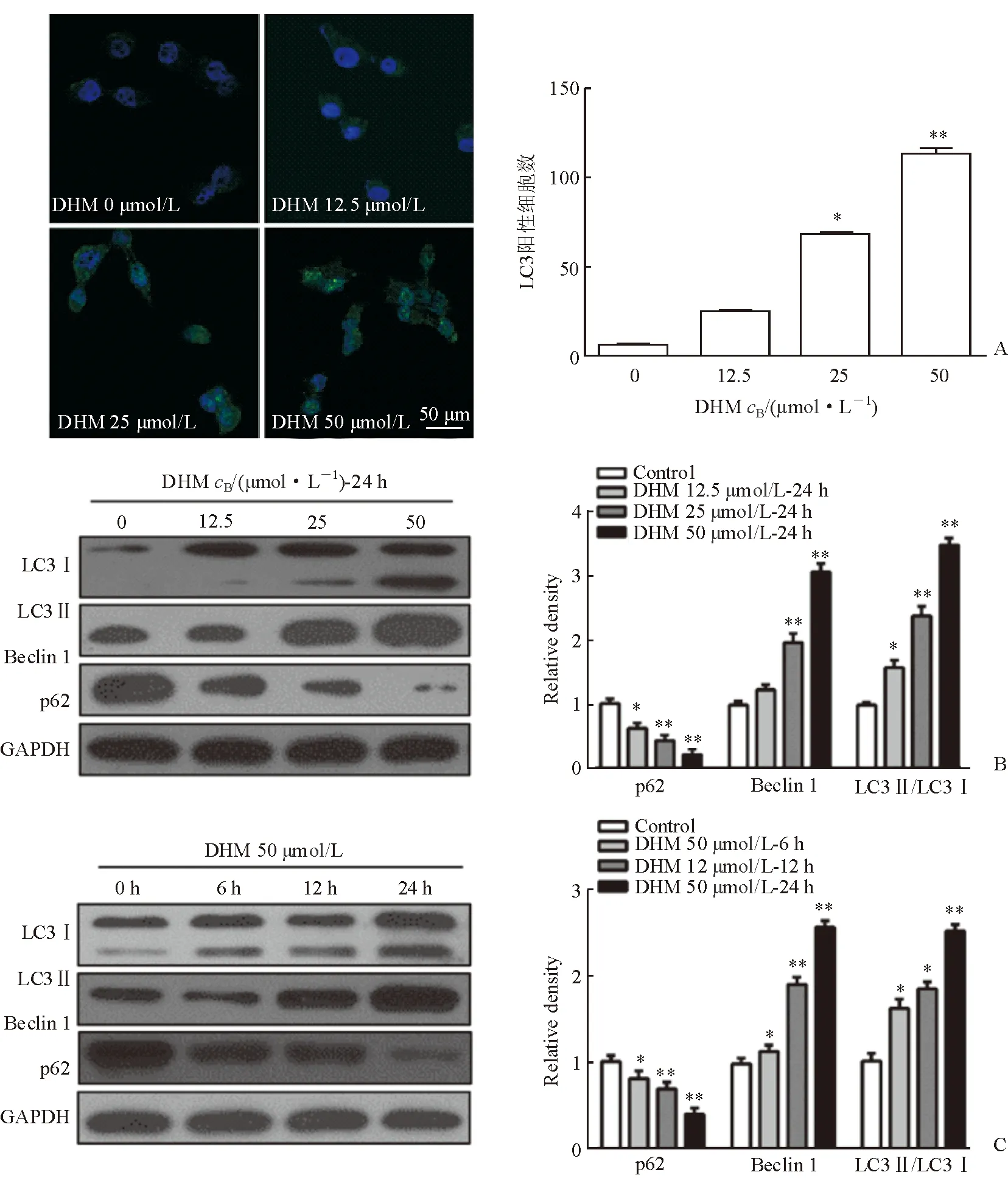
圖2 DHM誘導SCC-25細胞自噬
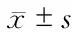
STAT3是信號轉導和轉錄激活因子家族的重要成員之一。持續激活STAT3信號轉導通路可導致腫瘤發生、發展。體內外使某些腫瘤細胞中的STAT3信號通路被阻斷,可使細胞的增殖和存活被抑制,并誘導細胞自噬[20]。本研究發現,p-STAT3的表達隨DHM濃度的增加而增加;用p-STAT3特異性抑制劑NSC74859抑制p-STAT3的活性后,DHM所導致的腫瘤細胞自噬減少,而DHM所引起的腫瘤細胞凋亡增多。
綜上所述,本研究結果表明,人HNSCC細胞凋亡及自噬水平可在DHM所誘導下升高,其機制可能與STAT3信號通路相關,提示抑制自噬可使DHM的抗癌能力顯著增強,DHM聯合應用抗自噬藥物會加強抗腫瘤效應。但是,目前國內外基于DHM抗腫瘤效應的研究中,各種腫瘤細胞對DHM的敏感性機制并不一致[4-9]。本研究證明,DHM可誘導自噬和凋亡,而STAT3信號的研究說明引起的自噬起保護作用,為了增加DHM的殺腫瘤效應可以聯合使用自噬抑制劑。
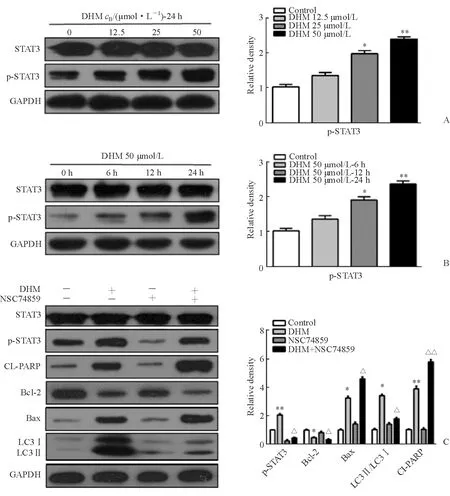
圖3 DHM通過促進p-STAT3的表達影響SCC-25細胞自噬及凋亡蛋白的表達
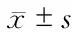
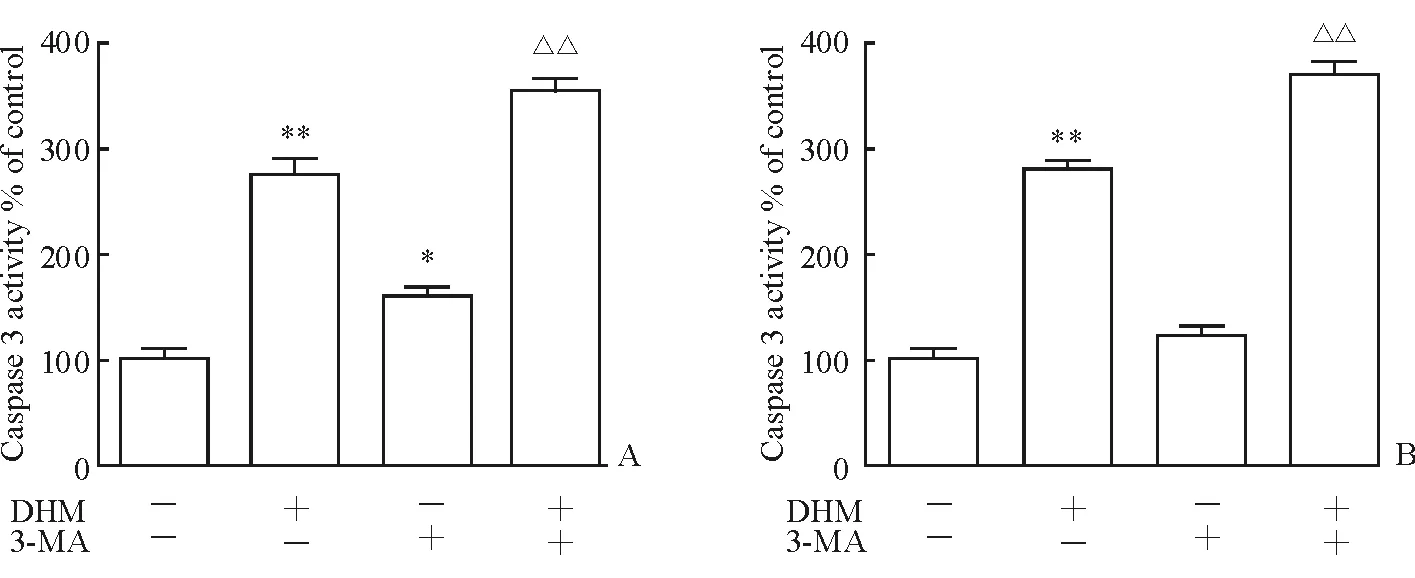
圖4 3-MA(A)和ATG5 si-RNA(B)抑制自噬增強DHM對SCC-25細胞中caspase-3活性的增強效應
[ 1 ] AMINUDDIN A, NG P Y. Promising druggable target in head and neck squamous cell carcinoma: wnt signaling[J]. Fronti in Pharmacol, 2016,7:244.
[ 2 ] MARTIN A, SALVADOR F, MORENO-BUENO G, et al. Lysyl oxidase-like 2 represses Notch1 expression in the skin to promote squamous cell carcinoma progression[J]. EMBO J, 2015,34(8):1090-1109.
[ 3 ] WONG I L, WANG B C, YUAN J, et al. Potent and nontoxic chemosensitizer of P-glycoprotein-mediated multidrug resistance in cancer: synthesis and evaluation of methylated epigallocatechin, gallocatechin, and dihydromyricetin derivatives[J]. J Med Chem, 2015,58(11):4529-4549.
[ 4 ] ROY K, KANWAR R K, KRISHNAKUMAR S, et al. Competitive inhibition of survivin using a cell-permeable recombinant protein induces cancer-specific apoptosis in colon cancer model[J]. Int J Nanomedicine, 2015,10:1019-1043.
[ 5 ] ZHANG K, LI Y, LIU W, et al. Silencing survivin expression inhibits the tumor growth of non-small-cell lung cancer cells in vitro and in vivo[J]. Mol Med Rep, 2015,11(1):639-644.
[ 6 ] LIU B, ZHOU W, CHEN X, et al. Dihydromyricetin induces mouse hepatoma Hepal-6 cell apoptosis via the transforming growth factor-beta pathway[J]. Mol Med Rep, 2015,11(3):1609-1614.
[ 7 ] ZHOU Y, SHU F, LIANG X, et al. Ampelopsin induces cell growth inhibition and apoptosis in breast cancer cells through ROS generation and endoplasmic reticulum stress pathway[J]. PLoS One, 2014,9(2):e89021.
[ 8 ] ZHANG Q Y, LI R, ZENG G F, et al. Dihydromyricetin inhibits migration and invasion of hepatoma cells through regulation of MMP-9 expression[J]. World J Gastroenterol, 2014,20(29):10082-10093.
[ 9 ] XU Y, WANG S, CHAN H F, et al. Dihydromyricetin Induces Apoptosis and Reverses Drug Resistance in Ovarian Cancer Cells by p53-mediated Downregulation of Survivin[J]. Sci Rep, 2017,7:46060.
[10] WANG Y F, ZHANG W, HE K F, et al. Induction of autophagy-dependent cell death by the survivin suppressant YM155 in salivary adenoid cystic carcinoma[J]. Apoptosis, 2014,19(4):748-758.
[11] LI Z L, HU J, LI Y L, et al. The effect of hyperoside on the functional recovery of the ischemic/reperfused isolated rat heart: potential involvement of the extracellular signal-regulated kinase 1/2 signaling pathway[J]. Free Radic Biol Med, 2013,57:132-140.
[12] LIU B, TAN X, LIANG J, et al. A reduction in reactive oxygen species contributes to dihydromyricetin-induced apoptosis in human hepatocellular carcinoma cells[J]. Sci Rep, 2014,4:7041.
[13] MENG G, YANG S, CHEN Y, et al. Attenuating effects of dihydromyricetin on angiotensin Ⅱ-induced rat cardiomyocyte hypertrophy related to antioxidative activity in a NO-dependent manner[J]. Pharm Biol, 2015,53(6):904-912.
[14] SHEN Y, LINDEMEYER A K, GONZALEZ C, et al. Dihydromyricetin as a novel anti-alcohol intoxication medication[J]. J Neurosci, 2012,32(1):390-401.
[15] YE L, WANG H, DUNCAN S E, et al. Antioxidant activities of Vine Tea (Ampelopsis grossedentata) extract and its major component dihydromyricetin in soybean oil and cooked ground beef[J]. Food Chem, 2015,172:416-422.
[16] LIU B, ZHOU W, CHEN X, et al. Dihydromyricetin induces mouse hepatoma Hepal-6 cell apoptosis via the transforming growth factor-beta pathway[J]. Mol Med Rep, 2015,11(3):1609-1614.
[17] JI F J, TIAN X F, LIU X W, et al. Dihydromyricetin induces cell apoptosis via a p53-related pathway in AGS human gastric cancer cells[J]. Genet Mol Res, 2015,14(4):15564-15571.
[18] XIE J, LIU J, CHEN T M, et al. Dihydromyricetin alleviates carbon tetrachloride-induced acute liver injuryviaJNK-dependent mechanism in mice[J]. World J Gastroenterol, 2015,21(18):5473-5481.
[19] KLIONSKY D J, ABDALLA F C, ABELIOVICH H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy, 2012,8(4):445-544.
[20] MALI S B. Review of STAT3 (signal transducers and activators of transcription) in head and neck cancer[J]. Oral Oncol, 2015,51(6):565-569.
[本文編輯] 姬靜芳
Dihydromyricetin promotes autophagy and apoptosis in head and neck squamous cell carcinoma cells through STAT3/Bcl-2 signaling pathway
WANG Man-ying, DING Xiao-jun*, SUN Yang, YU You-cheng
Department of Stomatology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To study the effects of dihydromyricetin (DHM) on cell proliferation and apoptosis of head and neck squamous cell carcinoma (HNSCC).Methods: SCC-25 cancer cells were treated with 12.5, 25, 50 μmol/L DHM for 6, 12, and 24 h. SCC-25 cell apoptosis was detected by flow cytometry. Immunofluorescence was used to observe the emergence of autophagosomes in HNSCC cells. Western blotting was used to detect the expression of apoptosis and autophagy markers in SCC-25.Results: After treatment of 12.5, 25, and 50 μmol/L DHM for 24 h, the apoptosis of SCC-25 cells gradually increased; the apoptotic markers CL-PARP, Bax, and CL-casp3 gradually increased and Bcl-2 gradually decreased (P<0.05). After treatment of 12.5, 25, and 50 μmol/L DHM for 24 h, in line with the apoptosis, the autophagy markers of SCC-25 cells gradually changed, the p-STAT3 expression was up-regulated; the ratio of LC3 Ⅱ /LC3 Ⅰ gradually increased, Beclin 1 increased, p62 gradually decreased (P<0.05). Inhibition of autophagy could promote apoptosis of SCC-25 cells which were induced by DHM, increase apoptosis markers CL-PARP and Bax, and decrease Bcl-2 (P<0.05).Conclusions: DHM can induce apoptosis and increase autophagy of HNSCC cells. The mechanism is related to STAT3 signaling pathway. Inhibition of autophagy can promote apoptosis of HNSCC cells induced by DHM.
head and neck squamous cell carcinoma;dihydromyricetin; apoptosis; autophagy
R 739.91
A
2016-10-17 [接受日期] 2017-01-14
王滿英, 碩士生. E-mail:14211210070@fudan.edu.cn
*通信作者(Corresponding author). Tel: 021-64041990-2585, E-mail:dingxiaojun@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20160961

