葡聚糖微柱離心法測定多西紫杉醇脂質體包封率影響因素考察
徐 緩, 韓 東,2, 汪曉嬋, 高藝源, 王 倩, 孫 蕾
(1.遼寧師范大學 化學化工學院,遼寧 大連 116029; 2.大連市藥品檢驗所,遼寧 大連 116029)
葡聚糖微柱離心法測定多西紫杉醇脂質體包封率影響因素考察
徐 緩1, 韓 東1,2, 汪曉嬋1, 高藝源1, 王 倩1, 孫 蕾1
(1.遼寧師范大學 化學化工學院,遼寧 大連 116029; 2.大連市藥品檢驗所,遼寧 大連 116029)
建立多西紫杉醇(Docetaxel,DOC)脂質體包封率的測定方法,利用高效液相色譜法測定DOC的含量.采用葡聚糖凝膠微柱離心法分離脂質體與DOC,系統考察不同因素對脂質體過柱率的影響,篩選最優方案進行DOC脂質體包封率的測定.結果表明:在1~60 mg/L的范圍內DOC的濃度與峰面積線性關系良好(r=0.999 9).在離心力2 000 g、離心時間15 min、脂質體吸附20 min、預飽和脂質體用量150 μL、預飽和次數3次、脂質體上樣量150 μL為測定DOC脂質體包封率的最佳條件.利用該方法測得DOC脂質體的包封率為(87.76±2.65)%,該方法簡便快速,重復性好.
多西紫杉醇;脂質體;葡聚糖凝膠;微柱離心法;包封率
包封率是評價脂質體質量的重要指標之一,高包封效率可以避免后期分子生物學實驗和動物實驗對未包封藥物和脂質體的進一步分離處理,此外,包封率測定存在誤差會增加處方篩選階段工作的煩瑣性和不必要的浪費.因此準確的測定包封率的方法尤為重要.目前,葡聚糖微柱離心法以其分離速度快、對樣品稀釋倍數較小和操作簡便等優點而備受關注[1-3],在利用葡聚糖微柱離心法測定脂質體包封率時通常會對游離藥物過柱率、空白脂質體過柱率等進行考察,而脂質體吸附時間、空白脂質體對微柱的預飽和用量、微柱預飽和次數、離心時間、離心力等會影響包封率數值的因素少見詳細的方法學考察.
紫杉醇因對乳腺癌、卵巢癌、肺癌等有良好的臨床療效[4],多西紫杉醇(Docetaxel,DOC)是紫杉醇的一種半合成產物,分子式為C43H53NO14,研究表明:與紫杉醇相比,DOC以較高的生物利用度、更為優異的廣譜抗癌作用和更長的半衰期在臨床上被廣泛應用[5].由于DOC水溶性差,給藥時需使用吐溫80和乙醇作為復合溶媒助溶,該溶劑系統在使用時易引起許多不良反應,如過敏反應和溶血等[6],因此使用前需服用抗過敏藥物,給患者帶來極大的不便和痛苦.目前,以脂質體作為DOC的遞送載體的研究較多[7-8],本研究以空白脂質體和DOC脂質體為模型,擬對上述影響脂質體包封率測定的因素進行綜合評價,篩選出合適的測定DOC脂質體包封率的測定方法,為DOC脂質體包封率的測定提供參考.
1 實驗部分
1.1 試劑與儀器
DOC(北京華奉聯博科技有限公司);大豆磷脂(上海艾偉特科技有限公司);膽固醇(Biosharp公司,日本);曲拉通(Triton X100,國藥集團化學試劑有限公司);葡聚糖凝膠(Sephadex G-25,北京夢怡美生物科技有限公司);氯仿、甲醇(Methanol)、磷酸二氫鈉、磷酸氫二鈉(天津市科密歐化學試劑有限公司).
FA1204B電子天平、752N紫外可見分光光度計(上海精密科學儀器有限公司);DF-101S恒溫加熱磁力攪拌器(予華儀器有限責任公司);JY92-2D超聲波細胞破碎儀(寧波新芝生物科技有限公司);KQ5200B型高功率數控超聲波清洗器(昆山市超聲儀器有限公司);LC-100高效液相色譜儀(上海伍峰科學儀器有限公司);SC-05離心機(安徽中科中佳科學儀器有限公司);移液槍(Thermo Fisher Scientific,上海).
1.2 DOC含量測定方法的建立
1.2.1 DOC含量測定色譜條件 利用LC-100高效液相色譜儀采用外標法測定DOC的含量,色譜條件如下:色譜柱:C18反相色譜柱(200 mm×4.6 mm,5 μm,大連伊利特分析儀器有限公司);流動相:乙腈-水(55∶45,V∶V);檢測波長:230 nm;流速:1 mL/min;進樣量:20 μL;柱溫:室溫.
1.2.2 方法專屬性實驗 分別取0.1 mL空白脂質體和DOC脂質體,以甲醇稀釋至5 mL,即可得到澄清溶液,過0.45 μm微孔濾膜,得到破乳的空白脂質體和DOC脂質體.分別移取20 μL甲醇、甲醇破乳的空白脂質體、DOC標準品溶液和甲醇破乳的DOC脂質體溶液,HPLC進樣檢測,記錄樣品峰面積.
1.2.3 DOC標準曲線的繪制 取適量DOC母液,甲醇逐級稀釋得到1、10、20、30、40、50、60 mg/L 濃度的DOC標準溶液,進樣20 μL檢測樣品峰面積,以濃度為橫坐標、峰面積為縱坐標得到DOC的標準曲線.
1.2.4 精密度試驗和回收率試驗 移取適量DOC母液配制1、30、60 mg/L DOC溶液,于1 d中1、3、5、7、9 h進樣檢測得到日內的相對標準偏差(RSD)(n=3).另外于第1、2、3、4、5天進樣測定峰面積計算日間RSD(n=3).分別移取適量1、30、60 mg/L的DOC溶液于2 mL容量瓶中,再分別向其中加100 μL空白脂質體,甲醇稀釋至刻度后充分混勻,每個樣品取20 μL進樣檢測(n=3),記錄峰面積,根據外標一點法計算回收率.
1.3 脂質體的制備
薄膜分散的方法制備脂質體,稱取m(大豆卵磷脂)∶m(膽固醇)=3∶1,置入茄形瓶內,加5 mL 氯仿(含或不含DOC,藥脂比為1∶20,m∶m),于37 ℃水浴中減壓旋轉蒸發完全除掉溶劑.加入適量PBS(pH 7.4)手搖水化得到大單室脂質體,進一步利用細胞粉碎儀探頭超生工藝(200 W/2 min、400 W/2 min、600 W/4 min)對粗分散脂質體進行處理后,利用0.45、0.22 μm的微孔濾膜整粒,分別得到空白脂質體和DOC脂質體,置于4 ℃冰箱備用.
1.4 葡聚糖凝膠柱測定DOC脂質體包封率的方法學考察
1.4.1 葡聚糖凝膠微柱的制備 取2.5 mL注射器去掉內芯,剪下合適大小的墊片墊入其中,將浸泡好(去離子水中室溫浸泡24 h)的Sephadex G-25分少量多次加入其中,直至加滿注射器并且下端不再有水流下,靜置一段時間后放入低速離心機,離心力設定為1 000 g離心5 min,得到高度約2 cm的獨立凝膠柱即可[2-3].
1.4.2 離心力對空白脂質體過柱率的影響 移取100 μL空白脂質體,逐滴加入到已預飽和的Sephadex G-25柱頂端,靜置吸附20 min,然后以不同離心力(1 000、1 500和2 000 g)離心15 min,收集濾液于5 mL容量瓶中,以水定容利用紫外分光光度計在波長450 nm處測定吸光度,記為A;另移取空白脂質體100 μL,直接以水稀釋至5 mL,在450 nm波長處測定吸光度,記為A0.利用公式(1)計算過柱率.
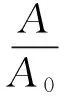
(1)
1.4.3 離心時間對空白脂質體過柱率的影響 移取100 μL空白脂質體2份,1份逐滴加到已預飽和的Sephadex G-25柱頂端,靜置吸附10 min,設定離心力為2 000 g,離心不同時間(5、10、15、20、30 min)后收集溶液,去離子水洗滌離心管,洗液一并加入5 mL容量瓶定容,渦旋混勻,在波長450 nm處測定吸光度,記為A;另1份直接以水稀釋至5 mL,在450 nm波長處測定吸光度,記為A0,利用公式(1)計算過柱率.
1.4.4 脂質體吸附時間的考察 將加滿Sephadex G-25的微柱分成4組,移取100 μL空白脂質小心加于凝膠柱頂端,靜置5 min,放置低速離心機中配平離心5 min,預飽和凝膠柱.另移取2份100 μL空白脂質體,其中,1份置于5 mL的容量瓶中定容,混勻,于紫外分光光度計在450 nm波長條件測定其吸光度,記為A0;另1份加至Sephadex G-25 微柱頂端,分別吸附不同時間(5、10、20、30 min),離心力設定為2 000 g,離心15 min,用移液槍將離心液小心轉入5 mL的容量瓶中,洗滌離心管3次,洗液一并加入容量瓶,最后以去離子水定容,混勻,450 nm波長處測定其吸光度,記為A.利用公式(1)計算過柱率.
1.4.5 Sephadex G-25對空白脂質體的吸附 移取空白脂質體50、100、150、200 μL各2份.1份置于5 mL的容量瓶中定容,混勻,于紫外分光光度計450 nm波長處測定其吸光度,記為A0;另1份加至預飽和Sephadex G-25微柱的頂端,于2 000 g離心15 min后,將離心液轉移至5 mL 容量瓶中,少量水洗滌離心管3次,洗液一并加入容量瓶,最后以水定容,充分混勻,450 nm波長處測定其吸光度,記為A,繼續滴加100 μL PBS(pH 7.4)至Sephadex G-25微柱頂端,測定方法同上,重復洗滌5次,分別記錄吸光度為A1、A2、A3、A4和A5.
1.4.6 預飽和空白脂質體用量考察 取體積為50、100、150、200 μL的空白脂質體各1份,小心滴加到Sephadex G-25柱頂端.上樣后的Sephadex G-25柱靜置5 min,其后以2 000 g離心力配平后離心3 min(預飽和凝膠柱).另取100 μL空白脂質體若干份,分別加到不同體積空白脂質體預飽和的Sephadex G-25柱頂端,靜置5 min后放入離心機配平后2 000 g離心15 min,少量水洗滌離心管3次,合并洗液至容量瓶內,以水稀釋至刻度,以紫外分光光度計在450 nm處測定其吸光度,記作A.另1份100 μL脂質體混懸液直接轉移到5 mL容量瓶中定容,同法測定吸光度,記為A0,利用公式(1)計算過柱率.
1.4.7 空白脂質體預飽和Sephadex G-25柱次數的考察 取空白脂質體100 μL 2份:1份直接置于5 mL量瓶中,稀釋至刻度,混勻,于450 nm波長處測定其吸光度,即為A0;另1份樣品小心加至Sephadex G-25微柱的頂端,設定離心力為2 000 g,離心15 min.然后將管內液體小心轉移至5 mL容量瓶中,去離子水洗滌離心管3次,合并洗液至容量瓶內,以水稀釋至刻度,充分混勻,于450 nm波長處測定其吸光度,即為A.繼續滴加空白脂質體100 μL至SephadexG-25微柱頂端,同法測定,重復上樣空白脂質體5次,平行操作3次.
1.4.8 脂質體上樣量對其過柱率的影響 移取體積為50、100、150 μL的空白脂質體各2份,1份小心滴加到已預飽和的Sephadex G-25柱頂端.將上樣后的凝膠柱靜置10 min,設定離心力為2 000 g,離心15 min,然后將管內的脂質體混懸液合并于5 mL容量瓶定容,在波長450 nm處測定吸光度,記為A.另1份脂質體混懸液直接以水稀釋至5 mL,在450 nm波長條件下測定吸光度,記為A0.根據公式(1)計算空白脂質體的過柱率.
1.4.9 凝膠柱對DOC的吸附考察
取40、50、60 mg/L的DOC溶液各2份,移取100 μL不同濃度的DOC溶液以甲醇定容到5 mL,通過HPLC測定峰面積記為AP0.另取100 μL不同濃度的DOC溶液滴加到Sephadex G-25柱頂端.將上樣后的Sephadex G-25柱靜置適當時間,其后以2 000 g離心力配平后離心15 min,將離心管內的混合液以甲醇定容到5 mL,通過高效液相色譜測定峰面積記為AP(n=3),根據公式(2)計算游離DOC的過柱率.
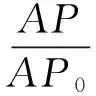
(2)
1.5 DOC脂質體包封率的測定
移取100 μL DOC脂質體2份.1份DOC脂質體直接定容到2 mL,渦旋混勻,移取20 μL進樣,記錄峰面積并計算濃度記為c0;另1份小心滴加到150 μL空白脂質體預飽和后的 Sephadex G-25柱頂端,緩慢滴液勿使脂質體混懸液沖散凝膠柱.上樣后吸附20 min,設定離心力為2 000 g時間20 min,離心后將管內的混合液小心移入2 mL容量瓶中,洗滌離心管2~3次后定容,移取20 μL進樣檢測,記錄峰面積并計算濃度記作c(n=3),根據公式(3)計算DOC脂質體包封率.
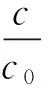
(3)
2 結果與討論
2.1 DOC含量分析方法建立
2.1.1 方法專屬性 由圖1B可知,在230 nm檢測波長下DOC的保留時間為5.31 min,峰形良好.根據甲醇(圖1A)、空白脂質體(圖1C)和DOC脂質體(圖1D)色譜圖判斷溶劑和脂質體對DOC的含量測定無干擾.
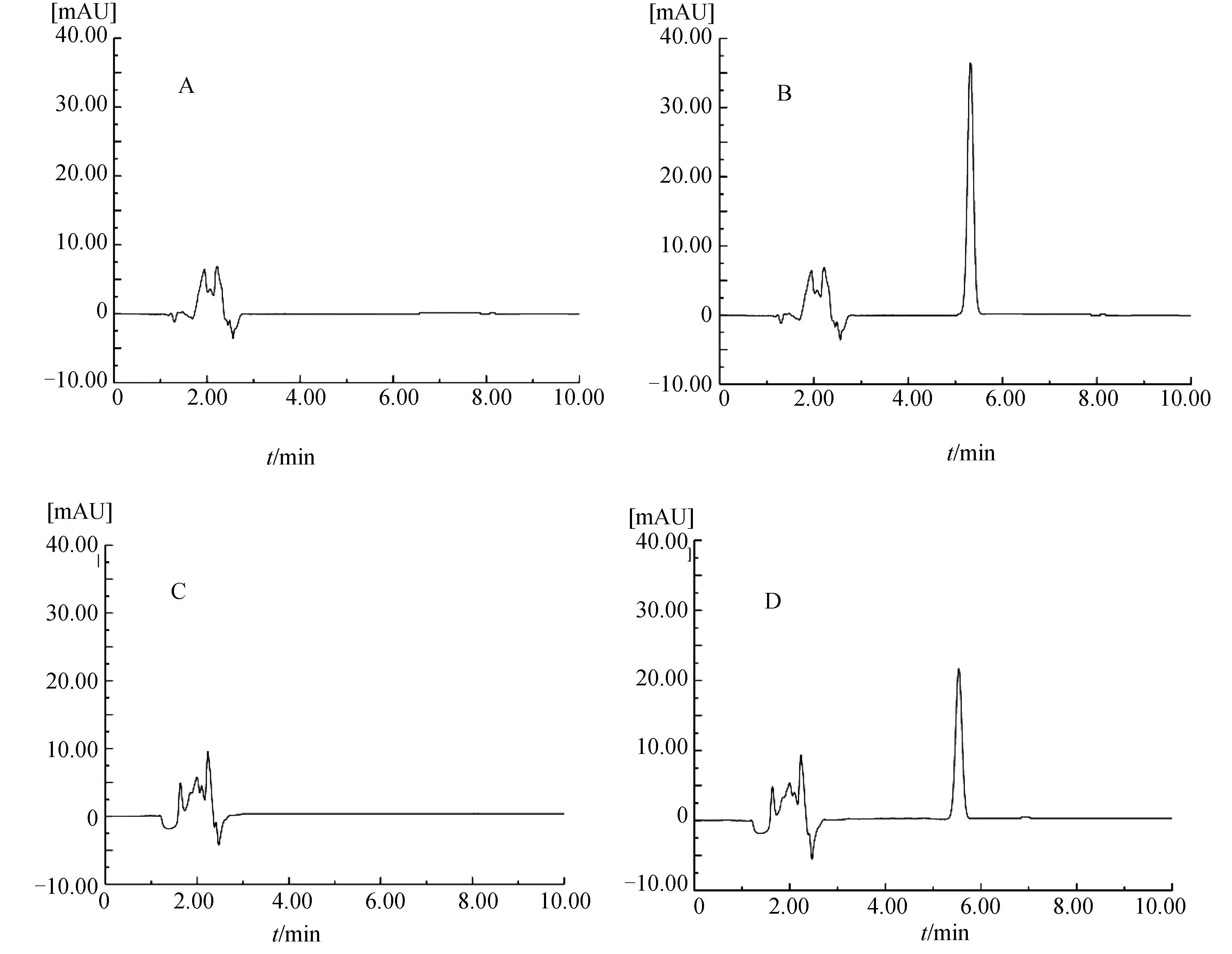
圖1 DOC的HPLC專屬性A 甲醇;B DOC溶液;C 空白脂質體;D DOC脂質體Fig.1 The HPLC specificity of DOCA Methanol;B DOC standard;C Blank liposomes;D DOC liposomes
2.1.2 DOC標準曲線的繪制 經計算DOC標準曲線回歸方程為y= 17.069x+ 17.553(r= 0.999 9),DOC的濃度(x)和峰面積(y)呈線性相關,表明濃度在1~60 mg/L的范圍內DOC的濃度和峰面積線性關系良好.
2.1.3 精密度和回收率試驗結果 DOC溶液日間、日內RSD值均小于1%,符合含量測定要求.回收率試驗結果表明:不同濃度DOC溶液回收率的RSD值均低于1%,證明脂質體DOC回收率良好.
2.2 葡聚糖凝膠微柱離心法測定DOC脂質體影響因素考察結果
2.2.1 不同離心力對空白脂質體過柱率的影響 不同離心力對空白脂質體過柱率的影響情況見表1,由表可知隨著離心力的增加,空白脂質體的過柱率明顯增加,當離心力提高到2 500 g時,Sephadex G-25微柱被嚴重破壞,為了盡量增加過柱率而不破壞凝膠柱,所以選擇離心力為2 000 g.
2.2.2 不同離心時間對其過柱率的影響 不同離心時間對脂質體過柱率的影響情況見表2.由表可知隨著離心時間增加,空白脂質體過柱率隨之增加,離心時間為15 min過柱率接近100%,當離心時間超過20 min,過柱率變化不大,離心20 min后吸光度大于柱前的吸光度可能的原因是預飽和的脂質體也被離心下來導致吸光度數值遠大于未過Sephadex G-25柱的空白脂質體的吸光度值.因此15 min的離心時間即可保證將全部脂質體吸脫下來.
表1 不同離心力對空白脂質體過柱率的影響(n=3)
Table 1 Passing rate of blank liposome under different centrifugal force(n=3)

離心力/g過柱率/%100054.55±2.23150069.70±3.752000104.04±5.78
表2 不同離心時間對空白脂質體過柱率的影響(n=3)
Table 2 Passing rate of blank liposome under different centrifugal time(n=3)
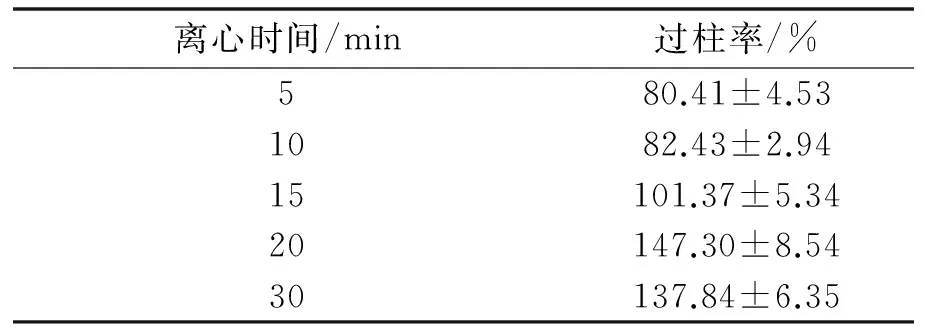
離心時間/min過柱率/%580.41±4.531082.43±2.9415101.37±5.3420147.30±8.5430137.84±6.35
2.2.3 藥物在Sephadex G-25微柱吸附時間的考察 制備Sephadex G-25凝膠柱,考察脂質體吸附時間對空白脂質體過柱率的影響,結果見表3,由表可知空白脂質體過柱率隨吸附時間的延長而增加,當吸附超過20 min時,空白脂質體的過柱率即可達到100%,故選擇最佳的吸附時間為20 min.
2.2.4 Sephadex G-25對空白脂質體的吸附 Sephadex G-25對空白脂質體的吸附作用見表4.由表可知雖然Sephadex G-25柱對空白脂質體有一定的吸附性,但一次離心即可洗脫下94%以上的空白脂質體,上樣量并未明顯影響Sephadex G-25對空白脂質體的吸附行為.

表4 Sephadex G-25對空白脂質體的吸附考察(n=3)
2.2.5 預飽和Sephadex G-25柱的空白脂質體用量的考察 空白脂質體預飽和用量結果見表5,由表可知隨著預飽和用量的增加,過柱率增加,當用量大于150 μL過柱率不再增加,Sephadex G-25柱對空白脂質體的吸附達到飽和,故預飽和用量選擇150 μL.
2.2.6 空白脂質體預飽和凝膠柱次數的考察 預飽和次數實驗結果見表6,由表可知預飽和3次時,吸光度值與未過柱的空白脂質體最接近,說明預飽和3次,Sephadex G-25柱對空白脂質體的吸附達到充分飽和,實驗確定空白脂質體預飽和3次.
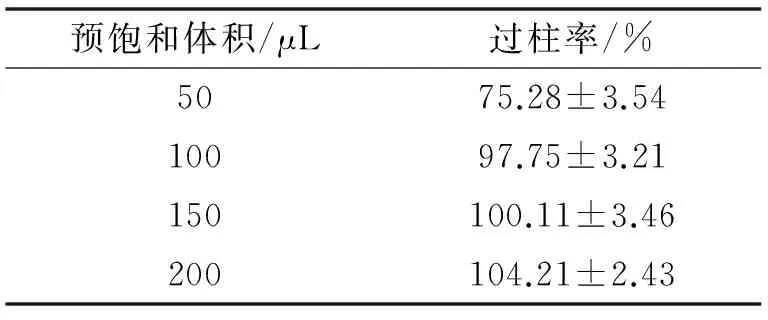
表5 空白脂質體預飽和Sephadex G-25用量考察(n=3)
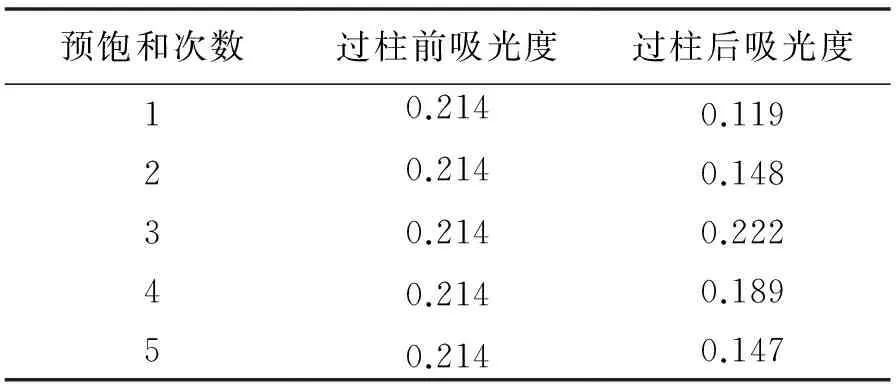
表6 預飽和凝膠柱次數的考察(n=3)
2.2.7 空白脂質體上樣量對其過柱率的影響 脂質體上樣量的影響見表7,由表可知上樣量對脂質體的過柱率有一定影響但并不明顯,當脂質體上樣量增加,過柱率隨之略有增加,根據實驗結果綜合分析最終選擇上樣量為150 μL.

表7 空白脂質體上樣量對其過柱率的影響(n=3)
2.2.8 游離DOC過柱率的考察 Sephadex G-25對DOC的吸附結果見表8,由表可知低、中、高3種濃度的DOC溶液過柱后過柱率均接近于0,表明葡聚糖凝膠柱對游離的DOC溶液有很好的截留作用并且與溶液濃度無相關性.

表8 DOC的過柱率(n=3)
2.3 DOC脂質體包封率的測定
根據以上優選結果,利用Sephadex G-25測定DOC脂質體的包封率,操作條件為:150 μL空白脂質體預飽和Sephadex G-25柱3次,上樣150 μL,離心力設為2 000 g,離心時間15 min.最終測定的DOC脂質體的包封率為(87.76±2.65)%.
3 結 論
葡聚糖凝膠微柱離心法是利用分子篩原理,較小的分子在柱中停留時間比大分子停留的時間要長,于是小分子藥物截留在葡聚糖凝膠的時間較長,粒徑大的脂質體分子則從凝膠空隙先流入到離心管中,因此離心管中得到的脂質體混懸液是去除游離藥物的載藥脂質體[1].為了得到更準確的實驗結果,收集離心管中的脂質體混懸液后洗滌離心管2~3次,合并洗液.
準確測定包封率的關鍵在于選擇準確的測定方法,對離心力、離心時間、脂質體的上樣量、吸附時間等影響包封率準確性的因素進行了系統的考察,最終確定最佳的測定DOC脂質體包封率的條件,得到精確并且重復性好的測定結果,使葡聚糖微柱離心法測定脂質體包封率更加規范和標準,為脂質體等納米藥物遞送系統包封率的測定提供參考.
[1] 托爾欽林V P,魏西希V.脂質體[M].鄧意輝,徐暉,譯.北京:化學工業出版社,2007:21-22.
[2] 陳建霞,徐緩,于濤,等.微柱離心-紫外分光光度法測定超氧化物歧化酶模擬物脂質體的包封率[J].中國新藥雜志,2011,20(10):928-931.
[3] 耿思聰,龔昊宇,許航,等.微柱離心法測定克拉霉素離子對脂質體注射液的包封率[J].中國藥劑學雜志,2016,1(3):18-25.
[4] 赫春香,趙靜,何長濤.紫杉醇與牛血清白蛋白的相互作用研究[J].遼寧師范大學學報(自然科學版),2010,33(4):465-468.
[5] CROWN J,O′LEARY M.The taxanes:an update[J].The Lancet,2000,355(9210):1176-1178.
[6] HOANG B,ERNSTING M J,MURAKAMI M,et al.Docetaxel carboxymeth ylcellylose nanoparticles display enhanced anti-tumor activity in murine models of castration-resistant prostate canver[J].International Journal of Pharmaceutics,2014,471(12):224-233.
[7] PEREIRA S,EGBU R,JANNATI G.Docetaxel-loaded liposomes:The effect of lipid composition and purification on drug encapsulation and in vitro toxicity[J].International Journal of Pharmaceutics,2016,514(1):150-159.
[8] NAIK S,PATEL D,SURTI N,et al.Preparation of PEGylated liposomes of docetaxel using supercritical fluid technology[J].The Journal of Supercritical Fluids,2010,54(1):110-119.
Studyonthethefactorsaffectingtheencapsulationefficiencyofdocetaxelliposomesbysephadexmicrocolumncentrifugationmethod
XUHuan1,HANDong1,2,WANGXiaochan1,GAOYiyuan1,WANGQian1,SUNLei1
(1.School of Chemistry and Chemical Engineering, Liaoning Normal University, Dalian 116029, China; 2.Dalian Institute for Drug Control, Dalian 116029, China)
A method for determining the encapsulation efficiency (EE) of Docetaxel (DOC) liposomes was established.The concentration of DOC was determined by high performance liquid chromatography (HPLC).The liposomes and DOC were separated by Sephadex microcolumn centrifugation.The different influencing factors of the passing rate of liposomes were investigated.The results showed that the HPLC method had good linearity in the range of 1~60 mg/L (r=0.999 9).The 2 000 g of centrifugal force,15 min of centrifugal time,20 min of liposomal adsorption,150 μL of pre-saturated amount,3 times of pre-saturation,150 μL of loading amount were identified as the optimal protocol to determine the EE of DOC liposomes and the results of EE was (87.76±2.65)%.This method is technically simple,rapid and reproducible.
docetaxel;liposomes;sephadex;microcolumn centrifugation;encapsulation efficiency
徐緩(1978- ),女,遼寧鐵嶺人,遼寧師范大學副教授,博士.E-mail:huan.xu1@163.com
R93.4
:A
2017-04-24
國家自然科學基金資助項目(81102394);遼寧省自然科學基金資助項目(20170540575);遼寧省大學生創新創業訓練計劃項目(201610165000015)
1000-1735(2017)03-0342-07
10.11679/lsxblk2017030342

