宮頸LEEP術后切緣陽性的MRI表現及臨床評價
謝潔林,韓志剛,田曉梅,張國福,張 娣
復旦大學附屬婦產科醫院放射科,上海 200011
·論著·
宮頸LEEP術后切緣陽性的MRI表現及臨床評價
謝潔林,韓志剛,田曉梅,張國福,張 娣
復旦大學附屬婦產科醫院放射科,上海 200011
目的:探討MRI在宮頸LEEP術后切緣陽性患者中的應用價值。方法:選取85例經病理組織學證實的宮頸LEEP術后切緣陽性患者,經盆腔MRI掃描,回顧性分析其影像學表現,并與病理結果對照分析。結果:宮頸LEEP術后切緣陽性患者行子宮切除術后,病理證實仍有病變殘留率為27.1%。與病理結果對比分析,MRI診斷的靈敏度為73.9%,特異度為87.1%,準確率為83.5%。結論:MRI診斷宮頸LEEP術后切緣陽性的準確率較高,對臨床治療方案的選擇及隨訪復查具有較高的參考價值。
宮頸環形電切術;磁共振成像;宮頸上皮內瘤變;宮頸癌
宮頸癌的發病率及死亡率在女性惡性腫瘤中居第2位,而宮頸上皮內瘤變(cervical intraepithelial neoplasia,CIN)反復發展易導致宮頸浸潤癌。目前,宮頸疾病尤其是CIN Ⅱ~Ⅲ主要采用宮頸環形電切術 (loop electrosurgical excision procedure,LEEP)治療[1],如何正確診斷LEEP術后切緣陽性患者是否有病灶殘留,從而根據患者情況進行個體化治療,不僅可阻止病變進展,還有利于提高患者生活質量。近年來,隨著MRI技術的不斷發展,其越來越多應用于宮頸疾病診斷中,對顯示宮頸病灶、宮旁浸潤及淋巴結轉移有很大優勢,但對宮頸LEEP術后的研究較少。本研究回顧性分析復旦大學附屬婦產科醫院85例LEEP術后切緣陽性患者的MRI圖像,探討MRI應用價值。
1 資料和方法
1.1 臨床資料
選取復旦大學附屬婦產科醫院2011年5月—2014年2月因宮頸疾病行LEEP術后切緣陽性的患者85例,進行MRI掃描,掃描時間均為LEEP術后1個月內。患者年齡27~66歲,平均48.3歲。其中LEEP術后病理學初步診斷為重度CIN (包括重度不典型增生和原位癌) 59例,早期微小浸潤性癌12例,浸潤癌14例(包括宮頸鱗癌9例、黏液腺癌4例、神經內分泌癌1例)。隨后,所有患者均于復旦大學附屬婦產科醫院行子宮切除術,取得病理學診斷。臨床上多以白帶增多、接觸性出血或血性白帶為主要癥狀。
1.2 檢查方法
使用SIEMENS公司Avanto 1.5 T 磁共振掃描儀及體部線圈。常規定位掃描與校正掃描后,先行盆腔平掃,采用T1WI、T2WI橫斷位掃描及T2WI矢狀位掃描;然后靜脈注射造影劑釓噴酸葡胺(Gd-diethylenetriamine pentaacetic acid,Gd-DTPA;0.1 mmol/kg)行T1WI橫斷位3期掃描,延時分別為注射造影劑后10、40及90 s;最后行T1WI矢狀位掃描。掃描參數為:橫斷位T1WI:重復時間(repetitive time,TR)/回波時間(echo time,TE)=761/10 ms;矢狀位T2WI:TR/TE=4 000/83 ms;橫斷位T2WI:TR/TE=8 000/83 ms;橫斷位T1WI增強掃描:TR/TE=4.89/2.38 ms;矢狀位T1WI增強掃描:TR/TE=752/12 ms。以上各序列掃描層厚/間隔均為4 mm/1.2 mm。
1.3 圖像分析
MRI圖像由2名高年資放射科醫師閱讀,主要觀察宮頸是否有病變,以及病變的信號、部位、強化情況,并與手術病理進行對照分析,用準確率、靈敏度和特異度評價MRI在LEEP術后切緣陽性患者中的診斷價值。
2 結 果
2.1 手術后病理結果
手術后病理診斷分為兩類:宮頸呈LEEP術后壞死修復性改變,未見殘留病變,共62例;宮頸有殘留病變,共23例。LEEP術后切緣陽性患者行子宮切除術后病變殘留率為27.1%。術后病理結果無1例宮旁組織及盆腔淋巴結轉移。
2.2 MRI診斷與病理結果比較
MRI診斷結果與手術后病理結果一致71例,其中無殘留病變54例,有殘留病變17例;MRI診斷結果與病理結果不一致14例,其中誤判為無殘留病變6例,誤判為有殘留病變8例。MRI診斷的準確率為83.5%,靈敏度為73.9%,特異度為87.1%。
2.3 LEEP術后切緣陽性患者的MRI表現
有殘留病變:平掃宮頸可見異常信號灶,T2WI呈稍高信號,T1WI呈等信號或稍低信號;增強掃描顯示病變早期強化明顯。23例殘留病變中,15例呈不均勻顯著強化,6例呈均勻顯著強化,2例顯示輕度強化(圖1)。
無殘留病變:平掃顯示宮頸信號欠均勻,無明顯腫塊顯示,LEEP切緣呈T2WI稍高信號,增強掃描顯示多為切緣呈均勻延遲強化。其中43例呈輕中度強化,19例呈顯著強化(圖2)。

圖1 浸潤性鱗狀細胞癌有殘留病變的MRI表現
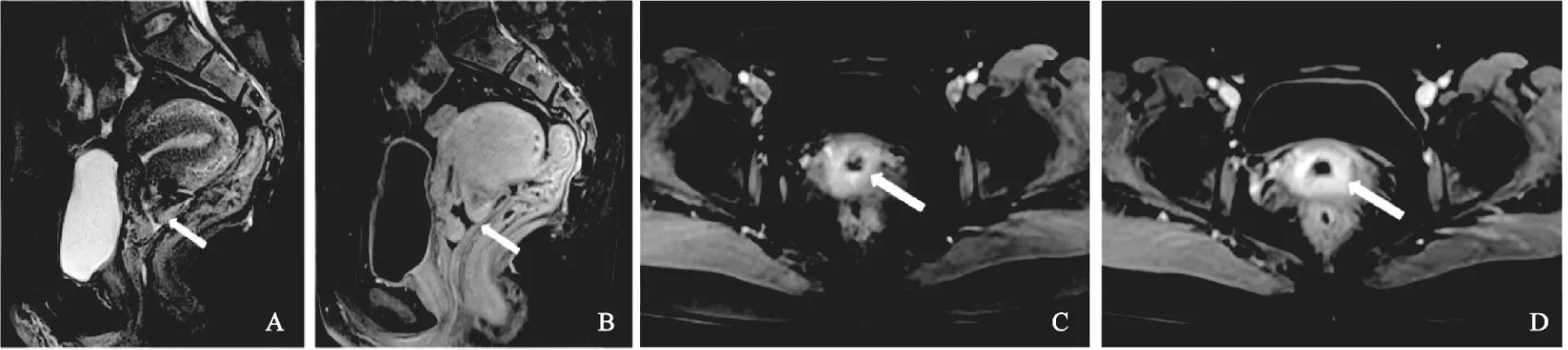
圖2 微小浸潤性鱗狀細胞癌無殘留病變的MRI表現
3 討 論
3.1 LEEP術的適應證
CIN是一組與宮頸浸潤癌關系密切的癌前病變統稱。宮頸LEEP術是目前治療CINⅡ~Ⅲ的標準術式,具有診斷和治療雙重作用[1]。LEEP術可在切除病變的同時,完整連續地保留組織學標本,具有價廉方便、不需住院、有效安全、并發癥少等優點。LEEP術的適應證:① 宮頸局部活檢病理學診斷為CIN Ⅱ或以上者;② CINⅠ不能定時隨訪者;③ 細胞學與陰道鏡檢查懷疑有CIN者;④ 宮頸重度糜爛者曾行激光或微波治療無效者[2]。
3.2 LEEP術后切緣陽性患者的治療
宮頸LEEP術后病理報告切緣陽性被普遍認為是CIN持續存在或復發的一個危險因素[3]。目前,對于切緣陽性患者的進一步處理方法尚未達成共識,因為對殘余宮頸中殘存病變的檢測和病變程度難以預測。美國陰道鏡及宮頸病理學會(American Society for Colposcopy and Cervical Pathology,ASCCP)推薦,對切緣陽性患者應告知觀察與進一步治療的相對危險,根據患者的生育要求、年齡、個人意愿及其他因素,最好術后4~6個月重復陰道鏡和子宮頸管診斷性刮宮的隨訪,也可再次行診斷性錐切術,臨床處理應個體化[4]。而國際婦產科聯盟《婦科惡性腫瘤分期及臨床實踐指南》中推薦的處理方法認為,應按照Ⅰb1期宮頸癌處理,行改良廣泛全子宮切除+淋巴結清掃術[5]。因此,臨床醫師在選擇治療方案時有一定困難,過大的手術會給患者帶來不必要的創傷,增加治療并發癥,而過于保守的治療又可能增加疾病復發或持續發展的危險。
有研究表明[6],即使CIN Ⅲ患者LEEP術后切緣陽性,大部分患者在日后隨訪中并未發現病灶持續存在或復發。其原因可能是LEEP切除過程中產生的熱效應能破壞殘留在切緣的病變,且傷口愈合過程中不同程度的組織壞死和炎性反應后,創面結痂脫落可能使病變消失。因此,只要嚴密隨訪,LEEP術后切緣陽性患者完全可進行保守性治療,不一定必須再次手術。
3.3 MRI在LEEP術后切緣陽性患者中的應用價值
Huang等[7]對CIN患者進行回顧分析,73例LEEP術后切緣陽性患者接受子宮切除術后,僅27例術后仍有病變殘留,病變殘留率為37%。Rodolakis等[8]研究發現,LEEP術后15%~24%的CIN Ⅱ~Ⅲ切緣陽性患者有病變殘留。本組資料中,子宮切除術標本病理學結果證實LEEP術后病變殘留率為27.1%,與Rodolakis等研究結果較接近。本研究中,MRI將14例患者誤判,分析原因,考慮為LEEP術與MRI檢查間隔時間較短(<2周),宮頸壞死水腫反應較明顯,影響了對局部病變的顯示及判斷。與病理結果對比分析,MRI的診斷準確率為83.5%,靈敏度為73.9%,特異度為87.1%。因此,臨床醫師在選擇患者治療方案時,可參考MRI結果。對于提示無明顯病變殘留的患者,可根據患者實際情況及個人需求,傾向于嚴密隨訪,不一定行手術治療。
總之,在LEEP術后切緣陽性患者的治療中,MRI對臨床治療方案的制訂有良好的輔助作用,是臨床其他檢查方法的重要補充。同時,MRI無創傷,可重復連續觀察,既可觀察局部又能看到整體,也可作為患者嚴密隨訪的重要工具。
[1] KYRGIOU M, TSOUMPOU I, VREKOUSSIS T,et al. The up-to-date evidence on colposcopy practice and treatment of cervical intraepithelial neoplasia:the Cochrane colposcopy & cervical cytopathology collaborative group (C5 group) approach [J]. Cancer Treat Rev, 2006, 32(7): 516-523.
[2] 陸繼紅, 楊賓烈. 子宮頸電環切除術治療宮頸疾病的有關問題及處理 [J]. 中華現代婦產科學雜志, 2005, 2(6):493-495.
[3] LEGUEVAQUE P, MOTTON S, DECHARME A, et al. Predictors of recurrence in high-grade cervical lesions and a plan of management [J]. Eur J Surg Oncol, 2010,36(11): 1073-1079.
[4] WRIGHT T C JR, MASSAD L S, DUNTON C J, et al.2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ [J]. Am J Obstet Gyneol, 2007, 197(4): 340-345.
[5] BENEDET J L, BENDER H, JONES H 3RD, et al.FIGO staging classifications and clinical practice guidelines in the management of gynecologic carcinomas. FIGO Committee on Gynecologic Oncology [J]. Int J Gynaecol Obstet, 2000, 70(2): 209-262.
[6] LEE S J, KIM W Y, LEE J W, et al. Conization using electrosurgical conization and cold coagulation for International Federation of Gynecology and Obstetrics stage IA1 squamous cell carcinomas of the uterine cervix[J]. Int J Gynecol Cancer, 2009, 19(3): 407-411.
[7] HUANG L W, HWANG J L. A comparison between loop electrosurgical excision procedure and cold knife conization for treatment of cervical dysplasia: residual disease in a subsequent hysterectomy specimen [J].Gynecol Oncol, 1999, 73(1): 12-15.
[8] RADOLAKIS A, THOMAKOS N, HAIDOPOULOS D, et al. Management of relapsing cervical intraepithelial neoplasia [J]. Reprod Med, 2009, 54(8): 499-505.
MRI findings of patients with positive margins after LEEP
XIE Jielin, HAN Zhigang, TIAN Xiaomei, ZHANG Guofu, ZHANG Di
(Department of Radiology, Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200011, China)
Objective:To investigate the value of MRI in the diagnosis of positive margins after loop electrosurgical excision procedure (LEEP).Methods:MRI findings of 85 cases with positive margins after LEEP were retrospectively analyzed and compared with the histopathological results.Results:The residual lesions were found in 27.1% of the patients with positive margins. The sensitivity, specificity and accuracy of MRI were 73.9%, 87.1% and 83.5%, respectively, in detecting residual lesions.Conclusion:MRI has a relatively high accuracy in evaluating the patients with positive margins after LEEP and is valuable for clinicians to determine the therapeutic strategy.
Loop electrosurgical excision procedure; Magnetic resonance imaging; Cervical intraepithelial neoplasia;Cervical cancer
HAN Zhigang E-mail: hzg921@sina.com
R445.2
A
1008-617X(2017)03-0217-04
2017-04-12
2017-04-26)
韓志剛 E-mail:hzg921@sina.com

