磁共振波譜成像技術對評價早期肝性腦病嚴重程度的可行性分析
黃天宇,梁英良,王嵩,姚曄
磁共振波譜成像技術對評價早期肝性腦病嚴重程度的可行性分析
黃天宇,梁英良,王嵩,姚曄*

目的運用3.0 T磁共振波譜成像技術評估早期肝性腦病(minimal hepatic encephalopathy,MHE)患者的局部腦代謝改變。材料與方法收集30例伴有輕微肝性腦病的肝硬化患者,29例不伴有輕微肝性腦病的肝硬化患者及30名健康志愿者。在3.0 T場強下對大腦前扣帶回及基底節區進行掃描得到其單體素質子波譜成像的數據。利用LC-model軟件計算出N-乙酰天門冬氨酸(N-acetylaspartate,NAA)、肌醇(myo-inositol,MI)、谷氨酸(glutamic,Glu)、谷氨酰胺(glutamate,Gln)以及肌酸(creatine,Cr)的濃度,并對其進行分析比較3組患者之間的差異。結果肝硬化患者的Glu濃度顯著升高,在合并MHE的肝硬化患者中尤其明顯。在所有肝硬化患者及對照組中,僅有部分肝硬化患者的Gln濃度升高。肝硬化患者的MI濃度明顯降低,但兩組肝硬化患者降低的程度差異無統計學意義。3組患者的NAA濃度差異無統計學意義。結論3.0 T場強下的磁共振波譜成像(magnetic resonance spectroscopy,MRS)掃描可以檢測出合并MHE肝硬化患者的腦代謝改變。合并輕微肝性腦病的肝硬化患者的Glu濃度增高。Glu濃度可以作為評價合并輕微肝性腦病的肝硬化患者病情嚴重程度的敏感指標。
磁共振波譜成像;肝性腦病;肝硬化;磁共振成像
早期肝性腦病(minimal hepatic encephalopathy,MHE)的典型特點是心理測試中認知功能的損害和/或腦電圖平均周期頻率的降低,而沒有明顯的臨床癥狀[1]。傳統肝性腦病的診斷主要依靠神經心理學檢查,但是這種檢查方法既不具有特異性,也不能反映患者當前的病理狀態。有研究對肝硬化患者進行3年隨訪后發現,在合并MHE的肝硬化患者中約有50%的患者會進展為顯性肝性腦病[2],而沒有MHE的肝硬化患者中僅有8%會發展為顯性肝性腦病,因此MHE的早期診斷至關重要,這一方面會影響MHE患者的預后,另一方面也會影響患者的生活質量[3]。與肝硬化相關神經精神損害的機制包括病理生理學、演變和預后尚未完全了解,這個問題的相關結果也是有爭議的[4]。目前的研究表明這些神經精神損害和腦代謝模式的改變有關,這些癥狀可以通過降低血氨來逆轉[5]。
對這些患者進行充分的神經精神評估目前仍舊很困難,因為低級別腦病相關的神經精神癥狀表現多樣且輕微。這個問題在MHE患者中更加突出,因為這些患者僅表現出神經心理學測試的改變。這些測試結果會受多種混雜因素的影響,比如年齡、情緒障礙和受教育程度等。因此,運用無創性影像學檢查,比如磁共振波譜成像(magnetic resonance spectroscopy,MRS)技術來輔助評估MHE成為目前研究的熱點。以前的研究僅報告了谷氨酰胺-谷氨酸復合物(glutamine and glutamate complex,Glx)的變化,而非谷氨酸(glutamic,Glu)和谷氨酰胺(glutamate,Gln)的變化[6]。在本研究中,筆者使用高磁場MR (3.0 T)進行MRS序列掃描區分Gln、Glu,并進行分析數據,以確定N-乙酰天門冬氨酸(N-acetylaspartate,NAA)、肌酸(creatine,Cr)、肌醇(myo-inositol,MI)、Gln和Glu水平與MHE的病理生理學之間的相關性。
1 材料與方法
1.1 臨床資料
收集2016年1月至2016年12月上海中醫藥大學附屬龍華醫院消化內科門診患者的資料,將受試者分為3組。組Ⅰ:33例合并MHE的肝硬化患者;組Ⅱ:30例不合并MHE的肝硬化患者;組Ⅲ:30名健康志愿者作為對照組。
在初步評估期間先對患者進行臨床評估。認知評估包括精神病史和簡易精神狀態檢查(minimental state examinatlon,MMSE)。MMSE評分小于24分的患者被認定為認知受損,并將其排除研究。筆者運用綜合評價方法,例如影像學檢查(腹部超聲,計算機斷層掃描)、組織學檢查和血液生化數據診斷肝硬化。患者的排除標準包括:MR檢查期間發生幽閉恐怖癥;年齡小于18歲或75歲以上;研究前3個月內有活動性酒精中毒;Ⅱ~Ⅳ級肝性腦病;Child-Pugh評分(評估肝臟疾病的嚴重性) C級;神經或精神疾病;接受用精神藥物或已知改變神經心理功能的其他藥物治療;研究前1 w內有胃腸道出血或感染;檢查前已進行分流手術。所有對照組中的受試者沒有任何神經或精神疾病、代謝紊亂、酒精或藥物濫用、頭部損傷或肝臟疾病的病史。所有受試者均接受詳細的臨床評估,包括神經系統檢查。
本研究由當地機構審查倫理委員會批準,受試者均簽署知情同意書,且該研究方案符合1975年赫爾辛基宣言的倫理準則。
1.2 臨床神經心理學測試
根據1998年維也納第11屆世界胃腸病學大會國際肝性腦病工作組的建議[7],筆者對患者進行了數字連接實驗A (number connection test,NCT-A)和數字符號實驗(digit symbol test,DST)兩項檢查。當測試分數高于或低于相應的年齡和教育對照組2個標準差時,該結果被視為異常。NCT-A和/或DST結果異常,但沒有明顯肝性腦病癥狀的患者診斷為合并MHE。
1.3 實驗室檢查
所有患者在進行MR掃描的前1 w內進行血液生物化學測試,包括凝血酶原時間、蛋白質代謝測試(例如總蛋白、球蛋白、白蛋白、白球比)、膽紅素代謝測試(例如總膽紅素、直接膽紅素、間接膽紅素)、谷氨酸丙酮酸轉氨酶和谷氨酸草酰乙酸轉氨酶。上述檢測結果用于計算Child-Pugh評分以評估肝臟疾病的嚴重程度,同時對患者進行靜脈血氨測試。
1.4 MR檢查
使用配備有8通道相位線圈的Philips 3.0 T MRI系統(Ingenia 3.0 T,Philips Medical System,The Netherlands)進行體內單體素MRS成像。磁共振T1加權圖像掃描參數如下:TR=550 ms;TE=10 ms;FOV=21 cm×21 cm;層厚=3 mm;間隔=0.1 mm。H1-MRS用于大腦中代謝物濃度的定量分析。運用2D-T1WI的冠、矢狀位成像數據對感興趣區體素進行圖像引導定位來進行數據采集。本研究對大腦前扣帶回和雙側基底神經節區進行了MRS評估(圖1)。單體素MRS激勵回波采集序列(stimulated-echo acquisition mode,STEAM)的掃描參數如下:TR=2000 ms;TE=72 ms;TM=6 ms;體素=20 mm×20 mm×20 mm;總點數=2048;平均值=256。總掃描時間為25 min。結果顯示各代謝產物的濃度分別為Glu 2.35 ppm、Gln 2.45 ppm、MI 3.55 ppm、Cr 3.02 ppm、NAA 2.01 ppm。其中雙側基底節區代謝物數值取平均值。代謝產物利用LC模型算法在頻域擬合實驗數據來實現定量測量。
1.5 數據分析
數據分析運用SPSS 11.5軟件,定量變量用均值±標準差表示,分類變量表示為頻率或百分比。使用雙尾t檢驗測試患者和健康對照組之間的差異。每組間的差異用配對t檢驗測試。獨立樣本t檢驗用于比較健康對照組和肝硬化患者之間的大腦前扣帶回和基底神經節區代謝物濃度差異。P<0.05認為差異有統計學意義。
2 結果
由于掃描時間過長,4名患者(組Ⅰ中3名,組Ⅱ中1名)沒有完成MR檢查。剩余的患者分為以下幾組:組Ⅰ:30例(14例女性和16例男性)合并MHE的肝硬化患者組;組Ⅱ:29例(14例女性和15例男性)不合并MHE的肝硬化患者組;組Ⅲ:30名健康受試者(17名女性和13名男性)作為健康對照組。3組研究對象的臨床檢查和實驗室參數見表1。
大腦前扣帶回和雙側基底節區的MRS特點如表2所示。大腦前扣帶回的代謝改變如圖2所示。肝硬化患者的Glu水平顯著增加(P<0.001)。在合并與不合并MHE的患者之間其Glu濃度差異具有統計學意義(P<0.001),在合并MHE組明顯高于不合并MHE組。Gln在肝硬化患者中顯著增加(P1= 0.041,P2=0.034),但并不能在所有肝硬化患者和健康對照組中都檢測到。肝硬化患者的MI降低(P1=0.013,P2=0.006),但在合并與不合并MHE的患者之間差異無統計學意義(P=0.701)。3組間NAA差異無統計學意義。研究結果表明MHE患者的Glu升高,肝硬化患者大腦前扣帶回的MI/Cr減少。基底節區的測量結果與前扣帶回(ACC區域)類似。
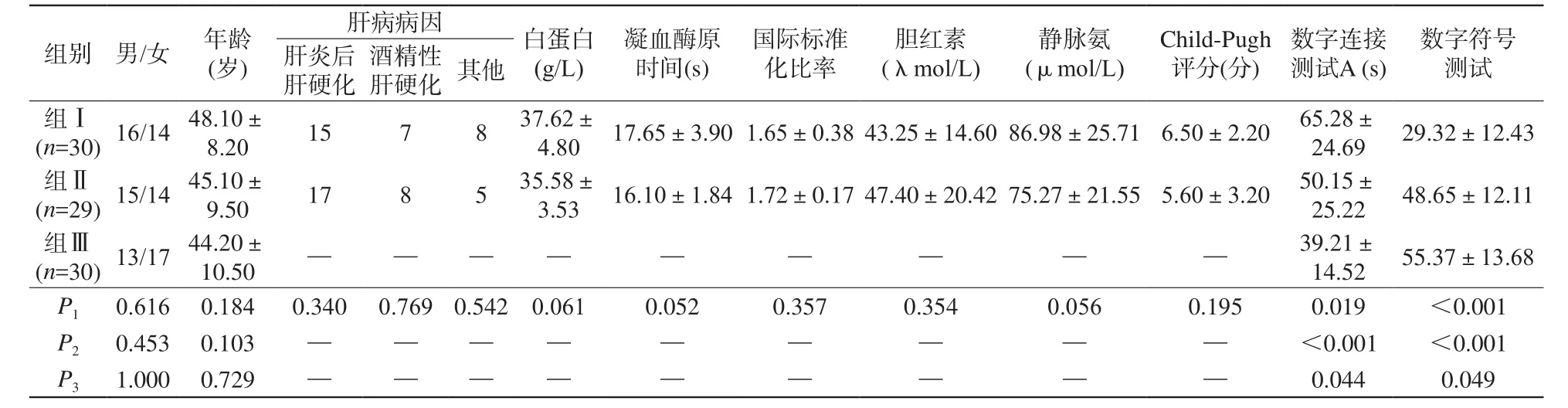
表1 3組研究對象的臨床和實驗室參數Tab.1 Clinical and laboratory parameters of the three groups of subjects
表2 根據2D MRS峰面積計算出的代謝產物濃度Tab.2 The concentration of metabolites calculated (MRS±SD) according to the peak area of 2D MRS

表2 根據2D MRS峰面積計算出的代謝產物濃度Tab.2 The concentration of metabolites calculated (MRS±SD) according to the peak area of 2D MRS
注:P1:組Ⅰ和組Ⅱ之間的P值;P2:組Ⅰ和組Ⅲ之間的P值;P3:組Ⅱ和組Ⅲ之間的P值;組Ⅰ中的11例患者、組Ⅱ中的9例患者及組Ⅲ中的5名健康受試者可以檢測到谷氨酰胺。
組別基底神經節(mM)(n=30)48.111±8.10017.578±3.2233.875±1.6413.923±1.5956.219±1.1769.327±1.11617.116±1.7153.052±1.2403.821±1.1056.023±1.295組Ⅱ前扣帶皮層(mM)N-乙酰冬氨酸谷氨酸谷氨酰胺肌醇肌酸N-乙酰冬氨酸谷氨酸谷氨酰胺肌醇肌酸組Ⅰ(n=29)8.873±1.36113.489±2.9563.348±1.5163.593±1.3066.447±1.2339.632±1.68212.159±1.8513.412±1.5473.515±1.2076.293±1.306(n=30)9.242±1.7658.893±1.2721.591±1.2775.827±1.0046.752±1.1638.893±1.3628.451±1.2461.633±0.7485.848±1.1766.477±1.062P10.572<0.0010.4690.3890.4710.414<0.0010.5700.3140.429P20.158<0.0010.015<0.0010.0830.237<0.0010.034<0.0010.143P30.373<0.0010.041<0.0010.3320.089<0.0010.034<0.0010.554組Ⅲ
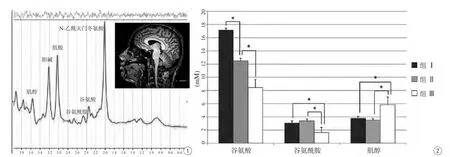
圖1 男,49歲,合并MHE的肝硬化患者前扣帶回MRS檢查。Glu:2.35 ppm,Gln:2.45 ppm,MI:3.55 ppm,Cr:3.02 ppm,NAA:2.01 ppm 圖2 合并MHE的肝硬化患者(組Ⅰ),不合并MHE的肝硬化患者(組Ⅱ)和健康受試者(組Ⅲ)的ACC代謝物變化,*P<0.05。肝硬化患者的Glu顯著增高,在合并及不合并MHE的患者中差異存在統計學意義;肝硬化患者的Gln增加,但并不能在所有肝硬化和健康者中檢測到。肝硬化MI顯著減低,在合并與不合并MHE患者之間差異無統計學意義Fig. 1 Male, 49-year-old, metabolite changes in the ACC for the cirrhotic patients with MHE. It revealed that Glu at 2.35 ppm, Gln at 2.45 ppm, MI at 3.55 ppm, Cr at 3.02 ppm, and NAA at 2.01 ppm. Fig. 2 Metabolite changes in the ACC for the cirrhotic patients with MHE (group Ⅰ), the cirrhotic patients without MHE (group Ⅱ) and the healthy volunteers (group Ⅲ).*P<0.05. Glu significantly increased in the cirrhotic patients, and the difference in Glu was statistically significant in patients with and without MHE. Gln significantly increased in the cirrhotic patients, but it could not be detected in all cirrhotic patients or healthy controls. MI significantly decreased in the cirrhotic patients; However, there was no significant difference between the patients with and without MHE.
3 討論
之前的相關研究主要關注于出現肝性腦病癥狀的肝硬化患者的腦代謝改變[7]。本項研究的主要目的是定量研究合并以及不合并MHE的肝硬化患者的腦代謝改變,并和健康對照組進行對比。同時測量了各代謝產物的濃度(Glu、Gln、MI、NAA和Cr),而不僅僅是各代謝產物之間的比例。在本研究中,使用3.0 T MR掃描儀進行MRS序列掃描,發現并不是所有的患者和對照組都可以檢測出Gln,但所有的肝硬化患者都可以檢測出Glu濃度的增加。肝硬化患者會出現Glu的增加,而且在合并以及不合并MHE的患者間其Glu濃度差異有統計學意義,這表明在肝硬化情況下觀察到的腦中Glx信號強度的增加主要歸因于Glu濃度的增加。
國際肝性腦病和氮代謝協會建議根據認知功能的損害程度來診斷肝性腦病,即認知功能未受損(無任何臨床、神經生理學或神經心理學變化)、隱蔽損害(輕微肝性腦病和West-Haven定義的I級肝性腦病)和明顯損害(West-Haven定義的Ⅱ級肝性腦病)[8]。MHE患者常常焦慮、激動,甚至有驚厥和睡眠困難,因為Glu是一種興奮性神經遞質。如何解釋本研究中的代謝物變化,筆者認為,在疾病的早期階段,發生高氨血癥的情況下,大腦會參與氨的轉化,星形膠質細胞中的Gln合成酶將大量的Glu轉化為Gln,從而導致細胞滲透壓失衡[9]。結合本研究的結果,筆者認為 Glu差異可以為臨床提供客觀的評價依據。MHE的早期階段Gln水平會增加,但星形膠質細胞同時代償性地將Gln轉移出大腦。隨著病情的發展,Gln水平會迅速增加[10-12]。研究還發現,肝硬化患者的MI水平下降,但在合并以及不合并MHE的肝硬化患者之間差異沒有統計學意義。MI是一種有機滲透壓調節劑,可以代償性地緩沖星形膠質細胞中氨誘導產生的過量Gln。然而,星形膠質細胞內達到穩定狀態需要一定時間,輕微肝性腦病常由于發病過急而不能及時進行代償性轉移。這可能解釋了為什么合并以及不合并MHE患者之間的MI差異無統計學意義,同時說明MI可能與MHE的嚴重性不相關。
在本研究中,筆者測量了代謝物的具體濃度,而不僅僅是代謝比值,這樣就不會受到內參變異的影響。在腦波譜學中,一般認為Cr信號可以作為對照較好的內參使用,但是Cr的濃度在許多疾病中都會發生改變,如肝性腦病[13-15]。本研究結果表明,健康對照組的Cr濃度高于其他兩個肝硬化組,但這些差異沒有統計學意義。肝硬化患者可能出現腦代謝改變,這些患者的Cr濃度也可能改變,所以使用Cr比值會產生一些偏差。
目前認為大腦氨代謝在急慢性肝衰竭患者發生MHE的病理生理學中發揮了關鍵作用。但是“氨中毒假說”并不能完全解釋為什么在肝硬化程度相同的患者中,只有部分患者繼續發展為MHE[16]。氨水平與MHE的嚴重程度不相關。在本研究中,肝硬化患者的靜脈血氨異常,同時合并以及不合并MHE的肝硬化患者的血氨水平差異無統計學意義。Child-Pugh C級的肝硬化患者可能發展為嚴重的MHE,因此本研究排除了這些患者,只選擇Child-Pugh A級和B級的患者。
本研究可能存在以下缺點:(1)由于掃描時間的限制,部分患者可能不一定耐受,尤其對合并MHE的患者;同時掃描的部位也受到限制不能選取更多的部位掃描,進而獲得更加豐富的腦代謝變化;(2)沒有進行長期隨訪,連續的跟蹤患者MRS代謝值的變化將會更加有意義地說明肝性腦病的代謝規律,這也是下一步研究的方向。
總而言之,本研究發現利用3.0 T MR進行MRS序列掃描可以用于檢測合并MHE的肝硬化患者的腦代謝改變,這些患者腦部MRS的典型特征是Glu水平升高,Glu水平升高可以作為評價肝硬化患者MHE嚴重程度的敏感指標。
[References]
[1] Zhan T, Stremmel W. The diagnosis and treatment of minimal hepaticencephalopathy, Dtsch. Arztebl Int, 2012, 109(10): 180-187.
[2] Stinton LM, Jayakumar S. Minimal hepatic encephalopathy. Can J Gastroenterol, 2013, 27(10): 572-574.
[3] Kappus MR, Bajaj JS. Covert hepatic encephalopathy: not as minimal as youmight think. Clin Gastroenterol Hepatol, 2012,10(11): 1208-1219.
[4] Mullen KD. Review of the final report of the 1998 working party on definition, nomenclature and diagnosis of hepatic encephalopathy.Aliment Pharmacol Ther, 2007, 25(Suppl): 11-16.
[5] Stewart CA, Smith GE. Minimal hepatic encephalopathy. Nat Clin Pract Gastroenterol Hepatol, 2007, 4(12): 677-685.
[6] Singhal A, Nagarajan R, Hinkin CH, et al. Two-dimensional MR spectroscopy of minimal hepatic encephalopathy and neuropsychological correlates in vivo. J Magn Reson Imaging, 2010,32(1): 35-43.
[7] Amodio P, Montagnese S, Gatta A, et al. Characteristics of minimalhepatic encephalopathy. Metab Brain Dis, 2004, 19(3):253-267.
[8] Foerster BR, Conklin LS, Petrou M, et al. Minimal hepatic encephalopathy in children: evaluation with proton MR spectroscopy.Am J Neuroradiol, 2009, 30(8): 1610-1613.
[9] Baja JS, Cordoba J, Mullen KD, et al. Review article: the design of clinicaltrials in hepaticencephalopathy-aninternational society for hepatic encephalopathy and nitrogen metabolism(ISHEN) consensus statement. Aliment Pharmacol Ther, 2011, 33 (7): 739-747.
[10] Savlan I, Liakina V, Valantinas J. Concise review of current concepts onnomenclature and pathophysiology of hepatic encephalopathy.Medicina (Kaunas), 2014, 50(2): 75-81.
[11] Sturgeon JP, Shawcross DL. Recent insights into the pathogenesis of hepaticencephalopathy and treatments. Expert Rev Gastroenterol Hepatol, 2014, 8(1): 83-100.
[12] Sturgeon JP, Shawcross DL. Recent insights into the pathogenesis of hepaticencephalopathy and treatments. Expert Rev Gastroenterol Hepatol, 2014, 8(1): 83-100.
[13] Amodio P, Montagnese S, Gatta A, et al. Characteristics of minimalhepatic encephalopathy. Metab Brain Dis, 2004, 19(3):253-267.
[14] Weissenborn K, Ahl B, Fischer-Wasels D, et al. Correlations between magnetic resonance spectroscopyalterations and cerebral ammonia and glucose metabolism in cirrhoticpatients with and without hepatic encephalopathy. Gut, 2007, 56(12): 1736-1742.
[15] Patidar KR, Bajaj JS. Covert and overt hepatic encephalopathy:diagnosis and management. Clin Gastroenterol Hepatol, 2015,13(12): 2048-2061.
[16] Suraweera D, Sundaram V, Saab S. Evaluation and management of hepatic encephalopathy: current status and future directions. Gut Liver, 2016, 10(4): 509-519.
[17] Keiding S, Pavese N. Brain metabolism in patients with hepaticencephalopathy studied by PET and MR. Arch Biochem Biophys, 2013, 536(2): 131-142.
Viability assessment of magnetic resonance spectroscopy for the detection of minimal hepatic encephalopathy severity
HUANG Tian-yu, LIANG Ying-liang, WANG Song, YAO Ye*
LongHua Hospital Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
Objective:To evaluate regional cerebral metabolic changes in minimal hepatic encephalopathy (MHE) patients using magnetic resonance spectroscopy (MRS)in 3.0 T scanner.Materials and Methods:This study comprised 30 cirrhotic patients with MHE, 29 cirrhotic patients without MHE and 30 healthy volunteers. Single-voxel proton MRS data in the anterior cingulate cortex (ACC) and basal ganglia were acquired using a 3.0 T scanner. The concentrations of N-acetylaspartate (NAA), myo-inositol(MI), glutamate (Glu), glutamine (Gln) and creatine (Cr) were obtained by LC-model software. Statistical analysis was performed to evaluate the differences between the three groups.Results:There was a significant increase in Glu for the cirrhotic patients,particularly the MHE patients. There was an elevation of Gln in the cirrhotic patients,but not in all cirrhotic patients or controls. There was a significant decrease in MI for the cirrhotic patients, but no significant difference between the two cirrhosis groups. There was no significant difference in NAA between the three groups.Conclusion:MRS using a 3.0 T MR scanner could detect cerebral metabolic changes in cirrhotic patients with MHE. Glu levels were elevated in cirrhotic patients with MHE; Glu levels could be used as a sensitive indicator to evaluate the severity of MHE in patients with cirrhosis.
Magnetic resonance spectroscopy; Hepatic encephalopathy; Liver cirrhosis; Magnetic resonance imaging
28 Feb 2017, Accepted 9 May 2017
作者單位:
上海中醫藥大學附屬龍華醫院,上海200032
上海市衛生和計劃生育委員會科研課題(編號:201540198)
姚曄,E-mail:122186836@qq.com
2017-02-28
接受日期:2017-05-09
R445.2;R742
A
10.12015/issn.1674-8034.2017.06.003
黃天宇, 梁英良, 王嵩, 等. 磁共振波譜成像技術對評價早期肝性腦病嚴重程度的可行性分析. 磁共振成像, 2017,8(6): 413-417.
*Correspondence to: Yao Y, E-mail: 122186836@qq.com
ACKNOWLEDGMENTSThis work was part of Scientific Research Project of Shanghai Municipal Commission of Health and Family Planning (No.201540198).

