胰腺腺鱗癌的動態增強CT表現分析
付 怡,肖遙星,張 汐
1. 復旦大學附屬腫瘤醫院放射診斷科,復旦大學上海醫學院腫瘤學系,上海 200032;2. 復旦大學附屬腫瘤醫院病理科,復旦大學上海醫學院腫瘤學系,上海 200032
胰腺腺鱗癌的動態增強CT表現分析
付 怡1,肖遙星2,張 汐1
1. 復旦大學附屬腫瘤醫院放射診斷科,復旦大學上海醫學院腫瘤學系,上海 200032;2. 復旦大學附屬腫瘤醫院病理科,復旦大學上海醫學院腫瘤學系,上海 200032
目的:分析胰腺腺鱗癌的CT和臨床表現,旨在提高對該病的認識。方法:回顧性分析復旦大學附屬腫瘤醫院9例經病理證實的胰腺腺鱗癌患者的臨床及動態增強CT資料,重點觀察病灶部位、大小、邊緣、強化方式、胰周及胰腺外改變等。結果:9例患者中,男性6例、女性3例,平均年齡為58.7歲。3例位于胰頭、6例位于胰體尾部。腫瘤大小2.0 cm×2.0 cm 至10.0 cm×6.6 cm不等,平均為3.7 cm×4.8 cm。9例腫塊均呈浸潤性生長,5例侵及胰周組織。2例發生肝、脾轉移。8例腫瘤瘤體內發生壞死囊變,僅1例為實性組織。9例腫瘤均未見出血、鈣化。腫瘤實性成分在平掃期、動脈期和門靜脈期的平均CT值分別為(30.7±4.7) Hu、(60.2±14.5) Hu和(71.2±21.4) Hu。在發生中心壞死的8例腫瘤中,瘤體均呈環形漸進性輕度強化。僅1例實性瘤體呈不均勻中度漸進性強化,未見中心壞死。位于胰頭部的2例腫瘤引起膽、胰管輕度擴張,遠端胰腺未見明顯萎縮。結論:胰腺腺鱗癌常發生瘤體內壞死囊變,實性成分在CT中表現為環形漸進性輕度強化,對該病的診斷具有提示意義。
胰腺腫瘤;計算機斷層掃描;胰腺癌
胰腺腺鱗癌為罕見的外分泌胰腺原發上皮腫瘤。其病理學表現為腺癌細胞群內混雜著不同數量的鱗癌細胞,診斷標準為鱗癌成分至少占腫瘤細胞的30%[1-2]。胰腺導管腺癌與胰腺腺鱗癌具有共同的臨床癥狀,如腹痛、梗阻性黃疸,缺乏特異性臨床表現。雖然手術切除是最主要的治療手段,但僅少部分患者在術后生存期超過1年,預后較胰腺導管腺癌更差。目前有關胰腺腺鱗癌影像學表現的報道較少,本研究分析9例胰腺腺鱗癌的動態增強CT資料,旨在提高對該病的認識。
1 資料和方法
1.1 一般資料
回顧性分析復旦大學附屬腫瘤醫院2010—2015年經病理證實的9例胰腺腺鱗癌患者資料,其中男性6例、女性3例,平均年齡為58.7歲。臨床癥狀:7例為上腹疼痛,2例發生黃疸,僅1例后背部疼痛。腫瘤標記檢查發現,4例患者糖類抗原19-9 (carbohydrate antigen 19-9,CA19-9)明顯升高,3例輕度升高;2例患者CA12-5輕度升高;僅1例患者癌胚抗原(carcinoembryonic antigen,CEA)升高。所有患者甲胎蛋白(α fetal protein,AFP)均正常。3例患者行胰十二指腸切除術,3例患者行遠端胰腺切除術,3例患者行化療方案(表1)。
1.2 影像學檢查方法
所有患者均采用SIEMENS Somatom Sensation 64層螺旋CT進行平掃及動態增強掃描,管電壓120 kV,管電流250~300 mA,層厚、層距為3 mm。增強掃描采用非離子型對比劑碘海醇(300 mg I/mL) 80~100 mL,注射速率2~3 mL/s,注射對比劑后35 s和70 s進行動脈期、門靜脈期掃描。
2 結 果
2.1 CT表現
2.1.1 病灶位置、大小及形態改變
9例患者中,3例位于胰頭部、6例位于胰體尾部。腫瘤大小從2.0 cm×2.0 cm 至10.0 cm×6.6 cm不等,平均為3.7 cm×4.8 cm。所有腫塊均呈浸潤性生長,邊界模糊。5例腫塊侵及胰周組織,4例呈小腫塊位于胰腺內部。
2.1.2 胰腺腺鱗癌密度及強化方式
CT平掃胰腺腺鱗癌病灶呈相對等低密度。1例病灶為實性低密度腫塊,8例腫塊內部可見更低水樣密度區,實性成分平均CT值為(30.7±4.7) Hu,<3 cm病灶內亦可見腫瘤內部壞死區。動態增強后8例病灶為環形強化,外周實性成分呈漸進性輕度不均勻強化,動脈期實性成分CT值為(60.2±14.5) Hu,門靜脈期CT值為(71.2±21.4)Hu (圖1、2)。腫瘤中心壞死區域強化不明顯。僅1例病灶呈不均勻中等程度強化,未見中心壞死。
2.1.3 腫瘤繼發表現
2例患者出現輕度胰管擴張,胰管平均直徑為3 mm。2例胰頭部病灶壓迫膽總管致膽管輕度擴張。十二指腸、脾臟、脾血管、腎上腺可見腫瘤侵犯。出血、鈣化、假包膜及遠端胰腺萎縮均未見顯示。6例患者出現腹膜后、胰周多發淋巴結腫大。2例患者可見肝、脾轉移。
2.2 組織病理學
胰腺腺鱗癌病理結果顯示鏡下胰腺導管腺癌細胞內混雜鱗癌細胞,鱗癌細胞呈實體巢狀排列,癌巢中心可見同心圓狀角化珠。部分腺癌細胞有分化為鱗癌的趨勢。非病灶胰腺組織可見胰腺小葉萎縮,其周纖維組織增生,可見多量炎性細胞浸潤(圖1D)。
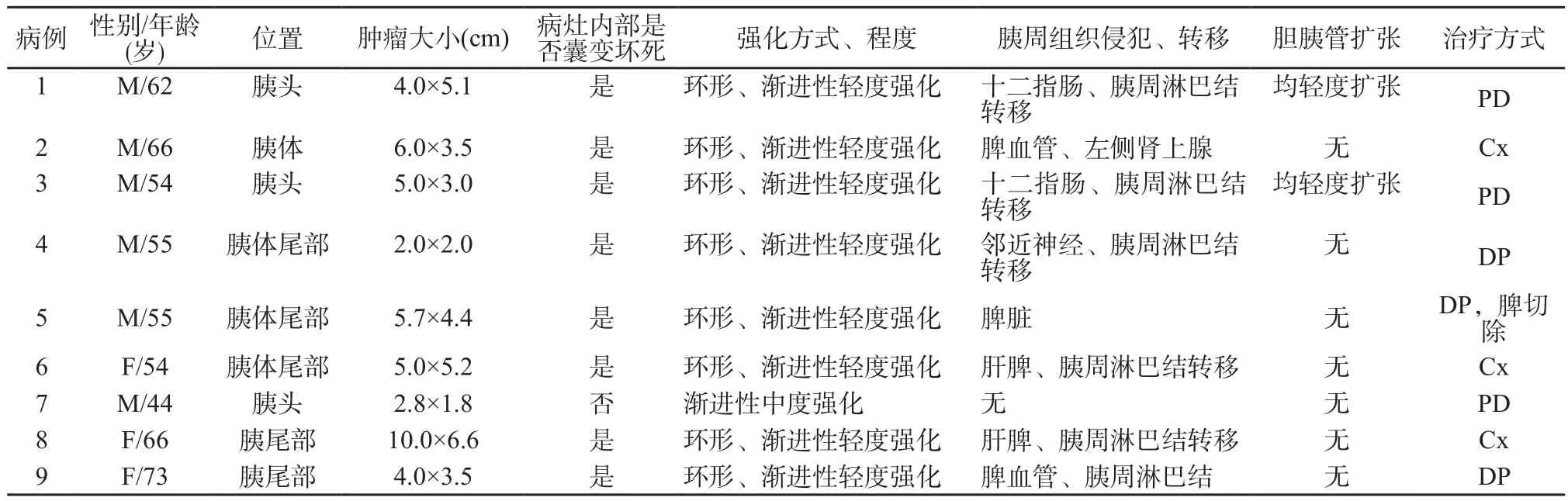
表1 9例胰腺腺鱗癌的臨床和影像學資料
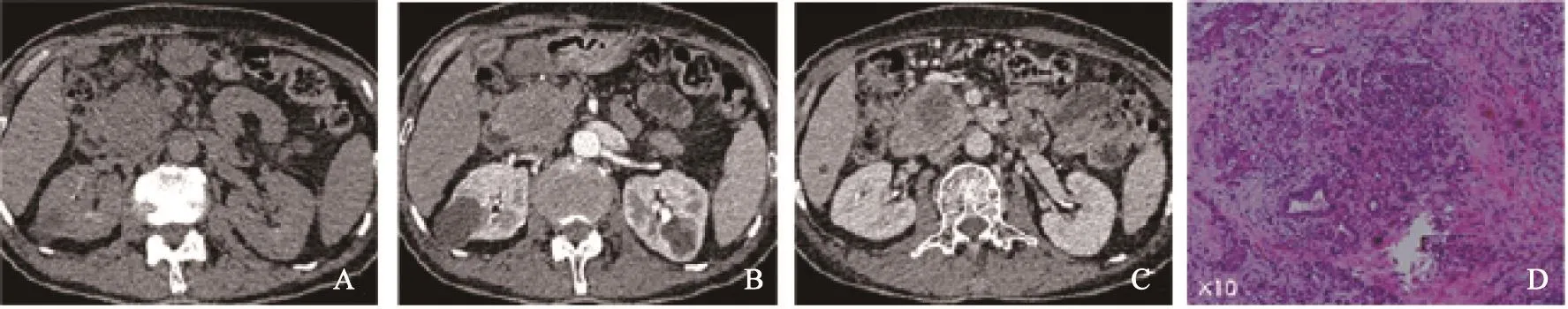
圖1 胰頭部胰腺腺鱗癌CT及病理表現

圖2 胰體尾部胰腺腺鱗癌CT表現
3 討 論
胰腺腺鱗癌是一類較為罕見的胰腺外分泌腫瘤,僅占胰腺惡性腫瘤的3%~4%。因腫瘤含有腺癌及鱗癌兩種腫瘤細胞,被稱為胰腺腺鱗癌,又名胰腺黏液表皮樣癌或棘皮樣癌[3]。對于胰腺腺鱗癌的病理學診斷,目前尚未有明確的定義。部分文獻將腫瘤內鱗癌細胞含量超過30%作為診斷依據,而另有部分文獻將找到鱗癌細胞即診斷為胰腺腺鱗癌[1,4]。胰腺腺鱗癌好發于60歲以上男性,平均年齡為66歲[4]。其臨床癥狀與胰腺導管腺癌相似,如上腹痛、體重減低、黃疸等。
腺鱗癌常見于腺癌好發部位,如肺、食管、涎腺等[4]。其惡性程度高,進展快。相較于導管腺癌,腺鱗癌預后更差[4],分化程度更低,淋巴結轉移陽性率更高[5-7]。相關研究表明,胰腺腺鱗癌發生于胰體尾部較胰頭部多見。相較于導管腺癌,其病灶更大[5-8]。本組病灶大小平均為3.7 cm× 4.8 cm,最大者長徑可達10.0 cm,與文獻報道一致。研究表明,手術切除是胰腺腺鱗癌的最佳治療手段[8],進行手術切除的胰腺腺鱗癌患者中位生存期為12個月,而無法手術的患者中位生存期僅為5個月[5]。多數病灶出現周圍臟器侵犯及肝轉移,
腫瘤標記CA19-9與CEA常作為胰腺癌及消化道腫瘤的輔助診斷指標,但目前尚未有一項腫瘤標記能對腫瘤的腺癌及鱗癌成分進行共同標示[9-11]。部分研究報道胰腺腺鱗癌患者中CA19-9與CEA濃度有不同程度升高,但對腫瘤組織學分型并無特異性[12]。本研究中4例患者CA19-9明顯升高,3例輕度升高,僅1例患者CEA升高,與文獻報道一致。本研究及其他文獻報道中AFP等其他腫瘤標記均未見異常改變。Inoue等報道該腫瘤可分泌類甲狀旁腺激素相關蛋白(parathyroid hormone-related protein,PTH-rP),出現血鈣升高[13]。
胰腺腺鱗癌較為特征的影像學表現為:胰體尾部的較大腫塊,多呈浸潤性生長;與導管腺癌相比,胰腺腺鱗癌病灶較小時即可出現明顯的囊變壞死,從而在動態增強中表現為不均勻環形強化,強化方式為漸進性輕度強化[14-18]。其CT漸進性強化的病理學基礎為:腫瘤內鱗癌細胞主要分布于囊壁上皮及腫瘤中心部分,呈巢狀緊密排列,中央乏血供,其倍增時間短,生長速度快,常因供血不足而出現壞死囊變;而實性成分多由腺癌細胞組成,該細胞呈管狀、篩狀排列,間質纖維組織增生,血管生成較少,混雜有鱗癌細胞,故在增強CT中實性成分呈漸進性不均勻強化[18]。本組8例病灶均出現中心壞死囊變,囊變區域與實性成分分界不清,實性成分呈輕度強化。僅1例患者呈實性均勻漸進性強化,考慮為鱗癌細胞含量較少而導致其影像學表現不同。而腺鱗癌轉移灶內絕大多數為腺癌細胞,很少發現鱗癌成分[18]。導管腺癌的病灶均由腺癌細胞組成,發生壞死囊變的概率較低。胰腺腺鱗癌繼發的影像學表現包括位于胰頭部的病灶侵犯,壓迫膽、胰管,表現為雙管征及梗阻性黃疸,但梗阻程度及癥狀較導管腺癌要輕。遠端胰腺的萎縮、出血、鈣化等表現較為罕見。
胰腺腺鱗癌需與以下胰腺疾病相鑒別:①胰腺導管腺癌,典型的胰腺癌發生壞死囊變的概率較低。位于胰頭部的腫瘤更易出現雙管征,擴張更明顯。病灶遠端的胰腺常發生萎縮,遠端胰管發生擴張。而腫塊邊界模糊,侵犯胰周組織及胰周淋巴結轉移與胰腺腺鱗癌的影像學表現相似。若胰腺腺鱗癌未發生中心壞死囊變,兩者較難鑒別。② 實性假乳頭狀瘤,常發生于年輕女性,腫塊多呈膨脹性生長,邊界清晰,可發生囊變壞死及鈣化。通常因腫塊較大,壓迫膽、胰管發生梗阻,較少侵犯膽、胰管。而胰腺腺鱗癌呈惡性浸潤性生長,邊界模糊,腫塊多累及膽、胰管發生擴張,較少出現鈣化。胰腺腺鱗癌CA19-9升高也有助于兩者的鑒別診斷。③ 腫塊性慢性胰腺炎:腫塊性慢性胰腺炎的病灶邊界較光整,內部多見鈣化,增強后早期強化不明顯,門靜脈期逐漸輕度均勻強化。常伴有主胰管串珠樣的擴張及沿胰管內分布的鈣化灶。
綜上所述,胰腺腺鱗癌作為一種罕見的胰腺腫瘤,與胰腺導管腺癌具有共同的臨床癥狀及實驗室檢查表現,且兩者治療方案相似。CT檢查對胰腺腺鱗癌的診斷具有提示作用:胰腺腺鱗癌腫塊體積較大,常發生中心壞死囊變,呈環形漸進性輕度強化,且多見淋巴結轉移及肝轉移。
[1] MADURA J A, JARMAN B T, DOHERTY M G, et al. Adenosquamous carcinoma of the pancreas [J]. Arch Surg, 1999, 134(6): 599-603.
[2] HSU J T, YEH C N, CHEN Y R, et al. Adenosquamous carcinoma of the pancreas [J]. Digestion, 2005, 72(2-3): 104-108.
[3] CIHAK R W, KAWASHIMA T, STEER A, et al. Adenoacanthoma (adenosquamous carcinoma) of the pancreas [J]. Cancer, 1972, 29(5): 1133-1140.
[4] KARDON D E, THOMPSON L D, PRZYGODZKI R M, et al. Adenosquamous carcinoma of the pancreas: a clinicopathologic series of 25 cases [J]. Mod Patho, 2001, 14(5): 443-451.
[5] OKABAYASHI T, HANAZAKI K. Surgical outcome of adenosquamous carcinoma of the pancreas [J]. World J Gastroenterol, 2005, 14(44): 6765-6770.
[6] SMOOT R L, ZHANG L, Sebo T J, et al. Adenosquamous carcinoma of the pancreas: a singleinstitution experience comparing resection and palliative care [J]. J Am Coll Surg, 2008, 207(3): 368-370.
[7] KATZ M H, TAYLOR T H, AL-REFAIE W B, et al. Adenosquamous versus adenocarcinoma of the pancreas: a population-based outcomes analysis [J]. J Gastrointest Surg, 2011, 15(1): 165-174.
[8] BOYD C A, BENARROCH-GAMPEL J, Sheffield K M, et al. 415 patients with adenosquamous carcinoma of the pancreas: a population-based analysis of prognosis and survival [J]. J Surg Res, 2005, 174(1): 12-19.
[9] TRIKUDANATHAN G, DASANU C A. Adenosquamous carcinoma of the pancreas: a distinct clinicopathologic entity [J]. South Med J, 2010, 103(9): 903-910.
[10] VOONG K R, DAVISON J, PAWLIK T M, et al. Resected pancreatic adenosquamous carcinoma: clinicopathologic review and evaluation of adjuvantchemotherapy and radiation in 38 patients [J]. Hum Pathol, 2010, 41(1): 113-122.
[11] MURAKAMI Y, YOKOYAMA T, YOKOYAMA Y, et al. Adenosquamous carcinoma of the pancreas: preoperative diagnosis and molecular alterations [J]. J Gastroenterol, 2003, 38(12): 1171-1175.
[12] YIN Q, WANG C, WU Z, et al. Adenosquamous carcinoma of the pancreas: multidetector-row computed tomographic manifestations and tumor characteristics [J]. J Comput Assist Tomog, 2013, r37(2): 125-133.
[13] INOUE T, NAGAO S, TAJIMA H, et al. Adenosquamous pancreatic cancer producing parathyroid hormone-related protein [J]. J Gastroenterol, 2004, 39(2): 176-180.
[14] KOBAYASHI N, HIGURASHI T, IIDA H, et al. Adenosquamous carcinoma of the pancreas associated with humoral hypercalcemia of malignancy (HHM) [J]. J Hepatobiliary Pancreat Surg, 2005, 15(5): 531-535.
[15] NA Y J, SHIM K N, CHO M S, et al. Primary adenosquamous cell carcinoma of the pancreas: a case report with a review of the Korean literature [J]. Korean J Intern Med, 2011, 26(3): 348-351.
[16] DING Y, ZHOU J, SUN H, et al. Contrast-enhanced multiphasic CT and MRI findings of adenosquamous carcinoma of the pancreas [J]. Clin Imaging, 2013, 37(6): 1054-1060.
[17] YIN Q, WANG C, WU Z, et al. Adenosquamous carcinoma of the pancreas: multidetector-row computed tomographic manifestations and tumor characteristics [J]. J Comput Assist Tomogr, 2013, 37(2): 125-133.
[18] KOSMAHL M, PAUSER U, PETERS K, et al. Cystic neoplasms of the pancreas and tumor-like lesions with cystic features: a review of 418 cases and a classification proposal [J]. Virchows Arch, 2004, 445(2): 168-178.
Manifestations of pancreatic adenosquamous carcinoma on dynamic contrast-enhanced CT
FU Yi1, XIAO Yaoxing2, ZHANG Xi1
(1. Department of Diagnostic Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Pathology,Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University,Shanghai 200032, China)
ZHANG Xi E-mail: zhangxi0009@163.com
Objective:To analyze the manifestations of pancreatic adenosquamous carcinoma on dynamic contrast-enhanced CT.Methods:Nine patients (6 men and 3 women; mean age, 58.7 years; range, 44-73 years) with pancreatic adenosquamous carcinoma confirmed by pathological examination underwent CT examination. The location, size, margin, contrast enhancement were evaluated.Results:The masses were localized in the pancreas (head in 3 cases, body and tail in 6 cases). The tumor size ranged from 2.0 cm×2.0 cm to 10.0 cm×6.6 cm, with an average size of 3.7 cm×4.8 cm. All masses were ill-de fined. Five masses invaded the peripancreatic tissues. The solid components’ CT values were (30.7±4.7) Hu, (60.2±14.5) Hu and (71.2±21.4) Hu on plan scan,arterial phase and portal vein phase. Eight masses with the presence of central necrosis showed heterogeneous and poorly enhanced areas. Only one tumor was moderately enhanced. Two patients with lesions in the head of pancreas had liver and lung metastases.Conclusion:CT imaging can provide useful information in the diagnosis of pancreatic adenosquamous carcinoma.
Pancreatic neoplasm; Computed tomography; Pancreatic carcinoma
R445.3
A
1008-617X(2017)04-0301-05
2016-12-25
2017-02-03)
國家自然科學基金項目(No:81271574);上海市自然科學基金項目(No:11ZR1407800)
張汐 E-mail:zhangxi0009@163.com

