HPLC測定玉米中玉米赤霉烯酮和赭曲霉毒素A
鄭睿行,周子焱,傅曉,林成棟,沈堅
(寧波市食品檢驗檢測研究院,浙江寧波315000)
HPLC測定玉米中玉米赤霉烯酮和赭曲霉毒素A
鄭睿行,周子焱,傅曉,林成棟,沈堅*
(寧波市食品檢驗檢測研究院,浙江寧波315000)
建立玉米中玉米赤霉烯酮(Zearalenone,ZEN)和赭曲霉毒素A(Ochratoxin A,OTA)的超高效液相色譜檢測方法。樣品用乙腈/水(90∶10,體積比)振蕩提取,過濾后過真菌毒素凈化柱,取上清液氮氣吹干,用流動相溶解殘渣,過0.22 μm有機濾膜于進樣瓶,采用高效液相色譜檢測法(High Performance Liquid Chromatography,HPLC)分析。在ZORBAX SB-C18反相柱上分離后,ZEN以甲醇/水(60∶40,體積比)作為流動相,OTA以乙腈/水/乙酸(43∶56∶1,體積比)為流動相,熒光檢測器檢測。ZEN的線性范圍為0.5 μg/mL~6.0 μg/mL,相關系數大于0.99;OTA的線性范圍為0.05 μg/mL~0.8 μg/mL,相關系數大于0.99。3個不同水平的加標平均回收率為86.4%~114.1%,相對標準偏差不大于10%。ZEN和OTA的檢測限分別為5.0 μg/kg和1.0 μg/kg。應用該方法對收集的不同玉米樣品進行測定,發現ZEN和OTA污染較嚴重,超標率均為71.4%。該方法具有操作簡單、靈敏度高、重現性好等特點,能夠用于玉米樣品中真菌毒素的測定。
玉米;玉米赤霉烯酮;赭曲霉毒素A;超高效液相色譜檢測
Abstract:Determination method of zearalenone(ZEN)and ochratoxin A(OTA)in corn by high-performance liquid chromatography (HPLC)was established.Acetonitrile/water(90 ∶10,volume ratio)for the extraction solvent extracted zearalenone and ochratoxin A in corn,clean-up column purification;then the supernatant was dried by nitrogen,with the mobile phase to dissolve the residue,through the 0.22 μm organic filter to the inlet,HPLC detection.Methanol/water(60∶40,volume ratio)was used as mobile phase for ZEN,and acetonitrile/water/acetic acid(43 ∶56 ∶1,volume ratio)for OTA.The linearity range of ZEN and OTA were 0.5 μg/mL-6.0 μg/mL and 0.05 μg/mL-0.8 μg/mL,respectively,with correlation coefficient>0.99.Recovery experiments were conducted by adding standard into the corn sample,with recoveries of 86.4%-114.1%,relative standard deviation of less than10%.The detection limit of ZEN and OTA were 5.0 μg/kg and 1.0 μg/kg,respectively.Different corn samples were found to be highly contaminated by ZEN and OTA using the method,with 71.4%of excessive rate.The method is simple and fast,good reproducibility,suitable for ZEN and OTA detection in the actual application.
Key words:corn;zearalenone;ochratoxin A;high performance liquid chromatography(HPLC)
玉米是我國重要的糧食作物和工業原料,經常用作食品配料和飼料原料。由于環境、氣候和儲藏因素的影響,玉米極易污染霉菌,在適宜的溫度、水分和濕度條件下,這些霉菌會產生真菌毒素,其中玉米赤霉烯酮(Zearalenone,ZEN)和赭曲霉毒素A(Ochratoxin A,OTA)是比較常見的兩種真菌毒素[1]。ZEN主要是由鐮刀菌屬(Fusarium)的菌株產生的類雌激素化合物,可對人和動物造成多種毒性作用。而由于ZEN的雌激素作用,生殖系統是其主要的靶器官[2]。研究表明ZEN對雌性和雄性的生殖力都會造成損傷,其中豬對ZEN最為敏感,食用ZEN污染的飼料可導致母豬外陰及乳腺腫脹,甚至引發陰道和直腸脫落[3]。OTA主要是由赭曲霉和青霉屬產生的有毒次級代謝產物,在農產品中廣泛存在。OTA可對很多動物物種造成毒性,其中腎臟是主要的靶器官。研究表明OTA可以導致腎病和人類巴爾干地方性腎病[4]。國際癌癥研究機構將OTA列為可能的人類致癌物。
ZEN和OTA污染的玉米被人和動物食用后,會對人和動物的健康造成極大地危脅,因此建立高效而準確檢測玉米中ZEN和OTA的方法十分重要。目前ZEN和OTA的檢測方法主要包括免疫法、薄層色譜法、高效液相色譜法、氣相色譜-質譜法和高效液相色譜-質譜法等[5-7]。但是免疫法、薄層色譜法的準確度不夠高,而質譜法對儀器和操作要求較高,因此目前高效液相色譜法是最常用的檢測方法。所用的樣品前處理技術包括液-液萃取和固相萃取,前者操作繁瑣且需要使用大量的有機溶劑,后者常用到免疫親和柱。但是免疫親和柱操作繁瑣且價格昂貴。本文通過固液萃取法同時提取玉米中的ZEN和OTA,選用真菌毒素凈化柱分離雜質,對國標中的前處理方法進行了簡化,高效液相色譜進行分離檢測,實現玉米中ZEN和OTA的快速檢測。
1 材料與方法
1.1 材料和試劑
ZEN和OTA污染玉米:河南洛陽;ZEN、OTA標品(純度≥98.0%):上海百靈威公司;甲醇、乙腈(色譜純):美國Fisher Scientific公司;氮氣:江蘇無錫新南氣體有限公司;其它分析純試劑均購自上海百靈威公司。
1.2 儀器與設備
Agilent HPLC 1260高效液相色譜儀:美國安捷倫科技有限公司;MD200-1氮氣吹干儀:杭州奧盛儀器有限公司;Simplicity UV超純水制備系統:法國Millipore公司。
1.3 方法
1.3.1 標準溶液的配置
準確稱取適量的ZEN和OTA標準品,分別用甲醇和乙腈配成濃度為100 μg/mL的標準儲備液,-20℃冰箱中避光保存。使用前用甲醇/水(60∶40,體積比)將ZEN 標準儲備液稀釋成 0.5、1、2、4、6 μg/mL 的標準工作液,用乙腈/水/乙酸(43∶56∶1,體積比)將 OTA 標準儲備液稀釋成 0.05、0.1、0.2、0.4、0.6、0.8 μg/mL 的標準工作液。上述標準工作液置于4℃冰箱中待HPLC分析。
1.3.2 玉米樣品的前處理
取一定量的玉米籽粒磨粉并過30目篩,然后稱量25 g玉米粉于150 mL具塞錐形瓶中。向錐形瓶中加入100 mL乙腈/水(90∶10,體積比)溶液,在搖床上振蕩45 min(30℃,200 r/min)。將提取液過濾得到上清液,取4 mL上清液通過凈化柱(PuriToxSR M160),收集2 mL流出液于5 mL聚乙烯離心管中;另外取4mL上清液通過赭曲霉毒素A專用凈化柱(PuriToxSR O130 Ochratoxin Column),收集2 mL流出液于5 mL聚乙烯離心管中。將上述液體于55℃下氮氣吹干后,分別用流動相復溶,漩渦振蕩器振蕩40 s,過0.22 μm有機濾膜于進樣瓶中,等待HPLC分析。
1.3.3 液相色譜條件
色譜柱:ZORBAXSB-C18(150 mm×4.6 mm,5 μm);柱溫:30℃;ZEN 流動相:甲醇/水(60∶40,體積比);流速:1.0 mL/min;進樣量:20 μL;熒光檢測器:激發波長274 nm,發射波長 440 nm;OTA 流動相:乙腈/水/乙酸(43 ∶56 ∶1,體積比);流速:0.9 mL/min;進樣量:20 μL;熒光檢測器:激發波長333 nm,發射波長477 nm。
1.3.4 定性和定量
根據國標采用外標法定量,保留時間定性,樣品中目標化合物色譜峰的保留時間必須與標準品色譜峰一致,同時向污染玉米中加標,通過比較目標峰的變化加以驗證。
2 結果與討論
2.1 提取溶劑的確定
ZEN和OTA都易溶于甲醇、乙腈、丙酮和乙酸乙酯等極性溶劑。考慮到丙酮和乙酸乙酯毒性較大,通常采用甲醇和乙腈作為提取溶劑。根據國標,ZEN采用乙腈/水(90∶10,體積比)作為提取溶劑,而OTA采用甲醇/水(80∶20,體積比)作為提取溶劑,考慮到分別提取過程繁瑣,所以采用一種提取劑同時提取兩種目標化合物。相比甲醇,乙腈更能減少蛋白質、糖類、氨基酸和酶類的溶解性,避免它們對目標物的干擾,因此選用乙腈/水(90∶10,體積比)作為兩者的共同提取溶劑,同時為了考察乙腈/水對于OTA的提取效果,本試驗分別用乙腈/水(90∶10,體積比)和甲醇/水(80∶20,體積比)提取玉米中的OTA,見圖1和圖2。
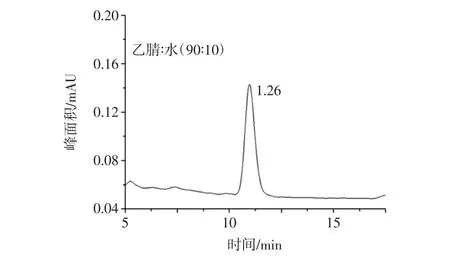
圖1 提取溶劑為乙腈∶水(90∶10,體積比)時OTA的峰面積Fig.1 The peak area of OTA by extraction of acetonitrile/water(90 ∶10,volume ratio)
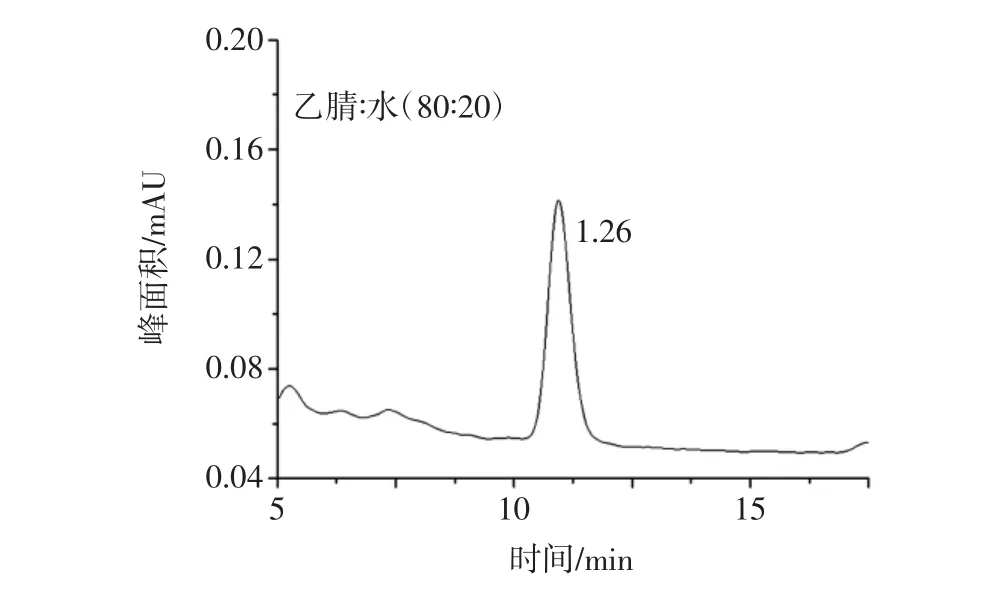
圖2 提取溶劑為甲醇∶水(80∶20,體積比)時OTA的峰面積Fig.2 The peak area of OTA by extraction of methanol/water(80 ∶20,volume ratio)
結果表明,當分別采用兩種提取劑時,OTA的峰面積沒有顯著差異,乙腈/水(90∶10,體積比)對OTA同樣具有較好的提取效果。因此,本試驗確定乙腈/水(90∶10,體積比)為樣品提取溶劑。
2.2 分離小柱的選擇
在不同過柱條件下ZEN和OTA的回收率見圖3。
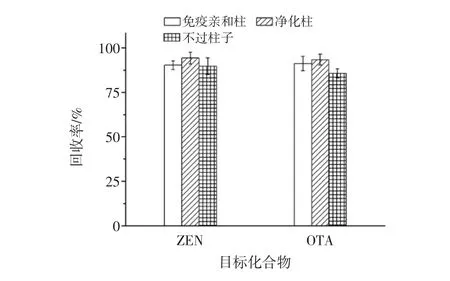
圖3 不同過柱條件下ZEN和OTA的回收率Fig.3 The recoveries of ZEN and OTA by different columns
向玉米粉中添加30 μg/kg的ZEN和10 μg/kg的OTA,按照1.3.2描述的方法進行前處理,除過柱條件不同外,其他步驟均相同。其中免疫親和柱的步驟參照GB/T 5009.209-2008《谷物中玉米赤霉烯酮的測定免疫親和層析凈化高效液相色譜法》[8]和GB/T 23502-2009《食品中赭曲霉毒素A的測定》[9]。結果表明,當使用凈化柱時,玉米粉中ZEN和OTA的回收率最高,對于ZEN,過免疫親和柱和不過柱子回收率沒有顯著差異,而對于OTA,不過柱子回收率偏低,且雜峰較多。本試驗所用凈化柱對玉米樣品中真菌毒素的提取回收率比免疫親和柱回收率要高,其對ZEN和OTA的回收率均在90%~95%;另外其操作步驟更為簡便,凈化前也不需進行活化、淋洗和洗脫等操作只需直接上樣,有效地減少了有機溶劑的使用和浪費。
2.3 樣品定性
ZEN、OTA標品加標后的色譜圖見圖4和圖5。
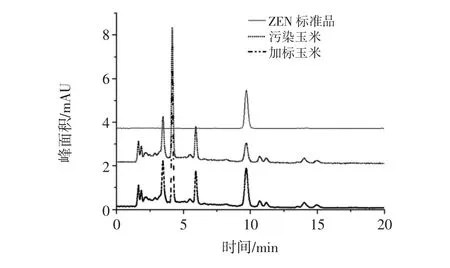
圖4 玉米樣品中ZEN的定性Fig.4 The qualitative determination of ZEN in corn
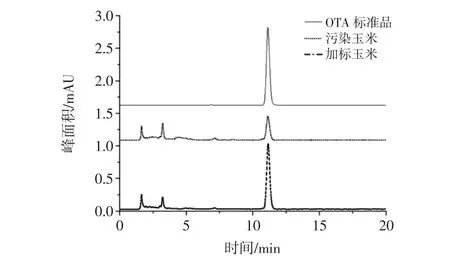
圖5 玉米樣品中OTA的定性Fig.5 The qualitative determination of OTA in corn
ZEN和OTA的定性采用保留時間,當保留時間和標準品色譜峰的保留時間一致時認為是目標化合物的色譜峰。本研究采用加標法對該定性方法進行確認,防止其他化合物的干擾。結果表明,污染玉米和污染玉米加標后均在與標品的保留時間一致處出現了色譜峰,且加標玉米的色譜峰峰高明顯大于污染玉米的色譜峰。這表明采用保留時間定性能夠確定目標化合物的存在。
2.4 線性關系、檢出限和回收率
測定1.3.1中系列標準液,得到ZEN和OTA的外標工作曲線見表1。
如表1 所示,ZEN 在 0.5 μg/mL~6 μg/mL,OTA 在0.05 μg/mL~0.8 μg/mL 范圍內線性良好。方法的檢出限以加標樣品色譜峰S/N≥3確定,結果見表2。
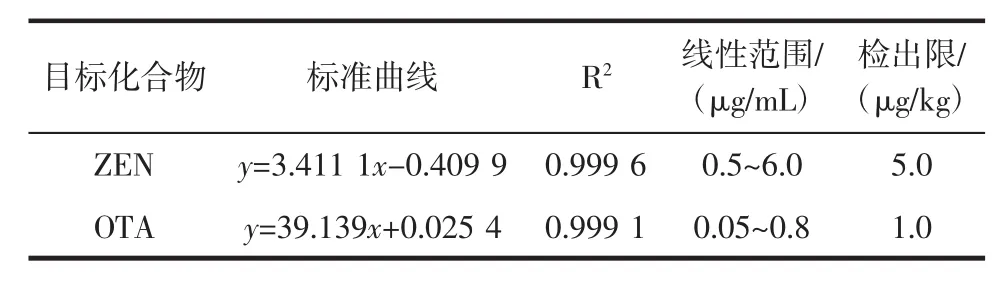
表1ZEN和OTA的線性曲線Table 1 The standard curve of ZEN and OTA
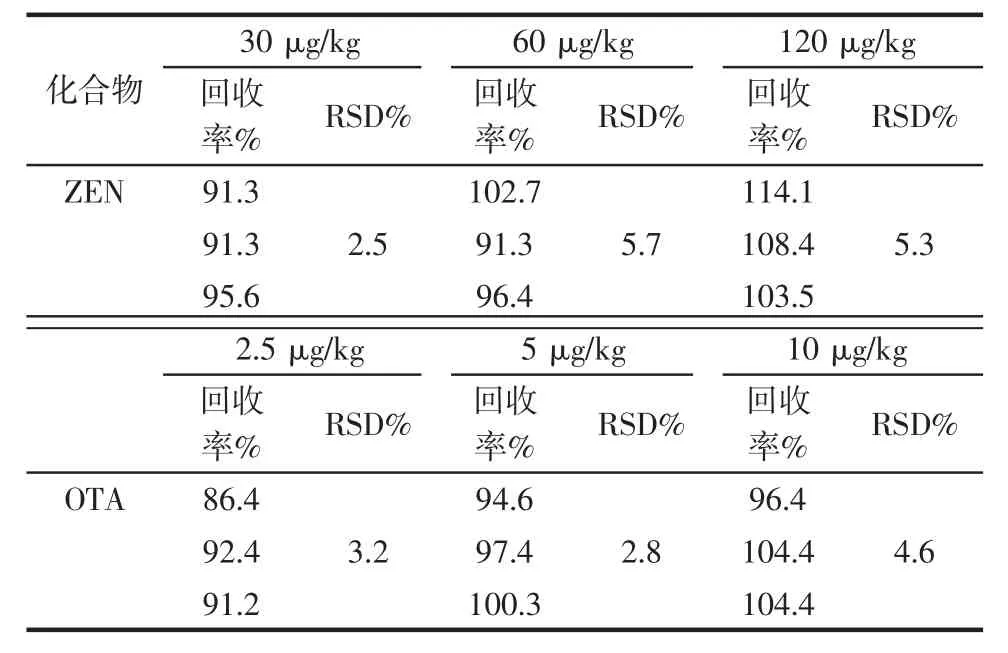
表2 玉米中ZEN和OTA的加標回收率Table 2 The recoveries of ZEN and OTA
精確稱取25 g玉米粉,分別加入ZEN和OTA標準液,使ZEN和OTA在玉米粉中的濃度分別為30、60、120 μg/kg和 2.5、5、10 μg/kg。按照優化的條件進行處理和測定,外標法定量。從表2可以看出,2種目標化合物在各自的3個加標水平下回收率為86.4%~114.1%,RSD小于10%,符合國際上對于食品污染物殘留檢測的要求。
2.5 實際樣品測定
收集不同品種的玉米,按照1.3.2優化方法測定,結果如表3所示。
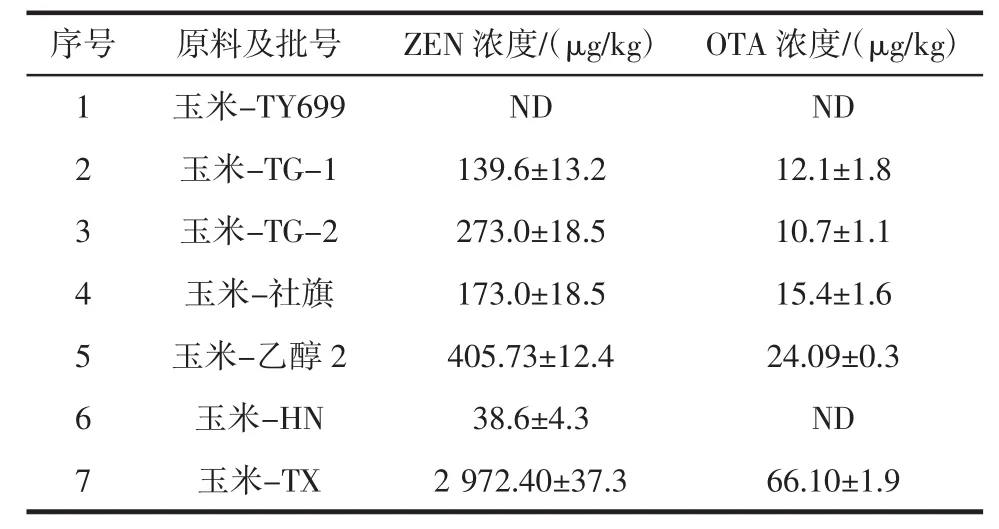
表3 不同玉米樣品中ZEN和OTA含量Table 3 Determination of ZEN and OTA in corn samples
數據表明,7個玉米樣品中ZEN的陽性檢出率為85.7%,超標率 71.4%(≤60 μg/kg)[10];OTA 陽性檢出率和超標率均為 71.4%(≤5 μg/kg)[10]。百奧明公司調查了2009年~2011年全球7049份農產品中的真菌毒素含量,其中ZEN和OTA的陽性率分別為45%和28%[11]。李榮濤等[12]利用單克隆抗體生物免疫技術測定了48份小麥樣本和33份玉米樣本,發現玉米赤霉烯酮的檢出率為 100%,含量為 18 μg/kg~730 μg/kg。相比這些結果,本研究中玉米樣品中ZEN和OTA污染較嚴重,這主要是由于取樣不同造成的。本試驗所采集的樣品主要用于后期真菌毒素脫毒研究,因此一般會采集污染較嚴重玉米。
3 結論
本文建立玉米中ZEN和OTA的超高效液相色譜檢測方法。該方法對國標中的方法進行了簡化,在所測定的范圍內,該方法的線性良好,回收率高,重現性好,符合玉米樣品中痕量污染物檢測的要求。本方法代替了免疫親和柱的使用,減少了有機試劑的使用,使操作更加簡單。另外對收集的玉米樣品進行測定,ZEN和OTA污染較嚴重,因此應該加強對糧食中真菌毒素的檢測和監管工作。
[1]單安山,周長路,張圓圓,等.東北地區不同飼料原料中霉菌毒素含量的測定[J].東北農業大學學報,2013(6):96-100
[2]Zinedine A,Soriano JM,Molto JC,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food and chemical toxicology,2007,45(1):1-18
[3]Shier WT,Shier AC,Xie W,et al.Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins[J].Toxicon,2001,39(9):1435-1438
[4]Pfohl-Leszkowicz A,Manderville RA.Ochratoxin A:An overview on toxicity and carcinogenicity in animals and humans[J].Molecular nutrition&food research,2007,51(1):61-99
[5]李沐潔.玉米赤霉烯酮和赭曲霉毒素A免疫快速檢測技術的建立與應用[D].杭州:中國計量學院,2012
[6]王向紅,劉濤,王忠斌,等.高效液相色譜法同時測定谷物中的赭曲霉毒素和玉米赤霉烯酮[J].中國食品學報,2008(5):148-152
[7]趙孔祥,胡筱蕓,何佳,等.免疫親和凈化-液相色譜-串聯質譜測定中成藥中14個真菌毒素[J].藥物分析雜志,2012(5):846-851
[8]中華人民共和國衛生部.GB/T 5009.209-2008谷物中玉米赤霉烯酮的測定[S].北京:中國標準出版社,2008:1-5
[9]中華人民共和國衛生部.GB/T 23502-2009食品中赭曲霉毒素A的測定免疫親和層析凈化高效液相色譜法[S].北京:中國標準出版社,2009:1-6
[10]中華人民共和國衛生部.GB 2761-2011,食品安全國家標準食品中真菌毒素限量[S].北京:中國標準出版社,2011:1-9
[11]Rodrigues I,Naehrer K,張艷,等.百奧明:2012年全球霉菌毒素調查報告[J].中國畜牧雜志,2013(14):15-18,23
[12]謝剛,蘭盛斌,張華昌,等.免疫親合柱在小麥真菌毒素檢測中的應用及毒素污染分析[J].糧食儲藏,2004(6):37-40
Determination of Zearalenone and Ochratoxin A in Corn by Means of HPLC
ZHENG Rui-hang,ZHOU Zi-yan,FU Xiao,LIN Cheng-dong,SHEN Jian*
(Ningbo Institute for Food Control,Ningbo 315000,Zhejiang,China)
2017-01-19
10.3969/j.issn.1005-6521.2017.19.030
鄭睿行(1982—),男(漢),高級工程師,碩士研究生,研究方向:食品質量安全檢驗。
*通信作者:沈堅(1966—),男(漢),高級工程師,本科,研究方向:食品質量安全檢驗。

