蛋白質組學分析揭示玉米籽粒發育過程中脅迫相關蛋白的表達特性
于濤,李耕,劉鵬,董樹亭,張吉旺,趙斌
?
蛋白質組學分析揭示玉米籽粒發育過程中脅迫相關蛋白的表達特性
于濤,李耕,劉鵬,董樹亭,張吉旺,趙斌
(山東農業大學農學院/作物生物學國家重點實驗室,山東泰安 271018)
【目的】從蛋白質組學的層面探討玉米籽粒發育過程中脅迫相關蛋白的表達特性,分析其功能,揭示籽粒自身防御系統的分子調控機理。【方法】大田條件下,以玉米品種登海661(DH661)為供試材料,67 500株/hm2密度下種植,開花期人工飽和授粉后第3、5、10、15、20、30、40和50 天(DAP)取果穗中部籽粒。TCA-丙酮沉淀法提取籽粒總蛋白,用同位素標記相對定量(iTRAQ)技術進行蛋白質組學分析。通過匹配Uniprot玉米蛋白數據庫鑒定籽粒總蛋白,并且用基因本論(GO)注釋按照生物過程、分子功能及細胞組件進行功能分類。分析鑒定籽粒發育過程中顯著差異表達的脅迫相關蛋白,并且將其分層聚類以展示其在籽粒發育過程中的表達模式。【結果】通過匹配玉米蛋白數據庫,籽粒中總計鑒定到4 751個蛋白,這些蛋白涉及多種生物過程與分子功能,其中代謝過程與分子過程是最主要的兩個生物過程,而催化活性與綁定功能是最主要的兩個分子功能類別,表明這些生物過程與分子功能對籽粒發育具有重要作用。定量分析檢測到123個脅迫相關蛋白在玉米籽粒發育過程中顯著差異表達,主要參與籽粒蛋白修飾(33個)、活性氧(ROS)體內平衡(31個)、貯藏物質保護(17個)、病蟲害響應(8個)及其他脅迫響應過程(34個)。蛋白修飾相關蛋白主要包含一系列的熱激蛋白、肽基脯氨酰順反異構酶及蛋白二硫鍵異構酶,并且這些蛋白在籽粒不同發育階段均顯著積累,這對穩定籽粒中的蛋白結構具有重要作用。ROS相關蛋白包含不同的抗氧化酶系,并且主要在籽粒發育前、后期顯著積累,維護了ROS的體內平衡。貯藏物質保護相關蛋白主要包含多種蛋白酶抑制劑、油脂體蛋白及油脂體固醇蛋白,并且這些蛋白隨著籽粒發育不斷上調表達,保護了貯藏物質的合成與積累。病蟲害響應相關蛋白同樣在籽粒發育后期顯著積累,增強了籽粒對生物脅迫的抗性。其他脅迫響應相關蛋白主要包括一系列的晚期胚胎豐富蛋白(LEA)、膜聯蛋白、脂質轉移蛋白、非特異性脂質轉移蛋白及脂氧合酶,其中LEA在籽粒發育后期顯著積累,膜聯蛋白與脂氧合酶主要在發育前期顯著表達,而脂質轉移蛋白及非特異性脂質轉移蛋白在籽粒不同發育階段均有積累,表明這些蛋白在籽粒不同發育階段發揮重要作用。【結論】脅迫相關蛋白在籽粒不同發育階段顯著積累,構建了一個協同、多樣、穩定的防御調控機制,維護了籽粒正常的發育過程。
玉米;籽粒發育;iTRAQ蛋白質組學;脅迫相關蛋白;蛋白功能
0 引言
【研究意義】玉米作為食物、飼料的重要來源,其籽粒發育好壞直接關系到最終的產量與品質。然而,籽粒發育過程中不可避免地遭受復雜多樣的環境脅迫,顯著影響籽粒產量與品質的形成。蛋白是生命活動的直接調控者。因此,在蛋白水平上,深入研究玉米籽粒發育過程中脅迫相關蛋白的表達特性,對于解析籽粒自身防御系統的分子調控機理,增強玉米的抗逆能力,提高籽粒產量與品質具有重要意義。同時,對于玉米育種與栽培種植也具有指導價值。【前人研究進展】玉米籽粒發育源于雙受精過程,可劃分為三個不同的階段:早期發育階段(庫容建成期)、灌漿期及成熟期[1]。然而,籽粒在不同發育階段常常受到多重脅迫,尤其在籽粒成熟期,含水量迅速下降,收獲時的籽粒含水量一般低于20%[2]。這種低水分條件下,玉米其他營養組織細胞會迅速失活,而籽粒在吸脹后仍能正常萌發,表明籽粒在發育過程中必須獲得充足的耐脫水能力[3]。前人對生物脅迫如細菌、真菌感染[4-5]及非生物脅迫包括干旱[6]、高溫[7-8]、弱光[9]和淹水[10-11]對籽粒發育的影響及籽粒應對這些脅迫形態、生理生化的響應機制進行了大量研究。然而,對其發育過程中防御系統的分子調控過程鮮見報道。蛋白質組學可以在蛋白水平解析籽粒發育過程中脅迫響應的分子調控機理,其中同位素標記相對定量技術(iTRAQ)能夠在復雜樣品中大規模鑒定與定量蛋白[12]。以iTRAQ為基礎的蛋白質組學分析在小麥[13]、水稻[14]中的研究表明,多種脅迫相關蛋白在籽粒發育過程中顯著差異表達,這些協同表達的蛋白參與籽粒防御調控,保證籽粒在不同發育階段的正常發育。【本研究切入點】前人針對玉米籽粒發育過程中形態、生理生化的脅迫響應進行了大量研究,但涉及籽粒發育防御系統的分子調控過程鮮見報道。籽粒在不同發育階段脅迫相關蛋白的表達特性尚不清楚。【擬解決的關鍵問題】本研究利用iTRAQ蛋白質組學方法,旨在鑒定及描述玉米籽粒不同發育階段脅迫相關蛋白的表達特性。通過分析這些蛋白的表達特性及潛在的生物學功能,以進一步揭示玉米籽粒發育過程中防御調控的分子機理,為培育玉米耐脅迫新品種及栽培種植提供生物學基礎。
1 材料與方法
1.1 試驗材料與設計
本試驗于2015年在黃淮海玉米區域技術創新中心及山東農業大學作物生物學國家重點實驗室進行。試驗采用玉米品種登海661,播種前精細整地、造墑。6月15日播種,10月5日收獲,種植密度67 500株/hm2。小區面積60 m2(6 m×10 m)。田間管理按照大田標準進行,生育期內水分供應充足,病蟲草害預防及時。
吐絲期,選擇有代表性、生長一致的植株掛牌標記。開花后人工飽和授粉,分別在授粉后第3、5、10、15、20、30、40及50 天(DAP)于標記的植株取3個果穗。將每個果穗中部籽粒剝離,并選取100粒液氮速凍后移至-80℃超低溫冰箱內保存。每個取樣時期進行3次生物學重復,用于iTRAQ蛋白質組學的分子生物學研究。
1.2 蛋白提取與含量測定
稱取1 g籽粒樣品于液氮中研磨,樣品懸浮于10倍體積含有10%(v/v)TCA的預冷丙酮溶液中,-20℃沉淀2 h。4℃、20 000×離心 30 min,棄上清液,取沉淀。沉淀中再加入10倍體積預冷的丙酮溶液,清洗沉淀(將沉淀搗碎或懸起),-20℃沉淀30 min,4℃、20 000×離心30 min。重復此過程多次直至沉淀基本為白色,后經真空干燥得到粉末狀蛋白。稱取0.2 g蛋白干粉溶解于3 mL裂解液(8 mol·L-1Urea,30 mmol·L-1HEPES,1mmol·L-1PMSF,2 mmol·L-1EDTA,10 mmol·L-1DTT),超聲5 min助溶,4℃、20 000×離心30 min,取上清液。上清液中加入DTT至終濃度10 mmol·L-1,56℃水浴1 h。取出后,迅速加入IAM至終濃度55 mmol·L-1,暗室靜置1 h。混合樣品中再次加入4倍體積的預冷丙酮溶液,-20℃沉淀3 h。隨后,4℃、20 000×離心30 min,取沉淀。沉淀溶解于400 μL的復溶液(0.5 mol·L-1TEAB,0.1% SDS),超聲3 min助溶,4℃、20 000×再次離心30 min,取上清液。采用蛋白定量試劑盒測定蛋白濃度。
1.3 蛋白消化與肽段標記
每個籽粒樣品取100 μg蛋白體積,用含0.1% SDS的TEAB補齊所有樣品體積。每100 μg蛋白樣品加入3.3 μg的胰蛋白酶,37 ℃水浴24 h。然后,補加胰蛋白酶1 μg,繼續37℃水浴24 h。凍干消化液,然后使用TEAB(水﹕TEAB=1﹕1)每管30 μL重新溶解肽段。按照試劑盒說明,用8標iTRAQ試劑中的113、114、115、116、117、118、119及121分別標記3、5、10、15、20、30、40及50 DAP的籽粒蛋白樣品。8個標記的蛋白樣品室溫靜置2 h后混合,真空干燥。試驗共進行3次生物學重復標記。
1.4 高效液相色譜
混合后的肽段樣品溶于10倍體積的強陽離子緩沖液A(10 mmol·L-1KH2PO4,乙腈25%,pH 3.0)。使用高效液相色譜系統并裝配強陽離子交換色譜柱(250 mm×4.6 mm,5 μm,100?)進行肽段分餾。緩沖液B(10 mmol·L-1KH2PO4,2 mol·L-1KCl,乙腈25%,pH 3.0)用于流動相,流速設置為1 mL·min-1。設置強陽離子交換液相色譜分級梯度(0%,45 min;0—5%,1 min;5—30%,20 min;30—50%,5 min并維持5 min;50—100%,5 min并維持10 min)。總共收集36份洗脫組分,并且根據色譜峰合并為16份。隨后,洗脫組分根據使用說明,經C18反相色譜除鹽后凍干,-80℃保存。
1.5 質譜鑒定
質譜分析使用納升液相系統(Shimadzu,Kyoto,Japan)。混合后的蛋白樣品經C18色譜柱(75 μm×2 cm,5 μm,100?)用含0.1%甲酸的乙腈溶液在45 min內濃度梯度由5%上升到80%分離樣品,流速為300 nL·min-1。
質譜分析采用Q-Exactive質譜儀(Thermo Fisher Scientific,MA,USA)檢測肽段信號。檢測方式如下:正離子模式;母離子掃描范圍350—2 000 m/z;一級質譜分辨率:m/z為200時70 000次;AGC target:1e6;一級最大IT:50 ms;掃描范圍數目:1;動態排除:15 s。
多肽和多肽的碎片的質量電荷比,按照下列方法采集:每次全掃描后采集20個碎片圖譜,二級質譜激活類型:HCD;隔離窗:2 m/z;二級質譜分辨率:m/z為200時17 500次;微碎片圖譜數:1;二級最大IT值:100 ms;規一化碰撞能量:28 eV;填充率:1%。
1.6 數據分析
對于蛋白鑒定,采用MASCOT軟件(版本2.3.01,Matrix Science,London,U.K.)將原始質譜數據自動匹配Uniprot玉米蛋白數據庫。搜索參數設置如下:胰蛋白酶作為消化類型,并且允許1個最大的胰蛋白酶漏切位點;固定修飾采用半胱氨酸,可變修飾采用iTRAQ 8-plex(K)、iTRAQ 8-plex(Y)、iTRAQ 8-plex(N-term)及Oxidation(M);肽段質量誤差為15 ppm;串聯質譜誤差為0.1 Da。蛋白至少含有一個唯一肽段,并且陽性結果錯誤率(FDR)≤1%才被認為鑒定有效。
對于蛋白定量,由于iTRAQ是相對定量的方法,因此,在每一個生物學重復中均以3 DAP籽粒樣品為參考,將后續每個時期的蛋白樣品分別與之進行比對。為保證定量結果的準確性,只有蛋白的定量信息至少存在于兩次生物學重復中才做進一步分析。以3次生物學重復的平均值作為最終蛋白表達倍率。籽粒發育過程中,平均相對表達水平上調或下調差異大于1.5倍,并且在統計學ANOVA檢驗上<0.05的蛋白定義為顯著差異表達的蛋白。
鑒定到的玉米籽粒蛋白進行基因本輪(GO)注釋,并且按照生物過程、分子功能及細胞組件的功能范疇進行分類[15]。采用Cluster 3.0軟件對籽粒發育過程中顯著差異表達的脅迫相關蛋白進行表達模式聚類分析,聚類參數使用相似性度量及歐氏距離。聚類結果采用Java TreeView軟件進行可視化處理。
2 結果
2.1 玉米籽粒蛋白鑒定及GO注釋
8個時期的籽粒蛋白樣品經過提取,用于iTRAQ蛋白質組學分析。通過匹配玉米蛋白數據庫,玉米籽粒中總計鑒定到4 751個蛋白,其中2 755個至少存在于兩次生物學重復中(圖1)。
玉米籽粒蛋白經GO注釋,按照生物過程、分子功能及細胞組件的功能范疇進行分類。如圖2所示,玉米籽粒中的蛋白涉及多種生物過程與分子功能。生物過程類別中,蛋白廣泛參與代謝過程(24.58%)、分子過程(22.85%)、單一生物過程(17.80%)、刺激應答(6.50%)、細胞成分組織(6.30%)、生物過程調控(6.22%)和定位(5.60%)等過程,其中代謝過程(24.58%)與分子過程(22.85%)是其最主要的兩個生物過程。分子功能類別中,蛋白主要具備催化活性(43.59%)、綁定(40.90%)、結構分子活性(5.00%)及轉運因子(4.10%)等活性,其中催化活性(43.59%)與綁定功能(40.90%)占據最大的兩個功能類別。細胞組件類別中,蛋白主要定位于細胞(37.62%)、細胞器(28.49)、細胞膜(14.97%)及大分子復合物中(10.59%)。
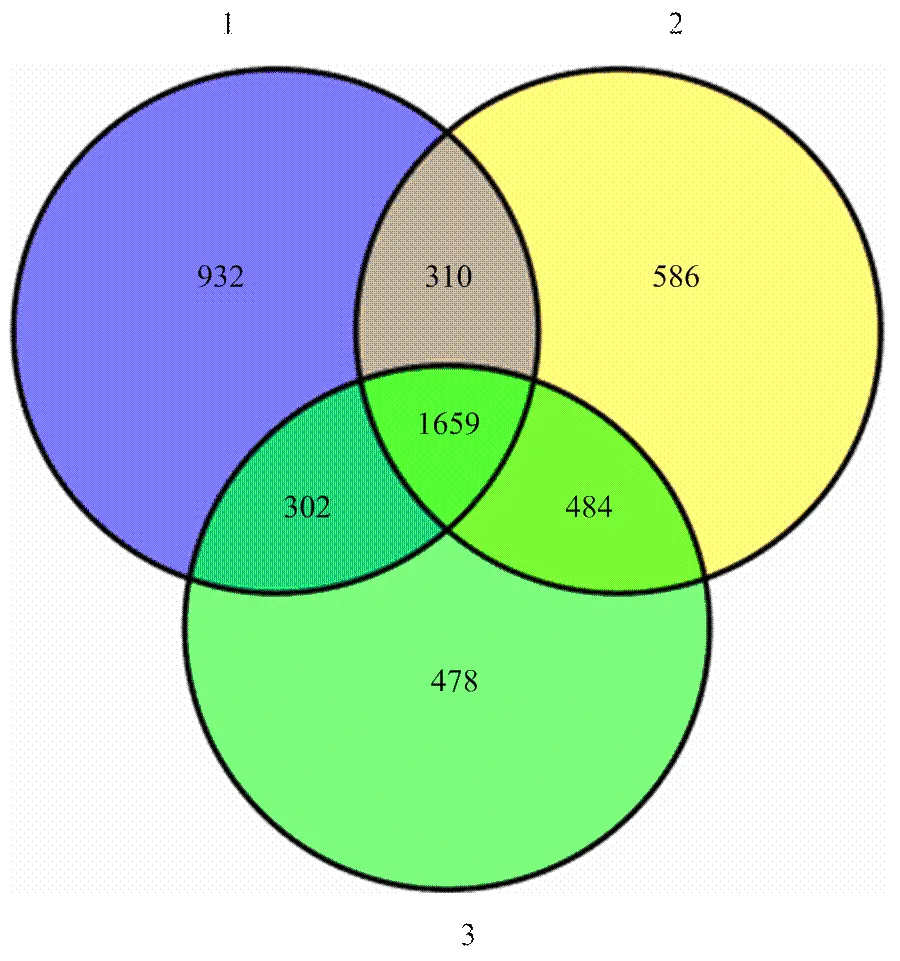
圖1 3次生物學重復鑒定到的玉米籽粒總蛋白
2.2 脅迫相關蛋白的功能類別與表達特性
如表1所示,GO注釋與定量分析發現123個脅迫相關蛋白在籽粒發育過程中顯著差異表達。根據這些蛋白的生物學功能,將其劃分為以下5種功能類別:蛋白修飾(33個)、ROS體內平衡(31個)、貯藏物質保護(17個)、病蟲害響應(8個)及其他脅迫響應過程(34個)。
如圖3所示,分層聚類分析將這些脅迫相關蛋白的表達模式劃分為5種(A、B、C、D及E)。表達模式A包含23個蛋白,其表達水平在發育前期最高,后隨著籽粒發育不斷下調;表達模式B包含16個蛋白,這些蛋白在5及40 DAP具有兩個表達高峰;表達模式C包含5個蛋白,其表達水平在15—20 DAP顯著積累;表達模式D包含34個蛋白,其表達水平在15 DAP開始緩慢上調,并在50 DAP達到最高;表達模式E包含45個蛋白,其表達趨勢與D相似,只是在20 DAP開始快速上調表達,并且持續到50 DAP。
2.3 蛋白修飾相關蛋白的表達特性
33個蛋白修飾相關蛋白在籽粒發育過程中顯著差異表達,其中包括一系列的熱激蛋白,如熱激蛋白16.9 kDa I類熱激蛋白(編號1)、17.5 kDa II類熱激蛋白(編號2)、推測的熱激蛋白20伴侶家族蛋白(編號29)、熱激蛋白101(編號12)、熱激蛋白1(編號13)及3個70 kDa 熱激蛋白(編號10、11及32)(表1)。此外,其他參與蛋白修飾的蛋白還主要包括9個肽基脯氨酰順反異構酶(編號16—24)及3個蛋白二硫鍵異構酶(編號26—28)(表1)。分層聚類分析顯示有6個(A),4個(C)及20個(D和E)蛋白分別在發育的前、中及后期顯著積累,而3個(B)在發育的前、后期均顯著積累(表2)。
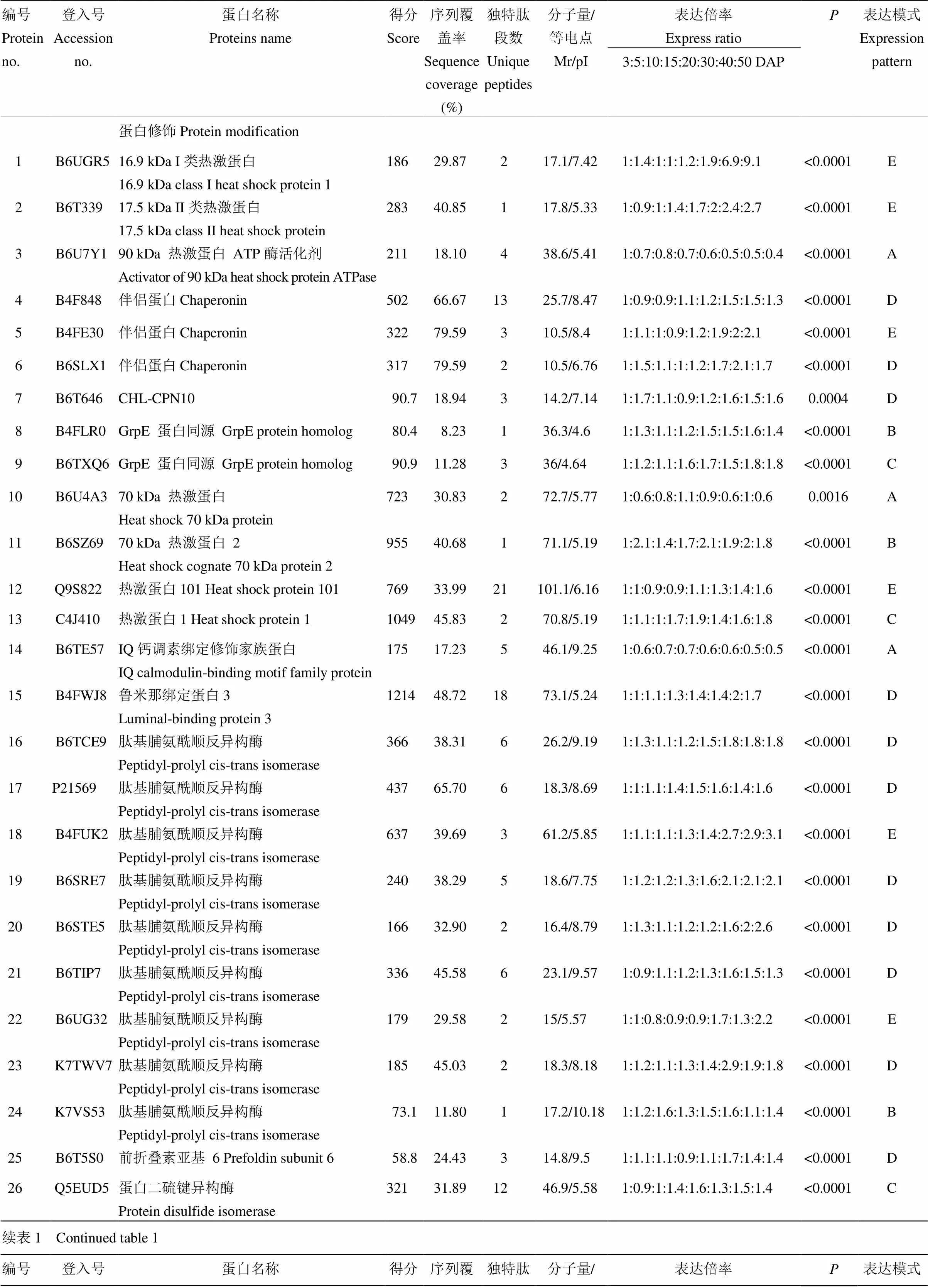
表1 籽粒發育過程中鑒定到的顯著差異表達的脅迫相關蛋白
2.4 活性氧(ROS)體內平衡相關蛋白的表達特性
如表1所示,31個顯著差異表達的脅迫相關蛋白涉及ROS的體內平衡,主要包括1-Cys過氧化物酶(編號34)、2個抗壞血酸過氧化物酶(編號35及36)、2個多酚氧化酶(編號52及53)、6個谷胱甘肽S-轉移酶(編號41—46)、5個超氧化物歧化酶(編號54—58)及6個硫氧還原蛋白(編號59—64)。分層聚類分析顯示有8個(A)及16個(D和E)蛋白分別在發育的前、后期顯著積累,而僅有1個(C)在發育中期顯著表達;此外,有6個(B)蛋白在發育的前、后期均顯著積累(表2)。值得注意的是同一蛋白的不同亞型(如谷胱甘肽S-轉移酶、超氧化物歧化酶及硫氧還原蛋白)具有不同的表達模式,以硫氧還原蛋白為例,6個硫氧還原蛋白亞型中,1個(編號64)亞型在發育中期顯著積累,3個亞型在發育后期顯著積累,剩下的2個亞型在發育的前、后期均顯著積累(表1)。此外,鋅金屬硫II類蛋白(編號40)在50 DAP的表達水平與3 DAP相比上調高于44倍(表1),顯示出其在籽粒發育后期發揮重要作用。
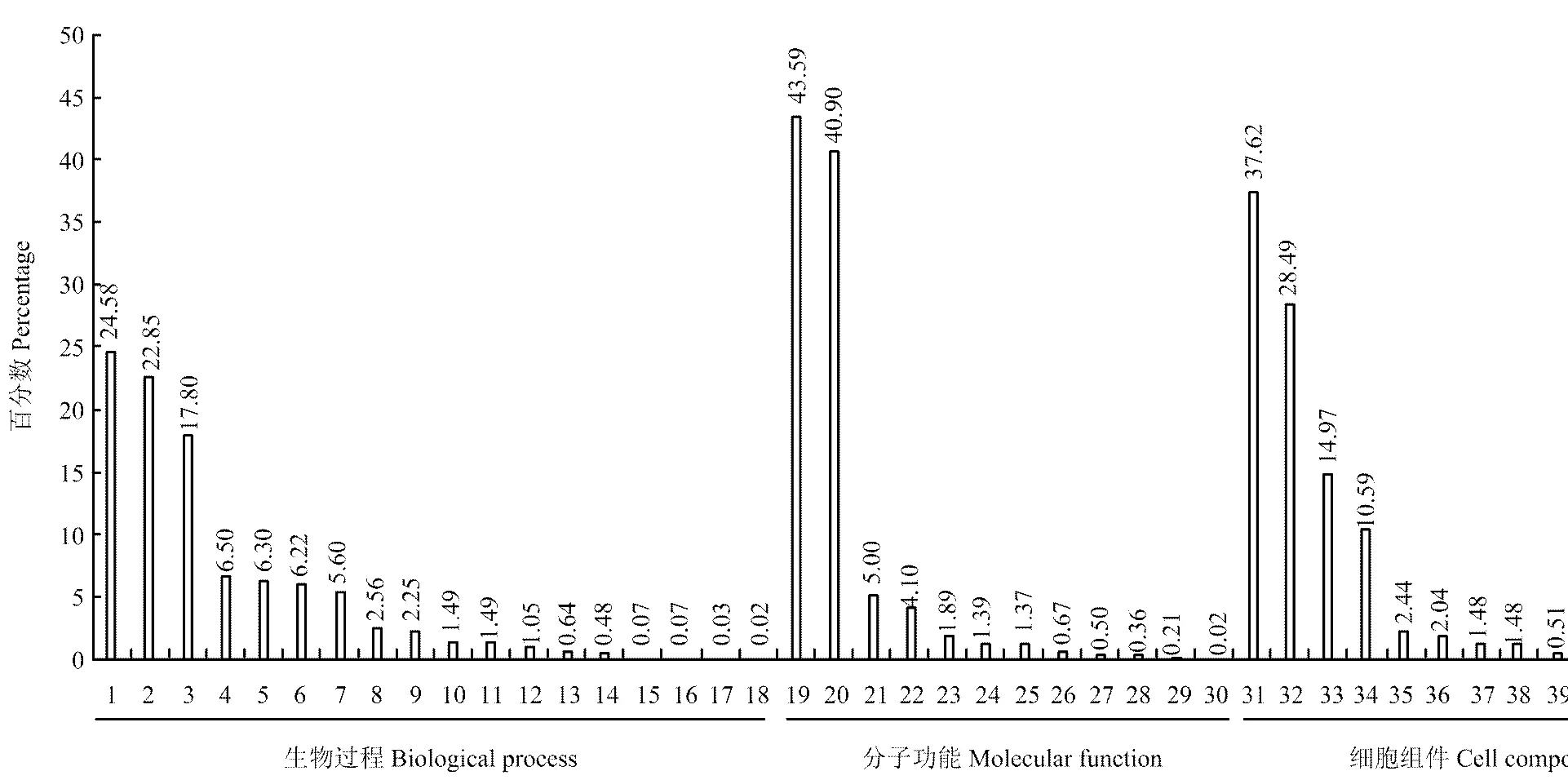
生物過程Biological process:1代謝過程Metabolic process;2分子過程Cellular process;3單一生物過程Single-organism process;4刺激應答Response to stimulus;5細胞成分組織Cellular component organization or biogenesis;6生物過程調控Biological regulation;7定位Localization;8發育過程Developmental process;9多細胞組織過程Multicellular organismal process;10再生Reproduction;11信號Signaling;12多機體過程Multi-organism process;13生長Growth;14免疫系統過程Immune system process;15生物過程調控Biological regulation;16生物附著Rhythmic process;17移動Locomotion;18細胞致死Cell killing。分子功能Molecular function:19催化活性Catalytic activity;20綁定Binding;21結構分子活性Structural molecule activity;22轉運因子活性Transporter activity;23分子功能調控Molecular function regulator;24電荷載體活性Electron carrier activity;25抗氧化活性Antioxidant activity;26營養受體活性Nutrient reservoir activity;27分子感應器活性Molecular transducer activity;28核苷酸轉錄因子活性Nucleic acid binding transcription factor activity;29蛋白質結合轉錄因子活性Protein binding and transcription factor activity;30金屬伴侶活性Metallo chaperone activity。細胞組件Cell component:31細胞Cell;32細胞器Organelle;33細胞膜Membrane;34大分子復合物Macromolecular complex;35膜結合腔體Membrane-enclosed lumen;36細胞間區域Extracellular region;37胞間連絲Cell junction;38共質體Symplast;39超分子纖維Supramolecular fiber;40病毒體Virion;41核狀體Nucleoid;42細胞外液Extracellular matrix
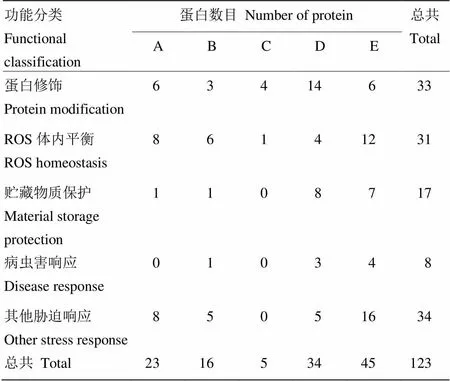
表2 分層聚類分析脅迫相關蛋白及蛋白功能在不同表達模式中的分布
2.5 貯藏物質保護相關蛋白的表達特性
17個顯著差異表達的脅迫相關蛋白涉及貯藏物質保護,主要包括多種蛋白酶水解抑制劑,如α-淀粉酶/胰蛋白酶抑制劑(編號65)、胰蛋白酶抑制劑(編號70)、3個枯草桿菌蛋白酶抑制劑(編號67—69)及7個半胱氨酸蛋白酶抑制劑(編號72—78)(表1)。此外,2個油脂體蛋白(編號79及80)及1個油脂體固醇蛋白(編號81)也被成功鑒定。分層聚類分析顯示幾乎所有的貯藏物質保護相關蛋白(15個,D及E)的表達均隨著籽粒發育不斷積累,并且在發育后期達到最高(表2)。
2.6 病蟲害響應相關蛋白的表達特性
如表1所示,8個顯著差異表達的脅迫相關蛋白涉及病蟲害響應,包括抗菌肽MBP-1(編號82)、Bet v I過敏原(編號85)、P21 蛋白(編號86)、主要乳膠蛋白22(編號87)、發病機制相關蛋白1(編號88)、推測的防御素(編號89)及2個幾丁質酶(編號83及84)。與貯藏物質保護相關蛋白的表達模式相似,除了Bet v I過敏原蛋白(B)在發育前、后期均顯著積累外(表1),剩下的所有病蟲害響應相關蛋白(15個,D及E)均在發育后期顯著表達(表2)。
2.7 其他脅迫響應相關蛋白的表達特性
如表1所示,34個涉及其他脅迫響應的蛋白在籽粒發育過程中顯著差異表達,主要包括一系列的晚期胚胎豐富蛋白(LEA),如2個LEA 1(編號95及96)、3個LEA D-34(編號100—102)及3個LEA 3(編號104—106)。此外,還主要包含2個膜聯蛋白(編號90及91)、3個脂質轉移蛋白(107—109)、6個非特異性脂質轉移蛋白(編號110—115)及4個脂氧合酶(編號120—123)(表1)。分層聚類分析顯示8個(A)蛋白在發育前期顯著積累,5個(B)蛋白在發育前、中期均顯著積累,而絕大多數蛋白(21個,D及E)均隨著籽粒發育上調表達,并且在發育后期達到最高(表2)。
3 討論
3.1 玉米籽粒中的蛋白質組特性
玉米籽粒發育是一個復雜的生理與分子過程。探討籽粒發育的分子調控機理是解析籽粒發育過程的重要手段。轉錄組學[16-17]分析表明大量基因在玉米籽粒發育過程中轉錄表達,涉及籽粒的基礎代謝和脅迫響應。相比于轉錄組學,蛋白質組水平上的研究相對較少,并且過去蛋白質組學研究主要依靠凝膠為基礎的試驗技術,如雙向電泳及熒光雙向電泳[18-21]。這些技術存在鑒定通量低、定量不準確等限制因素,如利用雙向電泳技術,玉米胚乳[20]及胚胎[21]中僅分別鑒定到504及111個蛋白。較少的蛋白數量必然限制對玉米籽粒整體蛋白質組特性的認識。本研究中,借助iTRAQ技術,玉米籽粒中成功鑒定出4 751個蛋白,其數量顯著高于過去以凝膠電泳為基礎的蛋白質組學研究[18-21],充分表明iTRAQ技術的高通量特性。GO注釋顯示玉米籽粒蛋白涉及多種生物過程與分子功能,其中代謝過程與分子過程是最主要的兩個生物過程,而催化活性與綁定功能是最主要的兩個分子功能類別(圖2)。這些結果與水稻籽粒中的研究相似[14],表明這些生物過程與分子功能對籽粒發育具有重要作用。值得注意的是一部分蛋白僅僅在單個生物學重復中被檢測到(圖1),這可能是由個體差異或者每一次獨立試驗中蛋白肽段提取不一致所導致。
3.2 籽粒發育過程中蛋白修飾相關蛋白的表達特性
籽粒發育過程中的生理代謝受到蛋白的直接調控,而穩定的蛋白結構是其行使功能的首要基礎。熱激蛋白可作為分子伴侶對新生蛋白進行折疊修飾,特別在脅迫條件下能夠穩定蛋白構象、阻止蛋白聚集、對變性及錯誤修飾的蛋白進行重新折疊修飾[22]。基于熱激蛋白的特性,其廣泛參與多種分子過程如蛋白代謝、脅迫響應與信號轉導[22]。本研究中,8個熱激蛋白在籽粒發育過程中顯著差異表達且具有不同的表達模式,其中兩個70 kDa熱激蛋白的亞型(編號10及11)分別在發育前、中期積累,另一個亞型(編號32)與16.9 kDa I類熱激蛋白、17.5 kDa II類熱激蛋白、熱激蛋白101及推測的熱激蛋白20伴侶家族蛋白在發育后期顯著積累,而熱激蛋白1在發育前、后期均顯著積累。小麥[13]、水稻[14]籽粒蛋白質組學研究中同樣觀察到熱激蛋白多樣的表達模式。這些結果反映出不同類型的熱激蛋白可能通過不同的表達模式在籽粒發育過程中行使多重功能。此外,9個肽基脯氨酰順反異構酶及3個蛋白二硫鍵異構酶同樣顯著差異表達(表1)。這兩種類型蛋白均參與蛋白的修飾過程,在穩定蛋白結構方面發揮重要作用[23]。值得注意的是除一個肽基脯氨酰順反異構酶亞型(編號24)在發育前、中期均顯著表達外,剩下8個蛋白亞型均在發育后期顯著積累(表1),表明肽基脯氨酰順反異構酶主要在籽粒發育后期發揮重要作用。總之,本研究結果顯示蛋白修飾相關蛋白在籽粒不同發育階段協同表達,這有利于穩定蛋白結構,進而保證蛋白在不同階段的功能調控。
3.3 籽粒發育過程中的活性氧(ROS)體內平衡調控
ROS平衡體系對維護植物發育過程中生理及分子代謝的正常進行具有重要作用,而ROS平衡被打破會導致植物細胞積累過多的ROS,進而氧化細 胞膜,對細胞結構及重要調控蛋白造成不可逆的損傷[24]。為維持細胞體內的ROS平衡,控制過多ROS帶來的毒性影響,植物建立了多重的抗氧化酶系 統[24]。本研究中,31個差異表達的脅迫相關蛋白涉及ROS的體內平衡,包含不同的抗氧化酶系如1-Cys過氧化物酶、抗壞血酸過氧化物酶、多酚氧化酶、谷胱甘肽S-轉移酶、超氧化物歧化酶及硫氧還原蛋白(表1)。ROS相關蛋白種類的多樣性表明多重抗氧化酶系統參與玉米籽粒發育過程的ROS調控。表達分析顯示,除1個ROS相關蛋白在中期顯著表達外,有8個和16個蛋白分別在發育前、后期顯著積累以及有6個蛋白在發育前、后期均顯著積累(表2)。分析其原因,一方面在籽粒發育前期,由于籽粒表皮發育還未成熟,外界氧氣易通過滲透作用進入籽粒內部而造成籽粒氧含量過高[25];另一方面在籽粒發育后期,由于水分含量迅速下降易擾亂細胞膜穩定性及破環電子傳遞鏈,進而導致ROS的顯著積累[26]。因此,玉米籽粒在這兩個階段激活多重的抗氧化酶系統維持了自身ROS的體內平衡。同時,同一蛋白的不同亞型(如谷胱甘肽S-轉移酶、超氧化物歧化酶及硫氧還原蛋白)具有不同的表達模式(表1),表明在籽粒不同發育階段不同的蛋白亞型發揮作用。此外,鋅金屬硫II類蛋白屬于金屬硫蛋白家族,而該蛋白家族涉及穩定金屬離子平衡,解毒、調控ROS平衡等過程[27]。本研究中一個鋅金屬硫II類蛋白(編號40)在50 DAP的表達水平與3 DAP相比上調高于44倍(表1),顯示其在籽粒發育后期發揮重要作用。總之,進一步深入分析這些抗氧化酶的生化反應,將有助于我們理解玉米籽粒發育過程中的ROS調控網絡。
3.4 籽粒發育過程中的貯藏物質保護及對生物脅迫的響應
淀粉、蛋白及油脂是玉米籽粒的貯藏物質,其在籽粒灌漿期開始合成與積累,并且在籽粒萌發期間分解,為幼苗生長提供必要的碳、氮資源。本研究中,17個貯藏物質保護相關蛋白被鑒定,包括多種蛋白酶水解抑制劑,如α-淀粉酶/胰蛋白酶抑制劑、胰蛋白酶抑制劑、枯草桿菌蛋白酶抑制劑及半胱氨酸蛋白酶抑制劑(表1)。這些蛋白能夠防止貯藏蛋白的水解,其中α-淀粉酶/胰蛋白酶抑制劑還能防止淀粉的水解退化[28]。除2個推測的半胱氨酸蛋白酶抑制劑(編號77及78)外,剩下的所有蛋白酶水解抑制劑均在籽粒灌漿期開始上調表達,并且在發育后期到達最高(表1),這也與淀粉及貯藏蛋白的積累模式相一致。此外,2個油脂體蛋白及1個油脂體固醇蛋白也在發育后期顯著積累(表1)。油脂體蛋白及油脂體固醇蛋白是植物油脂體的主要修飾蛋白,而油脂體是植物儲藏油脂的主要場所[29]。在籽粒發育后期,由于水分含量迅速下降,油脂體會相互聚集,顯著積累這兩種蛋白可能通過調節油脂體大小以及防止油脂體聚集,進而保證油脂的正常積累[29]。總之,這些貯藏物質保護相關蛋白的協同表達保證了貯藏物質正常的合成與積累。
籽粒發育除了受到非生物脅迫,還會受到一些生物脅迫如細菌、真菌感染[4-5]。本研究中,抗菌肽MBP-1、Bet v I過敏原、P21蛋白、主要乳膠蛋白22、發病機制相關蛋白1、推測的防御素及2個幾丁質酶被鑒定參與籽粒病蟲害響應。其中,幾丁質酶能夠水解真菌細胞壁,轉幾丁質酶基因顯著提高棉花對枯萎病和黃萎病的抗性[30]。與貯藏物質保護相關蛋白的表達模式相似,除了Bet v I過敏原蛋白在發育前、后期均顯著積累外,剩下的所有病蟲害響應相關蛋白均在發育后期顯著積累(表2)。這些協同表達的蛋白顯著增強籽粒對生物脅迫的抗性。
3.5 其他脅迫響應相關蛋白對籽粒發育具有重要作用
本研究中,34個顯著差異表達的蛋白涉及其他的脅迫響應,其中包括一系列LEA,并且這些蛋白均在發育后期顯著積累(表1),這也與小麥[13]、水稻[14]中的研究結果一致。研究表明水稻中顯著積累LEA可提升籽粒后期的耐脫水性[31]。玉米中,這些蛋白還被認為是籽粒保持高活力的必要因子[32]。此外,應對多種生物與非生物脅迫,LEA也會被誘導積累[33]。因此,LEA可以保護籽粒應對多重脅迫,特別是水分迅速下降所帶來的干燥脅迫,顯著積累這些蛋白提升了玉米籽粒的耐脫水能力。
除了LEA,2個膜聯蛋白、3個脂質轉移蛋白、6個非特異性脂質轉移蛋白及4個脂氧合酶也在籽粒發育過程中顯著差異表達(表1)。膜聯蛋白與脂氧合酶的活性在脅迫環境下顯著增強,表明這兩類蛋白在脅迫響應中發揮重要作用[34-35],其中脂氧合酶還可以通過合成茉莉酸而直接調控脅迫信號的轉導[36]。本研究中,2個膜聯蛋白及4個脂氧合酶中的3個亞型(編號120—122)均在發育前期顯著積累(表1),表明膜聯蛋白與脂氧合酶主要在此階段發揮重要作用。脂質轉移蛋白及非特異性脂質轉移蛋白能夠調控脂類化合物的跨膜運輸,廣泛參與植物的多重脅迫響應,如低溫、干燥、氧化脅迫及微生物感染[37]。本研究中,2個脂質轉移蛋白亞型(編號107及109)在發育前期顯著表達,5個非特異性脂質轉移蛋白亞型(編號110及112—115)在發育后期顯著積累,而1個脂質轉移蛋白亞型(編號108)及1個非特異性脂質轉移蛋白亞型(編號111)在發育前、中期均顯著積累(表1)。不同的表達模式反映出脂質轉移蛋白及非特異性脂質轉移蛋白在籽粒不同發育階段發揮不同功能。
4 結論
玉米籽粒中鑒定到4 751個蛋白,其中123個脅迫相關蛋白在玉米籽粒發育過程中顯著差異表達。這些蛋白主要參與蛋白修飾、活性氧(ROS)體內平衡、貯藏物質保護、病蟲害響應及其他脅迫響應過程。這些脅迫相關蛋白在籽粒不同發育階段顯著積累,構建了一個協同、多樣、穩定的防御調控機制,維護了籽粒正常的發育過程。
[1] Sabelli P A, Larkins B A. The development of endosperm in grasses., 2009, 149(1): 14-26.
[2] Moore J P, Le N T, Brandt W F, Driouich A, Farrant J M. Towards a systems-based understanding of plant desiccation tolerance., 2009, 14(2): 110-117.
[3] Huang H, M?ller I M, Song S Q. Proteomics of desiccation tolerance during development and germination of maize embryos., 2011, 75(4): 1247-1262.
[4] 段燦星, 王曉鳴, 宋鳳景, 孫素麗, 周丹妮, 朱振東. 玉米抗穗腐病研究進展. 中國農業科學, 2015, 48(11): 2152-2164.
Duan C X, Wang X M, Song F J, Sun S L, Zhou D N, Zhu Z D. Advances in research on maize resistance to ear rot., 2015, 48(11): 2152-2164. (in Chinese)
[5] 李秀坤, 劉昌林, 周羽, 雍洪軍, 張德貴, 翁建峰, 王振華.玉米病毒病的研究進展. 作物雜志, 2015(3): 13-16.
Li X K, LiU C L, Zhou Y, Yong H J, Zhang D G, Weng J F, Wang Z H. Research progress of viral diseases in maize., 2015(3): 13-16. (in Chinese)
[6] 張仁和, 郭東偉, 張興華, 路海東, 劉建超, 李鳳艷, 郝引川, 薛吉全. 吐絲期干旱脅迫對玉米生理特性和物質生產的影響. 作物學報, 2012, 38(10): 1884-1890.
Zhang R H, Guo D W, Zhang X H, Lu H D, Liu J C, Li F Y, Hao Y C, Xue J Q. Effects of drought stress on physiological characteristics and dry matter production in maize silking stage., 2012, 38(10): 1884-1890. (in Chinese)
[7] 趙福成, 景立權, 閆發寶, 陸大雷, 王桂躍, 陸衛平. 灌漿期高溫脅迫對甜玉米籽粒糖分積累和蔗糖代謝相關酶活性的影響. 作物學報, 2013, 39(9): 1644-1651.
Zhao F C, Jing L Q, Yan F B, Lu D L, Wang G Y, Lu W P. Effects of heat stress during grain filling on sugar accumulation and enzyme activity associated with sucrose metabolism in sweet corn., 2013, 39(9): 1644-1651. (in Chinese)
[8] 趙龍飛, 李潮海, 劉天學, 王秀萍, 僧珊珊, 潘旭. 玉米花期高溫響應的基因型差異及其生理機制. 作物學報, 2012, 38(5): 857-864.
Zhao L F, Li C H, Liu T X, Wang X P, Seng S S, Pan X. Genotypic responses and physiological mechanisms of maize (L.) to high temperature stress during flowering., 2012, 38(5): 857-864. (in Chinese)
[9] 周衛霞, 董朋飛, 王秀萍, 李潮海. 弱光脅迫對不同基因型玉米籽粒發育和碳氮代謝的影響. 作物學報, 2013, 39(10): 1826-1834.
Zhou W X, Dong P F, Wang X P, Li C H. Effects of low-light stress on kernel setting and metabolism of carbon and nitrogen in different maize (L.) genotypes., 2013, 39(10): 1826-1834. (in Chinese)
[10] 余衛東, 馮利平, 盛紹學, 石磊, 李德. 澇漬脅迫下夏玉米的灌漿特征及其動態模擬. 中國生態農業學報, 2015, 23(9): 1142-1149.
Yu W D, Feng L P, Sheng S X, Shi L, Li D. Analysis of the dynamics and characteristics of grain filling in summer maize under waterlogging stress., 2015, 23(9): 1142-1149. (in Chinese)
[11] 任佰朝, 張吉旺, 李霞, 范霞, 董樹亭, 趙斌, 劉鵬. 淹水脅迫對夏玉米籽粒灌漿特性和品質的影響. 中國農業科學, 2013, 46(21): 4435-4445.
Ren B Z, Zhang J W, Li X, Fan X, Dong S T, Zhao B, Liu P. Effect of waterlogging on grain filling and quality of summer maize., 2013, 46(21): 4435-4445. (in Chinese)
[12] Schulze W X, Usadel B. Quantitation in mass-spectrometry- based proteomics., 2010, 61(1): 491-516.
[13] Ma C, Zhou J, Chen G, Bian Y, Lü D, Li X, Wang Z, Yan Y. iTRAQ-based quantitative proteome and phosphoprotein characterization reveals the central metabolism changes involved in wheat grain development.,2014, 15(1): 1029.
[14] Zi J, Zhang J, Wang Q, Zhou B, Zhong J, Zhang C, Qiu X, Wen B, Zhang S, Fu X, Lin L, Liu S. Stress responsive proteins are actively regulated during rice () embryogenesis as indicated by quantitative proteomics analysis.,2013, 8(9): e74229.
[15] Conesa A, G?tz S, García-Gómez J M, Terol J, Talón M, Robles M. Blast2GO: a universal tool for annotation, visualization and analysis in functional genomics research.,2005, 21(18): 3674-3676.
[16] Chen J, Zeng B, Zhang M, Xie S, Wang G, Hauck A, Lai J. Dynamic transcriptome landscape of maize embryo and endosperm development., 2014, 166(1): 252-264.
[17] Teoh K T, Requesens D V, Devaiah S P, Johnson D, Huang X, Howard J A, Hood E E. Transcriptome analysis of embryo maturation in maize., 2013, 13(1): 19.
[18] 于濤, 李耕, 劉鵬, 董樹亭, 張吉旺, 趙斌, 柏晗. 玉米早期發育階段粒位效應的蛋白質組學分析. 中國農業科學, 2016, 49(1): 54-68.
Yu T, Li G, Liu P, Dong S T, Zhang J W, Zhao B, Bai H. Proteomics analysis of grain position effects during early developmental stages of maize.,2016, 49(1): 54-68. (in Chinese)
[19] 劉懷華, 王莉雯, 劉楠, 劉旭, 馬俠, 寧麗華, 張華, 崔德周, 姜川, 陳化榜. 玉米花粉與花絲早期互作的蛋白質組學分析. 中國農業科學, 2010, 43(24): 5000-5008.
Liu H H, Wang L W, Liu N, Liu X, Ma X, Ning L H, Zhang H, Cui D Z, Jiang C, Chen H B. Proteomic analyses of the early pollen-silk interaction in maize.,2010, 43(24): 5000-5008. (in Chinese)
[20] Méchin V, Balliau T, Chateau-Joubert S, Davanture M, Langella O, Negroni L, Prioul J L, Thevenot C, Zivy M, Damerval C. A two dimensional proteome map of maize endosperm., 2004, 65(11): 1609-1618.
[21] Huang H, M?ller I M, Song S Q. Proteomics of desiccation tolerance during development and germination of maize embryos., 2011, 75(4): 1247-1262.
[22] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response.,2004, 9(5): 244-252.
[23] 陳珍, 江瓊, 朱誠. 植物中的蛋白質二硫鍵異構酶及其類蛋白. 植物生理學報, 2013, 49(8): 715-721.
Chen Z, Jiang Q, Zhu C. Protein disulfide isomerise and PDI-like proteins in plant.,2013, 49(8): 715-721. (in Chinese)
[24] Mittler R, Vanderauwera S, Gollery M, Breusegem F V. Reactive oxygen gene network of plants., 2004, 9(10): 490-498.
[25] Rolletschek H, Koch K, Wobus U, Borisjuk L. Positional cues for the starch/lipid balance in maize kernels and resource partitioning to the embryo.,2005, 42(1): 69-83.
[26] Hoekstra F A, Golovina E A, Buitink J. Mechanisms of plant desiccation tolerance., 2001, 6(9): 431-438.
[27] Guo W J, Bundithya W, Goldsbrough P B. Characterization of themetallothionein gene family: Tissue-specific expression and induction during senescence and in response to copper.,2003, 159(2): 369-381.
[28] 肖懷秋, 林親錄, 李玉珍, 趙明謀. 蛋白酶抑制劑抗蟲基因工程研究進展. 生物技術通報, 2004(6): 22-25.
Xiao H Q, Lin Q L, Li Y Z, Zhao M M. Advances on applied studies of protease inhibitor in gene engineering.,2004(6): 22-25. (in Chinese)
[29] Siloto R M, Findlay K, Lopez-Villalobos A, Yeung E C, Nykiforuk C L, Moloney M M. The accumulation of oleosins determines the size of grain oilbodies in., 2006, 18(8): 1961-1974.
[30] 程紅梅, 簡桂良, 倪萬潮, 楊紅華, 王志興, 孫文姬, 張保龍, 王曉峰, 馬存, 賈士榮. 轉幾丁質酶和β-1,3-葡聚糖酶基因提高棉花對枯萎病和黃萎病的抗性. 中國農業科學, 2005, 38(6): 1160-1166.
Cheng H M, Jian G L, Ni W C, Yang H H, Wang Z X, Sun W J, Zhang B L, Wang X F, Ma C, Jia S R. Increase of fusarium- and verticillium-resistance by transferring chitinase and glucanase gene into cotton., 2005, 38(6): 1160-1166. (in Chinese)
[31] Sano N, Masaki S, Tanabata T, Yamada T, Hirasawa T, Kanekatsu M. Proteomic analysis of stress-related proteins in rice seeds during the desiccation phase of grain filling.,2013, 30(2): 147-156.
[32] Wu X, Liu H, Wang W, Chen S, Hu X, Li C. Proteomic analysis of seed viability in maize., 2011, 33(1): 181-191.
[33] 劉露露, 陳雷, 張春艷, 石瑞杰, 任江萍, 孟凡榮, 尹鈞, 李永春. 兩個小麥LEA基因的特征及其對非生物脅迫的響應. 中國農業科學, 2014, 47(19): 3736-3745.
Liu L L, Chen L, Zhang C Y, Shi R J, Ren J P, Meng F R, Yin J, Li Y C. Characterization of two LEA genes and their response to abiotic stresses in wheat., 2014, 47(19): 3736-3745. (in Chinese)
[34] Konopka-Postupolska D, Clark G, Hofmann A. Structure, function and membrane interactions of plant annexins: An update., 2011, 181(3): 230-241.
[35] 何全光, 鄺健飛, 陳建業, 陸旺金. 脂氧合酶在香蕉果實成熟過程中的作用. 中國農業科學, 2011, 44(1): 118-124.
He Q G, Kuang J F, Chen J Y, Lu W J. The role of lipoxygenase in banana fruit ripening., 2011, 44(1): 118-124. (in Chinese)
[36] Farmer E E, Johnson R R, Ryan C A. Regulation of expression of proteinase inhibitor genes by methyl jasmonate and jasmonic acid.,1992, 98(3): 995-1002.
[37] García-Olmedo F, Molina A, Segura A, Moreno M. The defensive role of nonspecific lipid-transfer proteins in plants., 1995, 3(3): 72-74.
(責任編輯 楊鑫浩)
Proteomic Analysis of Maize Reveals Expression Characteristics of Stress-Related Proteins During Grain Development
YU Tao, LI Geng, LIU Peng, DONG ShuTing, ZHANG JiWang, ZHAO Bin
(College of Agronomy, Shandong Agricultural University/State Key Laboratory of Crop Biology, Taian 271018, Shandong)
【Objective】In order to understand the molecular regulation mechanism of defense system in maize grain, the expression characteristics of stress-related proteins during grain development were studied by using approach of plant proteomics.【Method】Denghai 661 (DH661) was used as experimental material and planted at 67 500 plants/hm2in field. The middle grains were harvested after flowering artificial saturation pollination at 3, 5, 10, 15, 20, 30, 40, 50 d, respectively. The total proteins were extracted by the TCA-acetone precipitation method and then were analyzed by isobaric tags for relative and absolute quantitation (iTRAQ) proteomics. The proteins in maize grain were identified by searching the Uniprot maize protein database and gene ontology (GO) annotation was used to classify the functions of these proteins according to the biological process, molecular function and cellular component. Quantitative analysis was applied to identify stress-related proteins that were significantly differentially expressed during grain development. Hierarchical cluster analysis was used to show the expression patterns of these stress-related proteins during grain development.【Result】A total of 4 751 proteins were identified in maize grain by matching the maize protein database, and these proteins were involved in diverse biological processes and molecular functions, of which the metabolic process and molecular processes were the main biological processes, and the catalytic activity and binding function were the main molecular categories, showing that these biological processes and molecular functions played important roles in maize grain development. Quantitative analysis detected 123 stress-related proteins were significantly differentially expressed during grain development, and these proteins were mainly involved in grain protein modification (33), reactive oxygen species (ROS) homeostasis (31), storage material protection (17), disease response (8) and other stress response process (34). The proteins related to protein modification mainly included a series of heat shock protein, peptidyl-prolyl cis-trans isomerase and protein disulfide isomerase, and these proteins significantly accumulated at different development stages, which played important roles in stability of protein structure. ROS related proteins contained a variety of antioxidants, and mainly significantly accumulated at both early and late development stages, which maintained the homeostasis of ROS. Storage material protection related proteins mainly contained a variety of protease inhibitors, oleosin and steroleosin, and the expression of these proteins were constantly raised with the grain development, which protected the synthesis and accumulation of storage material. The proteins involved in disease response also significantly accumulated at late development stage, which enhanced the grain resistance to biological stresses. Proteins involved in other stress response mainly included a series of late embryogenesis abundant protein (LEA), annexin, lipid transfer protein, nonspecific lipid transfer protein and lipoxygenase, of which all of the LEA significantly accumulated at late development stage, annexin and lipoxygenase significantly accumulated at early development stage, while lipid transfer protein and nonspecific lipid transfer proteins were accumulated at different development stages, showing that these proteins played important roles in different grain development stages.【Conclusion】Stress-related proteins were accumulated during maize grain different development stages, which constructed a harmonious, diverse and stable defense regulatory mechanism, and thus maintained the normal development of maize grain.
maize; grain development; iTRAQ proteomics; stress-related protein; protein function
2016-09-29;
2017-02-20
國家自然科學基金(31371576,31401339)、國家重點研發計劃項目(2016YFD0300106,2016YFD0300205)、國家科技支撐計劃項目(2013BAD07B06-2)、國家公益性行業(農業)科研專項經費項目(201203100,201203096)、山東省現代農業產業技術體系項目(SDAIT-02-08)、國家現代農業產業技術體系建設項目(CARS-02-20)、山東省高等學校科技計劃項目(J14LF10)、山東省農業重大應用技術創新課題、山東省玉米育種與栽培技術企業重點實驗室
劉鵬,E-mail:liupengsdau@126.com。通信作者董樹亭,E-mail:stdong@sdau.edu.cn
聯系方式:于濤,E-mail:yutaosdnd@163.com。

