富氫水浸種增強黃瓜幼苗耐冷性的作用及其生理機制
劉豐嬌,蔡冰冰,孫勝楠,畢煥改,艾希珍
?
富氫水浸種增強黃瓜幼苗耐冷性的作用及其生理機制
劉豐嬌,蔡冰冰,孫勝楠,畢煥改,艾希珍
(山東農業大學園藝科學與工程學院/作物生物學國家重點實驗室/農業部黃淮地區園藝作物生物學與種質創制重點開放實驗室/山東省果蔬優質高效生產協同創新中心,山東泰安 271018)
【目的】氫氣(H2)是近年來發現的一種新型氣體信號分子,它參與植物對高溫、干旱、鹽害、重金屬等多種逆境脅迫的響應。探討外源氫氣(H2)對黃瓜幼苗耐冷性的調控作用及其生理機制,為增強日光溫室黃瓜對低溫的適應能力提供技術指導。【方法】以‘津優35號’黃瓜品種為試材,用飽和富氫水(HRW,H2供體)浸種,蒸餾水浸種作對照(CK),常溫下育苗。幼苗長至2葉1心時轉移至光照培養箱中進行低溫(晝/夜溫度8℃/5℃)處理,分別于處理后0、1、3和5 d后測定相關生理指標。【結果】低溫脅迫可使黃瓜幼苗葉片的電解質滲漏率(EL)、冷害指數、過氧化氫(H2O2)和丙二醛(MDA)含量及超氧陰離子()產生速率持續升高,超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)、抗壞血酸過氧化物酶(APX)和谷胱甘肽還原酶(GR)活性及還原型谷胱甘肽(GSH)、抗壞血酸(AsA)、脯氨酸和可溶性糖含量先升高后降低,相對含水量呈下降趨勢。與CK相比,低溫脅迫下HRW處理的EL和冷害指數的增加幅度較小,H2O2和MDA含量及產生速率較低,而SOD、POD、CAT、APX和GR活性及GSH和AsA含量較高。脅迫結束時(5 d),HRW處理的EL比CK低11.3個百分點,冷害指數較CK低15.9%,H2O2和MDA含量分別比CK低29.4%和9.9%,產生速率較CK低54.3%;而SOD、POD、CAT、APX和GR活性分別比CK高12.6%、20.1%、20.9%、53.0%和58.1%,GSH和AsA含量分別較CK高24.0%和17.6%。低溫下HRW處理的黃瓜幼苗葉片的相對含水量降低幅度明顯小于CK,而脯氨酸和可溶性糖含量始終高于CK。脅迫5 d時,HRW的相對含水量比CK高6.4個百分點,脯氨酸和可溶性糖含量分別比CK高23.0%和41.5%。【結論】富氫水浸種可增強黃瓜幼苗耐冷性,其主要作用機理是:(1)增強低溫下黃瓜幼苗抗氧化系統活性,減少活性氧(ROS)積累,從而減輕膜脂過氧化傷害;(2)通過提高低溫下黃瓜幼苗葉片的滲透調節能力,減緩幼苗失水速度,以較長時間地維持生理功能。
低溫脅迫;富氫水;種子處理;活性氧;滲透調節;黃瓜
0 引言
【研究意義】黃瓜(L.)屬于冷敏感植物,在北方冬春季日光溫室生產中經常遭遇低溫脅迫,據不完全統計,設施黃瓜每年因低溫造成的經濟損失高達50億元以上。因此,研究黃瓜對低溫脅迫的響應及緩解低溫逆境障礙的有效措施具有重要意義。【前人研究進展】氫氣(H2)是自然界中結構最簡單的氣體分子,由于生物體內缺乏直接利用氫分子的酶,所以,它一直被認為屬于生理惰性氣體[1]。直到1947年,Boichenko[2]研究發現,某些高等植物體內可能存在氫化酶,且于1964年被Renwick等[3]所證實。近年來研究發現,氫氣具有抗氧化、抗炎癥、抗過敏等作用,可作為醫療氣體,用于人類疾病治療[4-5]。在植物中,氫氣可能作為氣體信號分子參與植物對逆境脅迫的響應。Xie等[6]研究發現,氫氣可與活性氧(ROS)、一氧化氮(NO)、保衛細胞K+通道共同參與ABA介導的氣孔關閉。富氫水預處理能激活植物轉錄因子及其下游抗氧化基因的表達,促進Na+的外排,協助維持離子平衡,調控ABA、乙烯、茉莉酸等激素信號,從而減輕NaCl脅迫損傷[7-9]。富氫水浸種還可減少植物對重金屬的吸收和積累,重建細胞內離子平衡[10-12];增強抗氧化酶和抗氧化非酶類物質的表達量和活性[11-12];增加抗氧化損傷信號通路中血紅素氧化酶(HO-1)表達量和活性,參與HO-1信號途徑協助抵御逆境脅迫[13]。【本研究切入點】雖然已經明確H2參與植物的抗逆反應,然而有關H2對植物耐冷性調控的研究尚未見報道。【擬解決的關鍵問題】以‘津優35號’黃瓜為試材,通過人工模擬低溫弱光環境,研究外源H2制得的富氫水處理種子對低溫下黃瓜幼苗抗氧化系統和滲透調節的影響,旨在探討富氫水對黃瓜耐冷性的調控機理,為進一步了解富氫水處理在植物非生物脅迫應答中的作用提供理論依據,也為增強日光溫室黃瓜對低溫的適應能力提供技術指導。
1 材料與方法
試驗于2015年在山東農業大學進行。
1.1 供試材料及試驗設計
用QL-300純水氫氣發生器(山東塞克塞斯氫能源有限公司)將純度99.999%的H2以300 mL·min-1流速充入1 L蒸餾水(pH 5.86,25℃)中,1 h后用ENH-1000便攜式溶解氫測定儀(日本)測定氫氣含量,達到飽和時停止充氣,制成濃度為(0.45±0.02)mmol·L-1的富氫水備用。供試黃瓜(L.)品種為‘津優35號’(購自天津市黃瓜研究所)。選取140粒健康飽滿的黃瓜種子,先用55℃溫水浸泡殺菌,15 min后平分為兩組,分別用飽和富氫水(HRW)和蒸餾水(CK)浸種8 h,然后將種子排放入鋪有3張定性濾紙(分別用等量的HRW和蒸餾水潤濕)的培養皿中,置于28℃恒溫箱中催芽。種子露白后在日光溫室內用10 cm×10 cm營養缽育苗。幼苗長至2葉1心時,每處理選取生長一致的幼苗50株,置于光照培養箱中進行低溫(晝/夜溫度8℃/5℃)處理,光量子通量密度(PFD)100 μmol·m-2·s-1,光周期12 h/12 h。分別于處理0、1、3和5 d后取樣測定,每處理重復3次,取平均值。
1.2 試驗方法
1.2.1 冷害指數與電解質滲漏率 用奧立龍(ORION)TDS型電導率儀(DDB-303A,美國)測定上數第2片葉的電導率,參照趙世杰等[14]的方法計算電解質滲漏率(EL);參照于賢昌等[15]的方法測定冷害指數。
1.2.2 過氧化氫含量與超氧陰離子產生速率 過氧化氫(H2O2)組織化學染色參照THORDAL-CHRISTENSEN等[16]的二氨基聯苯胺(DBA)染色法進行,用南京建成生物科技有限公司生產的試劑盒檢測H2O2含量;超氧陰離子()組織化學染色參考JABS等[17]的方法進行,用羥胺氧化法測定產生速率[17]。
1.2.3 丙二醛含量與抗氧化酶活性 采用硫代巴比妥酸(TBA)比色法[18]測定丙二醛(MDA)含量,氮藍四唑(NBT)還原法[19]測定超氧化物歧化酶(SOD)活性,以抑制光化還原50%為1個酶活性單位;參照OMRAN[20]的方法測定過氧化物酶(POD)活性;按CHANCE和MAEHLY[21]的方法測定過氧化氫酶(CAT)活性;參照NAKANO和ASADA[22]的方法測定抗壞血酸過氧化物酶(APX)活性;按FOYER和HALLIWELL[23]的方法測定谷胱甘肽還原酶(GR)活性。
1.2.4 谷胱甘肽(GSH)與抗壞血酸(AsA)含量 用比色法測定谷胱甘肽(GSH)和抗壞血酸(AsA)含量[24]。
1.2.5 相對含水量、脯氨酸和可溶性糖含量 用磺基水楊酸法[19]測定脯氨酸含量;蒽酮比色法[19]測定可溶性糖含量。
1.3 數據處理
分別用Microsoft Excel和SigmaPlot處理數據和作圖,用DPS軟件對數據進行單因素方差分析,并運用Duncan檢驗法對顯著性差異(<0.05)進行多重比較。
2 結果
2.1 富氫水浸種處理對低溫下黃瓜幼苗電解質滲漏率和冷害指數的影響
從圖1-A看出,低溫下黃瓜幼苗葉片的EL逐漸升高,但與CK相比,HRW的升高幅度顯著減小。脅迫1 d時,HRW處理的EL比脅迫前增加了2.6個百分點,而CK的增加了10.5個百分點,脅迫結束(5 d)時,HRW處理的EL為60.4%,CK的為71.7%,前者比后者低11.3個百分點。低溫下黃瓜幼苗的冷害指數變化趨勢與EL相同,即脅迫時間越長,冷害指數越高(圖1-B),HRW處理的始終低于CK。低溫脅迫5 d時,HRW處理的冷害指數比CK低15.9%,說明用HRW浸種可提高黃瓜幼苗耐冷性。
2.2 富氫水浸種處理對低溫下黃瓜幼苗葉片H2O2和含量的影響
從圖2-A、B看出,低溫脅迫前,黃瓜幼苗葉片中的H2O2和含量很低,且兩處理差異不大,脅迫5 d后,H2O2和積累量大幅增加,但HRW葉片中的H2O2和積累量明顯少于CK。圖2-C、D顯示,低溫下兩個處理的H2O2含量和產生速率均快速增加,但HRW處理的增加幅度明顯小于CK,且脅迫時間越長,二者差異越大。低溫脅迫5 d時,HRW的H2O2含量比CK低29.4%,產生速率較CK低54.3%。可見,HRW浸種可明顯減少ROS積累,減輕細胞膜脂過氧化傷害,這可能是H2提高黃瓜幼苗耐冷性的重要機制。
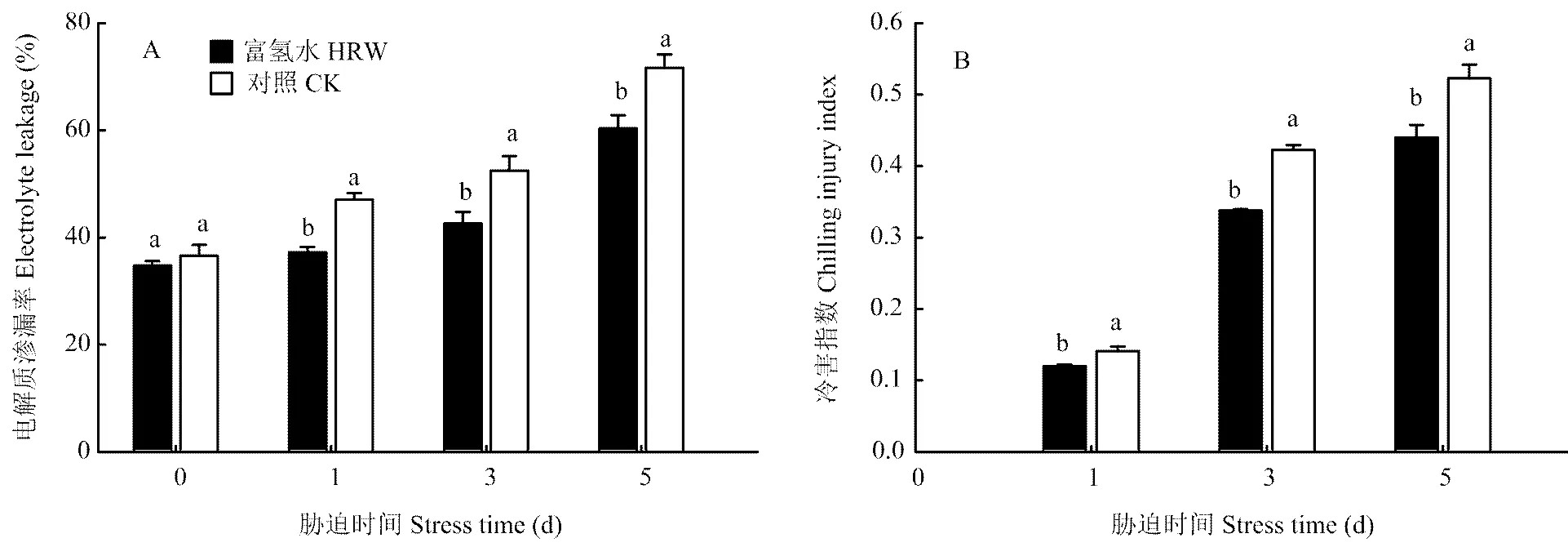
不同字母表示存在顯著性差異(P<0.05)。下同
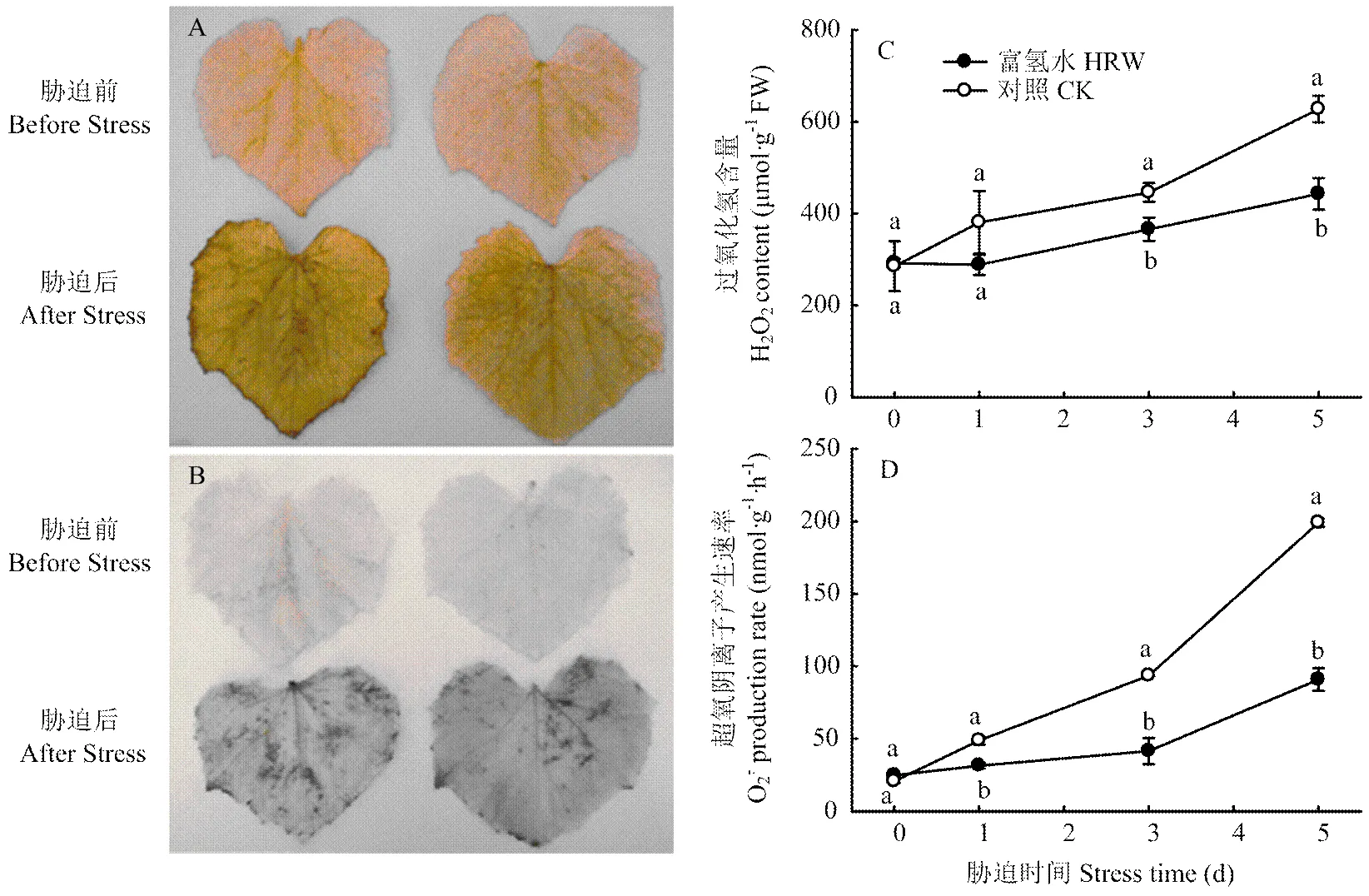
A、C:H2O2;B、D:
2.3 富氫水浸種處理對低溫脅迫下黃瓜幼苗葉片抗氧化系統的影響
MDA是脂質過氧化的主要產物,其含量高低可以反映植物膜系統的受傷程度。從圖3-A看出,低溫前HRW處理的MDA含量與CK相差不大,隨著低溫脅迫時間的延長,MDA含量均逐漸增加,但HRW處理的升高幅度明顯小于CK。低溫脅迫5 d時,HRW處理的MDA含量比對照低9.9%。
圖3-B顯示,低溫脅迫初期,HRW和CK的SOD活性快速增加,3 d后趨于降低,前者始終高于后者。脅迫結束時,HRW處理的SOD活性比CK高12.6%。POD、CAT、APX和GR活性(圖3-C—F)的變化趨勢與SOD相似,即均隨著低溫脅迫時間的延長先升高,后降低,HRW處理的顯著高于CK。說明HRW可通過提高抗氧化酶活性清除ROS,減輕低溫對黃瓜幼苗細胞膜的傷害。
圖4表明,低溫脅迫1 d時,黃瓜幼苗葉片的GSH含量變化不大,且HRW處理的與CK差異不顯著;脅迫時間延長至3 d時,HRW與CK的GSH含量均快速增加,但前者的增加幅度明顯大于后者。脅迫時間繼續延長,兩處理的GSH含量同步下降,但HRW的仍顯著高于CK。脅迫結束時,HRW處理GSH含量比CK高24.0%。
低溫下AsA含量的變化趨勢如圖3-B所示,脅迫初期,黃瓜幼苗葉片的AsA含量快速增加,HRW處理的與CK差異不大;1 d后兩個處理的AsA含量均逐漸降低,但HRW處理的降低幅度較明顯小于CK,脅迫5 d時HRW處理的AsA含量比CK高17.6%。
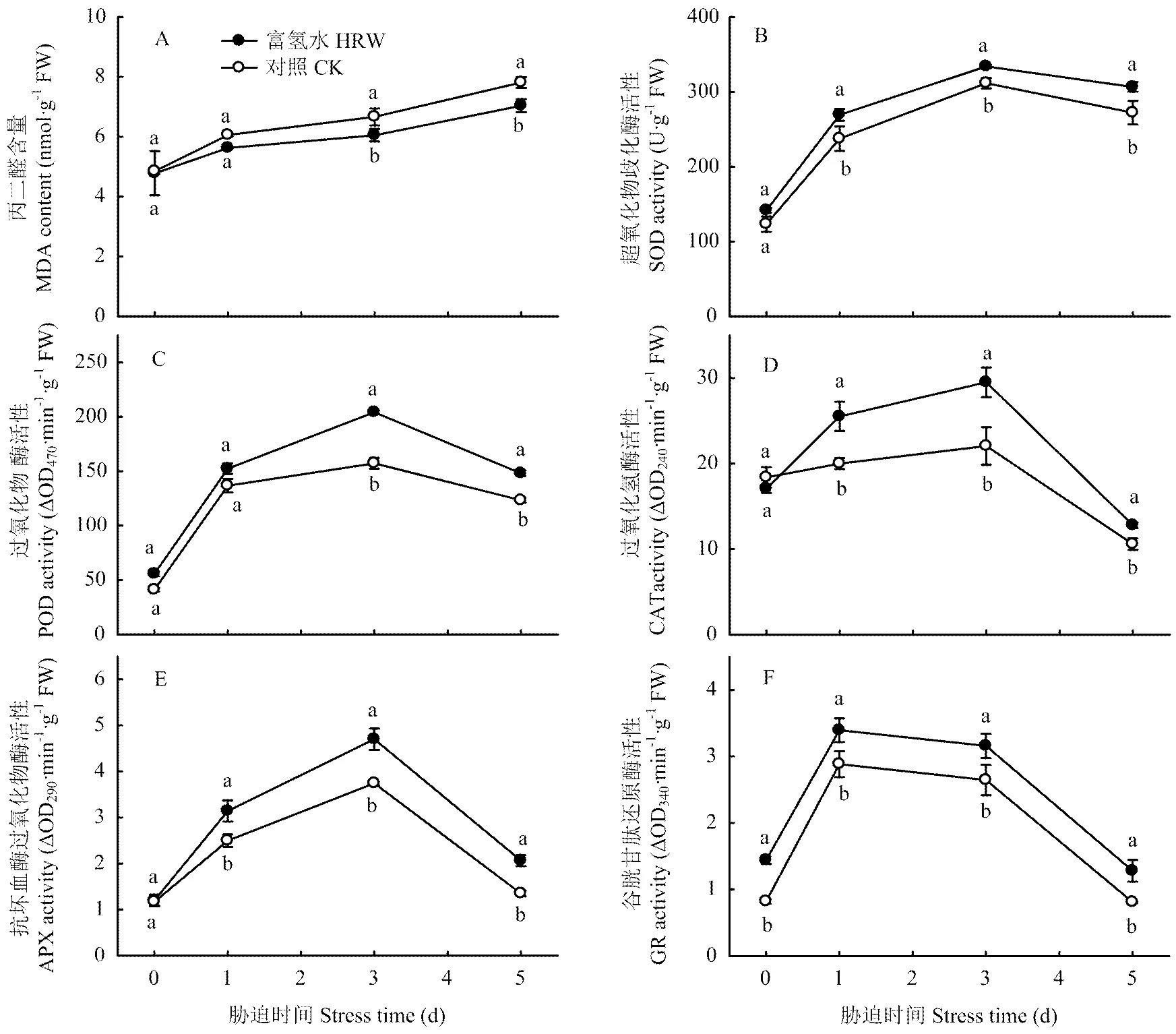
圖3 富氫水浸種處理對低溫脅迫下黃瓜幼苗葉片MDA含量和抗氧化酶活性的影響
2.4 富氫水浸種處理對低溫脅迫下黃瓜幼苗葉片含水量、脯氨酸和可溶性糖含量的影響
從圖5看出,低溫脅迫前HRW和CK黃瓜幼苗葉片的相對含水量無顯著差異;脅迫1 d時快速下降,HRW處理的下降幅度略低于CK。脅迫時間延長至3 d時,HRW處理的相對含水量明顯回升,而CK的趨于平穩。脅迫時間繼續延長,HRW和CK的相對含水量又逐漸降低,且前者的降低幅度小于后者。因此,脅迫結束時,HRW處理的相對含水量為79.8%,比脅迫前只降低了5.4個百分點,而CK的相對含水量降至73.4%,比脅迫前降低了11.0個百分點。
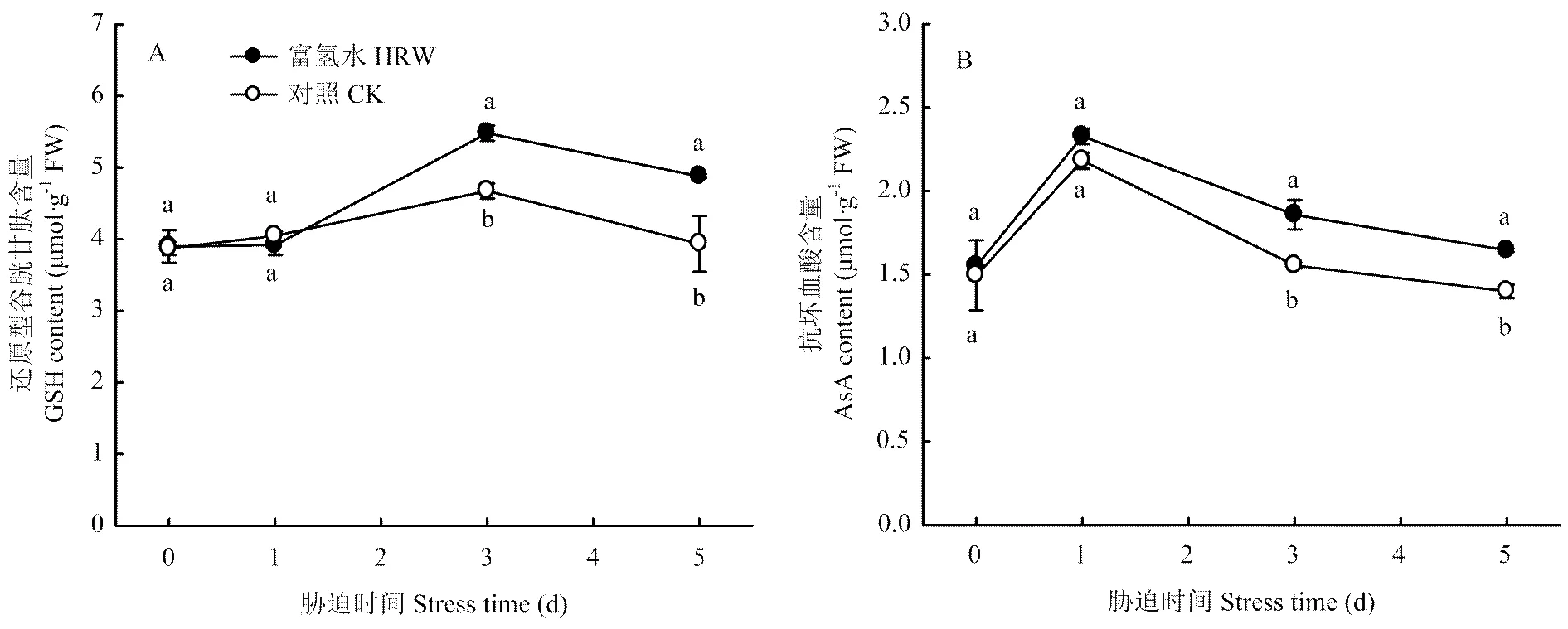
圖4 富氫水浸種處理對低溫脅迫下黃瓜幼苗葉片還原型谷胱甘肽和抗壞血酸含量的影響
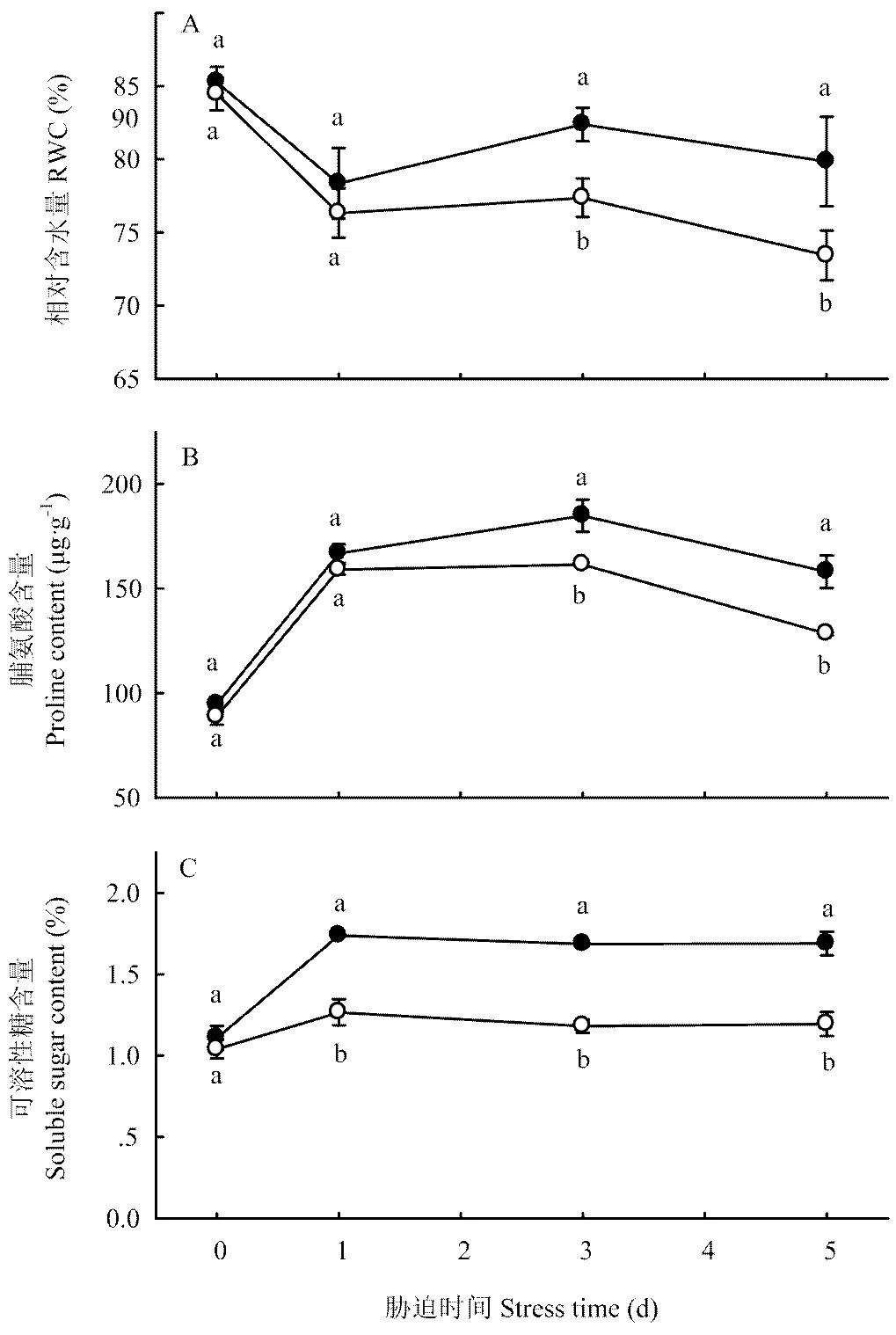
圖5 富氫水浸種處理對低溫脅迫下黃瓜幼苗葉片相對含水量及脯氨酸和可溶性糖含量的影響
游離脯氨酸與可溶性糖是植物細胞內重要的滲透調節物質,含量越高越有利于細胞持水和生物大分子穩定。圖5結果表明,低溫脅迫前,HRW處理黃瓜幼苗葉片的脯氨酸含量與CK差異不大;脅迫后均逐漸增加,但HRW處理的增加幅度顯著大于CK,3 d時HRW處理的脯氨酸含量較CK高14.5%,之后各處理都趨于下降,但HRW的仍顯著高于CK。低溫脅迫初期,黃瓜幼苗葉片的可溶性糖含量快速升高,但HRW處理的升高幅度明顯大于CK;脅迫時間超過1 d時,兩個處理的可溶性糖含量均趨于平穩。脅迫結束時,HRW處理的可溶性糖含量比CK高41.5%。可見,利用HRW浸種可通過提高低溫下黃瓜幼苗葉片的滲透調節能力,增加幼苗吸水量或減少植株失水量,這是黃瓜幼苗耐冷性增強的重要機理之一。
3 討論
近年來的研究證實,氫氣作為一種新的信號分子參與植物對逆境的響應,在抵御植物對干旱[6]、鹽漬[7-8]、重金屬[10-12]等非生物脅迫中有重要作用。本研究結果表明,低溫脅迫可使黃瓜幼苗葉片的EL和冷害指數顯著升高,但經HRW處理后其葉片的EL和冷害指數升高幅度明顯小于CK,表明富氫水可誘導黃瓜幼苗耐冷性。
正常條件下,植物細胞內活性氧(ROS)的產生和清除處于動態平衡狀態,但當受到逆境脅迫時,植物對ROS的調控能力降低,ROS(H2O2、、·OH等)則會在細胞內積累[25]。SU等[26]研究表明,富氫水處理能降低紫外線照射下蘿卜花芽內的H2O2和含量,降低膜質過氧化程度。CUI等[12]研究表明富氫水可減少ROS的產生,幫助植物對抗汞毒害帶來的氧化損傷。XU等[8]研究發現富氫水可減少鹽脅迫下水稻丙二醛積累量。在本試驗中,隨著低溫脅迫時間的延長,黃瓜幼苗葉片中的H2O2和大量積累,MDA含量逐漸增加,與CK相比,HRW處理的H2O2、和MDA含量增加幅度較小,葉片受傷程度明顯減輕。可見,氫氣可減輕低溫引起的ROS積累和膜脂過氧化傷害,與前人研究結果一致,這對提高黃瓜幼苗耐冷性具有重要意義。
植物體內存在兩類保護系統:一類是包括SOD、POD、CAT、APX、GR等在內的酶促保護系統,另一類是包括GSH、AsA等在內的非酶促保護系統。在酶促保護系統中,SOD是植物抗氧化系統的第一道防線,其主要作用是使Mehler反應中產生的ROS轉化成H2O2,然后通過POD、CAT等將H2O2分解為H2O和O2[27]。APX能通過AsA-谷胱甘肽-NADPH循環,清除H2O2和,GR可以直接抑制的形成,減少自由基的積累[28]。前人研究證明,氫氣可以通過增加抗氧化酶如CAT和SOD等的活性來保護細胞[29-30]。JIN等[13]研究表明,富氫水可以增加苜蓿抗氧化酶活性和基因表達量,抵御農藥導致的氧化損傷。CUI等[11-12]研究表明,富氫水可增加SOD、POD和APX等抗氧化酶的活性,并增加一些非酶類抗氧化物的含量,如GSH和AsA,幫助植物對抗鎘、汞毒害帶來的氧化損傷。本試驗結果表明,低溫脅迫初期,黃瓜幼苗葉片的SOD、CAT、POD、APX和GR活性,以及GSH和AsA含量均逐漸升高,說明短時低溫不僅會提高細胞ROS水平,同時也可誘導植物建立防御體系。當脅迫時間過長時,ROS積累量進一步增加,植物體內的防御系統會遭到破壞,因此抗氧化酶活性降低,GSH和AsA等抗氧化物質含量也趨于下降。與CK相比,HRW處理的抗氧化酶活性及GSH和AsA含量均顯著提高,表明HRW能夠增強黃瓜幼苗葉片的抗氧化能力,抑制ROS的產生和積累。這是氫氣提高黃瓜幼苗耐冷性的重要機理。
從圖5看出,低溫脅迫初期,黃瓜幼苗葉片的相對含水量快速下降,說明短時低溫可使黃瓜幼苗葉片快速失水。這一方面因為其根系吸水能力迅速減弱,另一方面是氣孔蒸騰失去控制[31]。低溫脅迫1 d后,HRW處理的相對含水量明顯回升,CK也趨于平穩,說明黃瓜幼苗可在一定時間內對低溫脅迫逐步產生適應機制。然而,當低溫脅迫時間超過3 d時,黃瓜幼苗葉片的相對含水量又呈下降趨勢,表明幼苗的生理代謝受抑程度超出其自身的適應和保護能力,因此,葉片失水量逐漸增加,冷害癥狀進一步加重。與CK相比,HRW處理的相對含水量降低幅度顯著小于CK,說明氫氣可減緩低溫下黃瓜葉片失水,從而可在較長時間內維持正常的生理功能。低溫脅迫初期,黃瓜幼苗葉片的脯氨酸和可溶性糖含量也明顯升高,即幼苗會主動積累滲透調節物質,提高細胞液的滲透壓,增加蛋白質分子的水合度,增強細胞的吸水和保水能力[32]。HRW處理的可溶性糖與脯氨酸的含量在低溫脅迫初期的增加幅度明顯大于CK,而1—3 d后的降低幅度略小于CK。表明氫氣能通過增加低溫下黃瓜幼苗葉片的滲透調節物質含量提高其滲透調節能力,從而減輕低溫傷害,這是其耐冷性增強的重要原因之一。
4 結論
富氫水浸種可以降低低溫下黃瓜幼苗葉片的電解質滲透率和冷害指數,減少活性氧在細胞內的積累,富氫水處理的黃瓜幼苗抗氧化酶活性、還原型谷胱甘肽和抗壞血酸含量、葉片相對含水量及滲透調節物質含量顯著高于對照。富氫水處理種子能通過提高抗氧化系統活性及滲透調節能力來增強黃瓜幼苗耐冷性。
References
[1] 張威, 蔡建美, 康志敏, 孫學軍. 氫分子醫學研究進展. 第二軍醫大學學報, 2009, 30(10): 1203-1205.
ZHANG W, CAI J M, KANG Z M, SUN X J. Medical application of hydrogen molecule: recent progress., 2009, 30(10): 1203-1205. (in Chinese)
[2] BOICHENKO E A. Hydrogenase of isolated chloroplasts., 1947, 12(2): 153-162.
[3] RENWICK G M, GIUMARRO C, SIEGEL S M. Hydrogen metabolism in higher plants., 1964, 39(3): 303-306.
[4] OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAJATA K, KATSURA K, KATAYAMA Y, ASOH S, OHTA S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals., 2007, 13(6): 688-694.
[5] HONG Y, CHEN S, ZHANG J M. Hydrogen as a selective antioxidant: a review of clinical and experimental studies., 2010, 38(6): 1893-1903.
[6] XIE Y J, MAO Y, ZHANG W, LAI D W, WANG Q Y, SHNE W B. Reactive oxygen species-dependent nitric oxide production contributes to hydrogen-promoted stomatal closure in., 2014, 165(2): 759-773.
[7] XIE Y J, MAO Y, LAI D W, ZHANG W, SHEN W B. H2enhances Arabidopsis salt tolerance by manipulating ZAT10/12-mediated antioxidant defence and controlling sodium exclusion., 2012, 7(11): e49800.
[8] XU S, ZHU S S, JIANG Y L, WANG N, WANG R, SHEN W B, YANG J. Hydrogen-rich water alleviates salt stress in rice during seed germination., 2013, 370(1-2): 47-57.
[9] ZENG J Q, ZHANG M Y, SUN X J. Molecular hydrogen is involved in phytohormone signaling and stress responses in plants., 2013, 8(8): e71038.
[10] CHEN M, CUI W T, ZHUA K K, XIE Y J, ZHANG C H, SHEN W B. Hydrogen-rich water alleviates aluminum-induced inhibition of root elongation in alfalfa via decreasing nitric oxide production., 2014, 267(1): 40-47.
[11] CUI W T, CAO C Y, FANG P, LIN G Q, SHENG W B. Alleviation of cadmium toxicity in Medicago sativa by hydrogen-rich water., 2013, 260: 715-724.
[12] CUI W T, FANG P, ZHUA K K, MAO Y, GAO C Y, XIE Y J, WANG J, SHEN W B. Hydrogen-rich water confers plant tolerance to mercury toxicity in alfalfa seedlings., 2014, 105: 103-111.
[13] JIN Q J, ZHU K K, CUI W T, XIE Y J, HAN B, SHEN W N. Hydrogen gas acts as a novel bioactive molecule in enhancing plant tolerance to paraquat-induced oxidative stress via the modulation of heme oxygenase-1 signalling system., 2013, 36(5): 956-969.
[14] 趙世杰, 劉華山, 董新純. 植物生理學實驗指導. 北京: 中國農業科學技術出版社, 1998: 146-148.
ZHAO S J, LIU H S, DONG X C.. Beijing: China Agricultural Science and Technology Press, 1998: 146-148. (in Chinese)
[15] 于賢昌, 邢禹賢, 馬紅, 魏珉. 不同砧木與接穗對黃瓜嫁接苗抗冷性的影響. 中國農業科學, 1998, 31(2): 41-47.
YU X C, XING S X, MA H, WEI M. Effect of different rootstocks and scions on chilling tolerancein grafted cucumber seedlings., 1998, 31(2): 41-47. (in Chinese)
[16] THORDAL-CHRISTENSEN H, ZHANG Z G, WEI Y D, COLLINGE D B. Subcellular localization of H2O2in plants. H2O2accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction., 1997, 11(6): 1187-1194.
[17] JABS T, DIETRICH R A, DANGL J L. Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide., 1996, 273(5283): 1853-1856.
[18] 李忠光, 龔明. 植物中超氧陰離子自由基測定方法的改進. 云南植物研究, 2005, 27(2): 211-216.
LI Z G, GONG M. Improvement of measurement method for superoxide anion radical in plant., 2005, 27(2): 211-216. (in Chinese)
[19] 李合生, 孫群, 趙世杰, 章文華.植物生理生化實驗原理和技術. 北京: 高等教育出版社, 2000.
LI H S, SUN Q, ZHAO S J, ZHANG W H.. Beijing: Higher Education Press, 2000. (in Chinese)
[20] OMRAN R G. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings., 1980, 65(2): 407-408.
[21] CHANCE B, MAEHLY A C. Assay of catalases and peroxidases., 1955, 2(55): 764-775.
[22] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts., 1981, 22(5): 867-880.
[23] FOYER C H, HALLIWELL B. The presence of glutathione and glutathione reductase in chloroplasts: a proposed role in ascorbic acid metabolism., 1976, 133(1): 21-25.
[24] WANG L J, HUANG W D, LI J Y, LIU Y F, SHI Y L. Peroxidation of membrane lipid and Ca2+homeostasis in grape mesophyll cells during the process of cross-adaptation to temperature stresses., 2004, 167(1): 71-77.
[25] 朱帥, 吳幗秀, 蔡歡, 劉張壘, 劉婧, 楊瑞, 艾希珍. 低鎂脅迫對低溫下黃瓜幼苗光合特性和抗氧化系統的影響. 應用生態學報, 2015, 26(5): 1351-1358.
ZHU S, WU G X, CAI H, LIU Z L, LIU J, YANG R, AI X Z. Effects of low magnesium on photosynthesis characteristics and antioxidant system in cucumber seedlings under low temperature., 2015, 26(5): 1351-1358. (in Chinese)
[26] SU N, WU Q, LIU Y Y, CAI J T, SHEN W B, XIA K, CUI J. Hydrogen-rich water reestablishes ROS homeostasis but exerts differential effects on anthocyanin synthesis in two varieties of radish sprouts under UV-A irradiation., 2014, 62(27): 6454-6462.
[27] KORNYEYEV D, LOGAN B A, PAYTON P, ALLEN R D, SCOTT HOLADAY A. Enhanced photochemical light utilization and decreased chilling-induced photoinhibition of photosystem II in cotton overexpressing genes encoding chloroplast-targeted antioxidant enzymes., 2001, 113(3): 323-331.
[28] 王洪濤, 艾希珍, 鄭楠, 姜飛, 李清明. 嫁接對低溫弱光下辣椒幼苗膜脂過氧化及抗氧化酶活性的影響. 應用生態學報, 2010, 21(5): 1289-1294.
WANG H T, AI X Z, ZHENG N, JIANG F, LI Q M. Effects of graft on lipid peroxidation and antioxidative enzyme activities of Capsicumannum seedlings under low temperature and weak light intensity., 2010, 21(5): 1289-1294. (in Chinese)
[29] KAJIYAMA S, HASEGAWA G, ASANO M, HOSODA H, FUKUI M, NAKAMURA N, KITAWAKAI J, IMAI S, NAKANO K, OHTAF M, Adachig T, Obayashih H, Yoshikawa T. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance., 2008, 28(3):137-143.
[30] Xie K L, Yu Y H, Pei Y P, Hou L C, Chen S Y, Xiong L Z, Wang G L. Protective effects of hydrogen gas on murine polymicrobial sepsis via reducing oxidative stress and HMGB1 release., 2010, 34(1): 90-97.
[31] 董緒兵, 畢煥改, 劉業霞, 于軍輝, 艾希珍. 黃瓜幼苗干旱-低溫交叉適應與滲透調節的關系. 中國農業科學, 2011, 44(2): 335-340.
DONG X B, BI H G, LIU Y X, YU J H, AI X Z. Relationship between cross adaptation to drought-low temperature and osmoregulation in cucumber seedlings., 2011, 44(2): 335-340. (in Chinese)
[32] 朱虹, 祖元剛, 王文杰. 逆境脅迫條件脯氨酸對植物生長的影響. 東北林業大學學報, 2009, 37(4): 86-89.
ZHU H, ZU Y G, WANG W J. Effect of proline on plant growth under different stress conditions., 2009, 37(4): 86-89. (in Chinese)
(責任編輯 趙伶俐)
Effect of Hydrogen-rich Water Soaked Cucumber Seeds on Cold Tolerance and Its physiological Mechanism in Cucumber Seedlings
LIU Fengjiao, CAI Bingbing, SUN Shengnan, BI Huangai , AI Xizhen
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology/Key Laboratory of Horticultural Crop Biology and Germplasm Innovation of Ministry of Agriculture/Collaborative Innovation Center of Shandong Province with High Quality and Efficient Production of Fruit and Vegetable, Tai’an 271018, Shandong)
【Objective】Hydrogen (H2), a newly discovered gas signal molecules, is involved in plant stress responses to high temperature, drought, salt damage, heavy metals and other kinds of adversity. The purposes of this study are to elucidate the regulatory mechanism of hydrogen-rich water (HRW, H2donor) on chilling tolerance in cucumber seedlings and provide technical guidance to improve the adaptation of cucumber to low temperature in solar-greenhouse. 【Method】 ‘Jinyou 35’ cucumber seedlings were used as experimental materials. Seeds were soaked with HRW or distilled water (control), respectively, for 8 h, and germinated on moist filter paper in the dark at 26℃ for 2 days, then grown in vermiculite in a solar-greenhouse for 15 days (day/night air temperature was 24-30℃/18-24℃, and RH 75%-90%). At 2-leaf stage, the HRW and the control seedlings were exposed to low temperature (day/night temperature was 8℃/5℃). Young fully expanded leaves were sampled for analysis on 0 d, 1 d, 3 d, and 5 d after transferring from control to stress condition. 【Result】The results showed that chilling stress significantly increased the electrolyte leakage (EL), chilling injury index, contents of hydrogen peroxide (H2O2) and malondaldehyde (MDA), and superoxide anion () production rate. The activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), ascorbate peroxidase (APX) and glutathione reductase (GR), as well as the contents of glutathione (GSH), ascorbic acid (AsA), proline and soluble sugar increased in the early days of chilling stress, but subsequently decreased. The relative water content trended to decrease in the chilling days. The increase in EL and chilling injury index were lower in HRW treated seedlings than in the control seedlings. Simultaneously, the HRW treatment showed a decrease in H2O2and MDA contents, andproduction rate, while revealed an increase in the activities of SOD, POD, CAT, APX and GR, as well as the GSH and AsA contents, compared with the control. At the end of stress (5 d), the EL and chilling injury index of HRW treatment declined by 11.3 percentage points and 15.9%, respectively, than those of the control. The H2O2and MDA contents andproduction rate of the HRW-treated seedlings were 29.4%, 9.9% and 54.3% lower than those of the control, respectively. However, the activities of SOD, POD, CAT, APX and GR of HRW treated seedlings were 12.6%, 20.1%, 20.9%, 53.0%, and 58.1% higher, and the GSH and AsA contents enhanced by 24.0% and 17.6%, respectively, than those of the control seedlings. Compared with the control, the HRW treated seedlings showed lower extent of decrease in the relative water content, and revealed higher contents of proline and soluble sugar. After 5 d of chilling stress, the HRW treatment increased by 6.4 percentage points, and the proline and soluble sugar contents were 23% and 41.5% higher, respectively, than those of the control. 【Conclusion】 Soaking seeds with HRW can improve the cold resistance in cucumber seedlings, and the main mechanisms were: (1) HRW enhances the antioxidant system activity and reduces the reactive oxygen species (ROS) accumulation under chilling stress, and consequently alleviates the injury of membrane lipid peroxidation in cucumber seedling; (2) HRW slows the dehydration rate through improving the osmotic adjustment ability, and thereby remains the normal physiological function for a long time in cucumber seedlings under chilling stress.
low temperature stress; hydrogen-rich water; seed treatment; reactive oxygen; osmotic regulation; cucumber
2016-07-19;接受日期:2016-12-02
山東省現代農業產業技術體系建設專項(SDAIT-05-10)
劉豐嬌,E-mail:lfjsdnd@126.com。 通信作者艾希珍,Tel:0538-8246015;E-mail:axz@sdau.edu.cn

