香菇YJ-01原生質體制備與再生條件的優化
劉 璐 高 原 杜雙田田夢媛 耿 緣
(西北農林科技大學生命科學學院,陜西楊凌712100)
我國是香菇生產消費大國,栽培規模居世界前列,但育種研究滯后。曾采用引種、馴化及雜交方法選育得到并推廣的“武香一號”、冬菇L26、慶科20、Cr系列、“申香8號”等仍難以滿足市場對香菇質量與產量的需求,香菇育種與種質改良工作迫在眉睫[1-3]。原生質體育種可有效縮短育種周期,目前由原生質體育種得到并推廣示范栽培的新品種還未見報道,外加香菇菌絲在原生質體制備過程中會出現原生質體單核化現象[4-5],結合誘變育種、原生質體融合育種可針對性的改良種質[6-7],顯著提高香菇的產量、品質與抗病性[8-17]。原生質體的制備與再生是原生質體育種的基礎,研究采用通用旋轉設計對香菇原生質體制備的工藝及再生條件進行優化,期望為香菇原生質體育種工作提供參考。
1 材料與方法
1.1 供試材料①香菇菌株:香菇(Lentinus edodes)菌株,編號YJ-01,由西北農林科技大學生命科學學院提供。②母種培養基(g/L):木屑150.0(煎汁過濾),馬鈴薯 200.0,葡萄糖 10.0,蔗糖 10.0,蛋白胨 2.0,KH2PO41.0,MgSO40.5,瓊脂粉12.0,H2O 1000.0 mL,(pH5.5)。再生培養基:母種培養基用相應穩滲劑定容。③穩滲劑分別為0.4 mol/L的NaCl、MgSO4、KCl、甘露醇,葡萄糖和蔗糖溶液(pH5.0)。
主要試劑:酶液用對應穩滲劑配制酶濃度(W/V)1.0%的蝸牛酶,纖維素酶與混合酶(蝸牛酶∶纖維素酶=1∶1),0.22 μm 微孔濾膜過濾除菌,現配現用。Cellulase(MP Biomedical)及 Snailase(Wolsen)等 為國產分析純。
1.2 試驗方法
1.2.1 菌絲體培養 菌株活化及擴大培養參考文獻[18]。
1.2.2 原生質體制備與純化 原生質體制備與純化方法參考文獻[19]。
1.2.3 原生質體計數 得到的原生質體用穩滲劑重懸后,血球計數板計數,稀釋至108涂布平板。
原生質體產量(個/mL)=每小格平均原生質體數×400×稀釋倍數×104
1.2.4 原生質體再生 原生質體再生參考文獻[20]。
原生質體再生率(%)=[(再生平板菌落數-CK板菌落數)×稀釋倍數]/(涂布體積×原生質體濃度)×100
1.2.5 試驗設計 對原生質體產量與再生率從以下7個因素進行研究,試驗水平見表1。

表1 單因素試驗水平
1.2.6 原生質體制備與再生條件優化 根據單因素試驗結果,以原生質體產量與再生率為指標,按通用旋轉設計安排試驗。
1.3 數據分析統計分析采用DPS(Version 7.05),作圖采用Orign 9.0。
2 結果與分析
2.1各單因素對YJ-01原生質體產量與再生率的影響
2.1.1 不同酶種類對YJ-01原生質體產量與再生率的影響 圖1顯示,混合酶的酶解效果優于單一酶。用混合酶酶解時,原生質體產量(5.69×108個/mL)是纖維素酶的4.15倍,蝸牛酶的1.42倍;用混合酶酶解時原生質體再生率(0.91%)僅次于蝸牛酶(0.90%),是纖維素酶的2.39倍。這是因為香菇菌絲細胞壁成分復雜,單一酶不能較好降解細胞壁從而獲得大量的原生質體。而蝸牛酶是含有果膠酶、淀粉酶、蛋白酶等20多種酶的復合酶,而纖維素酶主要由內切或外切β-葡聚糖酶等組成,因此蝸牛酶酶解細胞壁的效果顯著優于纖維素酶,但仍不及混合酶的酶解效果。故在后續的多因素試驗中采用混合酶酶系。
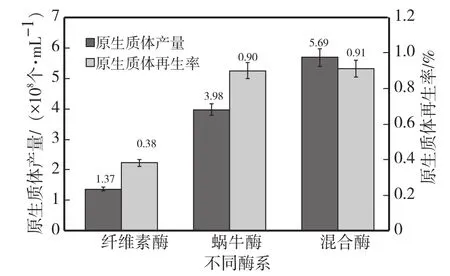
圖1 不同酶種類對YJ-01原生質體產量與再生率的影響
2.1.2 酶解溫度對YJ-01原生質體產量與再生率的影響 圖2顯示,酶解溫度對原生質體的產量及其再生率的影響顯著。隨著酶解溫度的升高,原生質體產量迅速增加,在酶解溫度為30℃左右時原生質體產量達到最大值,此后隨著酶解溫度的進一步升高,原生質體產量急劇下降。從酶解溫度在30℃左右時,原生質體的再生率也達到最大值。由回歸方程計算得,29℃酶解,原生質體產量最高(4.06×108個/mL);30℃酶解,原生質體再生率最高(1.08%)。這是由于酶解溫度影響了酶活,進而影響了原生質體產量與再生率。蝸牛酶的最適溫度為30~37℃,纖維素酶的最適溫度在35℃,在適宜溫度下酶活高,細胞壁分解速率快。雖然在35℃左右,混合酶能保持較高的活性,但過高的溫度會打亂香菇菌絲細胞內部代謝,破壞細胞膜的穩定性,進而導致原生質體細胞壁再生困難,所以溫度高于30℃時,原生質體產量與再生率圖線均呈現下降的趨勢。
2.1.3 酶解時間對原生質體產量與再生率的影響由圖3知,酶解時間小于3 h,有利于提高原生質體產量與再生率;酶解時間大于3 h時,原生質體產量與再生率均下降。從2 h開始,原生質體產量隨酶解時間延長急劇增加,2.5 h之后便緩慢下降。原生質體再生率在2~4.5 h先增加再減小。經回歸方程計算得,酶解時間3.44 h,原生質體產量最高(2.27×108個/mL);酶解時間2.82 h,原生質體再生率最高(1.70%)。
2.1.4 pH對原生質體產量與再生率的影響 在圖4中,當3≤pH≤4時,原生質體產量基本保持不變,再生率為0;4≤pH≤5時,原生質體產量與再生率均急劇增加;5≤pH≤7時,原生質體產量與再生率逐步減小。經回歸方程計算,在pH5.10時原生質體產量最高(2.34×108個/mL),pH5.69時原生質體再生率最高(1.86%)。

圖2 酶解溫度對YJ-01原生質體產量與再生率的影響
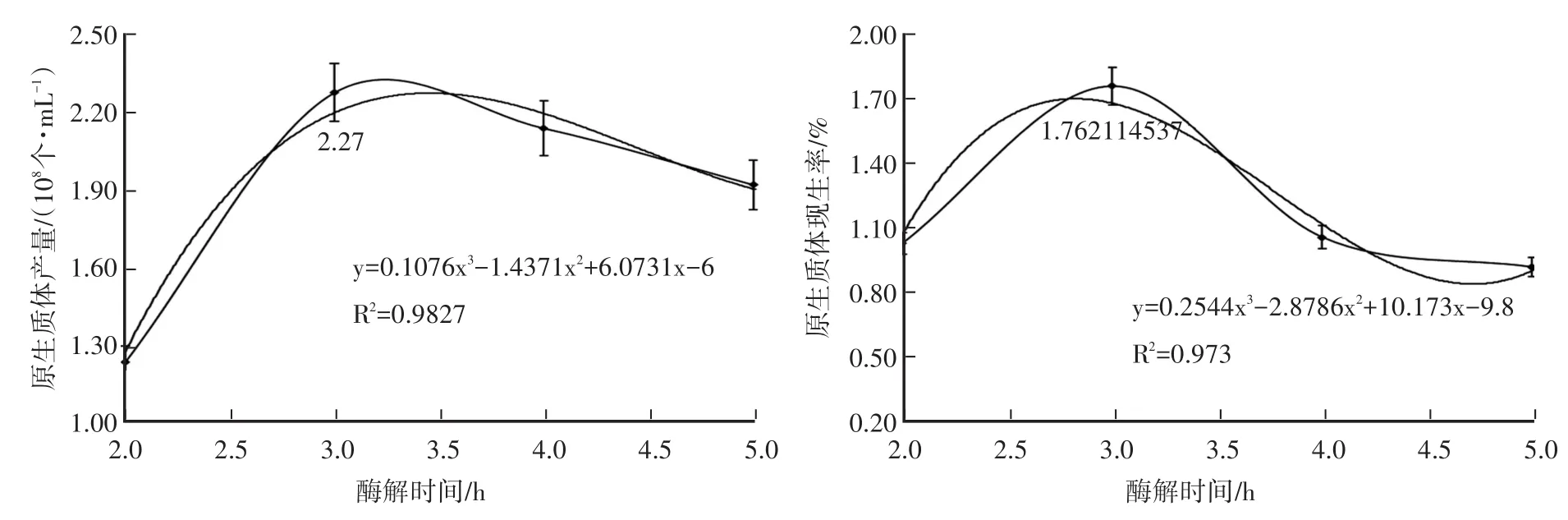
圖3 酶解時間對YJ-01原生質體產量與再生率的影響
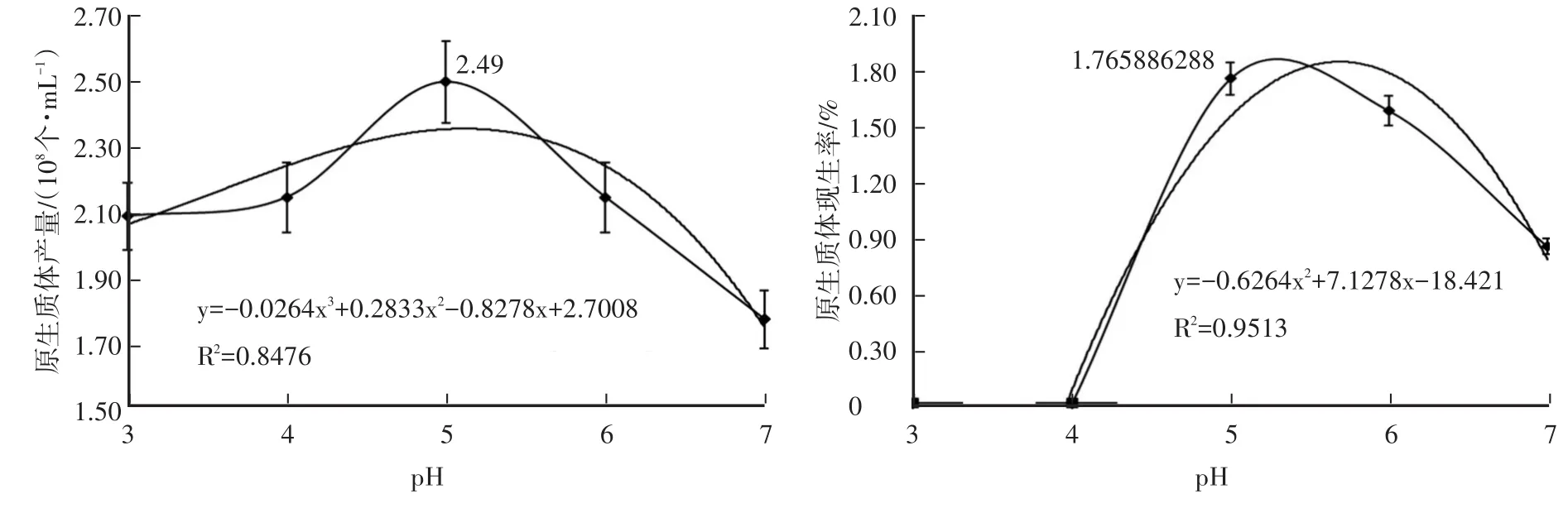
圖4 pH對YJ-01原生質體產量與再生率的影響

圖5 菌齡對YJ-01原生質體產量與再生率的影響
由于pH≤5.0時,再生培養基凝固狀態差,無法倒置培養,也無法挑取再生菌落進行下一步試驗,故根據回歸曲線確定原生質體制備過程中穩滲劑pH5.0,原生質體再生過程中再生培養基的pH5.5。
2.1.5 菌齡對原生質體產量與再生率的影響 圖5顯示,當菌齡小于4 d時,原生質體產量隨菌齡延長而增加;菌齡大于4 d時,原生質體產量逐漸降低。當菌齡小于6 d時,原生質體再生率隨菌齡延長而增加,當菌齡大于6 d時,原生質體再生率急劇下降。6日齡菌絲與7日齡菌絲的原生質體產量相近,再生率相差大。經回歸方程計算可知,菌齡4.1 d時原生質體產量最高(2.01×108個/mL),菌齡5.4 d時原生質體再生率最高(2.07%)。
2.1.6 不同穩滲劑對原生質體制備產量與再生率的影響 由圖6可知,以甘露醇作為穩滲劑,原生質體產量最高但再生率低;以MgSO4做為穩滲劑,原生質體產量(2.74×108個/mL),僅次于甘露醇和葡萄糖,再生率分別為1.73%(MgSO4)和1.60%(葡萄糖),僅次于以蔗糖為穩滲劑的再生平板(1.94%)。這是因為在制備原生質體時,以MgSO4作為穩滲劑,不僅可以維持細胞膜內外的滲透壓平衡,同時Mg2+可以與羧基及磷脂質交聯,穩定細胞膜。然而在原生質體再生的過程中,Mg2+等無機鹽離子不足以為細胞提供再生細胞壁所需的能量,同時單糖無法滿足細胞壁再生的物質需求。故以最大原生質體再生率為目標,確定以MgSO4做制備穩滲劑,以蔗糖做再生穩滲劑。
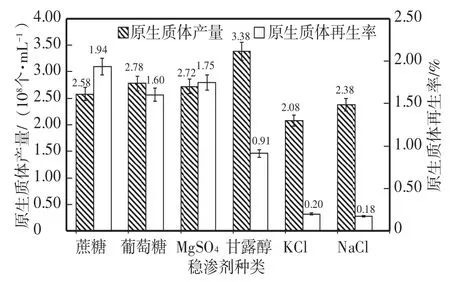
圖6 穩滲劑種類對YJ-01原生質體產量與再生率的影響
2.1.7 穩滲劑濃度對原生質體產量與再生率的影響 由圖7可知,適當濃度的穩滲劑有利于提高原生質體產量與再生率。以純水為穩滲劑作為對照組,此時原生質體產量低(4.2×107個/mL),再生率為0。隨穩滲劑濃度逐漸提高,原生質體產量與再生率均呈現先增加再減小的趨勢。試驗結果顯示,低濃度穩滲劑(0~0.2 mol/L)對原生質體再生率有顯著提高作用,0.2~0.8 mol/L對再生率影響不顯著,再生率在緩慢升高至1.88%后(對應穩滲劑濃度0.6mol/L)便呈緩慢下降趨勢。由回歸方程計算得,穩滲劑濃度0.51 mol/L時原生質體產量有最大值(1.85×108個/mL),穩滲劑濃度0.34 mol/L時,原生質體再生率有最大值(1.97%)。
2.2 原生質體制備及再生條件優化
2.2.1 多因素試驗方案確立 為了優化原生質體的制備條件與再生條件,根據2.1中結果以原生質體產量和再生率為指標,兼顧下一步試驗的實施性,最終確定以混合酶(纖維素酶∶蝸牛酶體積比1∶1)作為酶系,選擇pH5.0的MgSO4為原生質體制備穩滲劑,pH5.5的蔗糖作為原生質體再生穩滲劑。對另外4個因素酶解時間(X1),酶解溫度(X2),菌齡(X3)和穩滲劑濃度(X4)按四因素二次通用旋轉設計(1/2實施)安排試驗,試驗因素及水平編碼見表2。
2.2.2 原生質體制備數學模型的建立與檢驗 依據表2實施試驗,結果見表3,方差分析見表4。經計算得原生質體產量(Y)與各因素(Xi)水平的函數關系:
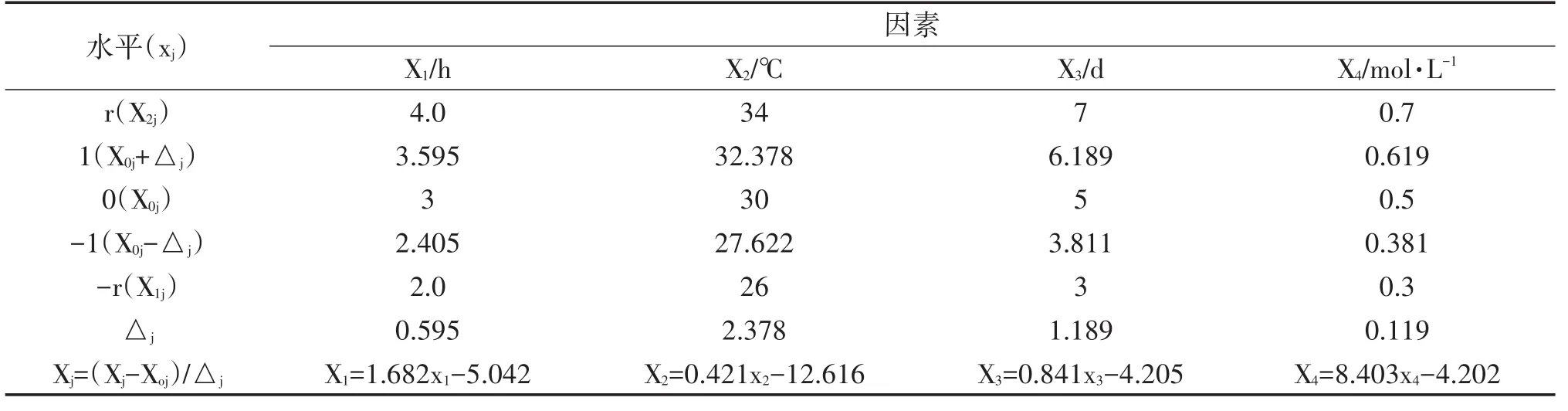
表2 試驗因素及水平編碼表

表3 原生質體產量試驗結果
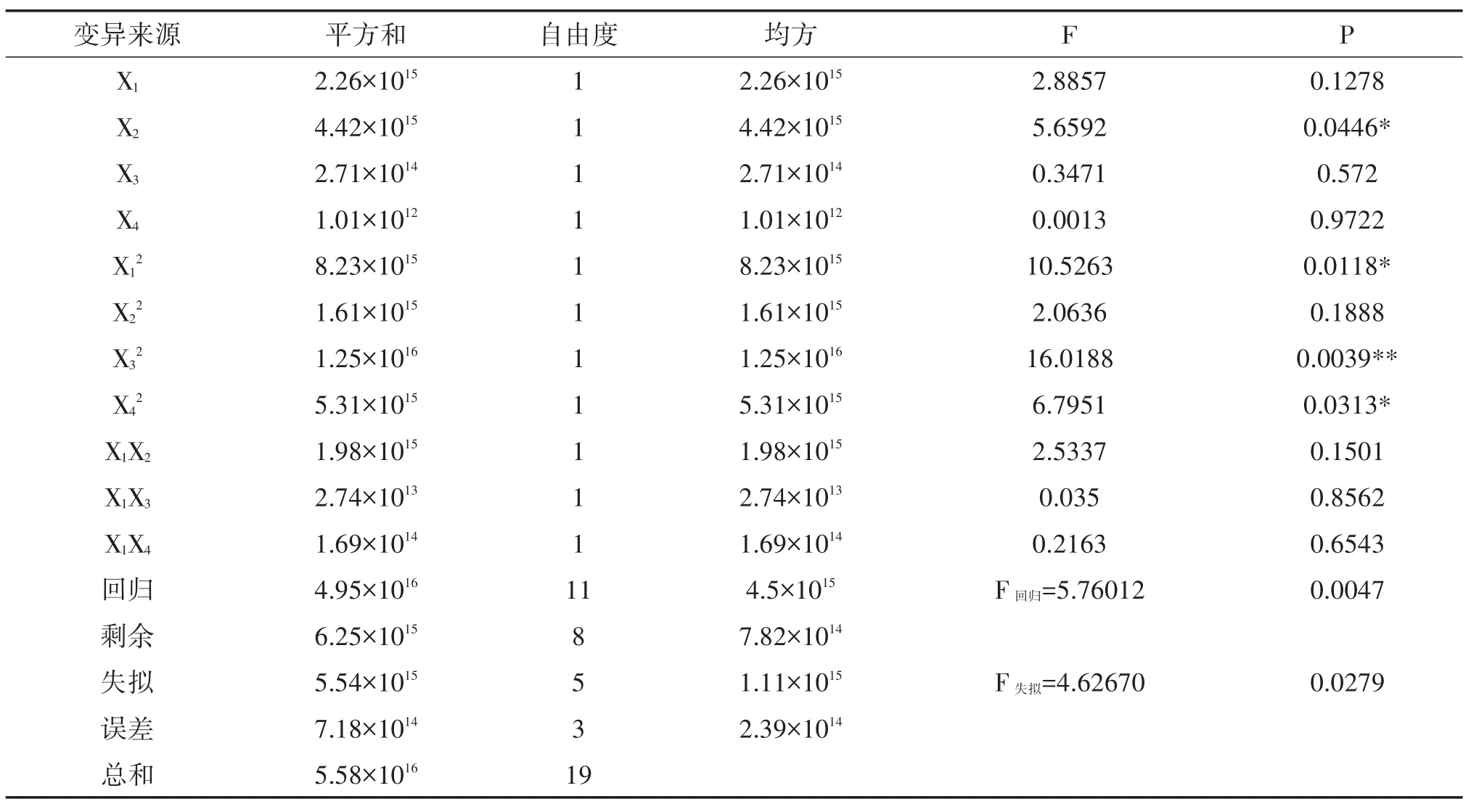
表4 原生質體產量方差分析表
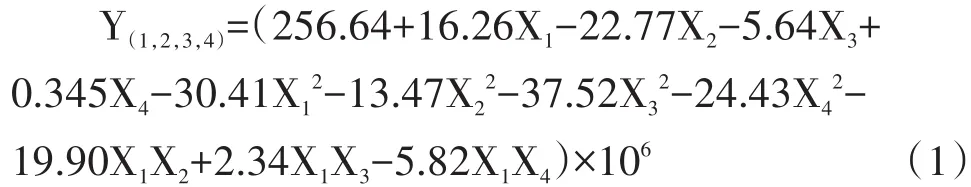
由表4知:對回歸方程(1)進行失擬性檢驗,F失擬=4.62670<F0.05(5,3)=9.013,可知不失擬。F回歸=5.76012>F0.05(11,8)=3.313,P=0.0047<0.05,模型符合客觀實際。且,達極顯著水平,X2、達顯著水平。剔除方程(1)在α=0.10條件下不顯著項后得:

2.2.3 單因素對原生質體產量的影響
對方程(1)降維得:


圖7 穩滲劑濃度對YJ-01原生質體產量與再生率的影響
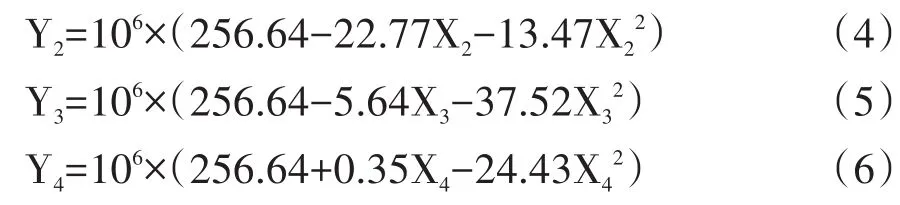
由方程(3)-(6)得圖8。
由方程(1)知,各因素在試驗范圍內對YJ-01原生質體產量影響作用大小依次為:X2>X1>X3>X4。由圖8曲線知,隨酶解時間,酶解溫度,穩滲劑濃度以及菌齡的增加,原生質體產量呈現先增加再減小的趨勢,各供試因素在試驗范圍內均有最大值。
對方程(3)-(6)求極值得:

經計算得:
X1max=0.27;X2max=-0.85;X3max=0.075;X4max=0.01
經轉化公式計算得原生質體制備條件:酶解時間(x1)=3.2 h,酶解溫度(x2)=27.9℃,菌齡(x3)=5.1 d,MgSO4穩滲劑(x4)=0.5mol/L。即:在pH=5.0,以0.5mol/L MgSO4做穩滲劑,對5日齡菌絲在28℃酶解3 h,最適原生質體制備(原生質體產量2.72×108個/mL)。

圖8 各編碼水平對香菇原生質體產量的影響
2.2.4 原生質體再生數學模型建立與檢驗 試驗結果見表5,方差分析見表6。
經計算得YJ-01原生質體再生率與各試驗因素的回歸方程為:
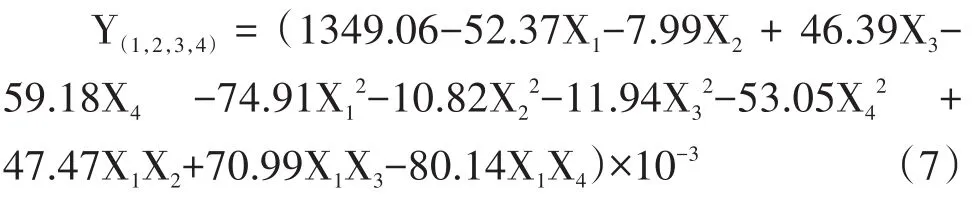
由方程(7)知,各因素對原生質體再生率的影響效果依次為:X4>X1>X3>X2。對結果進行方差分析,見表6:
依表6對回歸方程(7)進行失擬性檢驗與擬合分析,F失擬=3.65295<F0.05(5,3)=9.013,不失擬。F回歸=6.03451>F0.0(511,8)=3.313,P=0.0039<0.05,模型符合客觀實際。且,X1、X3、X4、、、X1X3與 X1X4達到顯著水平。剔除方程(7)在α=0.10條件下不顯著項后得:

表5 原生質體再生率試驗結果
表6 原生質體再生率方差分析表

由方程(9)-(12)得圖9。
對方程(9)-(12)求極值得:
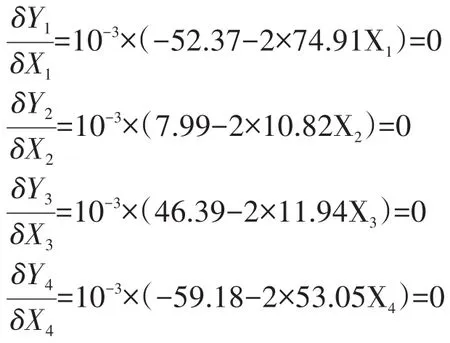
解得:
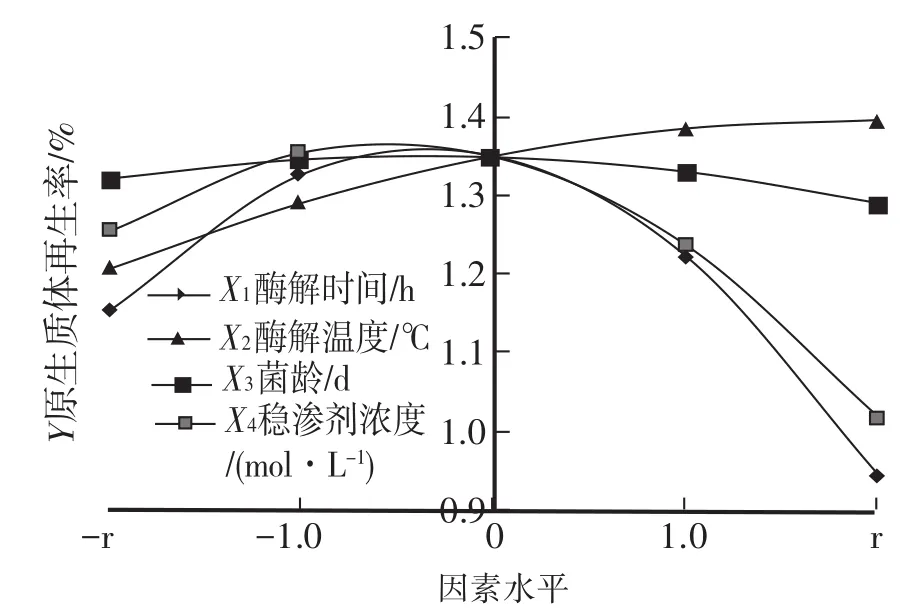
圖9 各編碼水平對香菇原生質體再生率的影響
X1max=-0.35;X2max=-0.37;X3max=1.94;X4max=-0.56
經轉化公式計算得:x1=2.8 h,x2=29.1℃,x3=7.3 d,x4=0.43 mol/L。即:當無交互作用時,以0.45 mol/L蔗糖做再生平板的穩滲劑,對7日齡菌絲在29℃酶解3 h,最適原生質體再生(再生率1.36%)。
2.2.6 交互作用對原生質體再生的影響
2.2.6.1 X1(酶解時間)與X3(菌齡)對香菇原生質體再生率的影響
由表6可見,在0.1顯著水平上,X1X3與X1X4兩個交互項滿足條件。故,X1和X3、X1和X4均存在顯著的交互作用。
令X2=0,X4=0,將方程(7)降維后得:
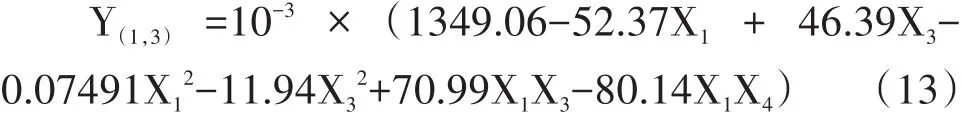
由方程(13)得圖10。
由圖10可知,Y(原生質體的再生率)在供試范圍內有最大值,當X1一定時,Y隨X3增加呈先增加再減小的趨勢;當X3一定時,Y均隨X1增加呈先增加再減小的趨勢。
2.2.6.2 X1(酶解時間)與X4(穩滲劑濃度)對香菇原生質體再生率的影響
令X2=0,X3=0,方程(7)降維得:
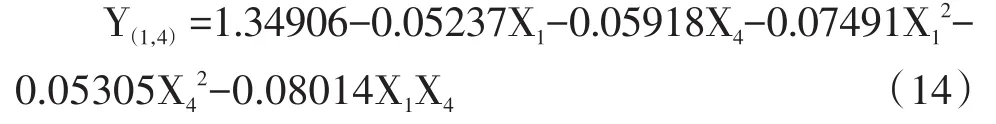
由方程(14)得圖11。由圖11可知,Y(原生質體的再生率)在供試范圍內有最大值,當X1一定時,Y隨X4增加呈先增加再減小的趨勢;當X4一定時,Y均隨X1增加呈先增加再減小的趨勢。

圖10 X1與X3的交互作用對YJ-01原生質體再生的影響

圖11 X1與X4的交互作用對YJ-01原生質體再生的影響
2.2.6.3 模型優化 對方程(7)求極值。
對其各變量求一階偏導并另其為零,求得模型的極值點:
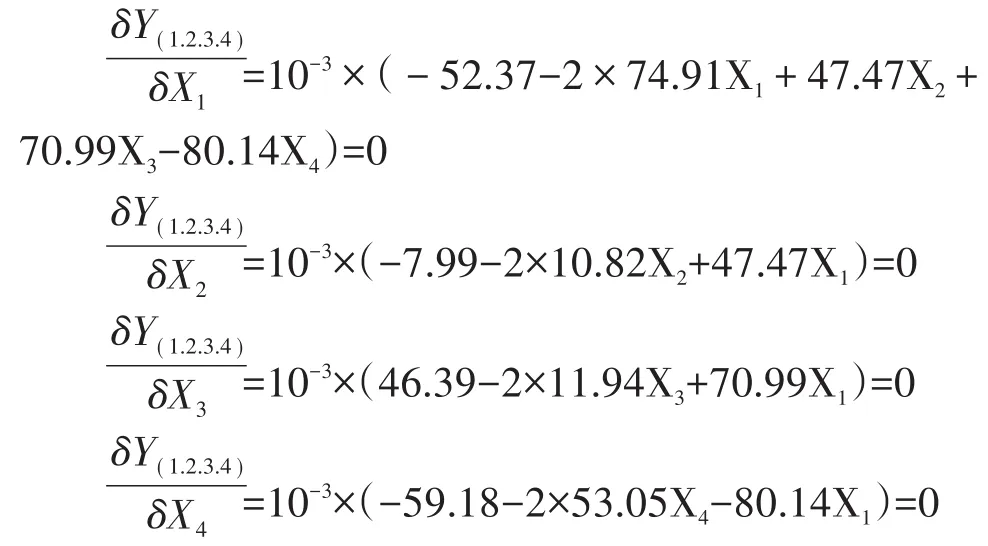
解方程組得:
X1=-0.24;X2=-0.90;X3=1.23;X4=-0.38
帶入轉化公式計算得:x1=2.9 h,x2=27.8℃,x3=6.5 d,x4=0.5 mol/L。即:以0.5 mol/L蔗糖做穩滲劑,對6.5日齡菌絲在27.8℃酶解2.9 h,原生質體有最大再生率(1.39%)。
2.2.6.4 驗證試驗 在以優化得到的最優再生條件下,進行驗證試驗,測得原生質體產量分別為2.32×108個/mL,1.79×108個/mL,1.54×108個/mL。原生質體再生率再生率分別為1.48%,1.06%,1.88%。與理論值相近,基本符合預測值。證明該條件具有科學性與穩定性。
3 小結與討論
通過以上分析可得如下結論:
(1)供試4種因素在一定范圍內,均可顯著提高YJ-01原生質體產量與再生率。YJ-01原生質體最優制備條件為:在pH為5.0條件下,以0.5 mol/L MgSO4做穩滲劑,對5日齡菌絲在28℃酶解3 h。最優再生條件為:在pH為5.5條件下,以0.5 mol/L蔗糖做穩滲劑,對6.5日齡菌絲在27.8℃酶解2.9 h。
(2)原生質體產量由酶活與酶解反應時間決定,各因素對原生質體產量的影響作用依次為:酶解溫度>酶解時間>菌齡>穩滲劑濃度。酶解溫度和酶解液pH通過影響酶活來影響原生質體產量。在pH4.5~6.0范圍內,纖維素酶最適溫度為45~55℃,蝸牛酶最適溫度為30~37℃,酶活越高,酶促反應越快,相同時間內的原生質體產量越高。穩滲劑濃度是通過影響細胞內外滲透平衡而影響原生質體的產量,當穩滲劑濃度過低時,原生質體吸水膨脹甚至脹破;當穩滲劑濃度過高時,原生質體失水皺縮。酶種類和酶解時間通過控制酶解反應來影響原生質體產量,混合酶可針對不同底物進行反應,因而酶解效果優于單一酶,相同酶解時間內產生原生質體數量多于單一酶。
(3)原生質體再生率由原生質體活性決定,各因素對原生質體再生率的影響作用依次為:穩滲劑濃度>酶解時間>菌齡>酶解溫度。原生質體再生過程中,當穩滲劑濃度過低或過高會導致原生質體嚴重吸水膨脹或皺縮,此時原生質體活性降低,細胞壁再生性能降低,再生率也隨之降低。在酶的最適反應條件范圍內,酶解反應較快,混合酶系可針對不同底物進行酶解,酶解時間越長,原生質體暴露在酶液中的時間越久,原生質膜損傷也相對變大,原生質體再生細胞壁的性能減弱,再生率降低。加上香菇菌絲與原生質體最適生長溫度為(25±1)℃,過高的酶解溫度雖然會提高酶促反應速率,但會降低原生質體活性,進而降低影響原生質體再生率。原生質體再生率與菌齡有關可能是因為當菌絲過于幼嫩時,酶解后原生質體不穩定,再生困難,當菌齡過長時,菌絲細胞壁加厚,次生物質增多,再生率下降。
(4)試驗利用二次通用旋轉組合設計方法建立了原生質體制備與再生的數學模型,并對模型優化,得到原生質體制備再生的較優條件,且驗證試驗結果接近預測值。試驗所得結果,與邢振楠的研究結果[21(]酶解溫度30℃,p H=5.5時原生質體產量最佳)接近,但與王鐠的研究結果[22(]34℃酶解時原生質體產量最高)、李蕤的研究結果[23(]菌齡6 d,酶解時間3 h,酶解溫度34℃,滲透壓穩定劑0.6 mol/L甘露醇最適于原生質體制備)、廖漢泉的研究結果[24(]菌齡5~6 d,以0.8 mol/L甘露醇作為穩滲劑,用1.5%溶壁酶液酶解1.5~2 h,所得原生質體的產量高達4×107個/mL,此時再生率也較高)存在差異,這可能與菌株及基礎培養基不同有關。
▲更正 本刊2016年第6期第49頁“食用菌發酵罐制種技術”(作者姜固勝、張娣、杜萍、王金賀)的基金項目是黑龍江省教育科學規劃課題(ZJD1215012)。由于作者投稿時未注明,應作者要求本刊現更正說明。

