人參皂苷Re對阿爾茨海默病模型小鼠腦組織生物標記物調控作用的研究
人參皂苷Re對阿爾茨海默病模型小鼠腦組織生物標記物調控作用的研究
李菁媛王喆劉穎李偉李乃靜
目的通過超高速液相色譜-質譜聯用(UPLC-MS)技術研究人參皂苷Re(G-Re)對阿爾茨海默病(AD)模型小鼠生物標記物的調控作用以及機制,為AD的中藥治療提供新思路。方法將小鼠隨機分為對照組、AD模型組和G-Re治療組,通過免疫組化實驗觀察小鼠腦部海馬區細胞的病理學改變,運用以UPLC-MS為基礎的代謝組學技術研究G-Re對AD模型小鼠腦組織生物標記物的調控作用。結果免疫組化實驗發現,對照組小鼠海馬區無Aβ沉積,AD模型組小鼠海馬區可見大量Aβ沉積,經G-Re治療后小鼠海馬區Aβ沉積明顯減少。代謝組學分析發現,AD模型組小鼠腦組織中存在次黃嘌呤、次黃嘌呤核苷、苯丙氨酸、16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰膽堿C16:0、溶血磷脂酰膽堿C18:1、溶血磷脂酰膽堿C18:0等9種生物標記物。與對照組比較,AD組次黃嘌呤、次黃嘌呤核苷和苯丙氨酸的含量明顯升高(P<0.05),16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰膽堿(C16:0、C18:1、C18:0)的含量明顯降低(P<0.05)。經G-Re干預后,AD組小鼠腦組織中次黃嘌呤、次黃嘌呤核苷和苯丙氨酸的含量明顯降低(P<0.05),16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰膽堿(C16:0、C18:1、C18:0)的含量明顯升高(P<0.05)。結論G-Re可以干預AD小鼠體內氨基酸、核酸及脂質等代謝途徑,減少小鼠海馬區的Aβ沉積,從而對AD起到治療作用。
人參皂苷Re; 阿爾茨海默病; 生物標記物; 超高速液相色譜-質譜聯用
阿爾茨海默病(Alzheimer’s disease,AD)是一種致死性的神經系統退行性疾病,其臨床特點包括漸進性的記憶減退、情緒改變、溝通及推理方面障礙,最終病人將失去獨立生活的能力[1]。AD不僅嚴重影響老年人的社交、工作與生活,其醫療和護理也給病人家庭和社會帶來沉重的經濟負擔[2]。因此,研究AD的發生機制,探索有效的預防和治療策略,具有重要的臨床意義。人參皂苷Re(ginsenoside Re,G-Re)作為人參的生物活性成分之一,具有改善腦缺血缺氧,提高學習和記憶能力等作用[3]。關于G-Re治療AD的代謝組學研究,國內外均未見報道。本研究首次將超高速液相色譜-質譜聯用(ultra performance liquid chromatography-mass spectrometry,UPLC-MS)為基礎的代謝組學技術,用于研究G-Re對AD生物標記物的調控作用及其機制,以期為AD的防治指明新方向。
1 材料與方法
1.1 試劑與儀器 G-Re(上海源葉生物科技有限公司);β淀粉樣肽25-35(amyloid β-protein 25-35,Aβ25-35)、兔抗鼠Aβ42(美國Sigma 公司);山羊抗兔/鼠免疫組化試劑盒(北京中杉金橋生物技術有限公司);色譜乙腈,色譜甲醇(美國Fisher公司)。TGL-16臺式高速冷凍離心機(湖南湘儀實驗室儀器開發有限公司);液相系統 AcquityTMUltra Performance Liquid Chromatography system,質譜儀 Quattro microTMAPI Mass Spectrometers(美國Waters公司)。
1.2 實驗動物及分組 健康12周齡雄性昆明小鼠24只,體質量為18~22 g,由沈陽藥科大學實驗動物中心提供,動物使用許可證號[SYXK(遼)2014-004]。將24只小鼠隨機分為對照組、AD模型組和G-Re治療組,每組各8只。小鼠置于室溫23 ℃~25 ℃,光照12 h/12 h晝夜循環的條件下飼養,自由飲水和進食。
1.3 實驗方法
1.3.1 AD模型制備:AD組和G-Re組小鼠經5%水合氯醛麻醉后,選取右側側腦室為注射位點,緩慢注射凝聚態的Aβ25-35溶液5 μl。對照組小鼠側腦室內注射等體積生理鹽水。
1.3.2 給藥方法:造模成功后3 d開始灌胃給藥,G-Re治療組小鼠給予G-Re 4 mg/(kg·d),對照組和AD組均給予生理鹽水10 ml/(kg·d)。1次/d,連續給藥30 d。
1.3.3 免疫組化實驗:實驗小鼠經乙醚麻醉后,采用斷頭取腦的方法獲取腦組織。取腦后置于4%多聚甲醛液中,固定3 d,將腦組織常規包埋并制成石蠟切片,切片厚度為2.5 μm。切片置于60 ℃恒溫箱內過夜。切片脫蠟處理后,用PBS洗去酒精。將切片放在抗原修復液中,37 ℃溫箱中修復30 min以暴露抗原。漂洗后3%過氧化氫溶液室溫孵育40 min,以阻斷內源性過氧化物酶活性。漂洗后滴加山羊血清封閉抗原,室溫孵育40 min。漂洗后滴加兔抗鼠Aβ1-42(1∶100),4 ℃孵育過夜。漂洗后滴加聚合物輔助劑,室溫孵育20 min。滴加辣根酶標記的抗鼠/兔IgG聚合物,室溫孵育20 min。應用DAB顯色、蘇木素復染后,自來水充分沖洗返藍,酒精梯度脫水,二甲苯透明,封片后光鏡下觀察。
1.4 樣品的采集與預處理 樣品采集:各組小鼠經乙醚麻醉后,斷頭取腦置于EP管中,分別稱重并記錄,放入-80 ℃冰箱待用。預處理:每0.1 g腦組織加入1 ml水,冰浴中勻漿。取150 μl勻漿液,加入600 μl甲醇沉淀蛋白,渦旋5 min,在4 ℃條件下15 000 r/min離心10 min,取上清液于氮氣下吹干。臨測時用100 μl初始流動相(乙腈-水,v∶v 2∶98)復溶,取10 μl注入UPLC系統。
1.5 色譜和質譜條件 色譜分析條件:色譜柱為ACQUITY UPLC? BEH C18 Column(1.7 μm,2.1×50 mm,Waters),流動相A為0.1%甲酸水,流動相B為0.1%甲酸乙腈,流速為0.25 ml/min。梯度洗脫條件如下:0 min,98% A;0~3 min,98%~80% A;3~4 min,80%~45% A;4~13 min,45%~0% A;13~14 min,0%~98% A。進樣量為10.0 μl,柱溫為30 ℃。質譜分析條件:采用電噴霧離子源(ESI),離子源溫度為120 ℃,正離子模式檢測,掃描方式為全掃描,掃描范圍為100~1000 m/z;毛細管電壓為3.2 kV,錐孔電壓為30 V;脫溶劑氣為氮氣,流速為600 L/h,溫度為350 ℃。在運用MS/MS的方式進行二級掃描時,碰撞氣為氬氣。
1.6 代謝組學數據處理 將原始圖譜導入Markerlynx V 4.1軟件分析,收集每個色譜圖的總離子強度數據,進行主成分分析(principal component analysis,PCA)。經PCA分析輸出得分圖和載荷圖,對數據進行分組,找出對分組貢獻較大的物質,進行二級掃描以獲得更多質譜碎片信息,根據HMDB(http://www.hmdb.ca/)、KEGG(http://www.kegg.jp/)和LIPID MAPS(http://www.lipidmaps.org/)等數據庫,確定AD的生物標記物。3組間各生物標記物的峰強度比較采
用t檢驗,P<0.05認為差異具有統計學意義。
2 結果
2.1 免疫組織化學實驗 對照組小鼠大腦海馬區神經元細胞排列緊密,細胞核大而規則,可觀察到明顯的核仁,細胞間無Aβ沉積。AD組小鼠大腦海馬部位神經元細胞稀疏,排列紊亂,細胞核深染,細胞間有明顯深褐色的大塊Aβ沉積。G-Re組小鼠與AD組比較,小鼠海馬部位神經元細胞排列較為整齊,細胞核染色變淡,Aβ沉積明顯減少。見圖1。
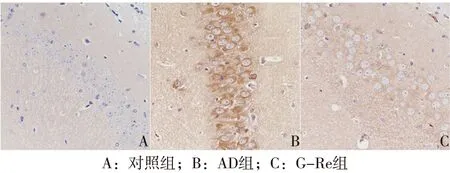
圖1 小鼠腦組織海馬區免疫組化染色結果(PV法,×400)
2.2 小鼠腦組織代謝組學分析
2.2.1 UPLC-MS代謝產物圖譜:對照組、AD組和G-Re組小鼠腦組織正離子模式下的基峰色譜圖見圖2。
圖2 小鼠腦組織正離子模式下的基峰色譜圖
2.2.2 UPLC-MS數據分析:將對照組、AD組和G-Re組小鼠腦組織的代謝物譜數據進行PCA分析,得到得分圖(圖3A,橫縱坐標分別代表PCA模型中的兩個主成分的打分向量)和載荷圖(圖3B,橫縱坐標分別代表的是兩個主成分的載荷向量)。得分圖可見對照組與AD組界限明顯,無任何交集,而G-Re組處于對照組和AD組之間,證明G-Re干預后AD小鼠腦組織代謝物發生明顯變化。載荷圖中分散于外圍的變量為對分組貢獻較大的變量,即AD的生物標志物。
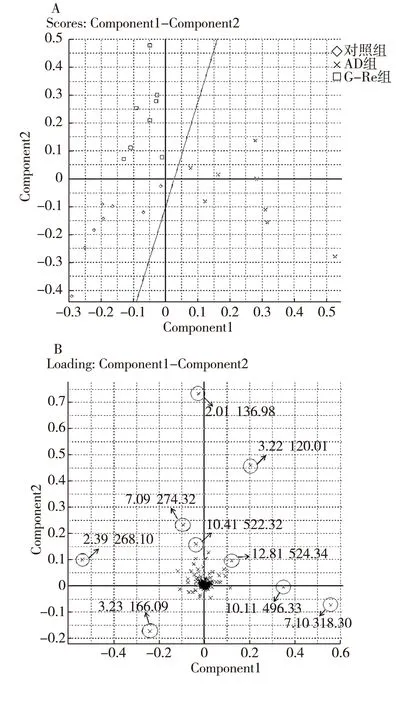
圖3 3組腦組織代謝物普的得分圖(A)和載荷圖(B)
2.2.3 生物標記物的確認:經PCA分析及相關代謝組學數據庫,確定了9種AD的生物標志物,分別是次黃嘌呤、次黃嘌呤核苷、苯丙氨酸片段、苯丙氨酸、16碳鞘氨醇、植物鞘氨醇、溶血磷脂酰膽堿(Lysophosphatidylcholine,LPC)C16:0、LPC C18:1、LPC C18:0,這9種生物標記物在各組小鼠腦組織中的峰強度變化見圖4。與對照組比較,AD組次黃嘌呤、次黃嘌呤核苷和苯丙氨酸的含量明顯升高(P<0.05),16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明顯降低(P<0.05)。經G-Re干預后,小鼠腦組織中次黃嘌呤、次黃嘌呤核苷和苯丙氨酸的含量明顯降低(P<0.05),16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明顯升高(P<0.05)。
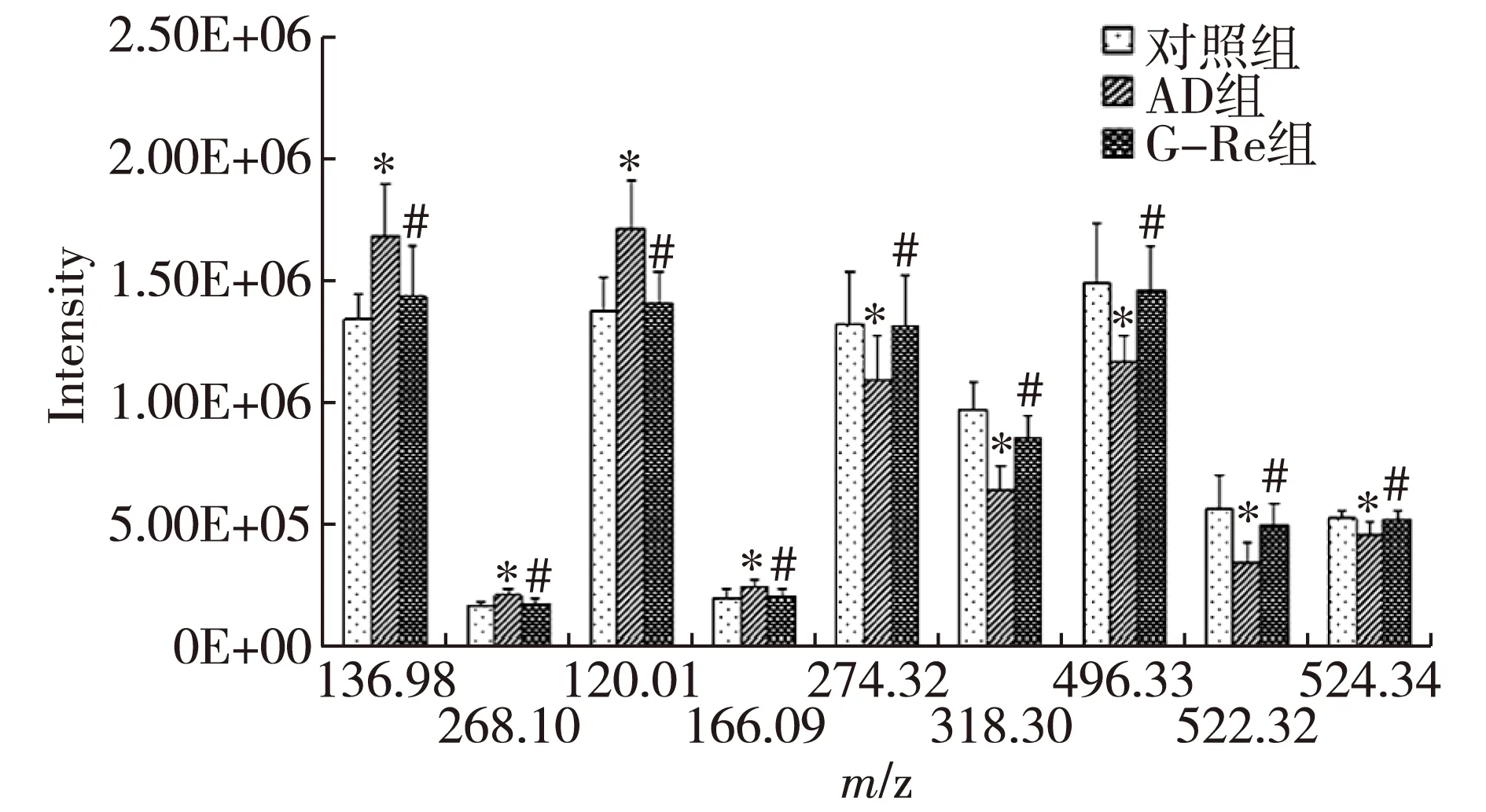
注:與對照組比較,*P<0.05;與AD組比較,#P<0.05。m/z 136.98:次黃嘌呤;m/z 268.10:次黃嘌呤核苷;m/z 120.01:苯丙氨酸片段;m/z 166.09:苯丙氨酸;m/z 274.32:16碳鞘氨醇;m/z 318.30:植物鞘氨醇;m/z 496.32:LPC C16:0;m/z 522.32:LPC C18:1;m/z 524.34:LPC C18:0。圖4 對照組、AD組和G-Re組生物標記物的峰強度
3 討論
研究表明,G-Re能通過減少AD細胞模型中活性氧的生成、抑制AD小鼠腦組織糖原合成酶激酶-3β的活性等途徑,對神經元起到保護作用,緩解AD的病理過程[4-5]。而代謝組學以相對分子質量<1000的小分子代謝物質為研究對象,著重研究機體受內外因素擾動后(如基因改變或環境變化等),代謝物的種類、數量變化及其規律[6]。換言之,代謝組學可以從宏觀層面來理解疾病的發展過程,與中醫的整體觀思維方式不謀而合。因此,代謝組學可用來研究G-Re對AD模型小鼠體內內源性代謝物及異常代謝通路的調控作用,進一步闡明G-Re治療AD的作用機理。
AD的特征性病理改變包括Aβ沉積形成的老年斑(senile plaques,SPs))和tau蛋白過度磷酸化形成的神經元纖維纏結(neurofibrillary tangles,NFTs),常伴有神經元丟失。本研究通過免疫組化的方法,在AD小鼠大腦海馬區觀察到神經細胞減少、排列紊亂,細胞核呈現凋亡的特征性改變(核質固縮、邊集及碎裂),并有明顯的SPs,提示AD模型小鼠具備與AD病人腦部類似的病理學改變。G-Re組與對照組比較,雖然神經元細胞似乎仍有減少,但相對于AD組,小鼠海馬區Aβ沉積明顯減少,僅能觀察到少量SPs。以上結果說明了G-Re可以減弱Aβ蛋白對海馬區神經元的毒害作用,對神經元具有保護作用。
本研究通過UPLC-MS技術來研究AD小鼠腦組織中代謝物譜的變化,確定了9種AD生物標記物。與對照組比較,AD小鼠腦組織中次黃嘌呤、次黃嘌呤核苷和苯丙氨酸的含量明顯增加,而16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明顯降低。經G-Re干預后,與AD組比較,次黃嘌呤、次黃嘌呤核苷和苯丙氨酸的含量明顯降低,16碳鞘氨醇、植物鞘氨醇、LPC(C16:0、C18:1、C18:0)的含量明顯升高。說明G-Re可以干預AD小鼠體內氨基酸、核酸及脂質等代謝途徑,對AD起到治療作用。
次黃嘌呤核苷又稱肌苷,是核酸代謝的中間產物,由腺苷脫氨后產生,在核苷磷酸化酶的作用下生成次黃嘌呤。有研究表明,AD病人腦中磷酸腺苷脫氨酶活性升高,加速磷酸腺苷降解生成腺苷[7],因而肌苷和次黃嘌呤的濃度隨之升高。嘌呤能信號在AD的發展過程中發揮重要的作用[8]。次黃嘌呤可以通過抑制Na+,K+-ATP酶的活性來誘導大鼠紋狀體氧化應激[9]。氧化應激在AD中起重要作用,多種可能的發病機制或病理生理改變都與氧化應激反應有關[10]。Kaddurah-Daouk等[11]研究表明,嘌呤代謝紊亂可能與tau蛋白及Aβ蛋白的病理發展過程相關。因此,次黃嘌呤和肌苷可以作為AD的生物標記物。本研究表明,AD小鼠腦組織內次黃嘌呤、肌苷的含量均高于對照組小鼠。G-Re給藥后,與AD組比較,次黃嘌呤和肌苷水平均明顯下調,證明G-Re可通過介導核酸代謝發揮作用。
苯丙氨酸是人體必需氨基酸之一,主要存在于血漿和腦組織內。Wissmann等[12]的研究表明,AD病人的血清中苯丙氨酸濃度升高,且苯丙氨酸/色氨酸的比值也升高,這與慢性免疫激活緊密相關,免疫應答激活有關的苯丙氨酸的代謝障礙可能與AD的炎癥機制相關。本研究中,與對照組相比,AD組小鼠腦組織中苯丙氨酸濃度顯著升高,這和之前的報道相一致。因此,苯丙氨酸可以作為AD一個的生物標記物。G-Re組與AD組比較,小鼠腦組織內苯丙氨酸的含量明顯降低,提示G-Re可以干預苯丙氨酸代謝發揮治療作用。
鞘氨醇又稱神經鞘氨醇,屬于鞘脂類。鞘脂類是體內重要的信號分子,參與多種生理功能調節,例如細胞的生長與老化、細胞識別、信號轉導等,在細胞功能的維持中起著一系列至關重要作用[13]。神經酰胺是鞘脂類的中間代謝產物,由神經鞘氨醇長鏈堿基與脂肪酸組成。鞘氨醇作為鞘脂的分解產物,它通過再酰化被回收利用,生成神經酰胺及其衍生物[14]。有報道稱,在以AD為代表的神經退行性疾病中,膜相關的氧化應激異常活躍,導致神經酰胺的的大量蓄積,而作為合成原料的鞘氨醇含量明顯降低[15]。本研究中,AD小鼠腦組織中16碳鞘氨醇和植物鞘氨醇的含量均顯著下降。經G-Re干預后,與AD組比較,二者的含量均明顯升高,說明G-Re可以改變異常的鞘氨醇代謝通路。
LPC是磷脂代謝的的中間產物,是體內重要的生物活性物質,可作為第二信使來參與多種細胞功能的調節,包括信號轉導、基因表達和細胞增殖等[16]。神經細胞膜上的磷脂代謝異常是AD的特征性病理改變,它會導致細胞膜崩解[17],這可能與AD發病過程中的神經元丟失有關。磷脂酶A2(phospholipaseA2,PLA2)是磷脂代謝的關鍵酶。PLA2的過度活化會刺激磷脂酰膽堿(PC)變性生成LPC,LPC迅速水解產生甘油磷酸膽堿(GPCh),磷酸膽堿(PCh),最后變為膽堿(Ch),并釋放游離脂肪酸[18]。有研究表明,LPC在 AD 病人的腦脊液[19]、腦組織[20]和血漿[21]中均顯著降低。 本實驗結果表明,AD小鼠腦組織中LPC C16:0、LPC C18:1、LPC C18:0的含量較對照組顯著降低。經G-Re干預后,與AD組比較,LPC(16:0、 C18:1、C18:0)的含量明顯升高,說明G-Re能通過調控磷脂代謝起到抗AD的效果。
本研究運用UPLC-MS技術,對G-Re干預的Aβ25-35所致AD模型小鼠的腦組織代謝物譜進行分析,確定了9種AD的生物標志物,并發現G-Re通過干預AD小鼠體內氨基酸、核酸及脂質等代謝途徑,發揮對AD的治療作用。
[1] Pan X, Nasaruddin MB, Elliott CT, et al. Alzheimer’s disease-like pathology has transient effects on the brain and blood metabolome[J]. Neurobiol Aging, 2016,38:151-163.
[2] Graham SF, Chevallier OP, Roberts D, et al. Investigation of the human brain metabolome to identify potential markers for early diagnosis and therapeutic targets of Alzheimer’s disease[J]. Anal Chem, 2013, 85(3):1803-1811.
[3] 姜紅柳, 楊振, 孟勤, 等. 人參皂苷Re對小鼠學習記憶障礙的作用[J]. 中國藥理學通報, 2008, 24(10):1399-1400.
[4] Huang GD, Zhong XF, Deng ZY, et al. Proteomic analysis of ginsenoside Re attenuates hydrogen peroxide-induced oxidative stress in human umbilical vein endothelial cells[J]. Food Funct, 2016,7(5):2451-2461.
[5] 賈立云, 潘曉華, 劉晶, 等. 人參皂苷Rb1、Re對Aβ25-35誘導SK-N-SH細胞損傷的保護作用[J]. 山東大學學報:醫學版, 2011,49(4):33-37.
[6] Alnouti Y. Metabolomics[M]. Springer New York, 2014:10.
[8] Kaddurah-Daouk R. Metabolomic changes in autopsy-confirmed Alzheimer’s disease[J]. Alzheimers Dement, 2011,7(3):309-317.
[9] Wyse AT, Bavaresco CS, Reis EA, et al. Training in inhibitory avoidance causes a reduction of Na+, K+-ATPase activity in rat hippocampus[J]. Physiol Behav, 2004, 80(4):475-479.
[10] 林玉坤, 曾園山, 曲澤強, 等. 氧化應激與阿爾茨海默病[J]. 解剖學研究, 2009,31(1):67-70.
[11] Kaddurah-Daouk R, Zhu H, Sharma S, et al. Alterations in metabolic pathways and networks in Alzheimer’s disease[J]. Transl Psychiatry, 2013, 3:e244.
[12] Wissmann P, Geisler S, Leblhuber F, et al. Immune activation in patients with Alzheimer’s disease is associated with high serum phenylalanine concentrations[J]. J Neurol Sci, 2013, 329(1/2):29-33.
[13] Alesenko AV. The potential role for sphingolipids in neuropathogenesis of Alzheimer’s disease[J]. Biomed Khim, 2013, 59(1):25-50.
[14] Kitatani K, Idkowiak-Baldys J, Hannun Y. The sphingolipid salvage pathway in ceramide metabolism and signaling[J]. Cell Signal, 2008,20(6):1010-1018.
[15] Haughey NJ, Bandaru VV, Bae M, et al. Roles for dysfunctional sphingolipid metabolism in Alzheimer’s disease neuropathogenesis[J]. Biochim Biophys Acta, 2010, 1801(8):878-886.
[16] Farooqui AA, Horrocks LA. Phospholipase A2-generated lipid mediators in the brain: the good, the bad, and the ugly[J]. Neuroscientist, 2006, 12(3):245-260.
[19] Mulder C, Wahlund LO, Teerlink T, et al. Decreased lysophosphatidylcholine/phosphatidylcholine ratio in cerebrospinal fluid in Alzheimer’s disease[J]. J Neural Transm(Vienna), 2003,110(8):949-955.
[20] Grimm MO, Gr?sgen S, Riemenschneider M, et al. From brain to food: Analysis of phosphatidylcholins, lyso-phosphatidylcholins and phosphatidylcholin-plasmalogens derivates in Alzheimer’s disease human post mortem brains and mice model via mass spectrometry[J]. J Chromatogr A, 2011,1218(42):7713-7722.
[21] Liu Y, Li N, Zhou L, et al. Plasma metabolic profiling of mild cognitive impairment and Alzheimer’s disease using liquid chromatography/mass spectrometry[J]. Cent Nerv Syst Agents Med Chem, 2014,14(2):113-120.
ProtectiveeffectofginsenosideReonbiomarkersinmicewithAlzheimer’sdisease
LIJing-yuan,WANGZhe,LINai-jing.
DepartmentofGerontology,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China;LIUYing.DepartmentofEmergencyMedicine,LaboratoryofPLAWoundandTraumaCenter,theGeneralHospitalofShenyangMilitary,Shenyang110016,China;LIWei.CollegeofPharmacy,ShenyangPharmaceuticalUniversity,Shenyang110016,China
ObjectiveTo investigate the effect of ginsenoside Re(G-Re) on biomarkers in an Alzheimer’s disease (AD) mouse model based on UPLC-MS, and to provide new ideas for traditional Chinese medicine treatment of AD.MethodsTwenty-four mice were randomly divided into control group, AD model group and G-Re treatment group with eight mice in each group. Pathological changes in the hippocampus were assessed by immunohistochemistry. UPLC/MS-based metabolomics was used to identify biomarkers which were differentially expressed in the brains of AD mice.ResultsThe hippocampal amyloid deposition increased in AD mice, and it was ameliorated by the treatment of G-Re. A total of 9 potential biomarkers were identified, which were associated with the metabolism of purine, amino acids, sphingolipids and lysophosphatidylcholines in AD mice. Compared to control group, the peak intensities of 9 biomarkers give a pronounced change in AD(P<0.05). G-Re treatment affected all these metabolic pathways.ConclusionsThese results indicate that G-Re can reduce the hippocampal amyloid deposition in AD mice by regulation of related brain metabolic pathways. In a word, G-Re plays a positive role in the treatment of AD.
ginsenoside Re; Alzheimer’s disease; biomarkers;ultra performance liquid chromatography-mass spectrometry
R 749.16
A
10.3969/j.issn.1003-9198.2017.10.007
2016-12-12)
國家自然科學基金(81203002)
110004 遼寧省沈陽市,中國醫科大學附屬盛京醫院干診科(李菁媛,王喆,李乃靜);110016 遼寧省沈陽市,沈陽軍區總醫院急診醫學部全軍重癥戰創傷救治中心實驗室(劉穎);110016 遼寧省沈陽市,沈陽藥科大學藥學院藥物分析教研室(李偉)
李乃靜,Email:lnjlw2003@163.com

