彩色馬鈴薯新品系花青素組分和含量的液質聯用分析
姜超,于肖夏,于卓*,高喆,張明飛,楊東升,石悅
(1.內蒙古農業大學農學院,內蒙古 呼和浩特 010000;2.內蒙古大學生命科學學院,內蒙古 呼和浩特 010000)
彩色馬鈴薯新品系花青素組分和含量的液質聯用分析
姜超1,于肖夏1,于卓1*,高喆2,張明飛1,楊東升1,石悅1
(1.內蒙古農業大學農學院,內蒙古 呼和浩特 010000;2.內蒙古大學生命科學學院,內蒙古 呼和浩特 010000)
為明確彩色馬鈴薯新品系蒙彩-01和蒙彩-02的塊莖花青素組分和含量的差異,對其新品種育成及花青素開發應用提供依據,以彩色馬鈴薯品種紅美作對照,利用高效液相色譜與質譜聯用技術,進行了塊莖花青素組分的定性和定量分析。結果表明:1) 對照品種紅美的塊莖花青素總含量為169.88 mg/100 g FW,共含4種花青素組分,即天竺葵素-3-蕓香糖苷、矢車菊素-3-香豆酰-葡萄糖苷、天竺葵素-3-阿魏酰-蕓香糖基-5-葡萄糖苷和天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷,其中天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷和矢車菊素-3-香豆酰-葡萄糖苷含量較高,分別占總花青素含量的48.95%和39.97%。2) 新品系蒙彩-01的塊莖花青素總含量為1051.65 mg/100 g FW,共含4種花青素組分,即矮牽牛素-3-香豆酰-蕓香糖苷、矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷、矮牽牛素-3-阿魏酰-蕓香糖基-5-葡萄糖苷和錦葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷。其中,矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷占總含量的79.14%,為主要組分。3) 新品系蒙彩-02的塊莖花青素總含量為159.41 mg/100 g FW,共含5種花青素組分,分別為矮牽牛素-3-香豆酰-蕓香糖苷、矮牽牛素-3-香豆酰-蕓香糖基--5-葡萄糖苷、矮牽牛素-3-阿魏酰-蕓香糖基-5-葡萄糖苷、芍藥素-3-咖啡酰-蕓香糖基-5-葡萄糖苷和芍藥素-3-香豆酰-蕓香糖基-5-葡萄糖苷,其中矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷含量最高(54.08%),芍藥素-3-咖啡酰-蕓香糖基-5-葡萄糖苷次之(24.06%)。綜上,2個彩色馬鈴薯新品系塊莖花青素組分和含量與對照品種紅美有明顯差別。
彩色馬鈴薯;新品系;花青素;組分;含量;液質聯用分析
花青素是一類天然水溶性色素,是目前世界上發現的最強效的自由基清除劑,具有很好的抗氧化功能和藥用價值。目前已知的花青素有20多種,常見的有6種:天竺葵色素、矢車菊色素、芍藥色素、飛燕草色素、矮牽牛色素和錦葵色素[1]。自然狀態下游離的花青素很少見,其多與糖基結合形成花色苷,廣泛存在于植物器官的細胞液中,使植物呈現繽紛色彩[2]。前人研究發現,天竺葵素表現為磚紅色,矢車菊素及芍藥素則表現為紫紅色,而飛燕草素、矮牽牛素和錦葵色素則呈現藍紫色系[3]。
彩色馬鈴薯(Solanumtuberosum)中含有豐富的花青素,因其適應性強、生產成本低、栽培范圍廣、生育期短等特點,近年來成為重要的天然色素和抗氧化劑來源之一[4]。關于彩色馬鈴薯花青素組分國外已有一些研究報道,但國內研究甚少。不同顏色彩色馬鈴薯塊莖花青素組分有一定差異,相同顏色不同基因型的彩色馬鈴薯塊莖花青素組分也有差異。Rodriguez-Saona等[6]在紅色馬鈴薯中發現了5種以天竺葵素為苷元的花青素。Lewis等[7]發現紅色馬鈴薯含有大量的天竺葵色素和少量的芍藥色素,而紫色馬鈴薯中則主要含有矮牽牛素和錦葵色素。Fossen[8]在紫色馬鈴薯中發現了3種矮牽牛素花青素和1種芍藥素花青素。楊智勇等[9]在紫色馬鈴薯“黑金剛”檢測出4種矮牽牛素花青素、2種芍藥色素衍生物和1種飛燕草素衍生物。彩色馬鈴薯的抗氧化活性強弱與花青素的含量高低呈正相關,約為普通馬鈴薯的3~5倍。
液質聯用技術(HPLC-MS)是20世紀90年代發展起來的一門綜合性分析技術,HPLC的高分離效能與MS的高靈敏度、高選擇性使之成為化合物未知組分研究中強有力的工具。大氣壓化學電離(Atmospheric Pressure Chemical Ionisation,API)、電噴霧電離(Electrospray Ionisation,ESI)、基質輔助激光解吸電離(Matrix-Assisted Laser Desorption Ionization,MALDI)、熱噴霧電離(Thermal Spray,TSP)和快速原子轟擊電離(Fast Atom Bombardment,FAB)等離子化方式以及各種多級質譜技術的出現,使該項技術日益成熟[10]。高效液相色譜串聯質譜技術具有靈敏度高、快速檢出的特點,克服了HPLC法缺少標準品的缺陷,顯著提高了花青素組分鑒定的準確性,是花青素定性和定量分析的先進手段。
本試驗用液質聯用技術,以彩色馬鈴薯品種紅美(Hongmei)為對照,對課題組育成的2個彩色馬鈴薯新品系蒙彩-01(Mengcai-01)和蒙彩-02(Mengcai-02)的塊莖花青素組分及其含量進行了分析,旨在明確不同材料花青素組分和含量的差異,為彩色馬鈴薯新品種選育及其花青素的開發應用提供依據。
1 材料與方法

圖1 供試材料塊莖薯皮薯肉特征Fig.1 Tuber shin and flesh characteristic of tested materialsA: 蒙彩-01 Mengcai-01; B: 蒙彩-02 Mengcai-02; C: 紅美Hongmei.
供試材料為課題組從“MIN-021×黑美人”雜交組合中選育出的彩色馬鈴薯優異新品系蒙彩-01(Mengcai-01)和從“紅彩×黑美人”雜交組合中選育出的優異新品系蒙彩-02(Mengcai-02),對照材料為彩色馬鈴薯品種紅美(Hongmei)。蒙彩-01塊莖為紫皮、黑紫肉,蒙彩-02塊莖為灰紫皮、紫色薯肉,由內蒙古農業大學農學院馬鈴薯育種研究中心提供;品種紅美塊莖薯皮薯肉均為紅色,由內蒙古馬鈴薯繁育中心李文剛研究員提供(圖1)。各材料種植于呼和浩特市賽罕區內蒙古農業大學農場,土壤為沙壤土,肥力中等,有灌溉條件,在各材料塊莖成熟后,分析花青素組分和含量。試驗于2016年5月至10月在田間和室內進行。
1.2方法
1.2.1彩色馬鈴薯花青素的提取 將供試馬鈴薯材料的塊莖用清水洗凈、晾干,切成小塊,在研缽內搗碎、研磨均勻。每種材料各取8 g放入用錫箔紙包裹避光的錐形瓶中作為提取物,加15 mL提取液(98 mL甲醇+2 mL甲酸),常溫下100 W超聲波處理30 min,5000 r/min離心5 min,吸取上清液,重復3次,合并3次離心后的上清液,用濾紙過濾除去蛋白質、不溶物,以及多糖,再經0.22 μm微孔濾膜過濾,置4 ℃冰箱中備用。
1.2.2花青素組分的定性分析 用WATERS ACQUITY UPLC I-CLASS/SYNAPT G2-SI液質聯用儀對塊莖花青素組分進行分析。質譜條件:正離子模式全掃描和自動二級離子掃描;掃描范圍(m/z)100~900 u;以氮氣作為干燥氣和噴霧氣,干燥氣溫度350 ℃,氮氣流速11.0 L/min,霧化氣壓35 psi;離子化方式為ESI+;所用的電離電壓為+4000 V,毛細管出口電壓106.0 V,八級射頻電壓振幅171 Vpp,skim電壓40.0 V。
1.2.3花青素組分的含量分析 采用Waters1525高效液相色譜儀(泵Waters1525、檢測器Waters 2998、自動進樣器2707)進行塊莖花青素組分的定量分析。色譜條件:色譜分析柱為TSK gel ODS-80 Ts QA(150.0 mm×4.9 mm,7 μm,Tosoh,Japan),保護柱C18柱(10.0 mm×4.9 mm,7 μm,Kromasil,Sweden);流動相A為10%含0.1%三氯乙酸的甲酸-水溶液,流動相B為15%甲醇-乙腈溶液,梯度洗脫條件見表1;流速1 mL/min,柱溫30 ℃,檢測波長525 nm,進樣體積20 μL。
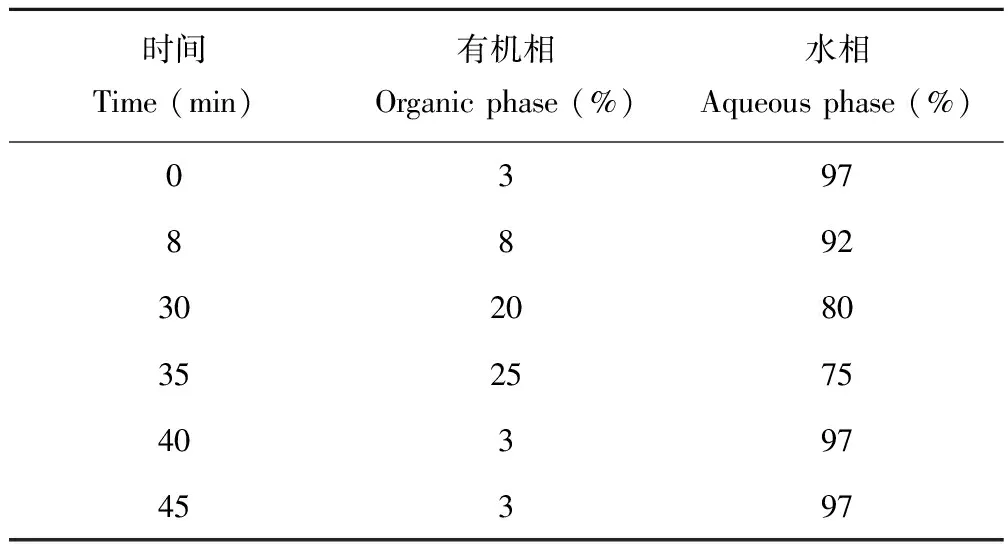
表1 梯度洗脫條件Table 1 The gradient elution program
1.2.4花青素組分定量分析的標準曲線繪制 標準品為矢車菊素-3-葡萄糖苷(Cyanidin-3-glucoside,Cy3G)。以質量濃度為橫坐標,測得峰面積為縱坐標,進行線性回歸,建立的標準曲線方程為:Y=92973X-20288,r=0.9995。其中,Y為色譜峰面積,X為矢車菊-3-葡萄糖苷的質量濃度,r為相關系數(>0.999),即花青素質量濃度與峰面積的線性關系緊密。將供試樣品中測得花青素成分峰面積代入標準曲線方程,計算各材料塊莖花青素總含量及各組分含量,花青素含量用mg/100 g FW表示。試驗重復3次。
施工前,提前1 h配制10 m3暫堵膠塞液體;施工時,先向油管內注入16 m3清水,適當平衡地層壓力,然后注入5 m3暫堵膠塞液體,并用5 m3清水將暫堵膠塞頂替至目的位,關井等待成膠;4 h后油壓由59 MPa降至29 MPa,暫堵壓井成功。后續采用不丟手帶壓更換主控閥技術完成了異徑法蘭和閥門更換后,向油管注入12 m3解堵液;解堵液與頂替液存在濃度差,使得解堵液逐漸與膠塞接觸,破膠、解堵,4 h后油壓逐漸恢復,氣井恢復產能,暫堵壓井獲得成功。
1.3統計分析
用統計軟件Excel和SPSS進行分析。
2 結果與分析
2.1彩色馬鈴薯塊莖花青素組分定性分析
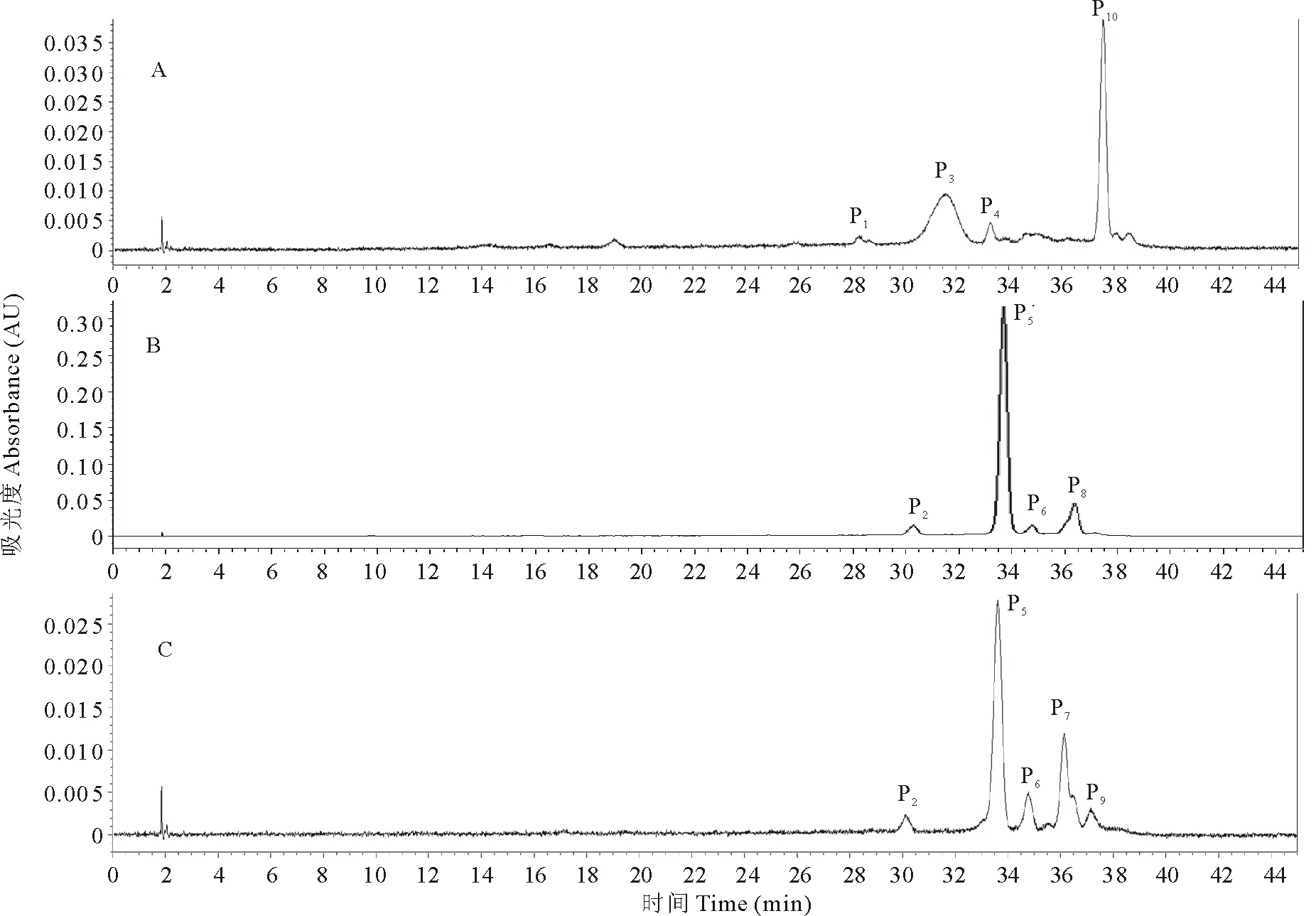
圖2 供試馬鈴薯材料塊莖花青素HPLC色譜圖(525 nm)Fig.2 The HPLC extracted chromatogram at 525 nm of tested colored potato tuber A:紅美 Hongmei; B:蒙彩-01 Mengcai-01; C:蒙彩-02 Mengcai-02.
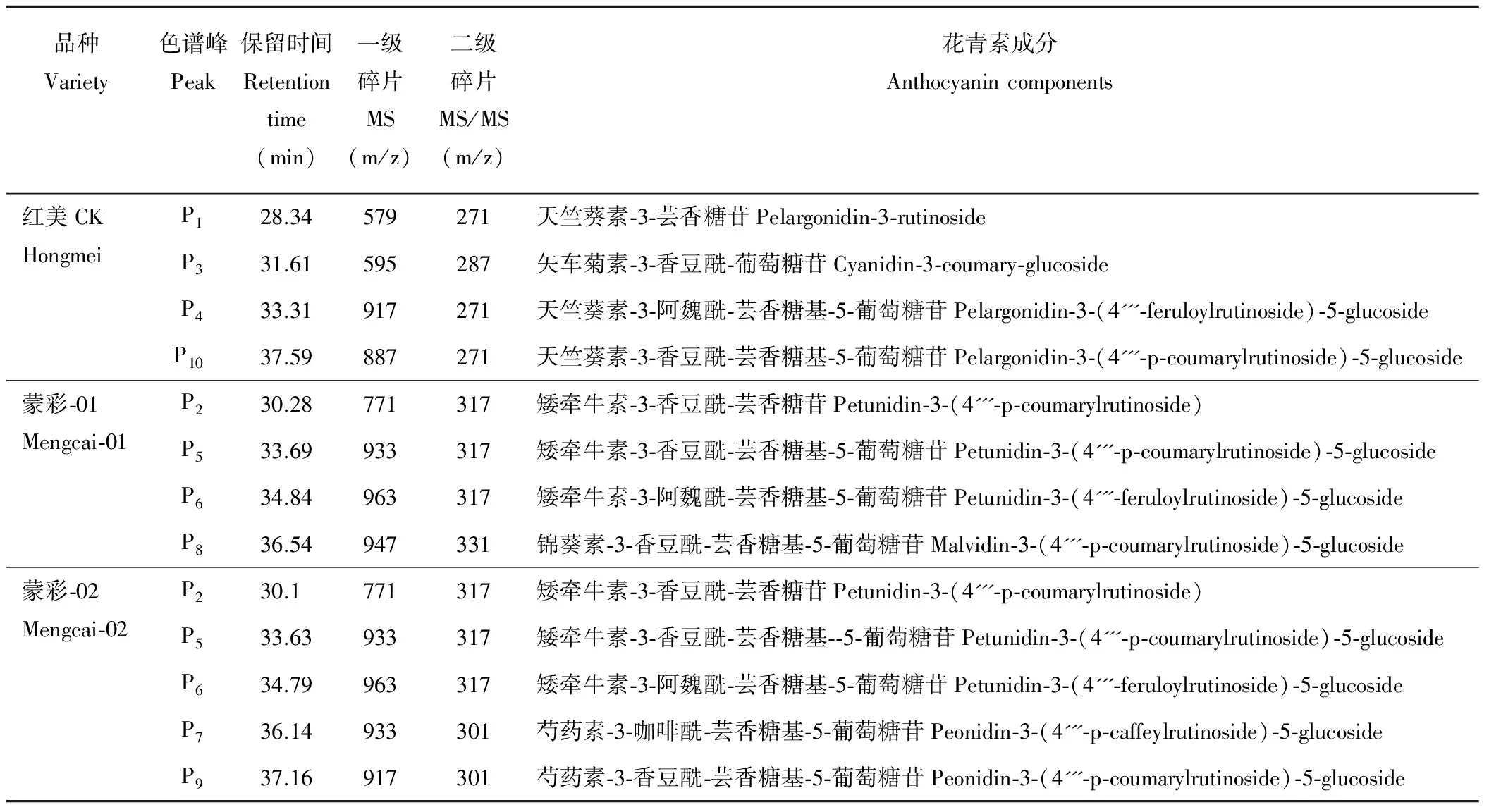
表2 彩色馬鈴薯塊莖花青素質譜參數及推斷結構Table 2 Mass spectrum data and tentative structures of anthocyanin detected in colored potato tuber
利用HPLC-MS方法對供試材料塊莖花青素組分鑒定結果見圖2和表2。3個彩色馬鈴薯材料共分離出10個有效峰,按保留時間順序命名為P1~P10,分別代表10個組分。對照品種紅美含P1、P3、P4和P10共4個組分;新品系蒙彩-01含P2、P5、P6和P8共4個組分,蒙彩-02含組分P2、P5、P6、P7和P9共5個組分。其中,組分P2、P5、P6為2個新品系的共有組分。
對色譜圖中的有效峰進行質譜分析得到含有不同質荷比的準分子離子峰及二級碎片離子,根據正離子模式下色譜峰的一級質譜的分子離子和二級質譜離子碎片,獲得化合物的準確分子量信息,分析每個譜峰,確定其分子量,并與文獻報道的組分相比較,推測出色譜峰的花青素組分。
組分P1:準分子離子峰的質荷比為[M]+=m/z579,子離子碎片質荷比為MS/MS=m/z271,與天竺葵素苷元相符,中性丟失質量308 Da,308為蕓香糖苷受到攻擊裂解成葡萄糖基(162)和鼠李糖基(146)而形成的中性碎片,據此推測組分P1的為天竺葵素-3-蕓香糖苷[11]。
組分P2:準分子離子峰的質荷比為[M]+=m/z771,子離子碎片質荷比為MS/MS=m/z317,為矮牽牛素衍生物,中性丟失質量454 Da,結合參考文獻分析[12],454基團由1分子脫水香豆酸(146)和1分子脫水蕓香糖(308)組成,因二糖基團被酰基化,質譜條件下容易從苷元上完整脫落,獲得單一的產物離子碎片,據此推測組分P2為矮牽牛素-3-香豆酰-蕓香糖苷。
組分P3:準分子離子峰為[M]+=m/z595,二級碎片離子為m/z449和m/z287。m/z287對應矢車菊素苷元,而m/z449對應于矢車菊素單己糖苷(m/z=449=287+162,162是己糖參與糖苷化脫去1分子水后的質荷比),常見的己糖包括葡萄糖和半乳糖,結合相關參考文獻分析[6],彩色馬鈴薯的花色苷成分中,己糖基團通常為葡萄糖,碎片離子m/z449來源于花色苷分子丟失質量146 Da所得(m/z=449=595-146),146可能是五碳糖或是香豆酸的中性碎片,由于馬鈴薯花色苷至今未發現含有五碳糖基,而馬鈴薯花色苷常酰化香豆酸,由此判斷失去的146是1分子脫水香豆酸,因此推測組分P3為矢車菊素-3-香豆酰-葡萄糖苷[14]。
組分P4:準分子離子峰[M]+=m/z917,二級碎片離子為m/z755、m/z433和m/z271,天竺葵素被1分子脫水葡萄糖取代得碎片離子m/z433(m/z=433=271+162),而m/z755則源于花色苷分子失去1分子脫水葡萄糖(m/z=755=917-162),且為天竺葵素經質荷比484的基團取代所得(m/z=755=271+484),結合參考文獻分析[15],m/z484由1分子脫水蕓香糖基(308)和1分子脫水阿魏酸(176)作為酰化基團,故推測組分P4為天竺葵素-3-阿魏酰-蕓香糖基-5-葡萄糖苷。
組分P5:準分子離子峰[M]+=m/z933,二級碎片離子為m/z771、m/z479和m/z317(圖3)。碎片離子m/z479對應矮牽牛素單葡萄糖苷(m/z=479=317+162),而m/z771則對應于花色苷分子失去1分子脫水葡萄糖(m/z=771=933-162),也是矮牽牛素被m/z454基團取代所得(m/z=771=317+454),與組分P2類似,m/z454基團由1個香豆酸(146)和1個蕓香糖基(308)組成,因此推斷組分P5為矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷[16]。
組分P6:[M]+=m/z963,二級碎片離子為m/z801、m/z479和m/z317,為矮牽牛素苷元,質譜碎裂方式與組分P4相似,推測為矮牽牛素-3-阿魏酰-蕓香糖基-5-葡萄糖苷[18]。
組分P7:準分子離子峰[M]+=m/z933,二級碎片離子為m/z771、m/z463和m/z301。m/z463為芍藥素單葡萄糖苷(m/z=463=301+162),m/z771為花色苷分子失去1分子脫水葡萄糖m/z=771=933-162),且為芍藥素被m/z470基團取代所得(m/z=771=301+470),m/z470基團由1個咖啡酸(162)和1個蕓香糖基(308)組成,故推測該組分為芍藥素-3-咖啡酰-蕓香糖基-5-葡萄糖苷[19]。
組分P8~P10:組分P8質譜數據為m/z947/785/493/331(圖3),為錦葵素衍生物;組分P9的質譜數據為m/z917/755/463和/301,為芍藥素苷元;組分P10的質譜數據為m/z887/725/433/271(圖3),為天竺葵素苷元。這3個組分質譜碎裂形式均與組分P5相似,據此分別指認為錦葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷[20]、芍藥素-3-香豆酰-蕓香糖基-5-葡萄糖苷和天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷[15]。
2.2彩色馬鈴薯塊莖花青素組分定量分析
依據花青素組分定量分析的標準曲線,對供試彩色馬鈴薯塊莖的花青素組分含量進行計算,結果如表3所示。新品系蒙彩-01的總花青素含量高達1051.65 mg/100 g FW,新品系蒙彩-02總花青素含量為159.41 mg/100 g FW,對照品種紅美的總花青素含量為169.88 mg/100 g FW,蒙彩-01、蒙彩-02與對照品種紅美間差異極顯著(P<0.01)。
新品系蒙彩-01和蒙彩-02共有的3種組分為矮牽牛素衍生物,其相對含量最高的組分均為矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷(P5),分別占其總花青素含量的79.14%(832.26 mg/100 g FW)和54.08%(86.21 mg/100 g FW)。此外,蒙彩-01含有1種錦葵素衍生物,即錦葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷(P8),含量為142.53 mg/100 g FW,占總含量的13.55%;蒙彩-02中含有2種芍藥素衍生物,即芍藥素-3-咖啡酰-蕓香糖基-5-葡萄糖苷(P7)和芍藥素-3-香豆酰-蕓香糖基-5-葡萄糖苷(P9),其中芍藥素-3-咖啡酰-蕓香糖基-5-葡萄糖苷的含量為38.35 mg/100 g FW,占24.06%。

圖3 部分彩色馬鈴薯花色苷結構及ESI正離子質譜圖Fig.3 Structures and MS spectra of anthocyanin extracted from the colored potato P5: 組分5 Component 5; P8:組分8 Component 8; P10:組分10 Component 10.
對照品種紅美含有3種天竺葵素衍生物和1種矢車菊素衍生物。這4個花青素組分中,天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷(P10)的含量最高,為83.16 mg/100 g FW,占花青素總量的48.95%;矢車菊素-3-香豆酰-葡萄糖苷(P3)次之,為67.91 mg/100 g FW,占39.97%。
3 討論
相關研究表明,顏色不同的彩色馬鈴薯塊莖花青素組分有一定差異,薯肉顏色呈紅色的馬鈴薯富含酰基化天竺葵素類和芍藥素類花青苷,而紫色馬鈴薯則含有酰基化的牽牛花素、飛燕草素、錦葵素、芍藥素的混合組分[21]。

表3 供試彩色馬鈴薯塊莖花青素組分含量Table 3 The anthocyanin content of tested colored potato tuber
注:不同小寫字母表示P<0.05水平差異顯著,不同大寫字母表示P<0.01水平差異極顯著。
Note: The different lowercase letters show significant difference atP<0.05, and the different capital letters show significant difference atP<0.01.
本試驗以本課題組育成的黑紫色和淺紫色薯肉的馬鈴薯品系蒙彩-01和蒙彩-02為材料,并以紅色薯肉的馬鈴薯品種紅美作對照,經液質聯用分析發現,蒙彩-01和蒙彩-02均含有3種矮牽牛衍生物,其中矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷組分含量最高,分別占各自總花青素含量的79.14%和54.08%,該組分在蒙彩-01中的含量為蒙彩-02中的9.7倍,這可能是二者塊莖薯肉分別呈現深黑紫色和淺紫色的原因所在。另外,新品系蒙彩-01還含有錦葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷(13.55%),但未檢測出飛燕草素和芍藥素這2種花青素衍生物;蒙彩-02中僅含有2種芍藥素衍生物,其占總花青素含量的29.83%,未發現有飛燕草素和錦葵素衍生物。這表明不同苷元的花青素組分也可能是導致2個紫色馬鈴薯品系薯肉顏色深淺不同的原因之一,此點有待深入研究。對照品種紅美(紅色薯肉)塊莖花青素中檢測出3種天竺葵素衍生物組分,占總花青素含量的60.03%,其中以天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷含量最高,占總含量的48.95%,表明它是決定塊莖薯肉呈紅色的主要色素組分之一,這與Lewis等[14]和胡艷梅等[27]的研究結果基本一致;此外,品種紅美塊莖花青素中還檢測出含量較高的矢車菊素-3-香豆酰-葡萄糖苷,其占總花青素含量的39.97%,表明該組分也是決定塊莖薯肉呈紅色的重要組分。
自然界花青素的穩定性與花色苷組成有關,一般認為所含花色苷種類越多,穩定性越強,而酰基化形式的花色苷往往比單純糖基取代方式占優勢[28]。本研究中,3個彩色馬鈴薯材料所含的花色苷種類主要為酰化雙糖基取代的形式,結構相對穩定。與藍莓、紫色甘藍和葡萄等天然色素資源相比較[29],彩色馬鈴薯種植較為簡單,且產量高,可作為天然色素的重要來源之一,尤其是新品系蒙彩-01,其總花青素含量高達1051.65 mg/100 g FW,具重要應用前景。
4 結論
1)彩色馬鈴薯新品系蒙彩-01和蒙彩-02均含有矮牽牛素-3-香豆酰-蕓香糖苷、矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷和矮牽牛素-3-阿魏酰-蕓香糖基-5-葡萄糖苷,其中矮牽牛素-3-香豆酰-蕓香糖基-5-葡萄糖苷為主要組分;此外,蒙彩-01特有錦葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷組分,蒙彩-02中特有芍藥素-3-咖啡酰-蕓香糖基-5-葡萄糖苷和芍藥素-3-香豆酰-蕓香糖基-5-葡萄糖苷2種組分。2)對照品種紅美含有天竺葵素-3-蕓香糖苷、天竺葵素-3-阿魏酰-蕓香糖基-5-葡萄糖苷、天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷和矢車菊素-3-香豆酰-葡萄糖苷3種組分,其中天竺葵素-3-香豆酰-蕓香糖基-5-葡萄糖苷和矢車菊素-3-香豆酰-葡萄糖苷為主要組分。3)新品系蒙彩-01塊莖花青素總含量高達1051.65 mg/100 g FW,蒙彩-02和對照品種紅美分別為159.41和169.88 mg/100 g FW,3個材料間差異極顯著。
References:
[1] Jiang C, Yu X X, Yu Z,etal. Nutritional quality, cytology and SSR analysis of new colored potato hybrid lines. Journal of Northeast Normal University: Natural Science Edition, 2016, 48(3): 126-134.
姜超, 于肖夏, 于卓, 等. 彩色馬鈴薯營養品質及染色體構型和SSR分析. 東北師范大學學報:自然科學版, 2016, 48(3): 126-134.
[2] Fang F. Anti-Prostate Cancer Effect of Anthocvanin Extracts from Purple Potato (SolanumtuberosumL.)inVitro[D]. Hangzhou: Zhejiang University, 2014.
方芳. 紫色馬鈴薯花色苷提取物體外抗前列腺癌[D]. 杭州: 浙江大學, 2014.
[3] Kong J M, Chia L S, Goh N K,etal. Analysis and biological activities of anthocyanins. Phytochemistry, 2003, 64(5): 923-933.
[4] Yin L Q, Peng Y Q, Zhong C,etal. Determination of anthocyanins composition of different pigmengted potato (SolanumtuberosumL). Journal of Food Science, 2015, 36(18): 143-147.
殷麗琴, 彭云強, 鐘成, 等. 高效液相色譜法測定8個彩色馬鈴薯品種中花青素種類和含量. 食品科學, 2015, 36(18): 143-147.
[5] Cui K S, Yu X X, Yu Z,etal. QTL location of anthocyanin content and yield in teraploid pigment potato. Acta Prataculturae Sinica, 2016, 25(5): 116-124.
崔闊澍, 于肖夏, 于卓, 等. 四倍體彩色馬鈴薯花青素含量及產量性狀的QTL定位. 草業學報, 2016, 25(5): 116-124.
[6] Rodriguez S L E, Giusti M M, Wrolstad R E. Anthocyanin pigment composition of red-fleshed potatoes. Journal of Food Science, 1998, 63(3): 458-465.
[7] Lewis C E, Walker J R L, Lancaster J E,etal. Changes in anthocyanins, flavonoids and phenolic acids in concentrations during development and storage of coloured potato (SolanumtuberosumL). Journal of the Science of Food and Agriculture, 1998, 79(2): 311-316.
[8] Fossen T. Anthocyanins from a norwegian potato cultivar. Food Chemistry, 2003, 81(2): 433-437.
[9] Yang Z Y, Li X S, Ma J Y,etal. Anthocyanin pomposition and content in “Heijingang” purple potato. Food Science, 2013, 34(14): 271-275.
楊智勇, 李新生, 馬嬌燕, 等. 紫色馬鈴薯“黑金剛”中花青苷組分和含量分析. 食品科學, 2013, 34(14): 271-275.
[10] Xu L L, An R, Wang X H. Application of liquid chromatography-mass spectrometry in traditional Chinese Medicine analysis. Chinese Traditional Patent Medicine, 2006, 28(2): 239-246.
許玲玲, 安睿, 王新宏. 液質聯用技術在中藥分析中的應用. 中成藥, 2006, 28(2): 239-246.
[11] Zhang C, Ma Y, Zhao X Y,etal. Determination of anthocyanins for purple potato by HPLC-MS. Science and Technology of Food Industry, 2011, 32(7): 417-422.
張超, 馬越, 趙曉燕, 等. 高效液相色譜-質譜法測定紫色馬鈴薯花色苷組成. 食品工業科技, 2011, 32(7): 417-422.
[12] Ishikura N. Anthocyanins in the flowers of Japanese garden iris belonging to ‘Higo’ line. Kumamoto Journal of Science Biology, 1978, 14(1): 9-15.
[13] Andersen M. Structure of petanin, an acylated anthocyanin isolated fromSolanumtuberosum, using homo-and hetero-nuclear two-dimensional nuclear magnetic tesonance techniques. Phytochemical Analsis, 1991, 2(5): 230-236.
[14] Lewis C E, Walker J R L, Lancaster J E,etal. Determination of anthocyanins, flavonoids and phenolic acids in potatoes Ⅰ: coloured cultivars ofSolanumtuberosumL. Journal of the Science of Food and Agriculture, 1998, 77(1): 45-57.
[15] Naito K, Umemura Y, Mori M,etal. Acylated pelargonidin glycosides from a red potato. Phytochemisry, 1998, 47(1): 109-112.
[16] Harborne J B. Plantp olyphenols—XI: the structure of acylated anthocyanins. Phytochemistry, 1964, 3(2): 151-160.
[17] Nerdal W, Andersen M. Intermolecular aromatic acidassociation of an anthocyanin (petanin) evidenced by two-dimensional nuclear overhauser enhancement nuclear magnetic resonance experiments and distance geometry calculations. Phytochemical Analsis, 1992, 3(4): 182-189.
[18] Fossen T, Andersen M. Anthocyanins from tubers and shoots of the purple potato,Solanumtuberosum. The Journal of Horticultural Science and Biotechnology, 2000, 75(3): 360-363.
[19] Fossen T, Ovstedal D O, Slimestad R,etal. Anthocyanins from a norwegian potato cultivar. Food Chemistry, 2003, 81(3): 433-437.
[20] Slimestad R, Aaberg A, Andersen M. Acylated anthocyanins from petunia flowers. Phytochemistry, 1999, 50(6): 1081-1086.
[21] Cristina A, Saavedra G, Pascual-teresas S D,etal. Identification of anthocyanins of pinta boca (Solanumstenotomum) tubers. Food Chemistry, 2004, 86(3): 441-448.
[22] Simirogiotis M J, Theoduloz C, Caligarri P D S,etal. Comparison of phenolic composition and antioxidant properties of two native chilean and one domestic strawberry genotypes. Food Chemistry, 2009, 113(2): 377-385.
[23] Hong V, Wrolsta D R E. Use of HPLC separation photodiodearray detection for characterization of anthocyanins. Food Chemistry, 1990, 38(3): 708-715.
[24] Reyes L F, Miller J C, Cisneros-zevallos L. Environmental condition influence the content and yield of anthocyanins and total phenolics in purple and red-flesh potatoes during tuber development. American Journal of Potato Research, 2004, 81(3): 187-193.
[25] Reyes L F, Miller J C, Cisneros-zevallos L. Antioxidant capacity, anthocyanins and total phenolics in purple and red-fleshed potato (SolanumtuberosumL.) genotypes. American Journal of Potato Research, 2005, 82(4): 271-278.
[26] Harborne J B. Plant polyphenols anthocyanin production in the cultivated potato. Biochemical Journal, 1960, 74(2): 262-269.
[27] Hu H M, Meng R R, Li Z,etal. Determination and analysis of total anthocyanin in colorful potatoes. Southwest China Journal of Agricultural Sciences, 2013, 26(37): 950-956.
胡艷梅, 孟然然, 李周, 等. 彩色馬鈴薯塊莖花色素苷分析測定. 西南農業學報, 2013, 26(37): 950-956.
[28] Luo X, Yang X, Su Y,etal. HPLC-MS determination of anthocyanins in pigmented tuber of potatoes. Seed, 2013, 32(7): 30-34.
羅弦, 楊雄, 蘇躍, 等. 彩色馬鈴薯品種塊莖花色苷HPLC-MS分析. 種子, 2013, 32(7): 30-34.
[29] Li M. Study on Component Analysis, Stability and Oxidation Resistance of Different Anthocyanins[D]. Nanjing: Nanjing University of Finance and Economics, 2013.
李敏. 不同花青素提取物的組成、穩定性及抗氧化性比較的研究[D]. 南京: 南京財經大學, 2013.
HPLC-MSanalysisofanthocyanincomponentsandcontentinnewstrainsofcoloredpotato
JIANG Chao1, YU Xiao-Xia1, YU Zhuo1*, GAO Zhe2, ZHANG Ming-Fei1, YANG Dong-Sheng1, SHI Yue1
1.AgronomyCollege,InnerMongoliaAgriculturalUniversity,Huhhot010000,China; 2.LifeScienceCollege,InnerMongoliaUniversity,Huhhot010000,China
To identify differences in anthocyanin composition and content in new varieties Mengcai-01 and Mengcai-02, and a control Hongmei and provide a foundation for colored potato breeding and the development and application of potato anthocyanin, qualitative and quantitative analysis of anthocyanin in each variety using high performance liquid chromatography-tandem mass spectrometry (HPLC-MS). The control variety Hongmei had a total anthocyanin content of 169.88 mg/100 g FW, and contained four anthocyanin components; pelargonidin-3-rutinoside, cyanidin-3-coumaryl-glucoside, pelargonidin-3-(4'''-feruloylrutinoside)-5-glucoside and pelargonidin-3-(4'''-p-coumarylrutinoside)-5-glucoside, of which pelargonidin-3-(4'''-p-coumarylrutinoside)-5-glucoside and cyanidin-3-coumary-glucoside were the main components, accounting for 48.95% and 39.97% of the total anthocyanin content, respectively. The new variety, Mengcai-01, had a total anthocyanin content of 1051.65 mg/100 g FW, and contained four anthocyanin components; petunidin-3-(4'''-p-coumarylrutinoside), petunidin-3-(4'''-p-coumarylrutinoside)-5-glucoside, petunidin-3-(4'''-feruloylrutinoside)-5-glucoside and malvidin-3-(4'''-p-coumar ylrutinoside-5-glucoside) of which petunidin-3-(4'''-p-coumarylrutinoside)-5-glucoside was the main component accounting for 79.14% of the total anthocyanin content. Mengcai-02 had a total anthocyanin content of 159.41 mg/100 g FW and contained five anthocyanin components; petunidin-3-(4'''-p-coumarylrutinoside), petunidin-3-(4'''-p-coumarylrutinoside)-5-glucoside, petunidin-3-(4'''-feruloylrutinoside)-5-glucoside, peonidin-3-(4'''-p-caffeylrutinoside)-5-glucoside and peonidin-3-(4'''-p-coumarylrutinoside)-5-glucoside, of which petunidin-3-(4'''-p-coumarylrutinoside)-5-glucoside was the most important followed by peonidin-3-(4'''-p-caffeylrutinoside)-5-glucoside was the second, accounting for 54.08% and 24.06% of the total anthocyanin content, respectively. In conclusion, there were clear differences of anthocyanin components between the two new colored potato strains and the control variety Hongmei.
colored potato; new strains; anthocyanin; composition; content; high liquid chromatography-tandem mass spectrometry analysis
10.11686/cyxb2017051http//cyxb.lzu.edu.cn
姜超, 于肖夏, 于卓, 高喆, 張明飛, 楊東升, 石悅. 彩色馬鈴薯新品系花青素組分和含量的液質聯用分析. 草業學報, 2017, 26(10): 99-107.
JIANG Chao, YU Xiao-Xia, YU Zhuo, GAO Zhe, ZHANG Ming-Fei, YANG Dong-Sheng, SHI Yue. HPLC-MS analysis of anthocyanin components and content in new strains of colored potato. Acta Prataculturae Sinica, 2017, 26(10): 99-107.
2017-02-17;改回日期:2017-05-22
內蒙古科技計劃重點項目(2016ZD),內蒙古自然科學基金博士基金(2014BS0324)和內蒙古自然科學基金重大項目(2013ZD03)資助。
姜超(1989-),女,遼寧阜新人,在讀博士。E-mail: jiangchao8905@sina.com
*通信作者Corresponding author. E-mail: yuzhuo58@sina.com

