鈣離子調控微絲切割蛋白中A6亞基解折疊的單分子力譜研究?
李鵬飛 曹毅 秦猛 王煒
(南京大學物理學院,固體微結構國家實驗室,南京 201193)
鈣離子調控微絲切割蛋白中A6亞基解折疊的單分子力譜研究?
李鵬飛 曹毅 秦猛?王煒
(南京大學物理學院,固體微結構國家實驗室,南京 201193)
在生命活動中,金屬離子扮演了非常重要的角色.微絲切割蛋白(adseverin)需要鈣離子的活化才能行使其切割肌動蛋白微絲的功能.本文通過基于原子力顯微鏡的單分子力譜研究了微絲切割蛋白C端末的A6亞基在結合鈣離子前后的力學解折疊機理.實驗結果顯示:在未結合鈣離子時,A6的解折疊表現為兩態過程;在結合鈣離子后A6力學穩定性顯著提高;同時,鈣離子的結合使得A6解折疊過程中出現穩定的中間態.通過對中間態的鏈長的分析,我們推測了中間態對應著A6的N端部分解折疊.而這一部分的解折疊可以使得掩藏在該結構后的A5亞基中肌動蛋白微絲結合位點暴露,從而促使微絲切割蛋白執行功能.我們的實驗結果為理解微絲切割蛋白的工作原理提供了新的實驗證據.
微絲切割蛋白,單分子力譜,解折疊,中間態
1 引 言
金屬離子在生命活動中扮演這非常重要的角色,例如鉀離子使神經纖維產生內外電位差并維持其穩定,使得神經電信號實現傳導,鎂離子能夠激活多種酶的活性,鈉離子能夠維持生物體的內環境的穩定.金屬離子與蛋白質的結合是很多蛋白質完成其生物功能的重要保證.鐵離子與血紅蛋白的結合使得氧運輸得以實現,銅離子與銅伴侶蛋白的結合使生物體能夠正常利用銅離子,促進鐵的吸收與利用[1].在生物體中,鈣離子同樣執行著非常重要的功能.鈣離子是骨骼構成的重要物質,同時,鈣離子對于維持肌肉正常的收縮-舒張也有至關重要的意義.鈣離子與凝溶膠蛋白的結合使其結構發生變化,暴露其肌動蛋白的結合位點從而被激活行使生物功能[2?4].同時,鈣離子與蛋白質的結合也可能使蛋白質本身的力學性質發生變化.有研究表明,一些蛋白質與鈣離子結合后,其本身的力學穩定性得到增強[5].本文利用基于原子力顯微鏡的單分子力譜方法,研究了受鈣離子調控的微絲切割蛋白的C端末端結構域(A6)的受力解折疊性質隨鈣離子結合的變化.
原子力顯微鏡單分子力譜技術是新興的能夠很好地研究分子本身力學性質以及分子間相互作用強度的手段[6?8],在高分子材料[9?11]、細胞生物學[12]、力化學等[13,14]方面也有廣闊的應用前景.其在生物大分子的研究方面,例如蛋白質的解折疊研究[15,16]、DNA和RNA性質研究[17?19]、生物分子間的相互作用研究[20,21]都有著很好的應用.通過單分子力譜,我們可以直接獲得所研究體系的力分布,同時,通過對所得力分布進行分析,根據Kramers方程,可以得到體系的壽命,解離常數(K0)以及轉變態長度(?x),進而通過Bell模型,得到體系的自由能分布[22?24].
微絲切割蛋白通過本身存在的肌動蛋白結合位點與微絲結合,執行對微絲切割、加帽活性以及成核的功能[25,26].在未結合鈣離子時,其結構無法與肌動蛋白契合,因此不能與微絲結合.結合鈣離子后,其結構發生變化,A4與A6兩個亞基能夠形成一個與肌動蛋白結構符合的面,進而執行其功能(圖1)[4].在其功能執行過程中,會受到微絲的牽引而受力,因此其力學穩定性對于其功能的實現具有重要的意義.微絲切割蛋白與肌動蛋白結合后,位于A5上的纖維形肌動蛋白結合及成核位點是被包埋住的[27],我們發現A6蛋白質在結合鈣離子后,其解折疊過程可能會出現穩定的中間態,從而在不影響A6與肌動蛋白結合的情況下,暴露出位于A5上的結合位點.
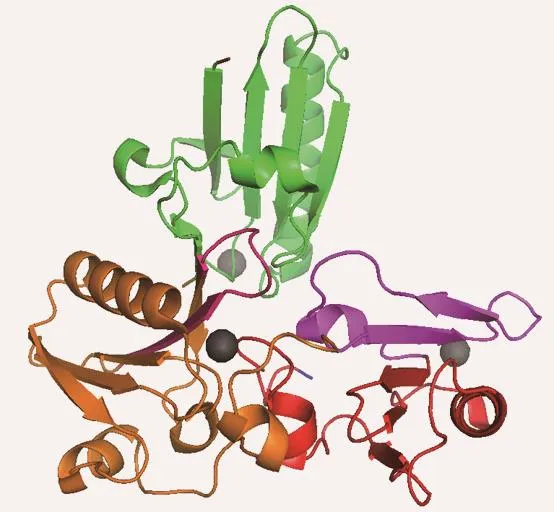
圖1 (網刊彩色)微絲切割蛋白中結合鈣離子后A4—A6結合域的三維結構圖(PDB ID:3FG6) 圖中黑色球體代表鈣離子;綠色、橙色以及紅色結構分別對應A4—A6;紫紅色部分為位于A5上的肌動蛋白結合及成核位點;紫色部分對應A6蛋白質解折疊的中間態打開部分;棕色位置為A4—A6的N端(甘氨酸396);藍色位置為其C端(色氨酸715)Fig.1.(color online)3D-structure of Ca-bound A4–A6 domain of adseverin(PDBID:3FG6). Ca2+ions are shown as black spheres;the amaranthine part in A5(orange)depicts the actin binding and nucleating module and the purple part corresponds to the unfolding segment in intermediate state of A6(red);the N-terminus of A4–A6 is shown in brown;while the C-terminus is shown in blue.
2 實驗方法
2.1 蛋白質載體構建及表達
A6與GB1融合蛋白的基因通過基因工程的方法構建.A6基因和GB1基因分別來自于Robert Robinson教授和Hongbin Li的實驗室.多聚蛋白基因通過限制性核酸內切酶BamHI及BglII產生的相同黏性末端連接來實現,在pUC19載體里完成構建.最終多聚蛋白基因通過測序確認,并轉入pQE80L載體,通過大腸桿菌BL-21菌株進行表達.由于表達載體上目的基因前端有6個組氨酸編碼,因此所得目的蛋白質N端會有六個組氨酸標記,能夠特異性地與鈷離子結合,純化過程使用鈷離子親和樹脂完成.之后,純化所得蛋白質溶液加入1 mmol EGTA去除鈣離子和其他金屬離子后在Tris緩沖液(25 mmol Tris,72 mmol氯化鈉,pH=7.4)中進行透析,4°C保存.
2.2 單分子力譜實驗
實驗通過原子力顯微鏡(ForceRobot 300,JPK,柏林,德國)實現,在Tris緩沖液中進行,結合鈣離子的A6解折疊實驗在緩沖液中加入1 mmol氯化鈣.實驗時,將150μL蛋白質溶液滴加到玻璃基板上,吸附20 min后使用Tris緩沖液沖洗掉多余的蛋白質,之后加入緩沖液即可進行實驗.實驗所用探針(Biolever-RC-150VB-70,Olympus)的勁度系數通過能量均分定理確定,其特征值為7 pN/nm.實驗所用拉伸速度為400 nm/s.
3 實驗結果與數據分析
我們構建了(GB1-A6)4(圖2(a))多聚蛋白進行單分子力譜.GB1與A6交疊連接,可以防止A6蛋白之間相互影響[28].蛋白質通過物理吸附的方式吸附在玻璃基板上,實驗時,原子力顯微鏡探針下壓到基板上時,有與蛋白質結合的概率,這樣抬起探針的過程中,蛋白質被拉伸,通過探測探針受蛋白質牽引的偏轉即可得到蛋白質解折疊過程的力響應.我們分別在無鈣離子以及含有1 mmol的溶液中對(GB1-A6)4進行了單分子力譜實驗.基于原子力顯微鏡的單分子力譜所得多聚蛋白質解折疊圖像為鋸齒狀峰,其形成原因為蛋白質本身是有結構的氨基酸殘基多聚分子,當受力解折疊后,轉變為被拉直的多肽鏈,釋放一段長度,其中GB1解折疊事件為間隔18 nm的峰,峰高約為150 pN.我們使用蠕蟲鏈模型擬合蛋白質分子鏈受力與拉伸距離的關系.在同一條力譜曲線上,如果觀察到GB1的特征峰,那么由于A6也在同一個多聚蛋白上,應觀察到其解折疊事件理應被觀察到.因此,在力譜圖中,GB1解折疊事件之前,間隔35 nm的峰即代表A6的解折疊.由于A6蛋白質擁有101個氨基酸殘基(微絲切割蛋白中614—715殘基),每個氨基酸殘基延伸長度為0.365—0.4 nm,A6折疊狀態N端到C端長度為3.5 nm,因此完全打開A6蛋白應該獲得33.4—36.9 nm的長度延伸,這與所得實驗結果是符合的.統計A6的解折疊事件,即可得到其解折疊力分布直方圖.結果顯示,在A6沒有結合鈣離子的情況下,其解折疊力平均值為25.4 pN±6.0 pN(平均值±標準差,n=99),在A6結合鈣離子的情況下,其解折疊力上升至44.7 pN±6.8 pN(n=164).這說明鈣離子的結合提高了A6蛋白質的力學穩定性.值得注意的是,探針吸附多聚蛋白的位置是隨機的,這使得所得數據并非一定包含所有結構域的解折疊事件[29].
在對A6解折疊事件進行分析的過程中,我們發現A6蛋白質在結合鈣離子情況下解折疊有時會存在中間態(圖3(a)).這意味著在結合鈣離子的情況下,A6蛋白質受力拉伸時,有分步完成解折疊的概率.該中間態的長度均為7.2 nm.同時對比中間態出現后的殘余A6部分的力學強度,我們認為解折疊中間態出現后,鈣離子并未從A6上脫落.根據單個氨基酸的長度0.365 nm估算,該中間態對應著長度約20個氨基酸的結構被打開,且剩余結構仍然有較高的力學強度.鈣離子通過644位的天冬氨酸以及666位的谷氨酸與A6結合.根據實驗結果分析其結構,我們發現只有從A6的N端(614位脯胺酸)到643位天冬氨酸打開符合所有條件(圖3(e)).同時對比A4—A6部分與肌動蛋白結合的情況,正是該部分結構對A5上的肌動蛋白結合位點的覆蓋使其被隔離,因此我們猜想當微絲切割蛋白與微絲結合,微絲切割蛋白受微絲牽引導致部分解折疊,暴露A5上的結合位點,從而使其激活了肌動蛋白成核功能.
對所得力分布使用Dudko-Hummer-Szabo方程,可以得到對應力條件下體系的壽命τ:
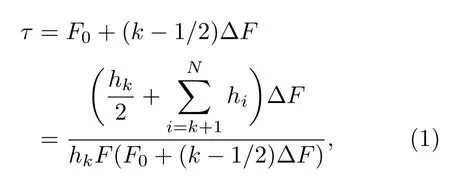
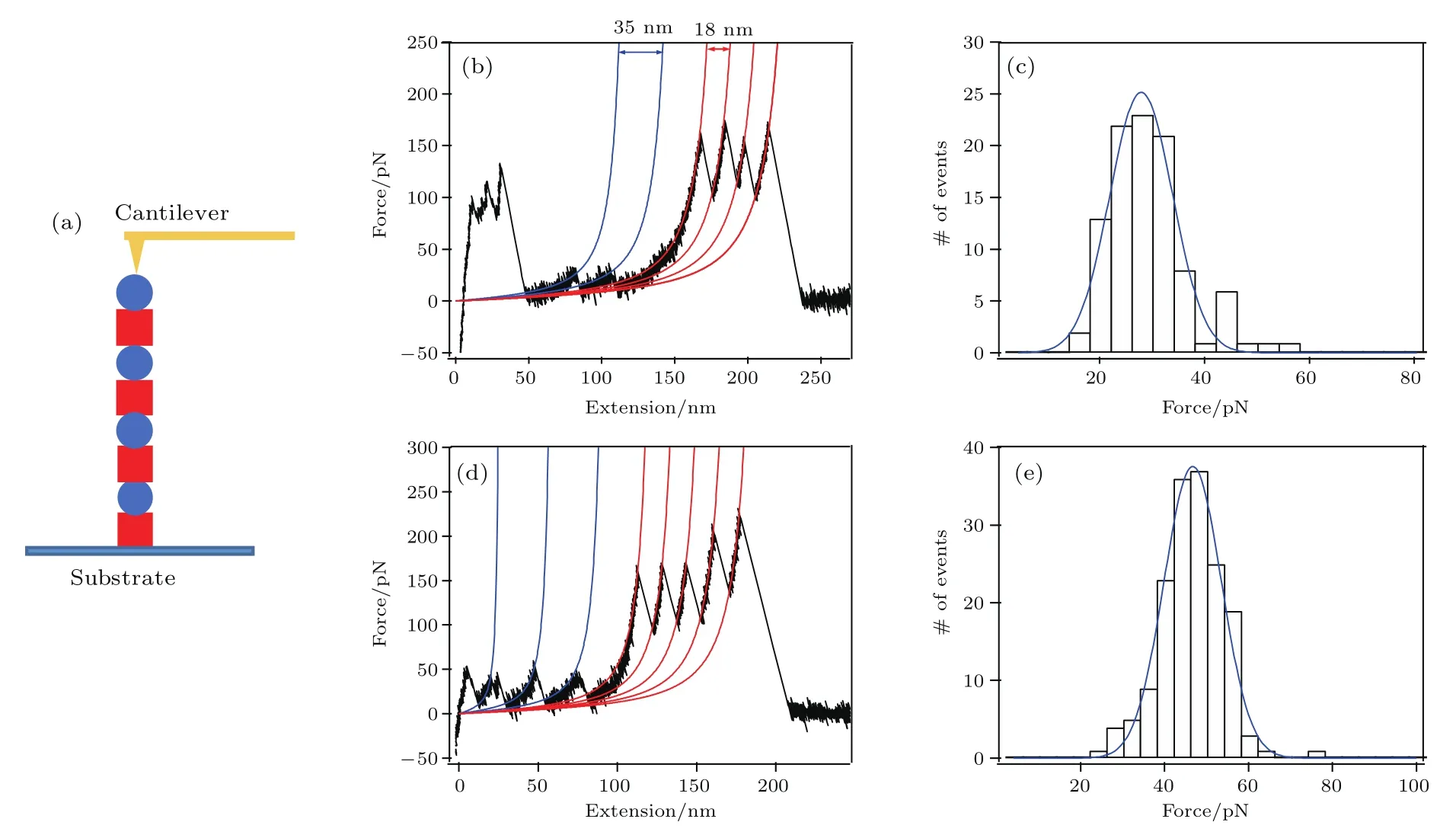
圖2 (網刊彩色)(GB1-A6)4的單分子力譜實驗結果 (a)(GB1-A6)4單分子力譜實驗示意圖,圖中紅色方塊代表GB1,藍色圓代表A6;(b)無鈣離子結合狀態下(GB1-A6)4的力譜圖,圖中藍色曲線為A6解折疊事件的蠕蟲鏈模型擬合曲線,紅色曲線為GB1解折疊的擬合曲線;(c)無鈣離子結合狀態下的A6解折疊力分布直方圖,藍色曲線為該分布的高斯擬合;(d)在1 mmol鈣離子緩沖液中(GB1-A6)4的力譜曲線圖;(e)1 mmol鈣離子緩沖液中A6解折疊力分布直方圖Fig.2.(color online)Mechanical properties of A6 probed by single-molecule AFM:(a)A schematic of polyprotein(GB1-A6)4used for single-molecule force spectroscopy experiment,red squares and blue circles represent GB1 and A6 domains,respectively;(b)typical unfolding trace for Ca-free(GB1-A6)4,worm-like chain fi tting curves for A6 and GB1 are shown in blue and red,respectively;(c)unfolding force histogram of Ca-free A6;(d)typical unfolding trace for Ca-bound(1 mmol Ca2+)(GB1-A6)4;(e)unfolding force histogram for Ca-bound A6.
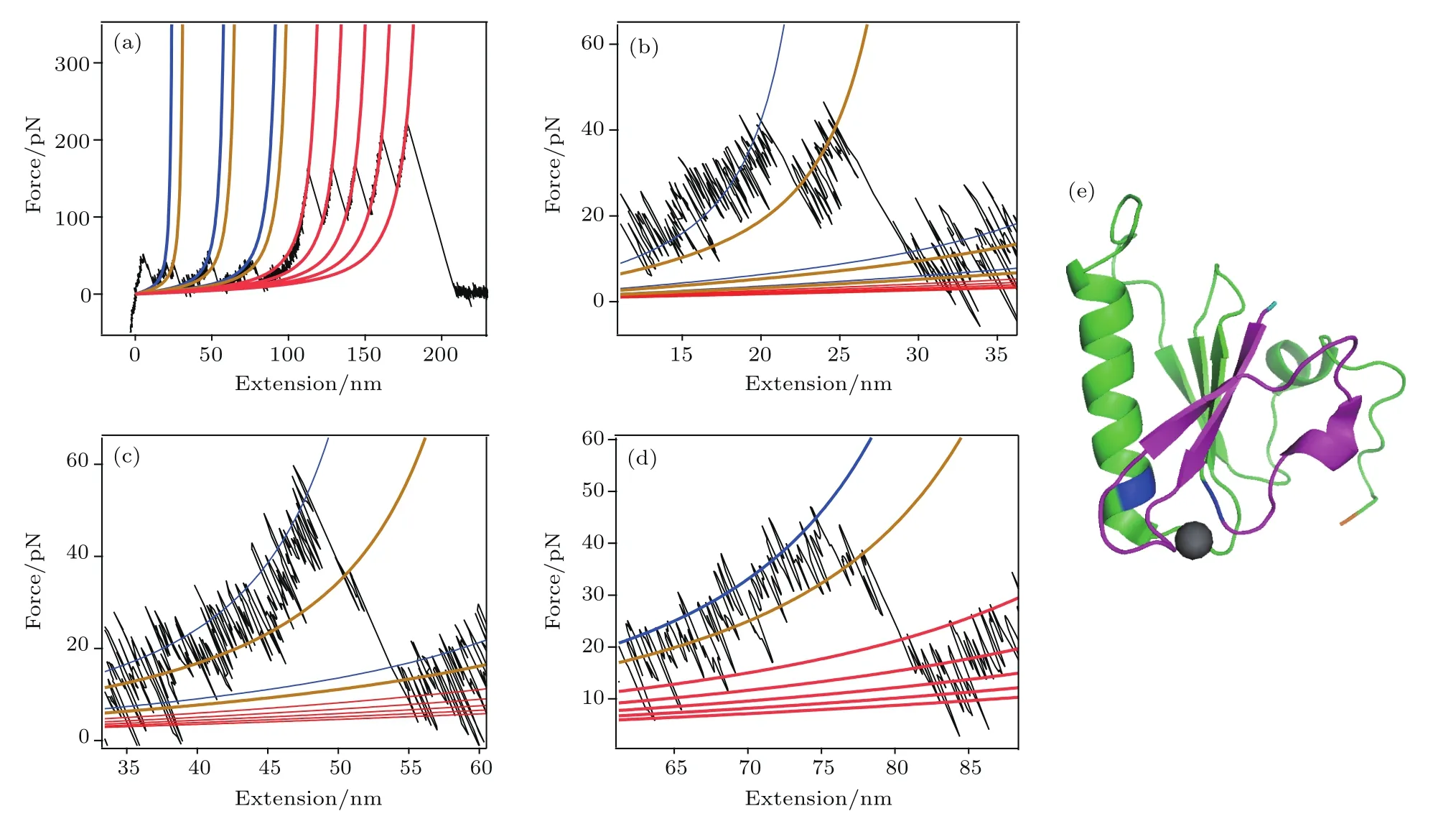
圖3 (網刊彩色)結合鈣離子情況下A6解折疊的中間態 (a)存在解折疊中間態的(GB1-A6)4單分子力譜曲線,藍色及棕色曲線分別為A6蛋白質兩步解折疊的蠕蟲鏈模型擬合曲線,紅色曲線為GB1解折疊的擬合曲線;(b)—(d)為(a)中A6解折疊力譜圖的放大圖;(e)A6的結構圖,紫色部分為猜想的解折疊中間態打開部分(614—643位氨基酸),藍色標注為A6上的鈣離子結合位點,分別為644位天冬氨酸以及666位谷氨酸,淺藍色位置為A6的N端(脯胺酸614),橙色位置為A6的C端(色氨酸725)Fig.3.(color online)The unfolding intermediate state of Ca-bound A6:(a)The unfolding trace for(GB1-A6)4with intermediate states appeared,blue and brown curves are the worm-like chain fi tting for two steps of A6 unfolding,respectively;(b)–(d)details of unfolding intermediate states of A6 in Fig.(a);(e)structure of A6,the proposed unfolded segment(residues 614–643)in intermediate state is shown in purple,and the Ca2+binding sites(Asp644 and Glu666)are shown in blue,N-terminus of A6 is shown in light blue(Pro614)and C-terminus is shown in orange(Trp715).
方程中F0為直方圖中力的開始點,N為直方總數,?F為每個直方的寬度,hk為第k個直方占總的比例,i與k為直方的編號,˙F為力的加載速率.
將所得體系的壽命-力關系(圖3(a))代入Krammers方程并聯立Bell模型進行擬合,即可得到體系在不受力情況下的壽命τ0以及轉變態長度?x:
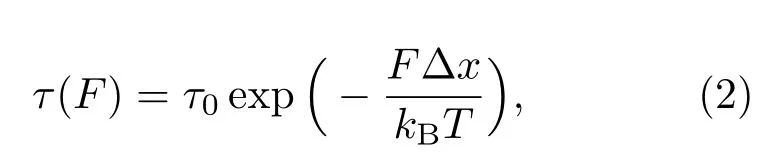
kB為玻爾茲曼常數,T為絕對溫度.
經擬合得到無鈣離子結合的情況下,A6蛋白質在不受力的情況下壽命τ0為0.5 ms,解折疊轉變態長度?x1為0.82 nm,在結合鈣離子的情況下,其壽命τ0提高至13.4 ms,解折疊轉變態長度?x不變.在有解折疊中間態的情況下,第一步解折疊的τ0及?x不變,第二步解折疊的τ0為4.9 ms,?x3為1.1 nm.
壽命τ0的倒數即為解離常數k0,由阿倫尼烏斯方程:
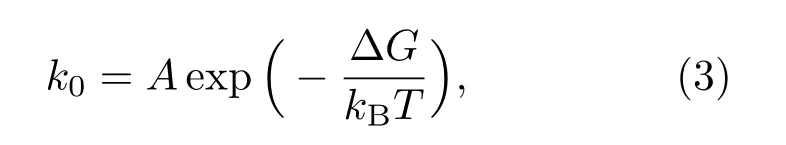
方程中?G為反應的自由能勢壘,A為表征自由能形面的指前因子,在本體系中,A取106s?1,經計算得無鈣離子結合時,A6蛋白質自發解折疊的自由能勢壘高度為6.2kBT,結合鈣離子情況下,A6蛋白質自發解折疊的自由能勢壘提高到9.5kBT,解折疊中間態第一步勢壘與其相同,第二步勢壘高度為8.5kBT.由計算結果可知,該中間態可相對穩定存在.由此可得到體系的自由能曲線,如圖4(b)所示.
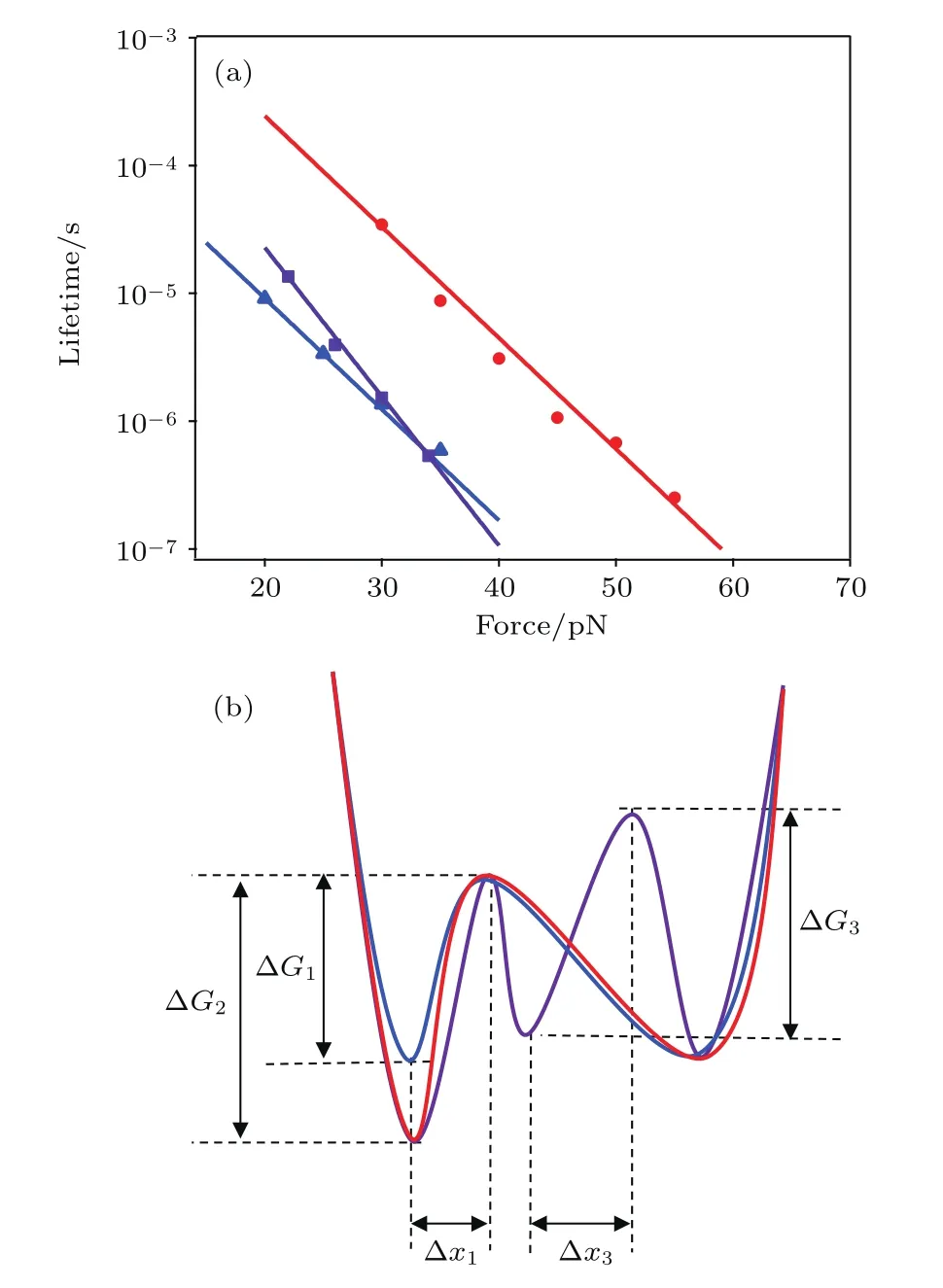
圖4 (網刊彩色)A6蛋白質在有無鈣離子結合情況下的壽命-力分布及自由能曲線 (a)藍色三角形代表無鈣離子結合情況下A6的壽命-力關系,紅色圓形代表結合鈣離子情況下的壽命-力分布,紫色方塊代表A6解折疊中間態第二步的壽命-力關系,圖中藍色、紅色以及紫色曲線分別為三種情況下的Krammers方程擬合;(b)圖中藍色曲線為無鈣離子結合情況下的A6蛋白質自由能曲線,紅色曲線則對應于結合鈣離子情況下無解折疊中間態的自由能分布,紫色曲線對應于結合鈣離子情況下有解折疊中間態的自由能分布Fig.4.(color online)The lifetime-force plot and unfolding free-energy landscape for A6 under Ca-free and Ca-bound conditions:(a)Blue,red and purple markers represent the lifetime-force relationships for Cafree,Ca-bound and second step for unfolding intermediate state of A6,and the corresponding colour curves represent the Krammers-analysis;(b)blue,red and purple curves represent the free-energy landscape for Ca-free,Ca-bound and condition of unfolding with intermediate state of A6.
4 結 論
本文通過單分子力譜結合蛋白質工程技術研究了微絲切割蛋白的A6亞基的力學解折疊.結果表明,A6蛋白在結合鈣離子之前,其穩定性較差.但結合鈣離子后,A6蛋白的力學強度及穩定性有明顯的提高.這使得微絲切割蛋白能夠穩定地執行其生物功能.同時A6蛋白質在結合鈣離子情況下受力可進入穩定的中間態,此中間態可能導致A5上的結合位點暴露,使其功能被激活.具體的驗證有待進一步的研究.
[1]Lee J,Pena M M,Nose Y,Thiele D J 2002J.Biol.Chem.277 4380
[2]Nag S,Larsson M,Robinson R C,Burtnick L D 2013Cytoskeleton70 360
[3]Silacci P,Mazzolai L,Gauci C,Stergiopulos N,Yin H L,Hayoz D 2004Cell Mol.Life Sci.61 2614
[4]Chumnarnsilpa S,Lee W L,Nag S,Kannan B,Larsson M,Burtnick L D,Robinson R C 2009Proc.Natl.Acad.Sci.USA106 13719
[5]Lü C,Gao X,Li W,Xue B,Qin M,Burtnick L D,Zhou H,Cao Y,Robinson R C,Wang W 2014Nat.Commun.5 4623
[6]Qian H,Chen H,Yan J 2016Acta Phys.Sin.65 188706(in Chinese)[錢輝,陳虎,嚴潔2016物理學報 65 188706]
[7]Zhang W K,Wang C,Zhang X 2003Chin.Sci.Bull.48 7(in Chinese)[張文科,王馳,張希 2003科學通報 48 7]
[8]Cui S X 2016Acta Polymerica Sinica2016(9)1160
[9]Feng W,Wang Z,Zhang W 2017Langmuir33 1826
[10]Zhang X,Zhang W K,Li H B,Shen J C 2000Prog.Nat.Sci:Nat.Key Lab.Newsletter10 385(in Chinese)[張希,張文科,李宏斌,沈家驄 2000自然科學進展:國家重點實驗室通訊10 385]
[11]Pang X C,Cheng B,Cui S X 2016Chinese Journal of Polymer Science34 578
[12]Yu X T,Yang Z B,Wang X Y,Tang M J,Wang Z Z,Wang H B 2016Prog.Biochem.Biophys.43 28(in Chinese)[于小婷,楊忠波,王鑫艷,湯明杰,王占忠,王化斌2016生物化學與生物物理進展43 28]
[13]Xue Y,Li X,Li H,Zhang W 2014Nat.Commun.5 4348
[14]Cheng B,Cui S X 2015Polymer Mechanochemistry369 97
[15]Yuan G,Le S,Yao M,Qian H,Zhou X,Yan J,Chen H 2017Angew.Chem.Int.Ed.Engl.56 5490
[16]Gao X,Qin M,Yin P,Liang J,Wang J,Cao Y,Wang W 2012Biophys.J.102 2149
[17]Feng W,Wang Z,Zhang W 2017Langmuir33 1826
[18]Luo Z,Cheng B,Cui S 2015Langmuir31 6107
[19]Yang Z J,Yuan G H,Zhai W L,Yan J,Chen H 2016Science China-Physics Mechanics Astronomy59 680013
[20]Schoeler C,Malinowska K H,Bernardi R C,Milles L F,Jobst M A,Durner E,Ott W,Fried D B,Bayer E A,Schulten K,Gaub H E,Nash M A 2014Nat.Commun.5 5635
[21]Pfreundschuh M,Alsteens D,Wieneke R,Zhang C,Coughlin S R,Tampe R,Kobilka B K,Muller D J 2015Nat.Commun.6 8857
[22]Dudko O K,Hummer G,Szabo A 2006Phys.Rev.Lett.96 108101
[23]Dudko O K,Hummer G,Szabo A 2008Proc.Natl.Acad.Sci.USA105 15755
[24]Bell G I 1978Science200 618
[25]Rodriguez Del Castillo A,Lemaire S,Tchakarov L,Jeyapragasan M,Doucet J P,Vitale M L,Trifaro J M 1990EMBO J.9 43
[26]Maekawa S,Sakai H 1990J.Biol.Chem.265 10940
[27]Marcu M G,Zhang L,Elzagallaai A,Trifaro J M 1998J.Biol.Chem.273 3661
[28]Cao Y,Lam C,Wang M,Li H 2006Angew Chem.Int.Ed.Engl.45 642
[29]Rief M,Gautel M,Oesterhelt F,Fernandez J M,Gaub H E 1997Science276 1109
Single molecule force spectroscopy study of calcium regulated mechanical unfolding of the A6 domain of adseverin?
Li Peng-FeiCao YiQin Meng?Wang Wei
(National Laboratory of Solid Structure,Department of Physics,Nanjing University,Nanjing 201193,China)
Adseverin is a member of calcium-regulated gelsolin superfamily existing in secretory cells,which functions as an actin severing and capping protein.Adseverin is comprised of six independently folded domains(A1–A6),sharing high sequence identity(60%)with that of gelsolin(G1–G6).Calcium binding can convert both adserverin and gelsolin from a globular structure into a necklace structure and expose the actin binding sites.However,compared with gelsolin,adseverin lacks a C-terminal extension.Our previous single molecule force spectroscopy studies indicated that the C-terminal helix is critical to the force regulated calcium activation of gelsolin.It remains largely unexplored how the calcium binding to adseverin is regulated by force.
Here,using atomic force microscopy based single molecule force spectroscopy,we demonstrate that the mechanical unfolding of the sixth domain of adseverin(A6)can be signi fi cantly a ff ected by calcium binding.In order to identify the unfolding events of A6 unambiguously,we construct a hetero-polyprotein(GB1-A6)4,in which A6 is spliced alternatively with well-characterized protein domain GB1.Therefore,in the force-extension traces,GB1 unfolding events can serve as a fi ngerprint to identify the unfolding signature of A6.
In the absence of calcium,the unfolding traces for(GB1-A6)4show two distinct categories of events.The higher force events with unfolding forces of~180 pN and contour length increments of~18 nm correspond to the unfolding of GB1.The other category of events with lower unfolding forces of~25 pN and contour length increments of~35 nm are attributed to the mechanical unfolding of A6.The unfolding force for A6 is similar to that for the structural homological protein,G6.
However,in the presence of calcium ion,the unfolding force of A6 is dramatically increased to~45 pN,indicating that the structure of A6 can be mechanically stabilized by calcium ion-binding.Moreover,we observe a clear mechanical unfolding intermediate state for the unfolding of calcium bound A6(holo A6).Upon stretching,holo A6 is fi rst partially unfolded to an intermediate state with a contour length increment of~7.2 nm.Then,the intermediate state is unfolded to release a contour length of~27.8 nm.The total contour length change is the same as that for the calcium free A6(apo A6).Because each amino acid in the unfolded structure corresponds to a contour length increment of 0.365 nm,according to the contour length change,we infer that in the unfolding intermediate state of A6,its N-terminal regions is partially unfolded.This leads to the exposure of the cryptic actin binding site on A5,which is otherwise buried in the folded structure of A6.The force regulated activation mechanism for A6 is similar to that for G6,except that they use di ff erent sequences from those in the force-sensitive region.In G6 the C-terminal helix serves as the force-responsive tail to regulate actin binding,while in A6 the N-terminal sequences are unstructured upon stretching to promote the actin binding for adseverin.
Therefore,we infer that force may be an important regulator for the actin-binding of all members in the gelsolin family proteins,including adseverin and gelsolin.Our study represents an important step towards the understanding of the function of adseverin at a molecular level.
adseverin,single molecule force spectroscopy,unfolding,intermediate state
8 May 2017;revised manuscript
30 June 2017)
(2017年5月8日收到;2017年6月30日收到修改稿)
10.7498/aps.66.196201
?國家自然科學基金(批準號:21522402,11674153,11374148,11334004)和國家重點基礎研究發展計劃(批準號:2013CB834100)資助的課題.
?通信作者.E-mail:qinmeng@nju.edu.cn
?2017中國物理學會Chinese Physical Society
PACS:62.25.–g,64.60.Q–,68.37.Ps
10.7498/aps.66.196201
*Project supported by the National Natural Science Foundation of China(Grant Nos.21522402,11674153,11374148,11334004)and the National Basic Research Program of China(Grant No.2013CB834100).
?Corresponding author.E-mail:qinmeng@nju.edu.cn

