DCE-MRI在胰腺神經內分泌腫瘤術前分級中的應用
趙娓娓, 任靜, 印弘, 宦怡
·國家自然科學基金專欄·
DCE-MRI在胰腺神經內分泌腫瘤術前分級中的應用
趙娓娓, 任靜, 印弘, 宦怡
目的初步探討動態對比增強磁共振成像(DCE-MRI)在胰腺神經內分泌瘤(pNETs)術前分級中的應用價值。方法搜集2014年5月~2016年4月經手術病理證實的pNETs患者20例(25個病灶),其中G1期病灶14個,G2期10個,G3期1個,將G1期病灶歸為G1 pNETs組,G2期病灶歸為G2 pNETs組,由于G3期病灶僅1例暫未做入組分析。所有患者禁食禁水4 h后行DCE-MRI掃描。數據被傳輸到Research-DCEMRI Tool診斷分析工作站,測定各定量灌注參數-轉運常數(Ktrans)、速率常數(Kep)、細胞外血管外間隙百分比(Ve)及血漿容量百分比(Vp)。采用獨立樣本t檢驗分析不同級別pNETs定量灌注參數的差異,P<0.05表示差異有統計學意義。繪制定量參數的受試者工作特征曲線(ROC曲線),計算其在pNETs分級中的診斷效能。結果不同分級pNETs的Ktrans值和Kep值分別比較,差異均有統計學意義(P=0.014和P=0.025);不同分級pNETs的Ve值和Vp值分別比較,均無統計學差異(P=0.786和P=0.522)。Ktrans、Kep值的ROC曲線下面積(AUC)分別為0.782和0.771,Ktrans取界值為0.714時其敏感度、特異度分別為70.00%、85.71%,Kep取界值為1.721時其敏感度、特異度分別為60.00%、92.86%。結論DCE-MRI的Ktrans、Kep值可初步用于定量、無創評估pNETs分級,尤其Ktrans值在分級診斷中效能較高。
胰腺; 神經內分泌瘤; 磁共振成像; 腫瘤分級
胰腺神經內分泌腫瘤(pancreatic neuroendocrine neoplasms,pNETs)是一類起源于肽能神經元和神經內分泌細胞的異質性腫瘤,發病率逐年升高,達1.0~10萬分之3.0[1,2]。2006年及2010年,歐洲神經內分泌腫瘤學會(ENETS)和世界衛生組織(WHO)根據核分裂像計數和Ki-67指數將pNETs分為G1、G2、G3[3,4],以預測腫瘤的“惡性程度”。臨床上良性pNETs可經腹腔鏡手術,有惡性可能者應選擇開放性手術,并建議淋巴結清掃[5]。所以術前準確分期分級尤為重要。傳統的影像學檢查方法不足以滿足該需求,而穿刺活檢對于位置較深的胰腺有一定難度且具有創傷性。近年來發展起來的動態對比增強磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)可通過所獲得的血流動力學參數無創、定量評價組織的血流灌注情況,有望鑒別腫瘤的良、惡性及臨床分期、分級[6-10]。本研究旨在通過比較不同級別pNETs定量灌注參數的差異,初步探討DCE-MRI定量參數在pNETs術前分級中的價值。
材料與方法
1.受試者
該研究得到了倫理委員會的同意,簽訂了知情同意書。從2014年5月-2016年4月搜集pNETs患者20例,均經手術病理證實。其中男9例,女11例,年齡范圍24~68歲,平均年齡49.1歲。其中18例患者為單發病灶,2例患者為多發病灶,病灶數共25個,最大徑范圍為0.8~5.4 cm。其中胰頭病灶12個,胰頸4個,胰體5個,胰尾4個;G1期病灶14個,G2期10個,G3期1個。將G1期病灶歸為G1 pNETs組,G2期病灶歸為G2 pNETs組,由于G3期病灶僅1例暫未做入組分析。所有患者于DCE-MRI檢查前未行任何治療,不合并影響胰腺的其他疾患。患者掃描前禁食4 h,掃描前10 min肌注山莨菪堿10 mg(654-2,杭州民生藥業有限公司,中國)。
2.MRI掃描設備及參數
胰腺MRI掃描采用本院全身3.0T MR掃描儀(Discovery MR750,GE,美國),八通道相控陣體部線圈。首先行3D梯度回波序列的T1掃描,用可變的反轉角方法計算T1mapping,參數如下:TR 3.2 ms,TE 1.5 ms,翻轉角3°、6°、9°、12°,層數60,層厚4 mm,矩陣260×160,視野360 mm×360 mm。然后,用3D快速梯度回波序列行DCE-MRI掃描,參數如下:TR 3.2 ms,TE 1.5 ms,翻轉角12°,視野360 ×360 mm,矩陣260×160,層厚4 mm,層數60,帶寬83.33 Hz/pixel,掃描時間8 s/期,共掃描40期,總用時320 s。掃描3期后以濃度0.1 mmol/kg、流率2 mL/s團注對比劑Gd-DTPA-BMA(歐乃影,GE藥業,中國),之后立即用20 mL生理鹽水沖管。
3.數據分析
將DCE-MRI圖像傳輸到工作站,采用Research-DCEMRI Tool(Omni Kinetics,Version 2.00,GE藥業,中國上海)軟件分5步完成數據分析:①配準圖像,以減少運動呼吸偽影;②將反轉角圖像載入,然后將配準的圖像載入;③在腹主動脈上畫取感興趣區(regions of interest,ROI)并計算動脈輸入函數(arterial input function,AIF);④在相應病灶區域多層面多點手動畫取ROI,將所得的數值求平均值作為各參數的最終結果,根據腫瘤的形態不同,ROI為圓形、橢圓形或不規則形,畫取ROI時避開血管、壞死囊變區,避免緊貼病灶或胰腺組織邊緣;⑤選擇Extended Tofts Linear模型計算定量參數(轉運常數-Ktrans,流率常數-Kep,細胞外血管外間隙百分比-Ve,血漿容量百分比-Vp)。
4.統計學分析
用SPSS 19.0軟件行統計學分析。應用獨立樣本t檢驗評估不同級別pNETs灌注的差異。結果用均數±標準差表示,P<0.05為差異有統計學意義。用MedCalc (v12.3.0.0英文版)軟件繪制定量參數值的受試者工作特征(receiver operator characteristics,ROC)曲線,計算其在pNETs分級中的診斷效能。
結 果
1.不同病理分級pNETs的DCE-MRI圖像特征
G1和G2期pNETs均表現為富血供、高滲透性占位,G2期pNETs較G1期病灶異質性更高(圖1、2)。
2.不同病理分級pNETs的DCE-MRI定量參數比較
G1和G2期pNETs組間比較發現,Ktrans、Kep差異有統計學意義,Ve、Vp差異無統計學意義(表1)。
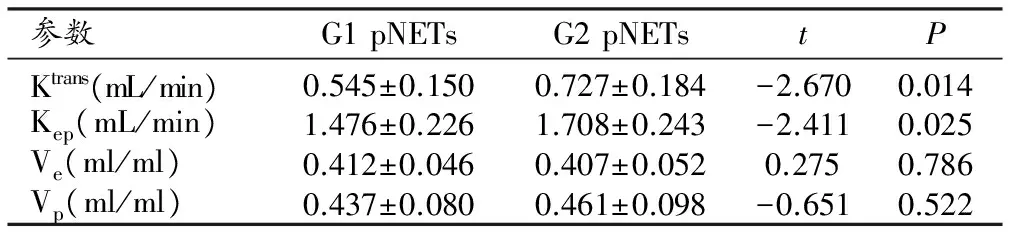
表1 G1和G2期pNETs的DCE-MRI定量參數比較
3.DCE-MRI定量參數在pNETs分級中的診斷效能
采用ROC曲線評價Ktrans和Kep在pNETs分級的診斷效能,曲線下面積(area under the curce,AUC)分別為0.782和0.771(圖3)。當Ktrans取閾值為0.714時,約登指數最大(0.4935),此時敏感度為70.00%、特異度為85.71%。當Kep取閾值為1.721時,約登指數最大(0.5286),此時敏感度為60.00%、特異度為92.86%。
討 論
pNETs是源于胰腺多能神經內分泌干細胞的一類腫瘤,過去認為是罕見病的pNETs發病率逐年升高,已達10萬分之1.0~3.0,成為一類嚴重影響人類健康的疾病[1,2,11]。pNETs惡性程度相對較低,腫瘤生長緩慢,手術切除是目前公認的最有效的治療方法[12,13]。然而不同惡性程度腫瘤手術方式不同,良性者僅需單純腫瘤摘除術[14],惡性潛能及惡性者需節段胰腺切除術,甚至部分聯合臟器切除術,并建議淋巴結清掃[5,15]。為此術前準確分期分級是制定精準處理方案的前提。隨著影像技術的進步及診斷水平的提高,常規影像(如超聲內鏡、CT、MRI等形態學成像模式)
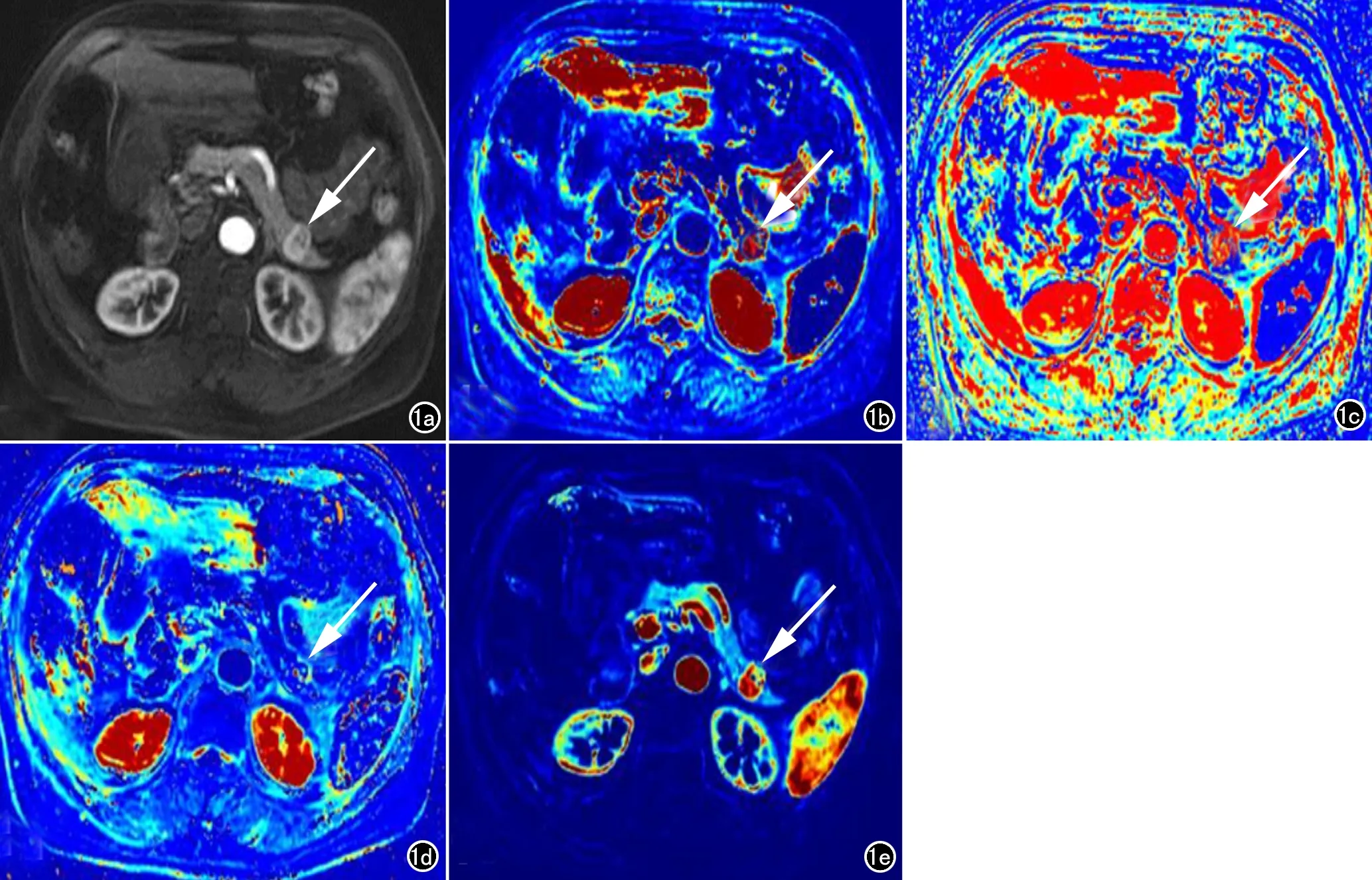
圖1 女,68歲,G1期pNETs。a) 增強圖像示胰尾部明顯強化結節(箭); b) Ktrans圖(Ktrans=0.599)示胰尾部強化結節呈高滲透性(箭); c) Kep圖(Kep=1.441)示胰尾部強化結節呈高滲透性(箭); d) Ve圖(Ve=0.416)示胰尾部異常結節細胞外血管外間隙百分比呈中等程度(箭); e) Vp圖(Vp=0.463)示胰尾部病灶血管豐富(箭)。
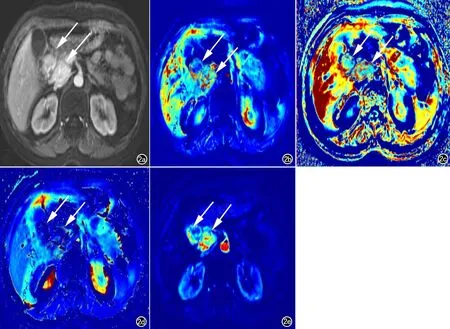
圖2 女,54歲,G2期pNETs。a) 增強圖像示胰頭部兩個明顯強化包塊(箭); b) Ktrans圖(Ktrans=0.722,0.734)示胰頭部強化包塊呈高滲透性(箭);c) Kep圖(Kep=1.783,1.771)示胰頭部強化包塊呈高滲透性(箭); d) Ve圖(Ve=0.406,0.413)示胰頭部異常包塊細胞外血管外間隙百分比呈中等程度(箭);e) Vp圖(Vp=0.438,0.453)示胰頭部病灶血管豐富。
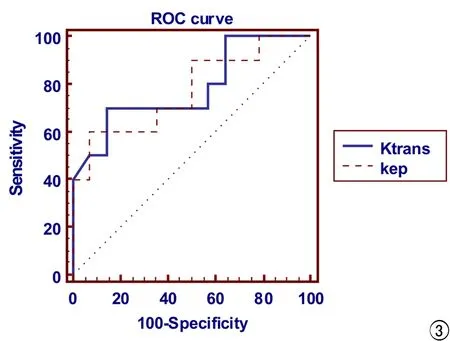
圖3 Ktrans和Kep對pNETs分級診斷效能的ROC曲線。
診斷pNETs的敏感度、特異度逐年提高,然在分級診斷方面仍處于探索階段。因此,探尋可用來評價pNETs病理分級的無創、可重復進行的影像學方法,具有潛在的臨床應用價值和優勢。
近年來發展起來的DCE-MRI是一種根據病變中異常的血管來評估病變組織生理特性的功能磁共振成像技術,通過一定的藥代動力學模型可獲得一系列定量、半定量參數,來評估腫瘤組織血管密度、完整性、滲透性以及相關的生理學信息,不僅可提供病變形態學的信息,還可以反映出病變微循環等功能方面的改變[16,17]。其在腫瘤病理分級中的應用日益受到關注,已被用于腦膠質瘤、乳腺癌、宮頸癌、前列腺癌等腫瘤的研究[7-10],但在pNETs分級中的應用鮮見報道。根據核分裂像計數和Ki-67指數的高低可將pNETs分為G1、G2和G3 3級[3,4],不同分級的腫瘤具有不同的生物學特性,且對比劑在不同病理組織中的藥代動力學亦不同,故DCE-MRI有望反映不同組織分級pNETs的本質差異。為此,本研究旨在應用DCE-MRI功能成像技術評價不同病理分級pNETs定量灌注參數的差異,并探討該定量灌注參數在pNETs術前分級中的診斷效能。
腫瘤對小分子對比劑(Gd-DTPA)的吸收和滯留主要取決于血流量、血管壁通透性和血管外細胞外間隙的大小[18]。Ktrans代表對比劑從血管內擴散到血管外細胞外間隙(Extravascular extracellular space,EES)的速率,Kep代表對比劑從EES回流到血管內的速率,這兩者都與毛細血管通透性有關,而Ktrans還受組織內血流灌注量和毛細血管表面積的影響。本研究發現,G2期pNETs的Ktrans值高于G1期病灶,同時G2期pNETs的Kep值也高于G1期pNETs,提示隨著pNETs級別增加,其微循環灌注更豐富、新生腫瘤血管更多、滲透性更強。這一結果與其它腫瘤研究結果一致。朱海濱等[9]研究發現前列腺癌的Ktrans與其Gleason評分呈正相關,即前列腺癌分化越差則其Ktrans值越大。Koo等[8]發現與低級別乳腺癌相比,高級別乳腺癌的Ktrans和Kep值均較高。孫勝杰等[7]發現隨著膠質瘤的級別增高,其Ktrans值相應增加導致Ktrans和Kep值隨腫瘤惡性程度增高而增加的原因可能是腫瘤細胞增殖越旺盛,其誘導微血管生成的能力越強,新生血管的異型性也越大,導致其微循環灌注及滲透水平均增高。另一方面微循環灌注及滲透水平增高又為腫瘤迅速生長提供了更多的物質營養,反過來又促進腫瘤細胞進一步增殖活躍,形成惡性循環。
Ve代表EES容積百分比,約等于Ktrans和Kep的比值。以往研究表明隨腫瘤惡性程度增高,Ve值可增加[6]或降低[7]。本研究發現中-高級別pNETs的Ve值略低于低級別pNETs,但無統計學意義。這可能與不同腫瘤的組織結構、病理特征不同有關。Vp代表血漿容積百分比。本研究發現中-高級別pNETs的Vp值略高于低級別pNETs,但無統計學意義。結合不同級別pNETs的Ktrans值的差異,進一步表明隨著pNETs核分裂像增加和Ki-67增殖指數的升高,其腫瘤局部新生血管的異型性也越大,血管滲透性越高。
本研究中Ktrans在pNETs分級診斷中的ROC曲線下面積為0.782,且取界值0.714時其敏感度、特異度分別為 70.00%、85.71%,提示其相較其他3個參數在pNETs分級診斷中效能最高。
本研究也有一些不足之處。首先,由于pNETs發病率相對較低,該研究的病例數相對較少,特別是 G3期僅1例患者,故未對G3期患者行入組分析,隨著病例的進一步搜集,我們將細分為G1、G2、G3組進一步分析。另外,在不同體系和不同掃描方案下,DCE-MRI結果的穩定可重復性也受到一定限制,相信隨著DCE-MRI軟硬件平臺的提高會克服這一難點,屆時DCE-MRI將有望成為疾病診斷、鑒別診斷和療效監測更有價值的研究工具。
總之,DCE-MRI定量灌注參數在鑒別pNETs分級方面有一定的價值,可輔助臨床更精準治療方案的制定。
[1] Fraenkel M,Faggiano A,Valk GD.Epidemiology of neuroendocrine tumors[J].Front Horm Res,2015,44(1):1-23.
[2] Ito T,Igarashi H,Nakamura K,et al.Trends of epidemiology of pancreatic endocrine tumors:a nationwide survey analysis in Japan[J].Nihon Rinsho,2015,73(Suppl 3):316-320.
[3] Rindi G,Kl?ppel G,Alhman H,et al.TNM staging of foregut (neuro) endocrine tumors:a consensus proposal including a grading system[J].Virchows Arch,2006,449(4):395-401.
[4] Pasaoglu E,Dursun N,Ozyalvacli G,et al.Comparison of World Health Organization 2000/2004 and World Health Organization 2010 classifications for gastrointestinal and pancreatic neuroendocrine tumors[J].Ann Diagn Pathol,2015,19(2):81-87.
[5] Hashim YM,Trinkaus KM,Linehan DC,et al.Regional lymphadenectomy is indicated in the surgical treatment of pancreatic neuroendocrine tumors (PNETs)[J].Ann Surg,2014,259(2):197-203.
[6] 袁瑛,姜夢達,陶曉峰.DWI及動態增強磁共振成像在口底病變良惡性鑒別中的應用[J].放射學實踐,2016,31(8):689-694.
[7] 孫勝杰,錢海峰,李鳳琪,等.定量動態對比增強磁共振成像滲透性與T1灌注多參數聯合分析對腦膠質瘤分級的診斷價值[J].中國醫學科學院學報,2015,37(6):674-680.
[8] Koo HR,Cho N,Song IC,et al.Correlation of perfusion parameters on dynamic contrast-enhanced MRI with prognostic factors and subtypes of breast cancers[J].J Magn Reson Imaging,2012,36(1):145-151.
[9] 金雁,張婭,李鹍,等.MRI定量動態增強參數在宮頸鱗癌病理分級中的價值[J].中華放射學雜志,2015,49(5):360-363.
[10] 劉會佳,趙娓娓,任芳,等.3.0T動態增強磁共振對前列腺癌的定量分析研究[J].放射學實踐,2014,29(5):477-481.
[11] Young K,Iyer R,Morganstein D,et al.Pancreatic neuroendocrine tumors:a review[J].Future Oncol,2015,11(5):853-864.
[12] Orditura M,Petrillo A,Ventriglia J,et al.Pancreatic neuroendocrine tumors:Nosography,management and treatment[J].Int J Surg,2016,28(Suppl 1):S156-S162.
[13] Abu Hilal M,McPhail MJ,Zeidan BA,et al.Aggressive multi-visceral pancreatic resections for locally advanced neuroendocrine tumours.Is it worth it?[J].JOP,2009,10(3):276-279.
[14] Yang M,Tian B,Zhang Y,et al.Epidemiology,diagnosis,surgical treatment and prognosis of the pancreatic neuroendocrine tumors:report of 125 patients from one single center[J].Indian J Cancer,2015,52(3):343-349.
[15] 胡亞,趙玉沛,廖泉,等.惡性胰腺神經內分泌腫瘤的外科手術選擇[J].中華外科雜志, 2010,48(18):1398-1401.
[16] Calcagno C,Lobatto ME,Dyvorne H,et al.Three-dimensional dynamic contrast-enhanced MRI for the accurate,extensive quantification of microvascular permeability in atherosclerotic plaques[J].NMR Biomed,2015,28(10):1304-1314..
[17] Sourbron SP,Buckley DL.Classic models for dynamic contrast-enhanced MRI[J].NMR Biomed,2013,26(8):1004-1027.
[18] Jennings D,Raghunand N,Gillies RJ.Imaging hemodynamics[J].Cancer Metastasis Rev,2008,27(4):589-613.
Valueofdynamiccontrast-enhancedMRI(DCE-MRI)inthegradingofpancreaticneuroendocrinetumors
ZHAO Wei-wei,REN Jing,YIN Hong,et al.
Department of Radiology,Xijing Hospital Air Force Military Medical University,Xi'an 710032,China
Objective:To explore the value of dynamic contrast-enhanced MRI (DCE-MRI) in the grading of pancreatic neuroendocrine tumors (pNETs) before operation.Methods20 pNETs patients (25 lesions) confirmed by pathology were recruited for the study from May 2014 to April 2015.From all of them,14 lesions were evaluated as G1 (grade 1),10 lesions as G2 and 1 lesion as G3.They were divided into two groups:G1 pNETs group and G2 pNETs group.All patients underwent pancreas DCE-MRI examination.Images were transmitted to research-DCE-MRI tool workstation to calculate the quantitative parameters (Ktrans,Kep,Veand Vp).Independent samplettest was used to evaluate the differences of pancreatic quantitative parameters between different groups.P<0.05 indicated the difference was statistically significant.The receiver operating characteristic curve was also performed for evaluating the diagnostic efficacy of parameters in pNETs grading.ResultsThere were significant difference in Ktransand Kepbetween G1 and G2 pNETs group (P=0.014 andP=0.025).There was no significant difference in Veand Vpbetween different groups (P=0.786 andP=0.522).When the Ktransvalue was 0.714,the AUC was the largest (0.782) in pNETs grading,and meanwhile the sensitivity and specificity were 70.00%,85.71% respectively.When the Kepvalue was 1.721,the AUC was the largest (0.771),and meanwhile the sensitivity and specificity were 60.00%,92.86% respectively.ConclusionKtrans,Kepof DCE-MRI can be applied to assess pNETs grading quantitatively and noninvasively.In particular,the diagnostic efficacy of Ktransvalue is higher.
Pancreas; Neuroendocrine tumors; Magnetic resonance imaging; Neoplasm grading
R322.491; R730.264; R445.2
A
1000-0313(2017)10-1003-05
2016-12-13
2017-04-20)
710032 西安,空軍軍醫大學西京醫院放射科
趙娓娓(1984-),女,河南洛陽人,博士,主治醫師,主要從事腹部磁共振成像及診斷工作。
宦怡,E-mail:huanyi3000@163.com
國家自然科學基金資助項目(81220108011)
10.13609/j.cnki.1000-0313.2017.10.002

