基于N,C螯合π共軛骨架的四配位有機硼化合物及其光電應用
秦妍妍 許文娟 胡長永 劉淑娟 趙 強
綜 述
基于N,C螯合π共軛骨架的四配位有機硼化合物及其光電應用
秦妍妍 許文娟 胡長永 劉淑娟 趙 強*
(南京郵電大學信息材料與納米技術研究院,有機電子與信息顯示國家重點實驗室培育基地,南京 210023)
具有N,C-螯合π共軛骨架的四配位有機硼化合物,其分子內存在的B-N配位作用使分子骨架趨于平面,π共軛性增強,使這類化合物具有較高的電化學和熱學穩定性、優異的發光性能和強的電子親和勢,成為非常有發展前景的新型光電材料,已在有機發光二極管(OLEDs)、有機場效應晶體管(OTFTs)、有機太陽能電池、傳感等方面進行了廣泛研究。在本文中,我們主要介紹了N,C-螯合四配位有機硼化合物的合成方法及其在電子傳輸材料、發光材料、光致變色材料及有機太陽能電池材料中的應用研究。
N,C-螯合四配位硼;電子傳輸材料;光致變色材料;有機發光二極管;有機太陽能電池
0 引 言
近年來,具有π共軛骨架的有機光電材料吸引了國內外眾多學者的研究興趣,這些材料在有機半導體器件方面具有很好的應用,已成功應用于有機太陽能電池、有機發光二極管、有機場效應晶體管、有機存儲器件、化學和生物傳感等方面。在碳原子骨架的大π共軛體系中引入主族元素 (如硼原子),是調節有機光電信息材料性質的有效途徑。通過改變硼原子與π共軛體系之間的軌道相互作用、電子效應以及雜原子價鍵數從而產生具有獨特結構的分子,可以實現對整個分子體系電子性質的調控。近年來,具有π共軛體系的有機硼發光化合物因其獨特的性能引起了化學家們的關注。這類化合物被廣泛應用于非線性光學、化學傳感、有機電致發光、生物分子識別等領域[1-7],我們課題組也開發了一系列含三芳基硼的金屬配合物,實現了其在氟離子傳感和光電器件中的應用[8-13]。
由于三配位有機硼化合物中硼原子具有空的2pπ軌道,N、O等原子的孤對電子可以填充到硼的pπ軌道中而形成配位鍵,從而使硼原子達到四配位。與三配位硼化合物相比,四配位硼化合物通常具有較高的化學穩定性,并且易于制備。常見的四配位有機硼化合物包括 N,N-、N,O-、N,C-、C,O-、C,C-、O,O-螯合的配合物(圖 1a),分子內 B…X 配位鍵的形成使分子骨架趨于平面,有利于增大π電子的離域程度,是非常有潛力的一類有機光電功能材料[14-16]。這幾類四配位硼配合物中,最為知名的N,N-螯合四配位硼化合物是氟化硼配位二吡咯甲川(BODIPY)類染料,這類化合物具有高的摩爾吸光系數、良好的光穩定性、激發波長在可見光區、結構易于修飾、發射波長可調到近紅外、不易受環境的影響等優點。國內外許多化學及生物學家通過在母體分子上引入不同的化學基團對其結構進行修飾,開發出許多具有不同性能BODIPY衍生物,并將這類化合物應用于各種金屬離子的檢測、pH值測定、DNA標記及測序等領域[17]。我們課題組[18-20]近期也制備了基于BODIPY的化合物,并實現了在離子檢測中的應用。張紅雨等[21]利用三苯基硼或氟化雙(五氟苯基)硼烷和1,3-二芳基-β-二酮反應獲得了O,O-螯合有機四配位硼化合物,其在溶液中表現出高效的綠色熒光,而在晶體中表現出紅光發射,顯示了聚集誘導發光顏色變化特征,且其晶體在用脈沖激光束照射時顯示出明顯變窄的發射,這是含硼化合物顯示受激輻射放大特性的第一個例子。這一發現表明了四配位硼化合物在有機固體激光中的潛在應用,從而擴大了含硼材料的應用領域。
基于N,C-螯合的有機四配位硼化合物主要是以結構1、2、3和4作為配體骨架構建(圖1b)。通過硼與N,C共軛骨架螯合,分子內B-N配位使分子骨架趨于平面,螯合物的π共軛性被增強,也可以有效增加材料的電子親和勢。四配位硼化合物的最低未占據分子軌道(LUMO)通常位于π共軛的螯合配體上,硼的配位使其更加趨于穩定,這使得可以用一些四配位硼化合物作為有效的電子傳輸材料。Yamaguchi和Wakamiya等[22-23]基于骨架1構建了一系列N,C-螯合的硼化合物,這類材料發光量子效率偏低,然而其具有低的LUMO能級和高的電子遷移率,可以作為優異的電子傳輸材料。四配位硼化合物的最高占有分子軌道(HOMO)可位于螯合配體或R基團上,這取決于R基團的性質。螯合物的π→π*電子躍遷或從R基團到螯合物的電荷轉移躍遷,通常決定了這類分子的發光性能。Wang等[24-28]合成了一系列基于骨架2的N,C-螯合有機硼化合物,大部分此結構的化合物具有可逆的光致變色性質,可以用于光開關。吉林大學的張紅雨等[29]制備了一系列基于骨架3的雙N,C-螯合的梯型有機硼化合物,這種雙硼的梯型化合物具有高的熱穩定性、高效的熒光發射和強的電子親和勢。Kawashima等[30-31]基于偶氮苯或亞胺類骨架4合成了一類發光的N,C-螯合有機硼化合物,共軛螯合骨架上的分子可發生π→π*躍遷。通過選擇合適的螯合物和R基團,四配位硼化合物也能進行簡單可逆的光熱異構化,這為四配位硼的研究提供了新的機遇。
在本文中,我們總結了近年來基于N,C-螯合四配位有機硼化合物的合成方法及其光電應用。
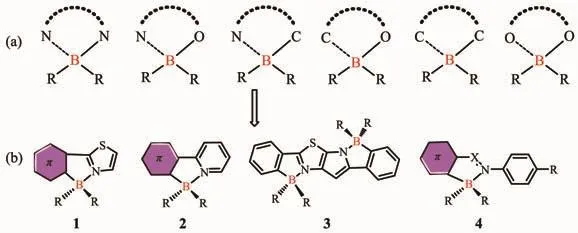
圖1 (a)四配位硼骨架示意圖;(b)N,C-螯合的四配位硼結構[22-31]Fig.1 (a)Chelated backbones of four-coordinated organoboron compounds;(b)Structures of N,C-chelate organoboron compounds[22-31]
1 合成方法
N,C-螯合四配位有機硼化合物的合成方法主要包括鋰化-硼化法、金屬催化法、親電芳基硼化法及其他方法。
1.1 鋰化硼化法
該方法是一種合成有機硼化合物的傳統方法。使用鹵素取代的N-雜芳香化合物,先在低溫-78℃下和n-BuLi試劑發生鋰化反應,1 h后,加入有機硼試劑低溫保持1 h后再移至室溫繼續反應,獲得相應的目標硼化產物,反應通式如圖2所示[24-29]。該反應過程復雜,所用的有機硼試劑價格昂貴,并且強親核試劑和有機鋰的堿性可能導致發生不必要的副反應,限制了結構修整的范圍。
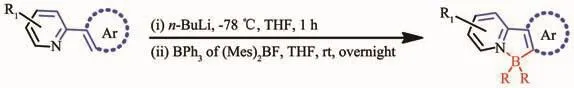
圖2 鋰化-硼化法反應式[24-29]Fig.2 Synthetic route of N,C-chelate four-coordinated organoboron compounds by lithiationborylation[24-29]
1.2 金屬催化法
隨著有機硼化合物的發展,2008年Murakami等[32]在加熱的條件下,首次使用金屬鈀催化含有銨鹽的炔基三芳基硼烷,經過重排,得到了一種具有立體選擇性的分子內含硼氮配位鍵的化合物。使用兩性的炔基三芳基硼烷,在THF溶液中加入適量的催化劑 Pd2dba3·CHCl3和 P(o-tol)3,經過重排,得到了環化的含B-N配位鍵的化合物。該化合物表現了較強的熒光,量子效率達0.44。通式如圖3a所示。在此基礎上,Kazuhiko等[33]在室溫下利用金屬鈀催化9-borabicyclo[3.3.1]nonane(9-BBN)的重排反應合成了一種新型的N,C-螯合四配位有機硼化合物,如圖3b所示。該方法選擇2-苯基吡啶衍生物作為配體骨架,利用金屬鈀對其進行催化,成功地以高產率獲得含B-N配位鍵的多種氮雜環π共軛材料,并且所得的有機硼材料在紫外燈照射下可表現出有趣的發光特性[33]。有機π-共軛體系也可通過該方法進行雙硼化以得到擴展。但該方法不具普遍適用性。
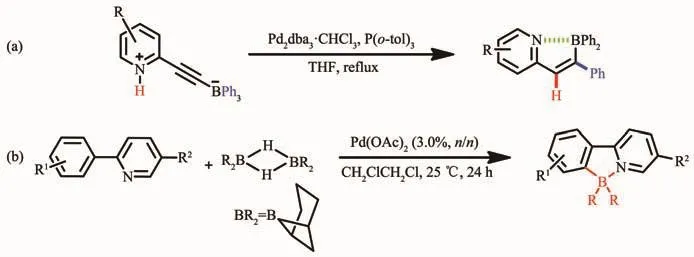
圖3 金屬催化法反應式a和b[32-33]Fig.3 Synthetic routes of N,C-chelate four-coordinated organoboron compounds by metal-catalyzed methods a and b[31-32]
1.3 親電芳香硼化法
繼有機金屬試劑取代反應之后,Murakami等[34]首次通過苯基吡啶及其衍生物的親電芳基硼化反應,合成了一系列N,C-螯合四配位有機硼化合物,且具有高的產率 (圖4)。該方法比較簡單且普遍適用。而且這種簡單的合成方法對含硼氮配位鍵的氮雜π共軛材料的合成非常有用。利用這種親電芳基硼化法,Ingleson[35]和Patil[36]分別合成了基于苯并噻二唑和喹啉的芳香硼化發光材料。J?kle等[37]基于苯基吡啶合成了一系列梯形雙硼化合物。Yam等[38]基于吡啶噻吩合成了光致變色有機硼化合物,可用于分子開關。
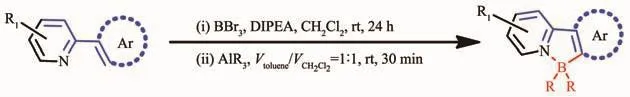
圖4 親電芳香硼化法反應式[34-38]Fig.4 Synthetic route of N,C-chelate four-coordinated organoboron compounds by electrophilic CH borylation[34-38]
1.4 其它合成方法
前面所述的合成方法中,鋰化-硼化法得到的化合物產率較低,親電芳香硼化法雖然可得到高產量的化合物,但這些強親核試劑如有機鋁試劑或者鋅試劑卻對質子酸堿敏感,產生含有離子鋅鹽或鋁鹽的混合物。因此,需要一種對空氣穩定的親核試劑,且合成的含硼化合物易分離。Ingleson等[39]在親電芳香硼化反應的基礎上發展了一種新的合成方法,即使用催化劑AlCl3,硼陽離子介導的硼氫化法對基于苯并噻二唑和芳基吡啶骨架的(N,C-螯合BCl2)進行功能化修飾。如圖5所示,在四配位硼烷(N,C-螯合BCl2)中加入 AlCl3,能夠生成三配位硼離子[(N,C-chelate)BCl]+。后者分別和芳基錫烷、芳基硅烷,通過硼脫甲硅基化和硼脫甲錫基化反應,生成芳基化硼烷。催化劑AlCl3的存在可以大大提高(CN-chelate)BCl2芳基化的產量。
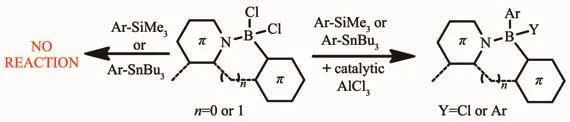
圖5 硼陽離子介導的硼氫化法反應式[39]Fig.5 Synthetic route of N,C-chelate four-coordinated organoboron compounds by borenium cation mediated electrophilic CH borylation[39]
2 N,C-螯合四配位有機硼化合物的光電應用
N,C-螯合四配位有機硼化合物由于其獨特的電子結構,從而可廣泛用于有機光電子領域,如作為電子傳輸材料、發光材料、光致變色材料以及光伏材料等用于有機發光二極管(OLEDs)、有機場效應晶體管、光敏材料和傳感、有機太陽能電池等方面。
2.1 電子傳輸材料
在含氮π共軛化合物的適當位置引入硼原子,路易斯堿氮原子和硼原子間可形成分子內配位,這種分子內酸堿配位作用不僅以平面方式有效地固定了π共軛骨架,增加了π共軛結構的共平面性,還降低了體系的LUMO能級,使材料的帶隙減小,從而有利于增強材料的電子傳輸特性。
2006 年,Yamaguchi等[22]基于(3-bromo-2-thienyl)-2-thiazole配體骨架,利用鋰化-硼化法合成了單硼化合物5和它的雙硼化合物5a~5c,這是首例四配位N,C-螯合有機硼化合物(圖6)。這類四配位有機硼化合物有較低的LUMO能級,可作為電子傳輸材料的一種新單元,且雙硼化合物5a有相對較高的電子遷移率 μ=1.5×10-4cm2·V-1·s-1[40],這是由于 π 共軛結構的延伸和分子內的B-N配位共同作用,使得螯合物的π共軛性增強,有效地增加了材料的電子親和勢。
Bazan等曾報道過,路易斯酸如B(C6F5)3和含N-雜環的π共軛骨架經配位作用可進行電子調諧[41],這種修飾對控制苯并噻二唑共軛低聚物的帶隙是非常有效的。噻唑π共軛骨架因有較強的吸電子能力、易進一步修飾或功能化[42]以及固態易形成緊密π堆積[43-45]等優點,可用于n型半導體材料[42-46]。Yamaguchi等[22]先利用咪唑環和路易斯酸硼烷B(C6F5)3作用形成分子內B-N配位,再用強堿甲基鋰進一步處理成環,合成化合物6,有效地降低了體系的LUMO能級,并增強吸電子性能。該團隊又進一步對噻唑芴噻唑配體、噻唑聯噻吩噻唑配體進行先配位再環化,得到的化合物6a和6b都有較高的熱穩定性[23],Td分別在387和376℃(圖7)。經過配位環化后,化合物的最大吸收波長有明顯的紅移,這是由于共軛骨架上的分子發生π→π*躍遷,且發射光譜也發生明顯的紅移,6a呈現藍光,6b呈黃光。6a和6b在正極有兩步還原峰,分別為6a:Epc=-1.81 V(E1/2=-1.74 V)和-1.96 V;6b:Epc=-1.70 V(E1/2=-1.61 V)和-1.89 V;未配位環化之前的配體還原電勢分別為Epc=-2.86 V、Epc=-2.44 V,這說明配位環化過程降低了LUMO能級,這有利于電子傳輸器件中電子從陰極的注入。
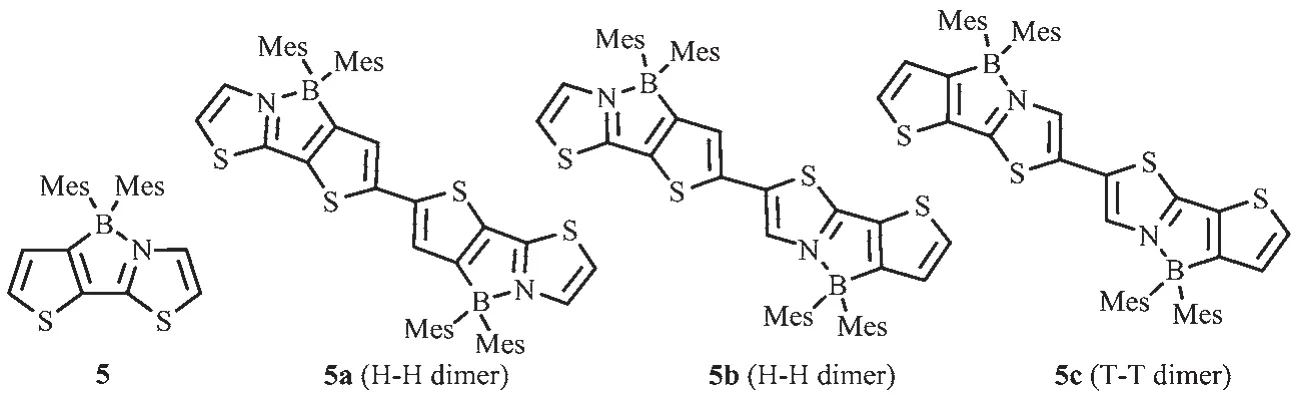
圖6 有機硼化合物5、5a~5c的分子結構[22]Fig.6 Molecular structures of boron compounds 5,5a~5c[22]
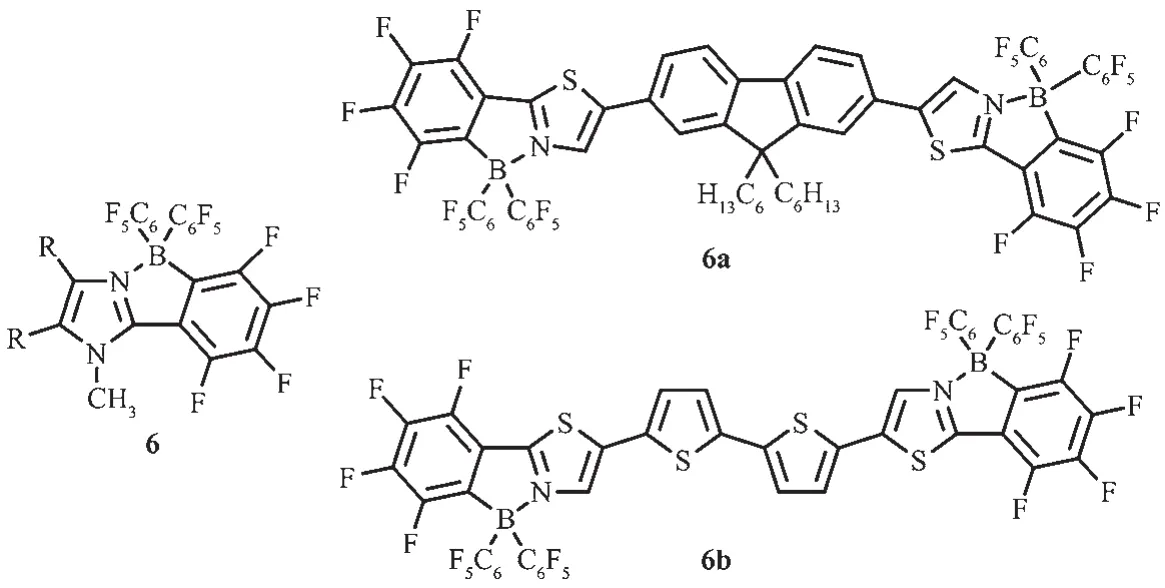
圖7 有機硼化合物6、6a和6b的分子結構[22-23]Fig.7 Molecular structures of boron compounds 6,6a and 6b[22-23]
Turner等[35]使用定向C-H親電硼氫化對含給體-受體基團的苯并噻二唑材料進行修飾,產生了一種融合的環硼材料7(圖8)。這種材料在質子溶劑(如水)中具有很好的穩定性,吸收峰有較大紅移,還有大的Stokes位移;和未硼化之前相比,硼化后的材料7的HOMO能級基本不變,但具有顯著降低的LUMO能級;且固體狀態下遠紅外/近紅外發光量子產率高達34%;溶液制造的遠紅外/近紅外電致發光OLEDs其EQEs>0.4%。在此基礎上,該團隊又利用偶合反應進一步合成了硼化的9,9-二辛基芴苯并噻二唑(F8-BT)材料 8-BAr2和 8-BPh2[47],有效地延伸了共軛長度,使得共軛骨架更趨于平面性和剛性。這類材料也具有較低的LUMO能級、低帶隙以及較高的穩定性。延伸的共軛分子8-BAr2和8-BPh2,在溶液中具有較強的吸收和發射,但在固態下其發光強度減弱,發射波長延伸到近紅外區域(λmax>700 nm)且有較高的發光量子效率。如帶有BPh2基團的F8-BT-F8材料,其固態熒光量子效率為33%,熒光發射在789 nm處。因此,對含D-A結構的低聚物BT化合物進行定向硼氫化,增強了材料的電子親和勢并可以調節有機半導體給受體間的帶隙,這是獲得具有較低LUMO能級發光材料的有效方法。
基于分子內路易斯酸堿配位作用,Fang等[48]對D-A-D結構上N進行定向硼化反應合成了低帶隙共平面有機材料9和10(圖9)。該材料具有低的LUMO能級,帶隙僅有1.3 eV。有趣的是,由于路易斯酸堿配位的動力學性質,這些體系的帶隙可以通過外部試劑(如路易斯堿溶劑)與硼配位的競爭進行調節。這一工作為以后設計低帶隙n型材料提供了模型。
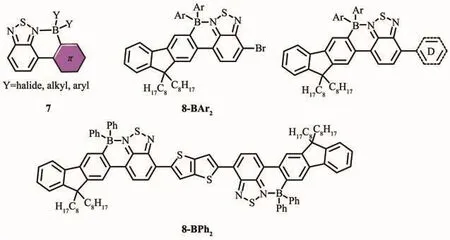
圖8 有機硼化合物7、8-BAr 2和8-BPh2的分子結構[35,47]Fig.8 Molecular structures of boron compounds 7,8-BAr 2 and 8-BPh2[35,47]
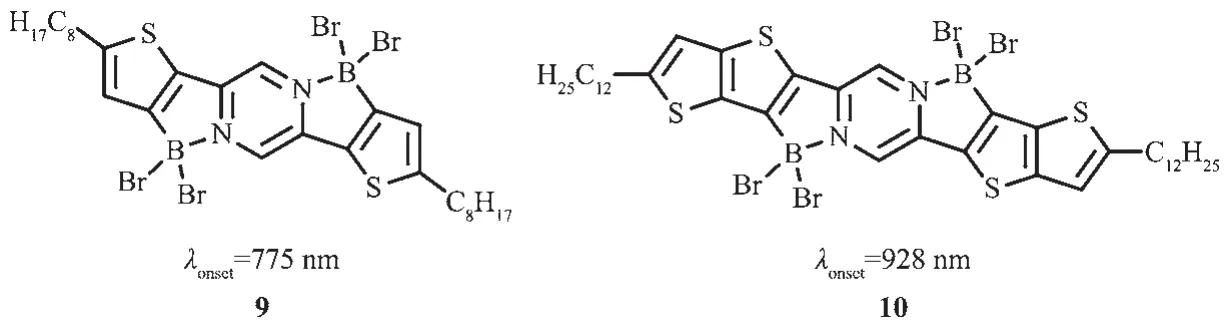
圖9 有機硼化合物9、10的分子結構[48]Fig.9 Molecular structures of boron compounds 9,10[48]
2.2 發光材料
B原子引入π共軛體系后,由于其缺電子特性,可使得硼與路易斯堿如N原子形成配位作用,產生獨特的電子結構和光學特性,因此可作為有應用前景的發光材料用于有機光電子領域。N,C-螯合四配位有機硼是一類新型發光材料,它們的剛性平面骨架產生了一些非常獨特的性質,如強發光、高載流子遷移率和高熱穩定性等。在激發光的作用下能產生強烈的熒光,可用于有機電致發光器件和生物標記等。如前文所述Ingleson和Turner等[35,47]報道的環硼發光材料7及其延伸的π共軛分子8-BAr2和8-BPh2,其發光紅移到近紅外區域(λmax>700 nm)且具有較高的發光量子效率,可用于生物成像[49]。
Patil等[36]報道了基于喹啉配體的芳香硼化反應制備的發光材料11a~16e(圖10)。在基于喹啉的新型N,C-螯合四配位有機硼化合物的硼位點或者N,C-螯合骨架上選取不同取代基,可以實現跨越整個可見光區域的固態發光調節。有機硼化合物11a~16e在液態和固態展現了較強的熒光。液態中所有化合物在387~491 nm有較寬的吸收帶,發射帶從466 nm(11a,藍光)過渡到 637 nm(12c,紅光),覆蓋了整個可見光區域。硼中心連有甲基的N,C-螯合四配位有機硼化合物具有較好的量子效率,如化合物13a的熒光量子效率達到0.81。所有的化合物都展現了較強的寬固態吸收 (吸收峰在397~496 nm紫外可見區)和強的固態熒光發射(發射峰在491~670 nm)。如化合物11a的固態發射峰在491 nm處,呈藍綠光;化合物16e的固態發射峰在670 nm,呈深紅光。這一類材料的固態強發光性質以及可修飾性使其在生物成像和探針領域也具有潛在的應用價值。
J?kle等通過苯基吡啶二聚體的定向親電硼化反應合成了N,C-螯合發光梯形有機硼化合物17[37](圖11)。該硼化后的梯形產物,其吸收和發射有顯著的紅移,并伴隨著明顯的電子振動結構。隨著溶劑極性的增加,其吸收峰藍移,但卻不影響發射峰的位置。發光梯形有機硼化合物17呈現了較強的藍光,具有較高的液態熒光量子效率,17-Pf可達到68%,而薄膜中的量子效率分別為7.1%(17-Ph)和3.8%(17-Pf),顯著低于液態中的。化合物17-Pf的高穩定性和強藍光可使其應用于OLEDs和成像。
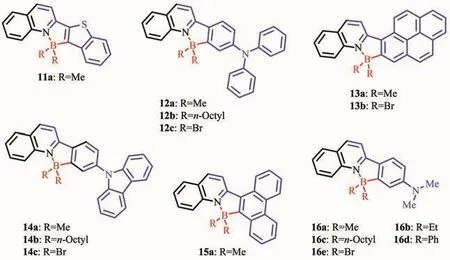
圖10 有機硼化合物11a~16e的分子結構[36]Fig.10 Molecular structures of boron compounds 11a~16e[36]
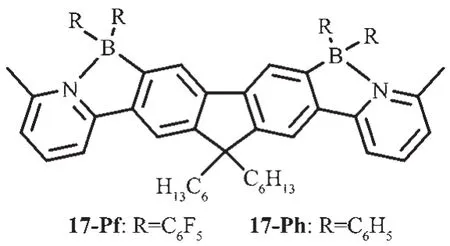
圖11 有機硼化合物17的分子結構[37]Fig.11 Molecular structures of boron compounds 17-Pf and 17-Ph[37]
在溫和的條件下,Zhang等對二苯噻唑并噻唑進行硼氫化反應合成了一系列梯形π共軛二硼化合物18a~d[29](圖12)。在骨架上引入吸電子或給電子基團,可調節分子的熒光發射。這些化合物都具有較高熱穩定性并且發光在藍綠光區域。化合物18c、d比18a、b光譜表現了明顯的紅移,說明在調節該類含硼梯形發光化合物的光物理特性方面,硼中心的功能化比梯形骨架的調整更有效。硼中心的大芳基取代基的空間位阻可有效保持該熒光單元分開,從而使這類材料在固態下具有強的發光性質。經過表征,合成的二硼化合物具有較高的熱穩定性,較強的發光效率和強的電子親和力,因此可作為功能材料用于有機光電器件,如OLEDs。
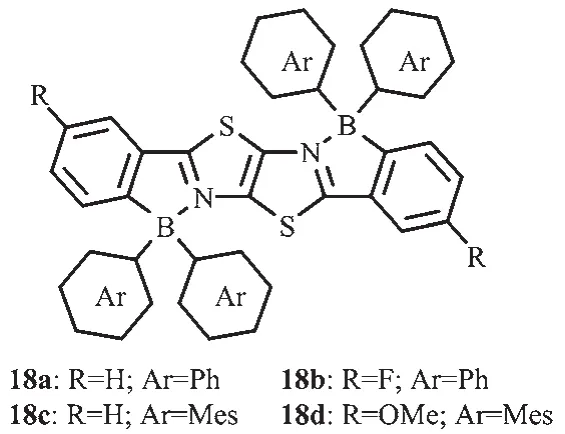
圖12 有機硼化合物18a~d的分子結構[29]Fig.12 Molecular structures of boron compounds 18a~d[29]
四苯乙烯(TPE)是一個有趣的螺旋槳狀激活發光的特殊發光體。稀溶液中發光微弱,但在聚集形式下強烈發光,呈現聚集誘導發光(AIE)的一種新特性[50-51]。最近的研究表明,含有TPE的平面型發光團分子,聚集誘導發射,可產生高效固態發光。Qiu和Tang等[52]提出了一種比較實用的方法合成有機硼化合物,基于吡啶和喹啉設計并合成了含有TPE部分的2種新型N,C-螯合四配位有機硼化合物TPEPBN(19)和 TPE-QBN(20)(圖 13),可作為有效的固態發光體。這2種新型的N,C-螯合四配位有機硼化合物具有較好的熱穩定性,其分解溫度分別在303和340℃。由于TPE的存在,2種有機硼化合物都展現了AIE特性和高聚集態發光效率。在溶液中,20的最大吸收波長在388 nm處,和沒有B-N配位的配體相比,紅移了57 nm;19顯示了微弱的發射,沒有可識別的發射峰,熒光量子效率低至0.40%。化合物20在501 nm處有較好的發射,熒光量子效率為0.94%。化合物19和20在液態呈現較弱的發射,但在聚集態卻顯示強藍光發射。它們的晶體發射分別在443和462 nm,非晶形薄膜發射更為紅移,分別在491和500 nm處。固態熒光量子效率分別為98%和99%,遠遠高于報道過的多數有機硼化合物。這說明,在聚集態時,這2種化合物有較好的AIE特性。經過理論計算和電化學研究,20的HOMO能級為-5.220 eV,和19(-5.216 eV)的比較接近,而20的LOMO(-2.108 eV)能級遠低于19(-1.719 eV)的,較低的LUMO能級有利于電子的注入與傳輸。
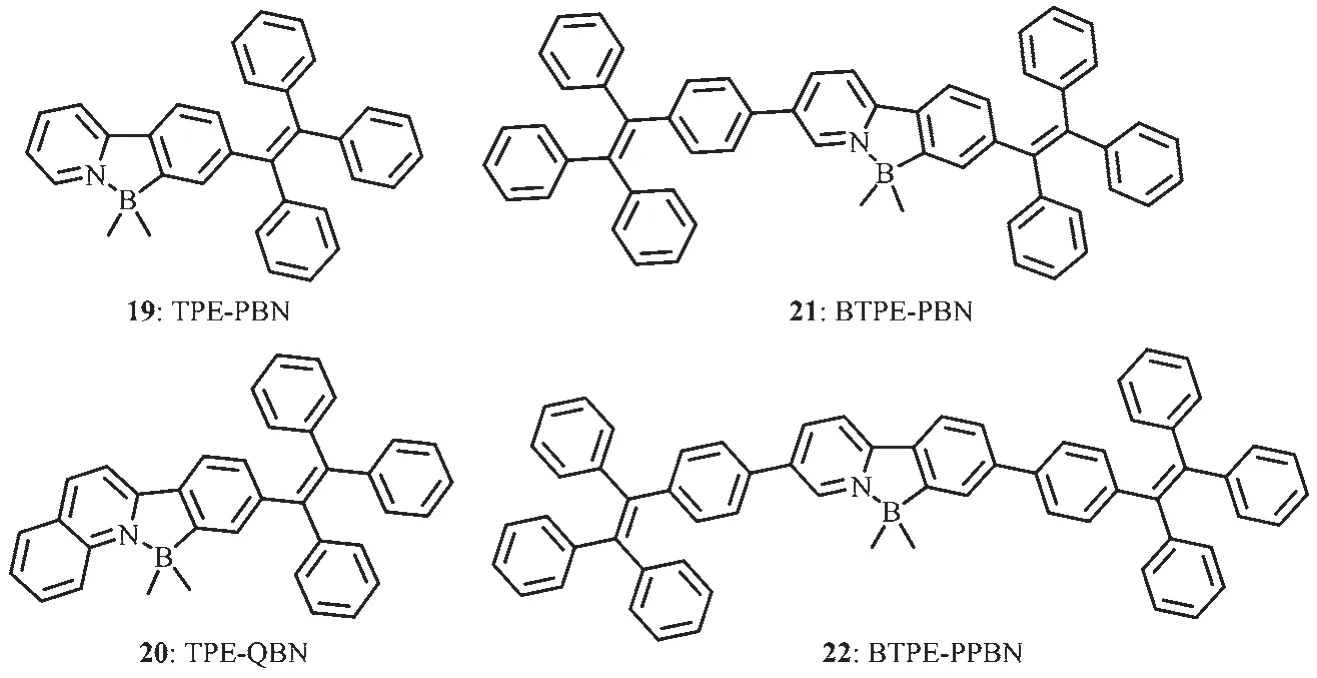
圖13 有機硼化合物19~22的分子結構[52-53]Fig.13 Molecular structures of boron compounds 19~22[52-53]
在此研究基礎上,Qiu等又對基于TPE的N,C螯合四配位有機硼化合物進行了深入研究,研究了分子內B-N配位作用對其光致發光特性、電子結構、電致發光特性的影響。他們設計合成了2種新的有機硼化合物,即BTPE-PBN(21)和BTPE-PPBN(22)[53](圖13)。這2種化合物有較高的熱穩定性,熱分解溫度分別為403和436℃。化合物21和22的最大吸收波長在376、373 nm,和沒有配位之前相比,分別紅移了27和23 nm。大部分基于TPE構建的發光材料在液態都是非熒光或者弱發光的,這是因為分子內TPE單元的自由旋轉消耗了發光體激發態能量。化合物21和22在稀溶液中呈現了弱的發射,熒光量子效率分別為0.53%和0.55%,和沒配位之前相比,略有升高。這是因為B-N配位減小了分子間的旋轉。化合物21和22的薄膜發射峰分別位于495和490 nm,熒光量子效率達到了100%,未配位之前為81%和40%,這些數據表明,分子內BN配位作用有利于提高發光體的發光量子效率。它們的HOMO能級和沒配位之前相近,但LUMO能級分別降低為-2.87和-2.67 eV(未配位之前為-2.68和-2.54 eV),說明B-N配位作用降低了LUMO能級,有利于電子的注入和傳輸。和光致發光相比,化合物21和22的電致發光波長分別紅移至516和520 nm。基于21的器件的最大電流效率ηC,max為4.43 cd·A-1,最大能量效率為 1.64 lm·W-1,最大外量子效率ηext,max為1.52%,遠遠高于未配位之前的(分別為 0.46 cd·A-1,0.14 lm·W-1,0.21%)。基于 22的器件的最大電流效率ηC,max為4.07 cd·A-1,最大能量效率為1.68 lm·W-1,最大外量子效率 ηext,max為1.43%。這些結果表明,B-N配位有利于提高電致發光器件的器件效率。這些新的固態發光N,C-螯合四配位有機硼化合物是非常有潛力的OLED發光材料。
p-羥基苯亞甲基咪唑啉酮(p-HOBDI)的獨特發光性能可用于RNA和蛋白的熒光探針。但由于光誘導異構化導致的低熒光量子效率,酸堿平衡引起的光譜pH值相關性,長發光波長衍生物的化學不穩定性及差的水溶性等限制了其作為熒光探針的應用。Baranov和Solntsev等[54]通過引入二氟化硼基團改善了p-HOBDI的熒光量子效率和水溶性,并成功用于熒光標記。氨基取代的p-HOBDI(即ABDI)可以使GFP發光團的光譜紅移,具有顯著的溶劑光致變色效應和強的氫鍵誘導熒光淬滅效應及抗氧化功能。因此,基于二氟化硼和氨基的結合,該團隊設計合成了一種新的基于構象鎖定的紅移強發光GFP發光染料23[55](圖14),并研究了其不同溶劑和pH值條件下的光學性質,做了一系列同系物的光物理性質對比分析,評估了它們在熒光標記中的潛在應用。和相應的非硼化產物相比,硼化后的23a和其烷基化衍生物23b~23d的吸收和發射光譜展現了大幅度的紅移,而且硼化后的產物其熒光量子效率也大幅度增加,最大達到0.82(23a)。23b~23d的熒光光譜紅移的同時也伴隨著顯著地熒光猝滅。化合物23a具有較好的水溶性,可以更好的用于熒光探針。該團隊也研究了不同氨基取代基對ABDIBF2染料(23e~23g)熒光猝滅的影響。和 23b~23d 的發射光譜相比,化合物23e~23g的光譜得到了更大的紅移。化合物23e表現出了和23b~23d相同的紅移,由于共軛骨架的延伸,23f紅移了20~30 nm,23g紅移了40~50 nm,并且熒光量子效率增大到0.86(23f)。
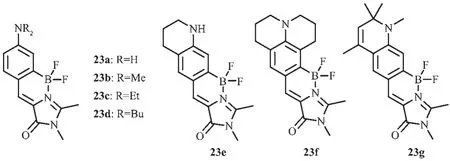
圖14 有機硼化合物23a~23g的分子結構[55]Fig.14 Molecular structures of boron compounds 23a~23g[55]
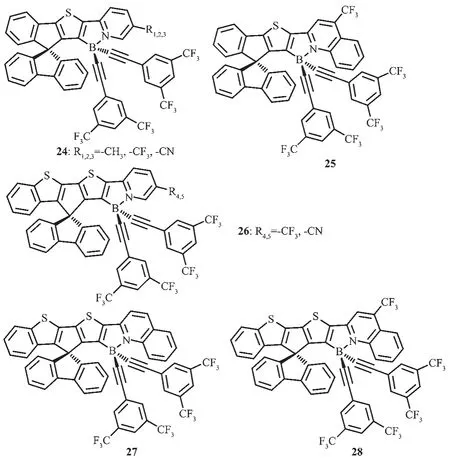
圖15 有機硼化合物24~28的分子結構[56]Fig.15 Molecular structures of boron compounds 24~28[56]
Wong等[56]設計合成了一系列對空氣穩定的螺芴梯形有機硼化合物24~28(圖15),并研究了這類化合物的電化學和光物理性質。通過簡單改變吡啶環上的取代基,延長螺芴骨架的π共軛結構,可以實現化合物的發光顏色從藍到紅的顯著調節,覆蓋了整個可見光區。該類化合物展現了寬的無結構發射峰,這是由于螺芴骨架上的噻吩基團到吡啶硼烷的分子內電荷轉移躍遷導致的。除此之外,這類化合物有較高的發光量子效率,在二氯甲烷中最高可達到0.81,在薄膜中可達到0.86。其中一些化合物已被用于OLEDs中的發光材料,外量子效率EQE達到1.3%并實現了發光顏色從藍光到紅光的調節。如摻雜化合物24-R1的器件展現了藍光發射,最大發射峰在468 nm;摻雜化合物26-R4的器件展現了綠光發射,最大發射峰在519 nm;摻雜化合物28的器件展現了紅光發射,最大發射峰在605 nm。
2.3 光致變色材料
有機硼化合物也是一類新興的光致變色材料,尤其是N,C-螯合二米基硼化合物,表現出了顯著變化的光致異構化現象,且這種光致異構化過程是熱可逆的,因此這類化合物可用作新型光敏材料。文獻中報道過的光致變色有機硼化合物很少,只有兩類,分別是Kawashima等[57]報道過的偶氮苯N,C-螯合有機硼化合物和Wang等[25]報道的N,C-螯合光致變色有機硼化合物。這兩類分子都表現出了可逆的光致變色現象。其硼中心都有一個通式為BAr2(N,C-螯合)四配位四面體結構。雖然如此,這兩類分子結構轉變的原理卻不同。一種是光誘導B-N鍵的解離從而引起偶氮基團的順反異構化,另一種是基于光誘導的B-C和C-C鍵的斷裂與形成。
2.3.1 偶氮苯N,C-螯合有機硼化合物
Kawashima等[57]在2005年報道了分子內含有B-N配位鍵的兒茶酚硼烷化合物(E)-29的光致異構化現象(圖16)。該化合物通過光照射,改變硼的配位數從而改變含偶氮基團的兒茶酚硼烷的酸性。這是因為在光照射下,化合物29會發生光致異構化過程。該分子在苯中的最大吸收波長在339 nm,這是來自于偶氮基團的π-π*躍遷。在360 nm光照射下,化合物(E)-29在339 nm處的吸收帶降低,并在460 nm產生了新的吸收帶,這一吸收帶來自于偶氮基團的順式異構體(Z)-29的吸收。在431 nm光照射下,順式異構體(Z)-29可以返回到反式異構體(E)-29。這種光致異構化過程可用于調節硼的路易斯酸性,從而使得該類化合物用于分子開關。兒茶酚硼烷化合物的這種光致異構化現象和相關的二芳基硼偶氮苯化合物30和31[58-59]形成了鮮明對比。由于其較短的B-N鍵長(0.162 5~0.163 8 nm),在光照射下化合物30和31及它們的衍生物并不經歷光致異構化過程,反而會產生較強的熒光。在正己烷溶液中,偶氮苯化合物30a和30b分別在λem=503 nm(ΦFL=0.23)和 λem=524 nm(ΦFL=0.76)處顯示綠光發射,而化合物30c卻在 λem=566 nm(ΦFL=0.52)處顯示橙光發射。與之相反,化合物31并不顯示發光,這可能是由于硼原子上的取代基淬滅了發光。
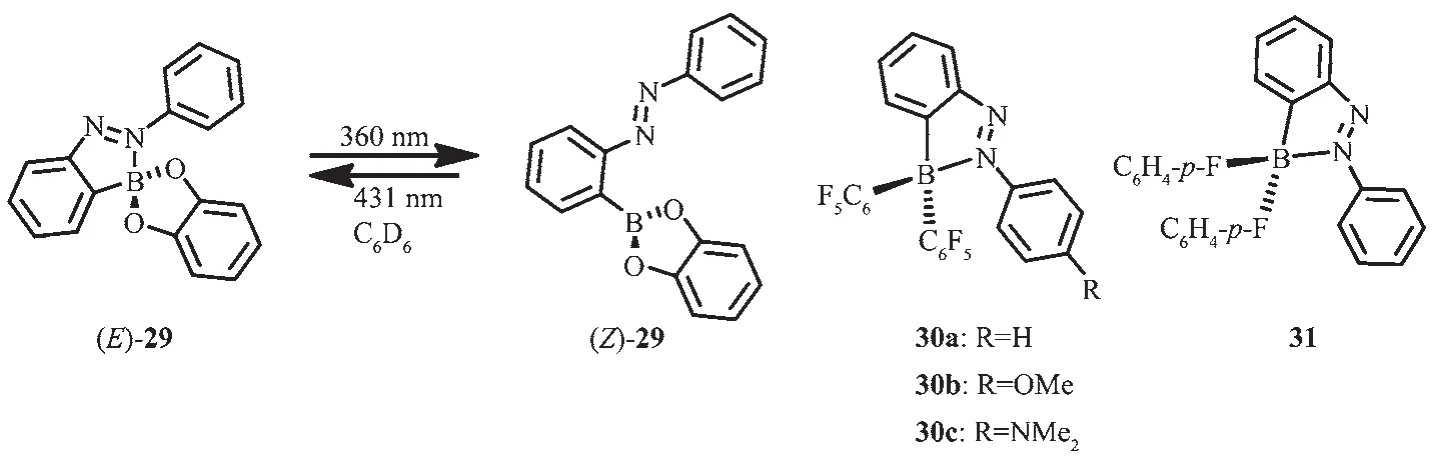
圖16 有機硼化合物29~31的分子結構[57-59]Fig.16 Molecular structures of boron compounds 29~31[57-59]
2.3.2 基于苯基吡啶配體的N,C-螯合有機硼化合物
Wang等設計合成了以苯基吡啶為配體的N,C-螯合有機硼化合物32[25](圖17),在液態和固態下其結構都能保持穩定性。但是當在365 nm光照射下,該化合物的顏色可快速從無色變為深藍色(在甲苯中,λem=458 nm,ΦFL=0.10),這是由于分子內 C-C鍵發生了Zimmerman重排,伴隨著σ鍵的移動;而且該過程是熱可逆的,而光致異構化效率達到85%。
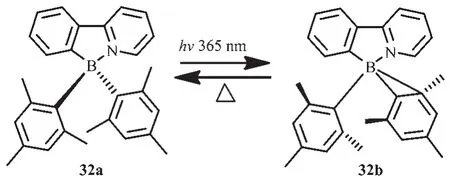
圖17 有機硼化合物32的光致異構化過程[25]Fig.17 Isomerization of compound 32[25]
隨后,他們將不同的給電子和吸電子基團引入到苯基吡啶配體上,合成了一系列N,C-螯合有機硼化合物33~36(圖18),研究不同取代基對這類硼配合物的光致變色性質的影響[25,60]。 由于πmesityl→π*ppy的電荷轉移躍遷,給電子基SiMe3使得化合物發射波長藍移(λem=418 nm,化合物 33),而吸電子基-C(O)H使化合物發射波長紅移(λem=~525 nm,化合物34和35),低能級吸收帶向長波移動。化合物33~36都以相同的方式發生光致異構化過程,而且都伴隨著顯著的顏色變化。這類材料異構化后產物的吸收峰也受取代基的影響,即吸電子基使得異構化后的產物吸收峰發生紅移,給電子基使之發生藍移。這說明可通過改變取代基來實現異構化產物的顏色變化。化合物33、35的光致異構化過程都是熱可逆的,而化合物34,其異構化后的產物在室溫就會逐漸發生分解。化合物36不經歷異構化過程,在365 nm激發時則會發生分解。
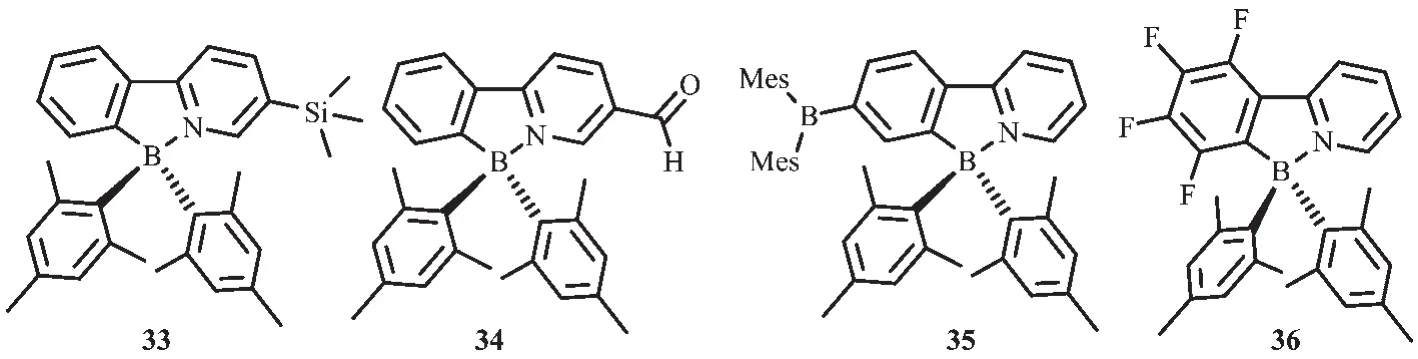
圖18 有機硼化合物33~36的分子結構[25,60]Fig.18 Molecular structures of boron compounds 33~36[25,60]
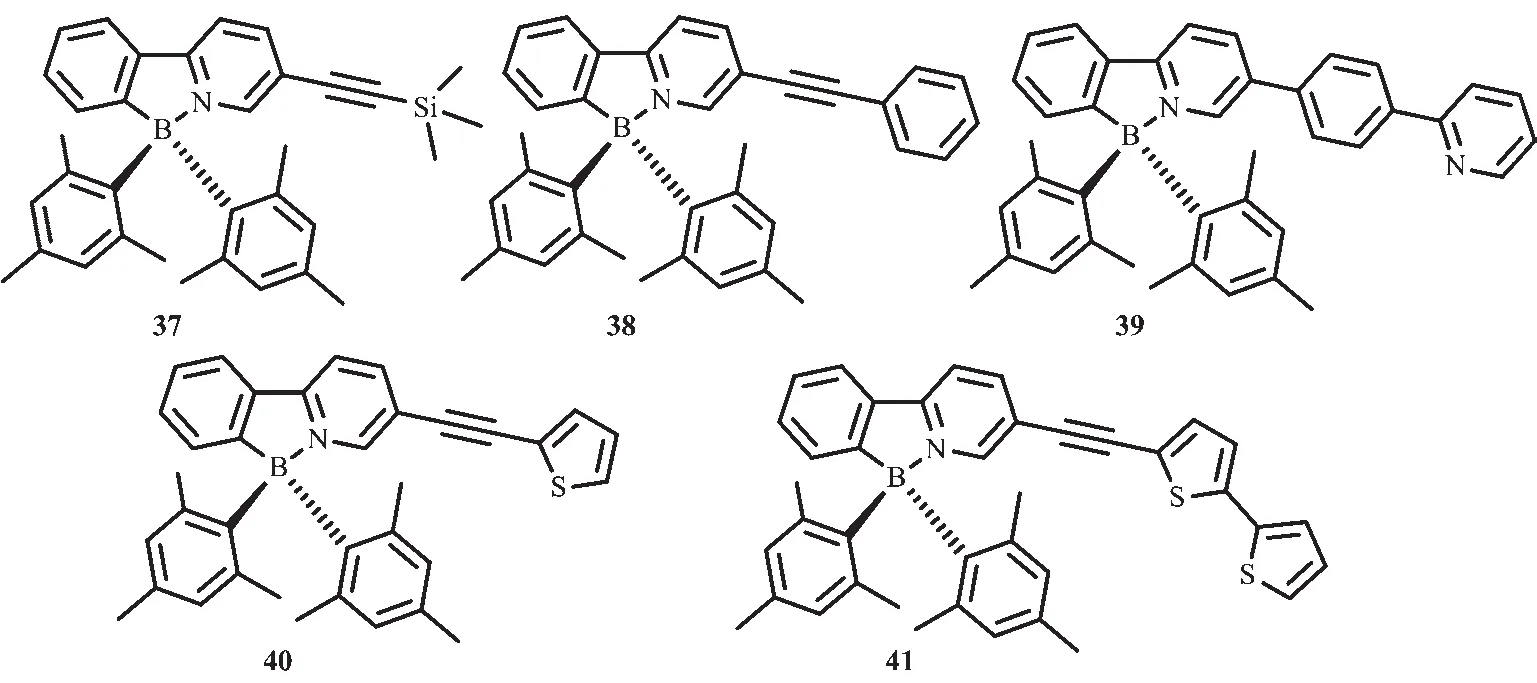
圖19 有機硼化合物37~41的分子結構[60-61]Fig.19 Molecular structures of boron compounds 37~41[60-61]
通過前面的研究發現,引入取代基來延伸螯合骨架π共軛結構可以顯著影響光致異構化的量子效率和化合物的顏色。因此,Wang等又進一步合成了化合物37~41[60-61](圖19),研究了延長螯合的π共軛結構對化合物光致異構化效率和光物理性質的影響。化合物37~40都以相同的方式進行光致異構化過程,然而化合物41卻不經歷異構化過程。由于延伸的π共軛骨架穩定了π*能級(LUMO),這些分子的吸收和發射光譜都發生了實質性紅移,其異構化產物的特征低能級吸收峰也發生了移動。這類化合物的一個重要特征就是熒光效率的顯著增強。如化合物37,ΦFL=0.28, 化合物38,ΦFL=0.37, 化合物39,ΦFL=0.18。這表明,與光致異構化相比,熒光發射是一種更有效的激發態輻射方式。因此,這類化合物往往有更低的光致異構化量子效率,如化合物38,Φphoto=0.33,化合物 39,Φphoto=0.03。 π 共軛結構發光效率的增強可歸因于螯合骨架上π-π*躍遷的增加。化合物41證明了π共軛效應,但是化合物41并不經歷如40的光致異構化過程。通過二噻吩基團引入低π→π*躍遷態,可與硼單元的電荷轉移躍遷進行有效競爭,可能引起了這種不尋常的現象。因此將二噻吩基團摻入含BMes2π共軛化合物中,可有效提高材料的光穩定性,防止它通過異構化降解。
為檢測烯鍵對N,C-螯合有機硼化合物的光致開關的影響,Wang等設計合成了化合物42~44[26],如圖20所示。這些分子發藍或藍綠光,溶液中ΦFL=0.30~0.59,固態約為 0.23。365 nm 激發時,沒有顏色變化。但反式化合物42的吸收光譜有明顯的藍移,主要吸收帶在370 nm處,這是烯鍵順反異構的標志。對多硼化合物43和44來說,只有一個烯鍵發生順反異構。然而,一個單烯鍵的異構化已足夠關閉硼中心的光致異構化過程,穩定B(ppy)Mes2發光團。該團隊合成的化合物45,在365 nm處激發時,烯鍵會發生光致異構化過程,當在2,2′-聯吡啶位置引入Cu(PPh3)2+后[62],金屬離子對烯鍵的異構化過程沒有顯著影響,但是引入PtPh2后,金屬離子完全抑制了化合物45烯鍵的光致異構化過程,這是由于低MLCT態的存在,有效地攔截了激發態能級,因此展示了烯鍵異構化。這說明分子內烯鍵和低的MLCT態都有利于硼發光團的穩定性。
Wang等[61]在基于苯基吡啶配體的N,C-螯合有機硼化合物中又進一步引入重金屬鉑配位獲得配合物46(圖21),研究了金屬離子的螯合或者簡單配位對B(ppy)Mes2光致變色的影響。室溫下這些化合物在甲苯中發磷光,而且都有較高的量子效率(0.13~0.45)。此Pt配合物的磷光源于螯合配體的3LC態。金屬Pt的螯合增強了配體中心單線態到三線態的系間躥躍,增強了分子的磷光。而且發現這3種Pt配合物中的B(ppy)Mes2發光團都可發生光致異構化過程,但異構化效率較低,這是由于Pt配合物的高效磷光抑制了B(ppy)Mes2發光團的光致異構化過程。
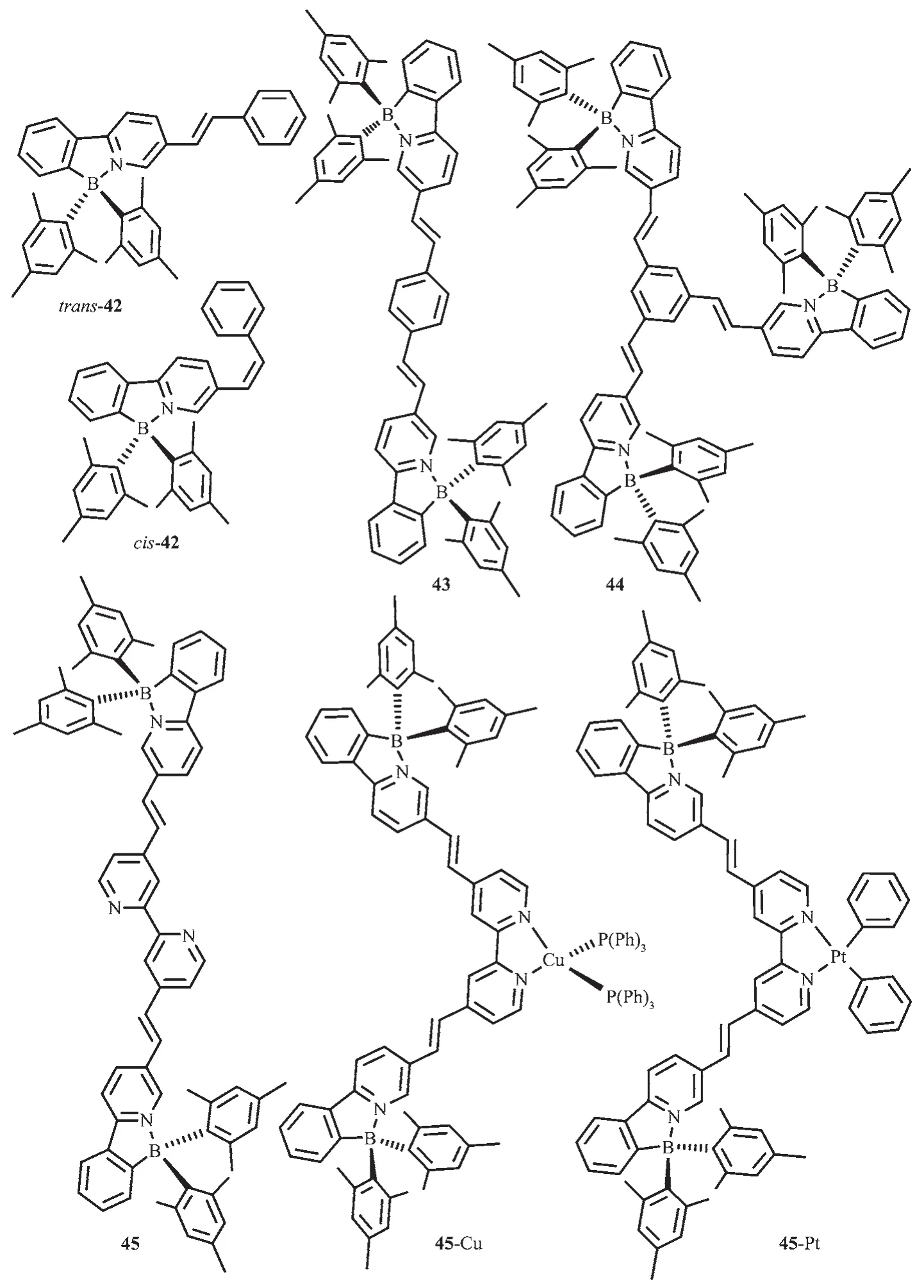
圖20 有機硼化合物42~45的分子結構[26,62]Fig.20 Molecular structures of boron compounds 42~45[26,62]
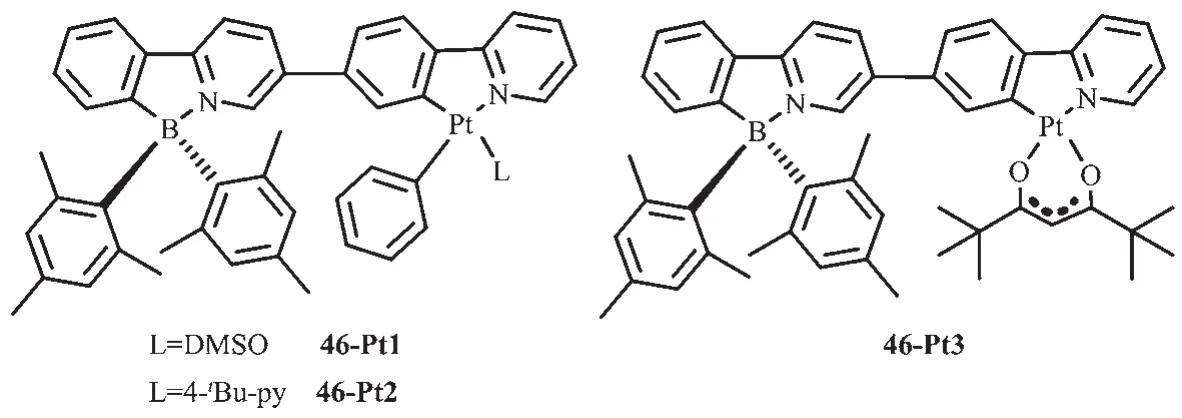
圖21 有機硼化合物46-Pt1~46-Pt3的分子結構[61]Fig.21 Molecular structures of boron compound 46-Pt1~46-Pt3[61]
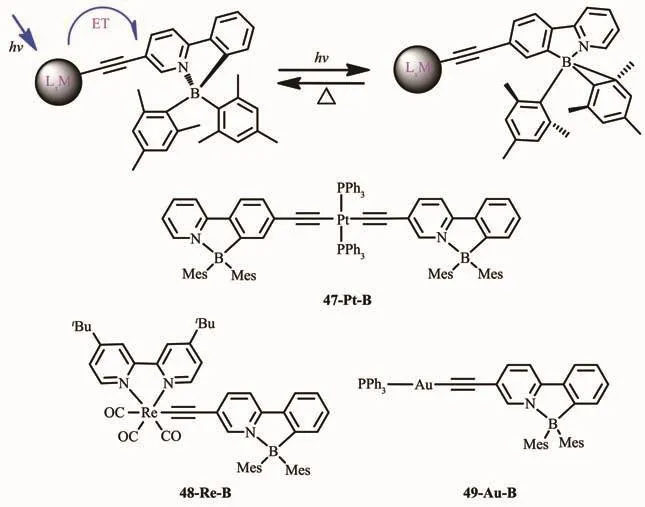
圖22 有機硼化合物47~49的異構化過程及分子結構[63]Fig.22 Isomerization and molecular structures of boron compounds 47~49[63]
二茂鐵是調節光電開關體系最常用的金屬單元。為了檢驗二茂鐵單元和N,C-螯合BMes2單元在電子、化學和光化學性質的相互影響,Wang等設計并合成含二茂鐵單元的N,C-螯合四配位硼化合物50[64](圖23)。化合物50顯示了一個不同尋常的動態交換和開環水解特性。水解產物(51)比較穩定,這是因為在溶液中,B-N鍵斷裂后形成三配位硼,氮原子與OH形成氫鍵,穩定了化合物。50的易水解行為是不含二茂鐵的N,C-螯合四配位米基硼所沒有的。化合物50和51具有獨特的電子特性,低能級二茂鐵的特征吸收帶分別在490 nm(1)和450 nm(2),摩爾吸收系數為 1 200 L·mol-1·cm-1,所以這 2種化合物顯示了獨特的顏色。化合物50中加入溫和的氧化劑如I2就可得到深棕色的物種[50]I3(52)。觀察其紫外可見近紅外吸收光譜,有一寬吸收帶在600~1 300 nm范圍內,且最大吸收波長在950 nm,摩爾吸收系數為400 L·mol-1·cm-1。這個低能級帶是配體到金屬的電荷轉移躍遷產生的。氮氣環境中,光激發或者白光照射數小時,化合物50都很穩定,不會發生任何變化。硼單元對光致異構化現象的不活潑性是由于二茂鐵單元的低能級電子態通過束縛激子,有效地猝滅了其光致異構化過程,而且二茂鐵的大體積空間位阻和螯合骨架導致了B-N鍵的分解,實現了硼開環水解的動態交換。固態化合物52在室溫穩定,但在弱極性溶劑如DMSO中可以還原回到化合物50。由于52中低的LMCT/d-d態,延緩了硼中心的光致異構化過程。研究發現,液態化合物52對光敏感,會快速分解,但并未觀察到硼中心的光致異構化現象。
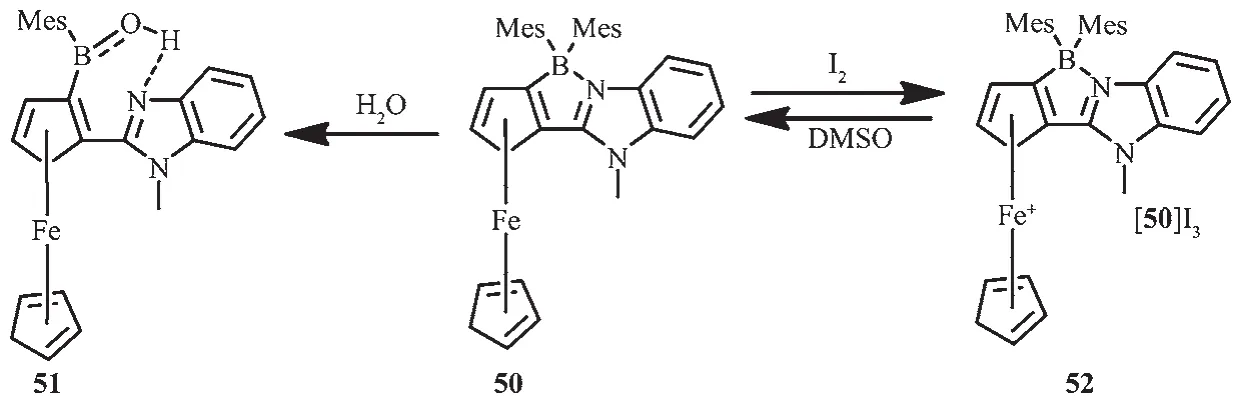
圖23 有機硼化合物50的水解過程及分子結構[64]Fig.23 Hydrolysis process of 50 and molecular structures of boron compound 50~52[64]
2.3.3 基于芳香雜環配體的N,C-螯合有機硼化合物
為了驗證觀察到的基于ppy配體N,C-螯合的有機硼化合物的光致異構現象是否是一普遍現象,Wang等設計合成了一些基于芳香雜環的有機硼化合物53~55[60,65-67],雜環基團如苯并呋喃、苯并噻吩、N-苯基吲哚代替了ppy中的苯環(圖24)。化合物53-O、53-S、55-O、55-S 都發藍光(λem=450 nm),ΦFL=0.30~0.80。 化合物 53-NPh 發藍綠光(λem=490 nm),ΦFL=0.32。在365 nm激發,化合物53都以32a相同的方式異構化為深色異構體,如53-O是深藍色;53-S是深綠色;53-NPh是深藍綠色。化合物53異構化后的產物其吸收光譜和32a相比,發生了弱微紅移,光致異構化量子效率低至0.10。相比之下,化合物55-O和55-S有較高的光致異構化量子效率,分別為0.35和0.75。化合物54也可發生光致異構化過程,產生深色異構體,但這類異構體對熱不穩定,會進一步發生結構變化。
在此前的研究基礎上,Yam等設計合成了一系列基于噻吩吡啶雙(炔基)骨架的有機硼光致變色配合物56~61[38],結構如圖25所示。該類化合物由于吸電子基炔基的存在,降低了化合物的吸收能級,光激發時,發射帶在460~580 nm,熒光量子效率在0.05~0.38之間。光致異構化也導致了發光強度的降低,這是由于閉環較低的激發態以能量轉移的方式猝滅了熒光。
之前的研究表明,大量的光致變色材料包括螺吡喃、螺嗪和二芳基乙烯,是通過光敏三線態發生異構化的。為了證明有機硼烷中光敏激發態的本質,Wang和Yamaguchi等將光致變色硼單元和不同三線態能級的受體發光團結合,設計合成了一系列化合物62~64[68](圖26)。受體發光團苯基萘(62)、苯芘(63)、聯苯蒽(64)單線態能級分別為 3.93、3.33、3.05 eV,都高于硼單元的(2.77 eV)。所有的化合物的最大吸收峰在417 nm,并有相似的消光系數,歸因于混合的π-π*躍遷和硼單元電荷轉移躍遷,使得化合物在固態和液態都呈淺黃色,發射光譜在λem=498~501 nm,呈黃綠光。但是,由于受體發光團的存在導致了化合物62~64有不同的光致變色行為。在419 nm處,甲苯溶液(10-5mol·L-1)中激發,化合物62和63都發生了定量的轉變,光致異構化量子效率分別為ΦPI=0.12,0.13。化合物64的異構化過程完全被禁止了,沒有觀察到任何光譜變化。此外,樣品的光反應活性可以通過有效的調節光致變色單元和三重態受體發色團之間的三線態能隙。這一發現在光致變色N,C-螯合硼化合物的設計具有重要意義,可以使用適當的三重態敏化劑或受體來敏化或猝滅BMes2單元的光異構過程。
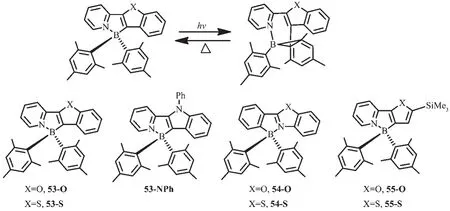
圖24 有機硼化合物53~55的異構化過程及分子結構[60,65-67]Fig.24 Isomerization and molecular structures of boron compounds 53~55[60,65-67]
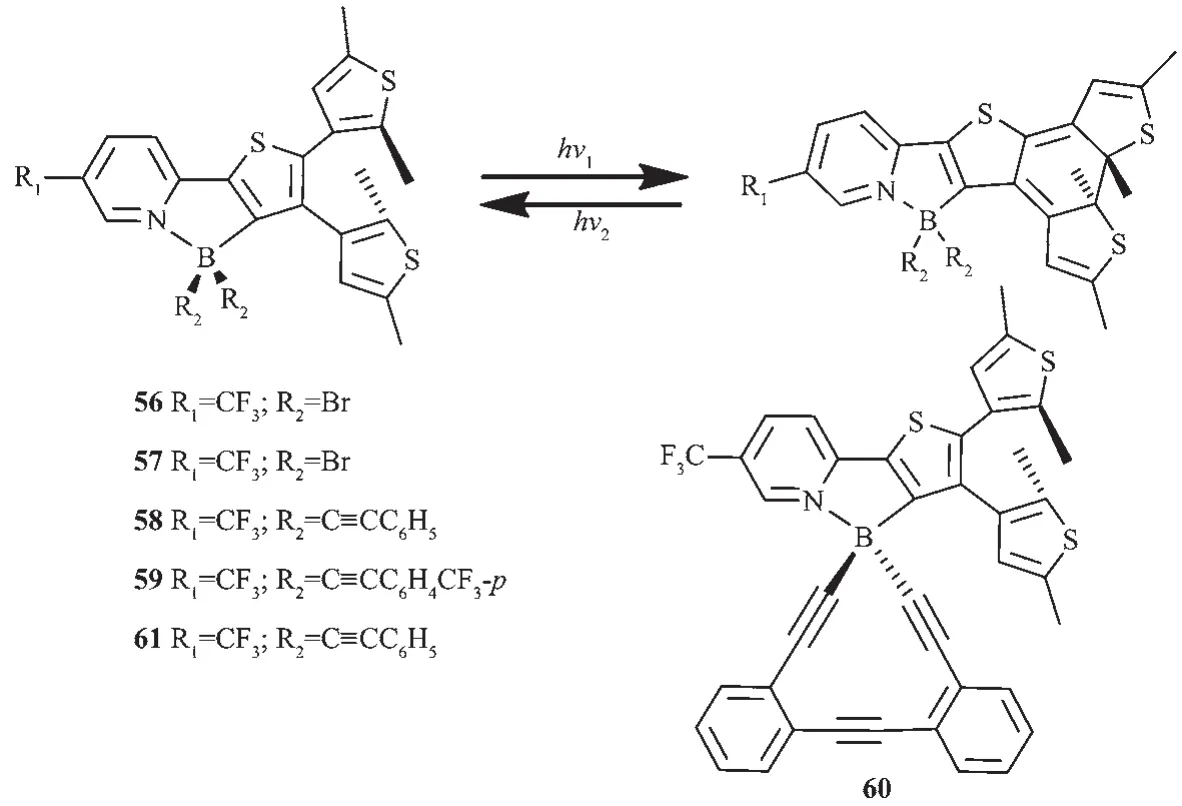
圖25 有機硼化合物56~61的光致異構化過程及分子結構[38]Fig.25 Isomerization and molecular structures of boron compounds 56~61[38]
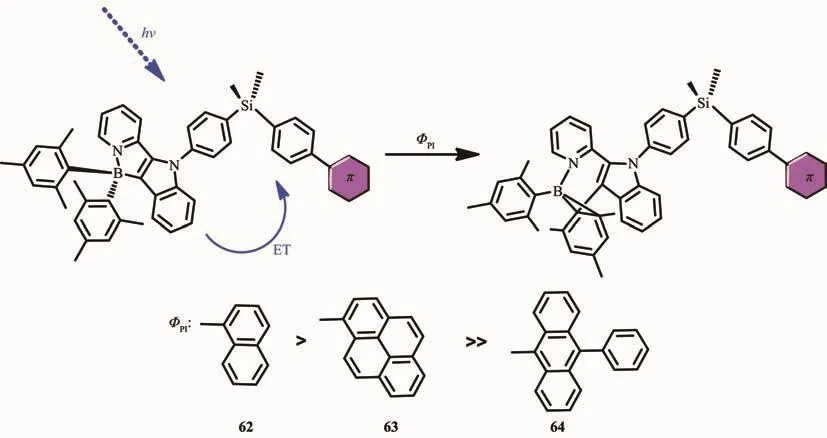
圖26 有機硼化合物62~64的異構化過程及分子結構[68]Fig.26 Isomerization and molecular structures of boron compounds 62~64[68]
2.4 太陽能電池材料
N,C-螯合四配位π共軛有機硼化合物具有較低的LUMO/HOMO能隙和較高的電子遷移率,因此這類材料也可以通過修飾作為有機太陽能電池的受體材料。
Yamaguchi等[22]發展了一種含B-N單元的新的噻吩噻唑骨架以設計合成具有高電子遷移率的電子傳輸小分子。Wang等[69-70]發展了一種新的方法來制備聚合物電子受體材料65(圖27),即將傳統的聚合物電子給體材料中的C-C單元利用B-N單元進行取代,這種方法可以明顯降低共軛聚合物的LUMO和HOMO能級,約0.6 eV。這次工作不僅提供了一種有效的方法調節共軛聚合物的LUMO和HOMO能級,而且利用有機硼化學作為一種新的方法發展具有高電子親和力的共軛聚合物,應用于聚合物光電器件。盡管得到的聚合物P-BN-TPD(65)展現了低ELUMO/HOMO,但是由于其較低的電子遷移率,其all-PSC器件性能卻很差。為了進一步提高這一類聚合物的電子遷移率,他們合成了聚合物P-BN-DPP(66)和P-BN-DPP(67)(圖27),與原來的聚合物P-BNTPD(65)相比,增加了聚合物電子受體重復單元的長度,這樣可以減輕大體積苯基的位阻效應,從而有利于聚合物骨架的π-π堆積,使材料的電子遷移率增強了近 2 個數量級,P-BN-IID、P-BN-DPP、P-BNTPD 的 電 子遷移率分 別 為 2.80×10-5、8.48×10-6、3.40×10-7cm2·V-1·s-1。聚合物作電子受體的 all-PSCs的能量轉換效率從0.12%增加到5.04%。
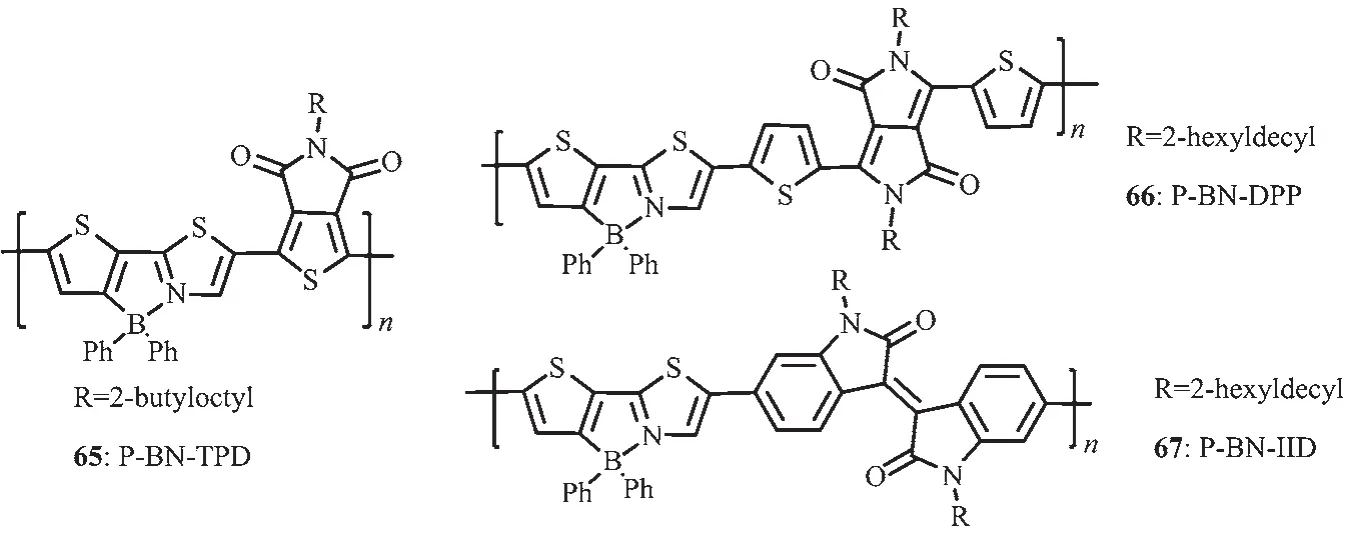
圖27 有機硼聚合物65~67的分子結構[70-71]Fig.27 Molecular structures of boron polymers 65~67[70-71]
3 結論和展望
本文中,我們總結了N,C-螯合四配位有機硼化合物的合成方法及其在電子傳輸材料、發光材料、光致變色材料及有機太陽能電池材料中的應用研究。這類有機硼化合物具有豐富的化學、物理特性及多功能應用,是一類非常具有發展潛力的有機光電功能材料。這類化合物中的分子內B-N配位作用在穩定螯合配體、增強π共軛性和影響π體系的電子特性等方面起到了重要的作用,在發光材料和電子傳輸材料領域具有很好的潛在應用價值。此外,光致變色N,C-螯合四配位硼化合物為研究發展光致變色材料及其應用提供了新的機遇。許多新的有機硼化合物具有顏色易調節、強發光以及高光致異構化量子效率等特點,這使得它們可應用于光致變色器件。但是在聚合物體系中,這種光致變色化合物的光致異構化過程及穩定性研究的還比較少,仍需深入的評估其在光致變色器件中的可行性,而且含N,C-螯合四配位硼單元的共軛聚合物作為聚合物太陽能電池的電子受體材料的研究還很少,值得進一步的深入研究。目前,有機硼材料的研究主要集中于三配位硼和四配位硼化合物,這兩類化合物都具有強發光和高電子親和性,因此,將這兩種基團引入同一個分子中,將會產生更有趣的特性,這類分子目前研究得還很少。
[1]Sun Y,Ross N,Zhao SB,et al.J.Am.Chem.Soc.,2007,129:7510-7511
[2]Gale PA.Acc.Chem.Res.,2006,39:465-475
[3]Mazzeo M,Vitale V,DellaSala F,et al.Adv.Mater.,2005,17:34-39
[4]Lin S L,Chan L H,Lee R H,et al.Adv.Mater.,2008,20:3947-3952
[5]Noda T,Shirota Y.J.Am.Chem.Soc.,1998,120:9714-9715
[6]Liu ZQ,Fang Q,Wang D,et al.Chem.Eur.J.,2003,9:5074-5084
[7]Hudson Z M,Wang S.Dalton Trans.,2011,40:7805-7816
[8]Zhao Q,Li F Y,Liu SJ,et al.Inorg.Chem.,2008,47:9256-9264
[9]Xu W J,Liu SJ,Zhao X Y,et al.Chem.Eur.J.,2010,16:7125-7133
[10]Xu W J,Liu SJ,Ma T C,et al.J.Mater.Chem.,2011,21:13999-14007
[11]Xu W J,Liu SJ,Sun H B,et al.J.Mater.Chem.,2011,21:7572-7581
[12]Xu W J,Liu SJ,Zhao X,et al.Chem.Eur.J.,2013,19:621-629
[13]Lin W P,Tan Q,Liang H,et al.J.Mater.Chem.C,2015,3:1883-1887
[14]Li D,Zhang H Y,Wang Y.Chem.Soc.Rev.,2013,42:8416-8433
[15]Tanaka K,Chujo Y.NPG Asia Mater.,2015,7:e223-e238
[16]Rao Y L,Wang S.Inorg.Chem.,2011,50:12263-122275
[17]Lu H,Mack J,Yang Y C,et al.Chem.Soc.Rev.,2014,43:4778-4823
[18]Sun H B,Dong X C,Liu SJ,et al.J.Phys.Chem.C,2011,115:19947-19954
[19]Liu SJ,Shi Z J,Xu W J,et al.Dyes Pigm.,2014,103:145-153
[20]Sun H B,Dong X C,Liu SJ,et al.J.Phys.Chem.C,2011,115:19947-19954
[21]Wang L,Zhang ZY,Cheng X,et al.J.Mater.Chem.C,2015,3:499-505
[22]Wakamiya A,Taniguchi T,Yamaguchi S.Angew.Chem.Int.Ed.,2006,45:3170-3173
[23]Job A,Wakamiya A,Kehr G,et al.Org.Lett.,2010,12:5470-5473
[24]Baik C,Murphy S K,Wang S,et al.Org.Lett.,2010,12:5266-5269
[25]Rao Y L,Amarne H,Zhao S B,et al.J.Am.Chem.Soc.,2008,130:12898-12900
[26]Baik C,Hudson Z M,Amarne H,et al.J.Am.Chem.Soc.,2009,131:14549-14559
[27]Baik C,Murphy SK,Wang S.Angew.Chem.Int.Ed.,2010,49:8224-8227
[28]Amarne H,Baik C,Murphy SK,et al.Chem.Eur.J.,2010,16:4750-4761
[29]Li D,Zhang Z L,Zhang SS,et al.Dalton Trans.,2011,40:1279-1285
[30]Yoshino J,Furuta A,Kambe T,et al.Chem.Eur.J.,2010,16:5026-5035
[31]Yoshino J,Kano N,Kawashima T.J.Org.Chem.,2009,74:7496-7503
[32]Ishida N,Narumi M,Murakami M.Org.Lett.,2008,10:1279-1281
[33]Kuninobu Y,Iwanaga T,Omura T,et al.Angew.Chem.Int.Ed.,2013,52:4431-4434
[34]Ishida N,Moriya T,Goya T,et al.J.Org.Chem.,2010,75:8709-8712
[35]Crossley D L,Cade I A,Clark E R,et al.Chem.Sci.,2015,6:5144-5151
[36]Shaikh A C,Ranade D S,Thorat S,et al.Chem.Commun.,2015,51:16115-16118
[37]Yusuf M,Liu K L,Guo F,et al.Dalton Trans.,2016,45:4580-4587
[38]Wong H L,Wong W T,Yam V W W.Org.Lett.,2012,14:1862-1865
[39]Crossley D L,Cid J,Curless L D,et al.Organometallics,2015,34:5767-5774
[40]Yasuda T,Yamaguchi Y,Zou D C,et al.J.Appl.Phys.,2002,41:5626-5629
[41]Welch GC,Coffin R,Peet J,et al.J.Am.Chem.Soc.,2009,131:10802-10803
[42]Jiang P,Morales G M,You W,et al.Angew.Chem.Int.Ed.,2004,43:4471-4475
[43]Curtis M D,Cao J,Kampf J W.J.Am.Chem.Soc.,2004,126:4318-4328
[44]Yamamoto T,Arai M,Kokubo H.Macromolecules,2003,36:7986-7993
[45]Mamada M,Nishida J I,Kumaki D,et al.Chem.Mater.,2007,19:5404-5409
[46]Hong X M,Katz H E,Lovinger A J,et al.Chem.Mater.,2001,13:4686-4691
[47]Crossley D L,Vitorica-Yrezabal I,Humphries M J,et al.Chem.Eur.J.,2016,22:12439-12448
[48]Zhu C Z,Guo Z H,Mu A U,et al.J.Org.Chem.,2016,81:4347-4352
[49]Pansare V J,Hejazi S,Faenza WJ,et al.Chem.Mater.,2012,24:812-827
[50]Hong Y,Lam J W Y,Tang B Z,et al.Chem.Soc.Rev.,2011,40:5361-5388
[51]Zhao Z J,Wang Z M,Lu P,et al.Angew.Chem.Int.Ed.,2009,48:7608
[52]Zhao Z J,Chang Z F,He B R,et al.Chem.Eur.J.,2013,19:11512-11517
[53]He B R,Chang Z F,Jiang Y B,et al.Dyes Pigm.,2014,101:247-253
[54]Baranov M S,Lukyanov K A,Borissova A O,et al.J.Am.Chem.Soc.,2012,134:6025-6032
[55]Baranov M S,Solntsev K M,Baleeva N S,et al.Chem.Eur.J.,2014,20:13234-13241
[56]Wong B Y W,Wong H L,Wong Y C,et al.Chem.Eur.J.,2016,22:1-13
[57]Kano N,Yoshino J,Kawashima T.Org.Lett.,2005,7:3909-3911
[58]Yoshino J,Kano N,Kawashima T.Chem.Lett.,2008,37:960-961
[59]Yoshino J,Kano N,Kawashima T.Chem.Commun.,2007,6:559-561
[60]Amarne H,Baik C,Wang S.Chem.Eur.J.,2010,16:4750-4761
[61]Rao Y L,Wang S.Organometallics,2011,30:4453-4458
[62]Baik C,Wang S.Chem.Commun.,2011,47:9432-9434
[63]Wang N,Ko S B,Lu J S,et al.Chem.Eur.J.,2013,19:5314-5323
[64]Rao Y L,Kusamoto T,Sakamoto R,et al.Organometallics,2014,33:1787-1793
[65]Rao Y L,Amarne H,Chen L D,et al.J.Am.Chem.Soc.,2013,135:3407-3410
[66]Amarne H,Baik C,Wang R Y,et al.Organometallics,2011,30:665-668
[67]Rao Y L,Amarne H,Lu J S,et al.Dalton Trans.,2013,42:638-644
[68]Hudson ZM,Ko SB,Yamaguchi S,et al.Org.Lett.,2012,14:5610-5613
[69]Dou C D,Ding Z C,Zhang Z J,et al.Angew.Chem.Int.Ed.,2015,54:3648-3652
[70]Zhao R Y,Dou CD,Xie Z Y,et al.Angew.Chem.Int.Ed.,2016,55:5313-5317
Four-Coordinated Organoboron Compounds withπ-Conjugated N,C-Chelate Ligand and Their Optoelectronic Applications
Four-coordinated organoboron compounds with aπ-conjugated N,C-chelate backbone have high thermal stability,intense luminescence,and strong electron affinity,and thereby,are promising candidates as novel optoelectronic materials for applications in organic light-emitting diodes(OLEDs),organic field-effect transistors(OFETs),organic solar cells and sensors.This article summarized the recent research progress on the synthesis and the application of this important class of optoelectronic materials.
organoboron compounds;N,C-chelate four-coordinated organoboron compounds;photochromic materials;organic light-emitting diodes(OLEDs);organic solar-cells
O613.8+1
A
1001-4861(2017)10-1705-17
10.11862/CJIC.2017.223
QIN Yan-Yan XU Wen-Juan HU Chang-Yong LIU Shu-Juan ZHAO Qiang*
(Key Laboratory for Organic Electronics and Information Displays&Institute of Advanced Materials(IAM),Nanjing University of Posts&Telecommunications,Nanjing 210023,China)
2017-04-20。收修改稿日期:2017-08-31。
國家自然科學基金(No.21671109)、江蘇省自然科學基金(No.BK20141422)、江蘇高校優勢學科建設工程(No.YX03002)和南京郵電大學引進人才啟動基金(No.NY213096)資助項目。
*通信聯系人。 E-mail:iamqzhao@njupt.edu.cn

