原液中鐵殘留檢測方法研究
趙辰宇(聊城市第二中學高二七班,山東 聊城 252000)
原液中鐵殘留檢測方法研究
趙辰宇(聊城市第二中學高二七班,山東 聊城 252000)
通過實驗方法的建立,對含蛋白原液中鐵殘留檢測方法進行摸索,確定出最簡單、準確的檢測方法。
鐵殘留;檢測方法
通過查詢大量資料,未發現含蛋白原液的鐵殘留的檢測方法,有一部分藥用輔料規定了鐵殘留的檢測方法。氯化鈉不僅是輔料,更是一種注射劑(醫用0.9%生理鹽水),同時也是原液復溶的溶劑,因此,以氯化鈉的檢測量及檢測限為原液的檢測標準較為適宜。
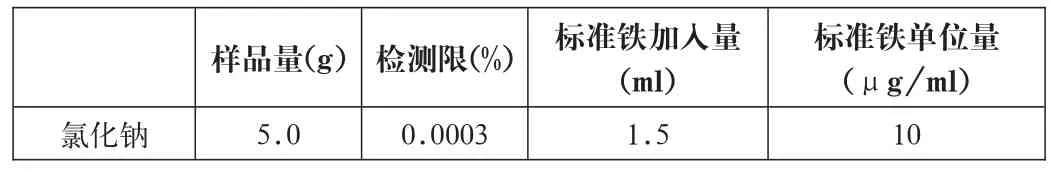
表1 .藥典中部分原輔料鐵殘留檢測限比較
1 實驗方法的確立
由于氯化鈉是小分子,原液中含有大分子蛋白會干擾最終的比色。因此,怎樣建立一個有效地去除蛋白而不影響溶液中鐵元素的前處理方法是原液鐵殘留檢測標準建立的關鍵。
1.1 蛋白去除方法的提出及驗證
通過查資料,沉淀除去蛋白的方法有很多,如酚-氯仿法、硫酸銨鹽析法、冰凍乙醇法及丙酮法等。而除蛋白的方法在此應符合下面幾個基本原則:一、不能影響溶液中鐵元素的含量;二、盡量不引入新的雜質離子;三、盡量減少有毒、有害物質的使用。經實驗驗證,其中,酚-氯仿法會明顯影響鐵離子;硫酸銨鹽析法和冰乙醇法不能完全除干凈蛋白,最終的樣品比色溶液中容易出現乳光,而影響比色;而丙酮需要設備較復雜,處理程序較多、時間較長,容易殘留影響比色。
根據以上情況和原則,經過進一步實驗摸索確立了兩種方法:低pH沉淀和高溫熾灼沉淀法。這兩種方法的優點都不引入新的雜離子,不會干擾最終的比色判定;其次是方法簡單易行,易操作、易控制。
1.2 蛋白去除方法的確立
1.2.1 低pH沉淀法:
取兩個燒杯,分別放入5ml樣品原液;5ml樣品原液和1.5ml標準鐵溶液,作為樣品陽性對照;兩燒杯靜置半小時以上,使蛋白充分沉淀。然后離心,把上清倒入比色管,沉淀管小心洗三遍都移入比色管。下面步驟依據藥典氯化鈉鐵殘留檢測,不同點是樣品管和陽性對照管都不加4ml稀鹽酸。重復三次檢測,一次沉淀去除較好,比色成功,樣品管顏色淺于對照管,陽性對照管略深于對照管。另兩次樣品管和陽性對照管都有淡乳光,影響比色。經過多次反復試驗,結果均不理想。說明低pH沉淀蛋白的方法不太穩定,重復性不好。
1.2.2 高溫熾灼沉淀法:
取三個燒杯,分別放入5ml樣品原液;5ml樣品原液和1.5ml標準鐵溶液,作為樣品陽性對照;1.5ml標準鐵溶液,作為方法對照;將以上三組溶液一起進行高溫熾灼。把樣品原液和樣品陽性對照的兩個燒杯同時放在約120℃的溫度迅速加熱煮沸使蛋白變性,考慮到除蛋白更保險、更徹底,第一次兩燒杯都熾灼到炭化,再各加4ml稀鹽酸,用玻璃棒充分攪起碳化物,反應15分鐘以上,使鐵離子充分溶解。過濾,把濾液轉入納氏比色管后發現,溶液呈淺黃色,必定影響比色,終止試驗,判定不適宜用高溫熾灼碳化的方法去除蛋白。
修正此方法為高溫熾灼蒸干但不碳化。其它步驟同上述。這樣以來,樣品和樣品陽性對照濾液的顏色清亮無色,合乎要求。重復三次檢測,樣品等濾液均清亮無色,證明此法重復性較好,比色結果為:方法對照組與陽性對照組顏色深淺一致,說明高溫熾灼對溶液鐵離子沒有影響。
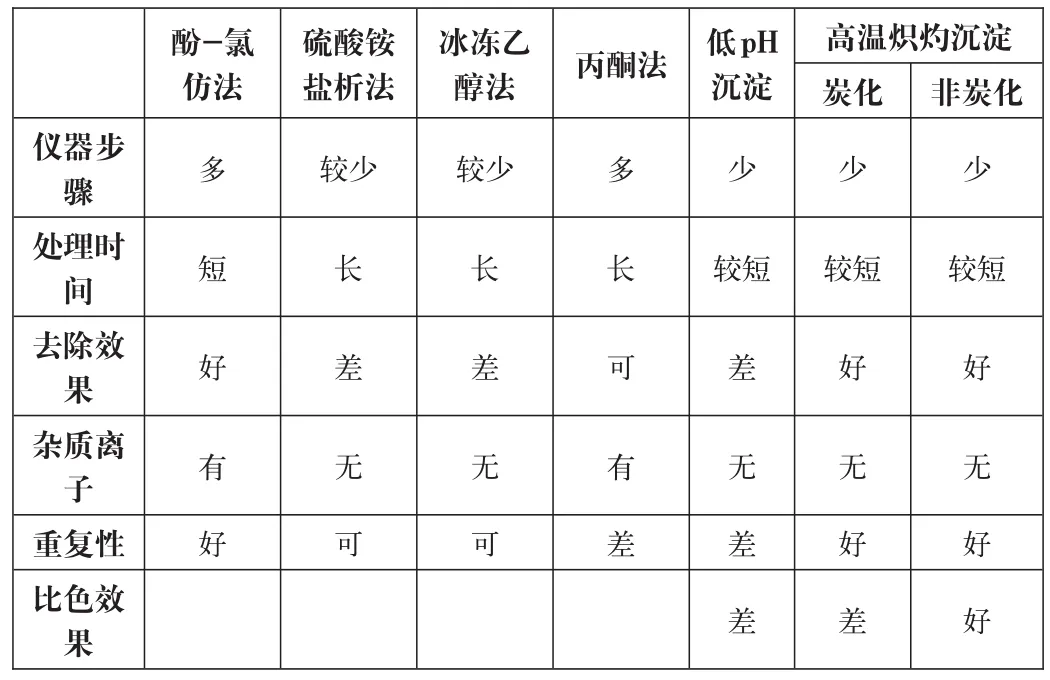
表2 .原液樣品蛋白去除主要方法的比較
3 檢測結果和結論
3.1 結果
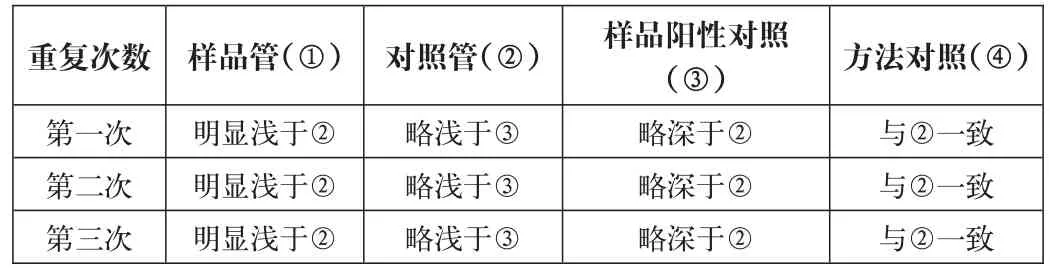
重復次數第一次第二次第三次樣品管(①)明顯淺于②明顯淺于②明顯淺于②對照管(②)略淺于③略淺于③略淺于③樣品陽性對照(③)略深于②略深于②略深于②方法對照(④)與②一致與②一致與②一致
熾灼非碳化去除蛋白法最終比色結果匯總分析詳見下表:
對照管顏色明顯深于樣品管,樣品陽性管顏色略深于對照管,證明蛋白沉淀對鐵離子的回收無顯著影響。方法對照組顏色也與對照組一致,證明高溫熾灼對鐵離子回收無顯著影響。
3.2 結論
熾灼非碳化去除蛋白法,對溶液鐵離子沒有明顯影響,而且操作簡單、易行,所用也是常規儀器,沒有新增其它有毒、有害試劑。比色效果穩定可靠,是一個含蛋白的液體制品檢測鐵殘留的可靠方法。
[1]2015版藥典二部,正文氯化鈉;附錄ⅧG鐵鹽檢查法

