咪唑乙煙酸降解菌的分離鑒定及降解條件優化
呂翻洋 許澤華 毛曉潔 孫建光
(1. 中國農業科學院農業資源與農業區劃研究所 農業部農業微生物資源收集與保藏重點實驗室,北京 100081;2. 寧夏農林科學院寧夏回族自治區銀川市 750002)
咪唑乙煙酸降解菌的分離鑒定及降解條件優化
呂翻洋1許澤華2毛曉潔1孫建光1
(1. 中國農業科學院農業資源與農業區劃研究所 農業部農業微生物資源收集與保藏重點實驗室,北京 100081;2. 寧夏農林科學院寧夏回族自治區銀川市 750002)
分離、鑒定除草劑咪唑乙煙酸降解菌IM9603并優化其降解條件。通過形態學,生理生化反應,16S rDNA初步鑒定該菌株分類地位,利用Box-Behnken優化該菌株對咪唑乙煙酸的降解條件。結果顯示,初步鑒定該菌株屬于表短桿菌屬,在條件(pH5.5,溫度26.2℃,接菌量1 mL(OD600=1))下降解能力最強,菌株IM9603在咪唑乙煙酸初始濃度為50 mg/L 的條件下在7 d內降解率可達93.08%。分離出的咪唑乙煙酸降解菌屬于Brevibacterium epidermidis菌株,該菌株對咪唑乙煙酸具有較高的降解能力,在環境修復方面存在潛在的應用前景。
咪唑乙煙酸;生物降解;短桿菌屬;響應面分析
環境中除草劑的降解主要有生物降解和非生物降解兩種方法[9],微生物是除草劑降解的主要因素,它可以利用除草劑為碳源或氮源供其自身生長和繁殖,從而達到降解除草劑的目的。微生物降解除草劑對環境無污染,安全性較高[10],所以分離篩選能高效降解咪唑乙煙酸的微生物是解決以上問題最為有效的途徑。目前國內外有關咪唑乙煙酸生物降解的報道較少,Ding[11]分離到一株降解菌BH-1,在72 h內能降解咪唑乙煙酸(500 mg/L-1)超過90%,該 菌 鑒 定 為 Alcaligenes sp.。Wang[12]發 現 菌 株WWX-1 Arthrobacter crystallopoietes可以利用咪唑乙煙酸作為唯一碳源生長。Liu[13]在中國東北黑土地分離到一株高效降解菌Acinetobacter baumannii IB5,并對其降解特性以及代謝產物進行了研究。
本研究利用長期施用咪唑乙煙酸的大豆田土壤樣品,采用富集馴化的方法分離得到1株可利用咪唑乙煙酸為唯一碳源生長同時可降解咪唑乙煙酸的菌株IM9603,并對其分類地位和降解特性進行了研究,同時優化其對咪唑乙煙酸的降解條件,以期為構建高效咪唑乙煙酸降解工程菌和降解酶制劑提供菌種資源。
1 材料與方法
1.1 材料
1.1.1 試劑 咪唑乙煙酸標準品(純度99%)購于美國Sigma-Aldrich公司,咪唑乙煙酸原藥(96%)由農藥檢定所提供。甲醇和乙腈均為色譜級,實驗中所用其他試劑均為分析純。高效液相色譜檢測所用樣品均用0.45 μm 的有機相針式過濾。
1.1.2 培養基 富集培養基(TYC):5 g 胰蛋白胨,5 g 酵母粉,1 g K2HPO4,1 g 葡萄糖,蒸餾水1 000mL。無機鹽培養基(MSM):1 g NH4NO3,1 g NaCl,0.5 g KH2PO4,1.5 g K2HPO4,0.1 g MgSO4· 7H2O,蒸餾水1 000 mL。
LB培養基:5 g酵母膏,10 g蛋白胨,10 g NaCl,蒸餾水1 000 mL。
1.2 方法
1.2.1 富集,分離咪唑乙煙酸降解菌 稱取10 g長期施用咪唑乙煙酸的大豆田土壤樣品并加入到含有100 mL富集培養基的250 mL三角瓶中,28℃、160r/min培養24 h,取上清液10 mL置于含100 mg/L咪唑乙煙酸的100 mL液體無機鹽培養基中,28℃、160 r/min黑暗培養,7 d后取10 mL轉接至含200 mg/L咪唑乙煙酸的100 mL無機鹽培養基中培養7 d。以此類推,連續富集培養至咪唑乙煙酸終濃度為800 mg/L。吸取100 μL富集液涂布于含800 mg/L咪唑乙煙酸的無機鹽平板上,28℃培養,直到平板上長出肉眼可見的菌落,挑取菌落進一步分離純化。共分離到12株形態差異的菌株。
將這12株菌株接種于液體LB培養基中,28℃生長24 h,離心收集菌體并用液體無機鹽培養基清洗菌體,調節OD600使OD600值為1,吸取以上菌懸液1 mL于100 mL含50 mg/L咪唑乙煙酸的無機鹽培養基中28℃、160 r/min黑暗培養,7 d后吸取培養液并用0.45 μm有機相針式過濾器過濾,用高效液相色譜(HPLC)測定菌株降解率。
1.2.2 降解菌的鑒定 選取降解率最高的菌株IM9603進行下一步研究。通過形態學,生理生化鑒定[14]及16S rDNA鑒定該菌株。16S rDNA擴增引物為通用引物:27F(AGAGTTTGATCCTGGCTCAG)和 1492R(TACGGTTACCTTGTTACGACTT)。 將PCR產物送至上海生工生物公司測序,測得序列提交至NCBI,并在網站EzTaxon 在線比對,采用MEGA 6.0構建系統發育樹。
1.2.3 咪唑乙煙酸降解菌降解條件優化 影響菌株降解的重要因素包括溫度、pH和接菌量[15]。本實驗所采用溫度范圍:20-40℃;pH:5.0-9.0;接菌量:1-3 mL(OD600= 1)。
采用Box-Behnken統計學試驗設計方法對以上3個影響因素進行試驗設計,試驗設計見表2,試驗結果為菌株IM9603在含有50 mg/L咪唑乙煙酸無機鹽培養基中生長第7天的降解率。
應用SAS統計學分析軟件對表2結果進行分析,同時繪制三維響應面圖,從而獲得最優降解條件的理論值。二項式如下所示:

Yi表示除草劑殘余量;Xi,Xj表示可變量;b0表示恒變量;bi表示線性系數;bij表示相互系數;bii表示二項系數。
1.2.4 菌株的生長以及咪唑乙煙酸降解率的測定 在最優條件(pH5.5,溫度26.2℃,接菌量1mL(OD600=1))下,將菌株IM9603接種于咪唑乙煙酸濃度為50 mg/L的液體無機鹽培養基中培養,每隔12 h取樣,并用分光光度計測定600 nm下的吸光值,繪制菌株IM9603的生長曲線。
在上述最優條件下每隔12 h取樣,經0.45 μm有機相針式過濾器過濾,將濾液置于4℃冰箱保存,并用高效液相色譜測定其峰面積。
高效液相色譜測定條件:Agilent 1100 Series(具有可調波長紫外分光檢測器),帶色譜工作站;色譜柱:C18 DiamosilTM 反相柱,250 mm×4.6 mm(i.d.),粒徑5 μm(迪馬公司)。流動相:乙腈 ∶水(冰乙酸調pH3.0)=40∶60檢測波長:258 nm;流速:1.0 mL/min;進樣體積:10 μL;柱溫:30℃。
1.2.5 降解菌對咪唑乙煙酸的降解動力曲線 向100 mL液體無機鹽液體培養基中加入96%的咪唑乙煙酸,使其終濃度依次為50、100、200、300、400mg/L,各接入 1 mL菌懸液(OD600=1),于 28℃、160 r/min、黑暗條件下培養。每個處理設置3個平行,每12 h之后取樣并測其峰面積計算降解率。
2 結果
2.1 降解菌的分離和生理生化特性
從東北大豆田土壤樣品中經過富集、篩選共分離到12株形態不同,具有降解咪唑乙煙酸能力的菌株,選取降解能力最強的菌株IM9603做進一步研究。菌株IM9603為革蘭氏陽性菌,在MSM培養基上呈圓形,中間凸,表面光滑,淡黃色,表面潮濕,不透明。生理生化特性測定結果,見表1。
2.2 菌株IM9603 16S rDNA系統發育分析
對菌株IM9603進行16S rDNA擴增并測序,序列在GenBank中的注冊號為(KX098473),經過EzTaxon在線比對發現菌株IM9603的16S rDNA與表皮短桿菌的16S rDNA相似度最高,相似性達99.19%,構建系統發育樹(圖1)。結合形態學特征、生理生化特性和系統發育樹分析,初步鑒定該菌株為表皮短桿菌(Brevibacterium epidermidis)。

表1 菌株IM9603 KX098473 生理生化反應測定
2.3 菌株降解條件的優化
應用SAS軟件對表2數據進行了回歸分析,得到咪唑乙煙酸殘留量(Y)對自變量溫度(X1),pH值(X2)和接種量(X3)的二次多項式方程如下:
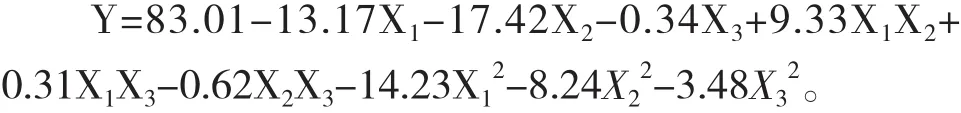
結果分析顯示溫度,pH值對菌株降解咪唑乙煙酸影響顯著(P<0.05),而菌體接種量和各因素之間的相互作用影響不顯著(P>0.05)。
在接種量為1 mL(OD600=1)的條件下,應用Box-Behnken繪制溫度、pH與咪唑乙煙酸殘留量之間的響應面圖(圖2)。在駐點處的溫度為26.2℃,pH為5.5時,咪唑乙煙酸殘留量最低。因此得出菌株IM9603降解咪唑乙煙酸的最優條件為:溫度26.2℃,pH5.5,接種量為1 mL(OD600=1)。
2.4 菌株生長和降解能力的測定
如圖3所示,在最優條件下第4天時菌株IM9603的生長和降解率均達到了最大值,咪唑乙煙酸的降解率在65%以上。4 d以后駐點開始衰退,降解能力隨之下降。在第7天時IM9603的降解率達到了90%以上。

圖1 菌株IM9603(KX098473)16S rDNA系統發育樹

表2 Box-Behnken試驗設計

圖2 接菌量為1 mL(OD600 =1),溫度和pH值對菌株IM9603降解咪唑乙煙酸的響應面圖

圖3 最優條件下菌株IM9603的生長曲線和咪唑乙煙酸的降解
2.5 菌株在不同濃度咪唑乙煙酸的降解動力曲線
在最優條件下菌株IM9603的降解動力學曲線,如圖4所示,在第5天時咪唑乙煙酸初始濃度為50 mg/L和100 mg/L時,降解率分別達到了89.98% 和87.05%,咪唑乙煙酸初始濃度為200 mg/L和300 mg/L時降解率分別達到77.49% 和 69.43%。然而,咪唑乙煙酸初始濃度為400 mg/L時,降解率只有64.56%。

圖4 最優條件下菌株IM9603對除草劑咪唑乙煙酸的降解動力曲線
3 討論
本研究以咪唑乙煙酸為唯一碳源,從土壤樣品中分離得到一株高效降解菌IM9603。經過形態學特征觀察、生理生化實驗、16S rDNA序列分析,將其鑒定為表皮短桿菌屬。到目前為止,研究者已經分離到多種可以降解咪唑乙煙酸的微生物,包括細菌、真菌和放線菌等[16],其中對細菌及真菌的研究較為深入。在細菌降解除草劑的研究中,假單胞菌屬、芽孢菌屬、黃桿菌屬和產堿菌屬等研究較多,對咪唑乙煙酸的降解能力較強[17]。本研究分離得到的表皮短桿菌具有高效降解咪唑乙煙酸的能力,目前尚未見該菌屬對咪唑乙煙酸降解的相關報道。
除草劑的生物降解是目前除草劑降解研究的熱點,并且已經取得了相當大的研究進展,但是應用微生物進行實際的生物修復往往受到環境中很多因素的影響,如環境樣品中的pH,水分及有機質的含量、溫度等都影響著除草劑的降解[18]。研究表明,不同比例的腐殖酸可以加快咪唑乙煙酸的降解速率[19]。本研究針對性的選擇了pH(5.0-9.0)和溫度(20-40)℃接菌量(1-3 mL)為影響因子通過Box-Behnken響應面法設計實驗,優化菌株IM9603對咪唑乙煙酸在不同溫度以及pH條件下的降解,探究其在不同條件下的降解能力,從而達到應用的潛力。結果表明在最優條件(pH5.5,溫度26.2℃,接菌量1 mL(OD600=1))下,菌株IM9603降解能力最強。
降解動力學的研究為實際生產過程中除草劑的處理提供了理論依據,進而達到減少能耗同時縮短降解周期的目的[20]。本研究發現在不同濃度咪唑乙煙酸的降解動力曲線中,菌株IM9603均表現出降解能力,在咪唑乙煙酸含量為50 mg/L降解能力最強,降解率可達93%。在咪唑乙煙酸濃度為400 mg/L時降解能力最差,降解率僅為64%。因此,在菌株IM9603實際應用過程中可以通過稀釋等方法調整咪唑乙煙酸的濃度,從而實現對咪唑乙煙酸的高效降解。
隨著研究的進一步深入以及研究者對除草劑降解規律的掌握,除草劑的生物降解將會有很大的發展空間,在除草劑環境污染的治理過程中將發揮巨大的作用[21],如何實現高效、安全、低成本、無二次污染[22]降解是咪唑乙煙酸生物降解未來發展方向。有關該菌株對咪唑乙煙酸的代謝產物的測定,其在土壤中的生態學行為,以及其降解基因的克隆及調控和降解酶制劑等相關研究還待深入。
4 結論
從大豆田土壤樣品中分離到一株高效咪唑乙煙酸降解菌IM9603,經形態學、生理生化以及16S rDNA初步鑒定為表皮短桿菌Brevibacterium epidermidis。基于Box-Behnken試驗設計,結合SAS軟件進行了響應面分析,優化得到了菌株IM9603對除草劑咪唑乙煙酸降解的最優條件(溫度26.2℃;pH為5.5)在此最優條件下,菌株IM9603在7 d時對50 mg/L濃度的咪唑乙煙酸降解率達到了90%以上,同時,測定了菌株IM9603在最優條件下對咪唑乙煙酸降解的動力學曲線,結果表明在低濃度咪唑乙煙酸含量情況下降解率更高。
[1]Espy R, Pelton E, Opseth A, et al. Potodegradation of the herbicide imazethapyr in aqueous solution:effects of wavelength, pH, and natural organic matter(NOM)and analysis of photoproducts[J].Journal of Agricultural and Food Chemistry, 2011, 59:7277-7285.
[2]Kaloumenos N, Capote N, Aguado A, et al. Red rice(Oryza sativa)cross-resistance to imidazolinone herbicides used in resistant rice cultivars grown in northern Greece[J]. Pesticide Biochemistry and Physiology, 2013, 105:177-183.
[3]Goeiz J, Lavy T, Gbur E. Degradation and field persistence of imazethapyr[J]. Weed Science, 1990, 38 :421-428.
[4]Singh H, Reager ML, Verma JK, et al. Growth, yield performance and nutrient content as influenced by intercropping and weed control measures in moth bean[J]. Environment and Ecology, 2017, 35 :193-196.
[5]劉亞光, 龐福德. 咪唑乙煙酸高效降解菌降解性能的研究[J].植物保護, 2009, 35(2):63-66.
[6]Perez-Iglesias JM, Soloneski S, Nikoloff N, et al. Toxic and genotoxic effects of the imazethapyr-based herbicide formulation Pivot H(R)on montevideo tree frog Hypsiboas pulchellus tadpoles(Anura,Hylidae)[J]. Ecotoxicology and Environmental Safety, 2015,119:15-24.
[7]García-Garijo A, Palma F, Iribarne C, et al. Alterations induced by imazamox on acetohydroxyacid synthase activity of common bean(Phaseolus vulgaris)depend on leaf position[J]. Pesticide Biochemistry and Physiology, 2012, 104:72-76.
[8] García-Garijo A, Palma F, Lluch C, et al. Physiological and biochemical responses of common vetch to the imazamox accumulation[J]. Plant Physiology and Biochemistry, 2013, 73:321-325.
[9]Maria S, Jens A, Sebastian R, et al. Microbial degradation of the benzonitrile herbicides dichlobenil, bromoxynil and ioxynil in soil and subsurface environments—Insights into degradation pathways,persistent metabolites and involved degrader organisms[J].Environmental Pollution, 2008, 154:155-168.
[10]Aiehele TM, Penner D, Penner D. Adsorption, desorption and degradation of imidazolinones in soil[J]. Weed Technology,2005, 19:154-159.
[11]Ding W, Cheng Z, Qu JJ, et al. Isolation and identification of imazethapyr degradable bacteria and its degradation characteristics[J]. Huan Jing Ke Xue, 2008, 29 :1359-1362.
[12] Wang X, Liu X, Wang H, et al. Utilization and degradation of imazaquin by a naturally occurring isolate of Arthrobacter crystallopoietes[J]. Chemosphere, 2007, 67 :2156-2162.
[13]Liu CG, Yang X, Lai Y, et al. Imazamox microbial degradation by common clinical bacteria:Acinetobacter baumannii IB5 isolated from black soil in China shows high potency[J]. Journal of Integrative Agriculture, 2016, 15:1798-1807.
[14]東秀珠, 蔡妙英. 常見細菌系統鑒定手冊[M]. 北京:科學出版社, 2001:267-273.
[15]Zhang C, Wang SH, Yan YC. Isomerization and biodegradation of beta-cypermethrin by Pseudomonas aeruginosa CH7 with biosurfactant production[J]. Bioresource Technology, 2011,102:7139-7146.
[16]陳玉潔, 束長龍, 劉新剛. 咪唑乙煙酸降解菌分離、鑒定及降解特性研究[J]. 農藥學學報, 2011, 13(4):387-389.
[17] Diamond ML, de Wit CA, Molander S, et al. Exploring the planetary boundary for chemical pollution[J]. Environment International,2015, 78:8-15.
[18]Gangadharan D, Sivaramakrishnan S, Nampoothiri KM, et al.Response surface methodology for the optimization of alpha amylase production by Bacillus amyloliquefaciens[J]. Bioresource Technology, 2008, 99:4597-4602.
[19]Huang X, Pan J, Liang B, et al. Isolation, characterization of a strain capable of degrading imazethapyr and its use in degradation of the herbicide in soil[J]. Current Microbiology, 2009, 59 :363-367.
[20]洪昌紅, 黃本勝, 邱靜等. 對硝基酚在超高交聯吸附樹脂NDA-701 上的脫附行為研究[J]. 環境科學, 2011, 32:1388-1393.
[21]Villaverde J, Rubio-Bellido M, Merchan F, et al. Bioremediation of diuron contaminated soils by a novel degrading microbial consortium[J]. Journal of Environmental Management, 2017,188:379-386.
[22]陳玉潔, 張浩, 張杰. 咪唑乙煙酸降解菌研究進展[J]. 公共植保與綠色防控, 2010, 3:208-213.
Isolation and Identification of an Imazethapyr-degrading Bacterium,and Optimization of Biodegradation Conditions
Lü Fan-yang1XU Ze-hua2MAO Xiao-jie1SUN Jian-guang1
(1. Key Laboratory of Microbial Resources,Ministry of Agriculture / Institute of Agricultural Resources and Regional Planning,Chinese Academy of Agricultural Sciences,Beijing 100081 ;2. Germplasm Resources Institute,Ningxia Academy of Agriculture and forestry Sciences,Yinchuan 750002)
This work aims to isolate and identify the strain IM9603 degrading herbicide imazethapyr,and optimize the degradation condition. IM9603 was identified as Brevibacterium sp. based on morphological,physio-biochemical characteristics,and analysis of 16S rDNA.Response surface methodology Box-Behnken was applied to optimize the degradation conditions. As results,strain IM9603 degraded 93.08% of the initial 50 mg/L supply of imazethapyr under the optimal condition(pH5 and 26.2℃)within 7 days,which was its best degradability. The isolated imazethapyr-degrading strain was Brevibacterium epidermidis,and presented high degradability to imazethapyr,suggesting that is owns a great potential in the environmental rehabilitation caused by imazethapyr.
imazethapyr;biodegradation;Brevibacterium sp.;response surface methodology
10.13560/j.cnki.biotech.bull.1985.2017-0076
咪唑酮類除草劑從20世紀80年代開始被廣泛應用于大豆田化學除草[1]。該類除草劑主要通過抑制植物乙酰乳酸合酶(ALS)合成,阻斷植物必需氨基酸的合成從而使植物死亡[2],目前已經被證實該類除草劑殘留時間較長,不僅對后茬作物造成嚴重危害,導致輪作困難,同時還給環境帶來了嚴重的污染[3]。
咪唑乙煙酸(imazethapyr)是咪唑酮類除草劑的種類之一,它具有殺草譜廣、選擇性強、活性高等優點[4]。在20世紀90年代它曾是美國大豆田的第一大除草劑品種,目前主要在中國東北地區大豆田中使用[5],主要用來控制一年生及多年生闊葉雜草。該類除草劑有效期長,在土壤中的吸附系數較低,而且在水中的溶解度較大,不僅對下茬敏感作物產生要害,同時有可能對地下水造成一定程度的污染[6]。García-Garijo[7-8]發現咪唑乙煙酸可以快速積累在下茬作物中,如大豆和野豌豆中,在植物組織中抑制ALS的產生。鑒于咪唑乙煙酸的廣泛使用和相關風險,快速有效去除農田土壤中咪唑乙煙酸殘留物是至關重要的問題。
2017-02-13
公益性行業(農業)科研專項(201203045)
呂翻洋,女,碩士研究生,研究方向:環境微生物;E-mail:lvfanyang150@163.com
孫建光,男,博士后,研究員,研究方向:農業微生物資源,環境污染修復;E-mail:jgsun@caas.ac.cn
(責任編輯 狄艷紅)

