細菌對城市污水中斜生柵藻生長與產脂的影響
韓松芳,金文標,涂仁杰,周 旭,陳洪一
?
細菌對城市污水中斜生柵藻生長與產脂的影響
韓松芳,金文標*,涂仁杰,周 旭,陳洪一
(哈爾濱工業大學深圳研究生院,深圳微藻生物能源工程實驗室,廣東深圳 518055)
研究并分析了EM菌和LAS菌對斜生柵藻()生長和油脂積累的促進作用.結果表明:添加上述2種細菌對城市污水中斜生柵藻的干重和油脂產量有顯著的促進作用,其油脂產量分別提高了36.2%和21.5%.通過對生成的脂肪酸甲酯進行氣相色譜分析,結果顯示EM菌的添加提升了斜生柵藻單不飽和脂肪酸的含量,有利于提升所得生物柴油的質量.培養結束后污水的菌群結構分析顯示投加細菌會增加污水中菌群的豐富度和多樣性,且相比于對照組,加菌后的試驗組中-、-豐度有所提高,而擬桿菌門()豐度有所降低.
斜生柵藻;城市污水;細菌;產脂
隨著能源危機與環境污染的加劇,微藻生物柴油越來越受到各國研究者的關注[1-3].微藻培養是其中一個重要環節,在微藻培養過程中,利用淡水培養微藻需消耗大量淡水資源,有悖于當前淡水資源緊缺的背景.同時,營養物質的投加進一步提高了微藻的培養成本[4-6].利用城市污水培養微藻可為微藻的生長提供豐富的氮磷等營養物質,有利于污水的資源化利用.
城市污水中含有大量的細菌,微藻與細菌之間存在互生、拮抗等復雜的相互關系[7].目前,關于菌藻的研究多集中在利用菌藻改善污水水質方面[8],如王冰等[9]研究表明小球藻和光合細菌共培養對污水中氨氮有較好的去除效果,氨氮去除率在4h內可達到80%.此外關于菌藻的研究多集中在利用細菌促進微藻在人工培養基中的生長與產脂方面.如Gonzalez等[10]構建了巴西固氮螺菌-普通小球藻共生系統,有效促進了藻細胞重量的大幅增加;Mayali等[11]發現甲藻()藻株NOAA1 共棲細菌群落中的某種細菌與一種殺藻的細菌41-DBG2競爭營養物質并占有優勢,因而間接地保護了微藻免受殺藻細菌的攻擊,從而促進了微藻的生長.但目前的研究中,將菌藻共生系統同時應用于實際城市污水處理與微藻培養制備生物柴油的研究報道較少,也極少關注微藻培養后菌群結構的變化情況[12-13].
斜生柵藻是一種具有高產脂效率的微藻[14].鑒于城市污水含有大量的原生菌類,且微藻與細菌之間存在著互生、拮抗等復雜的相互關系.本研究將基于城市污水系統中菌藻共生體系,篩選出能夠有效促進斜生柵藻生長和油脂積累的細菌,并對微藻培養后城市污水中菌群結構進行分析,以期為微藻培養與污水資源化利用耦合技術的推廣應用奠定基礎.
1 材料與方法
1.1 試驗藻種、菌種及培養
試驗所用藻種斜生柵藻()購買于中國科學院(武漢)水生生物研究所淡水藻種庫,藻種采用BG11培養基[15]進行傳代培養保藏.所選取的細菌共有兩個來源:水產養殖領域常用的對水質具有凈化作用的光合細菌(廣東省菌種保藏中心)、EM菌和枯草芽孢桿菌(河南中廣集團天義生物谷);課題組前期從污水中篩選的高效氨化菌[16]、聚磷菌、陰離子洗滌劑降解菌(LAS菌)[17]、二甲基甲酰胺降解菌(DMF菌)[18].
試驗所用城市污水取自深圳大學城市政污水井,經潛污泵抽取除去粗大懸浮物后使用,污水水質COD、TP、TN、NH4+-N分別為 140~200, 5.0~6.5,20~45,20~40mg/L.初步篩選對斜生柵藻產脂有促進作用的菌種時,將不同種類菌液分別投加于城市污水中,使投加后扣除基質吸光度值細菌懸液的吸光度值為600=0.02.進一步優化菌液投加量時,使投加菌液后扣除基質吸光度值細菌懸液的吸光度值600為 0、0.002、0.02、0.04、0.06.以BG11培養基培養處于對數生長期的斜生柵藻為種子液,等量分別接種于各試驗組中,使接種后培養體積為600mL,以相應的未加斜生柵藻,投加菌劑的城市污水為空白對照,使扣除空白后藻液初始吸光度為680=0.1.于氣泡柱式光生物反應器(直徑為5cm、長度50cm、容積大小約為1L)培養,以僅接種斜生柵藻,未投加細菌組作為試驗對照組,于培養溫度(25±1)℃,光照強度100mmol/(m2·s),光暗比(L:D)為12:12h條件下,連續通氣培養(空氣流速為120mL/min,由底部通入).取培養達到穩定期的藻液測定扣除空白后藻細胞的干重、油脂產量.每組試驗設3個平行對照.
1.2 微藻干重的測定
微藻的干重采用重量法測定,10mL藻液經預稱重(1)的微孔濾膜(0.45μm)過濾、洗滌,于105℃下烘至恒重(2),不加微藻的空白對照組過濾烘干前后的質量差為0,微藻干重DW(g/L)的計算公式如下:
DW=(2-1-0)/ 0.01 (1)
1.3 微藻油脂產量與脂肪酸組成的測定
微藻油脂提取采用氯仿甲醇共溶劑提取法[19].待提取結束后,收集氯仿相,轉移至預稱重的錫紙盤中,待有機溶劑揮發完全后,于80℃烘箱中烘至恒重,得到微藻油脂產量,微藻細胞油脂含量為微藻油脂產量與微藻干重的百分比.
微藻脂肪酸分析,首先對提取的油脂進行甲酯化[20],將5mL藻液中脂肪酸轉化成相對應的脂肪酸甲酯.采用賽里安456-GC氣相色譜儀進行分析,色譜柱為BR-2560柱,100m′0.25mm(內徑)′0.20μm(膜厚),FID檢測器,分流方式進樣,分流比為30:1,進樣量為1μL.
1.4 菌群結構分析方法
微生物菌群結構的研究主要是通過對細菌16S rRNA的V4V5高可變區基因進行測序,并基于測序結果進行數據篩選以及微生物菌群信息的分析.主要包括:細菌組DNA提取、PCR擴增、電泳驗證、PCR產物純化與濃度測定、高通量測序以及測序結果分析.
1.5 數據分析方法
數據采用統計軟件SPSS21.0進行單因素方差分析(one-way ANOVA),采用LSD法進行統計檢驗(<0.05).
2 結果與討論
2.1 細菌促進斜生柵藻產脂的初步優化
菌藻間存在著共生、拮抗等復雜的相互關系,不同細菌對斜生柵藻干重與產脂的影響如圖1所示.從圖1中可以看出,所投加的細菌,其中大多數對斜生柵藻干重影響不大,說明了斜生柵藻對環境良好的適應性.其中投加EM菌的情況下斜生柵藻干重增加最為顯著,相比未投加細菌的試驗對照組(WW)提高了16.8%(<0.05).微藻的脂肪產量由微藻干重和微藻油脂含量共同決定,總體表現為EM菌、LAS菌對斜生柵藻的油脂產量增長有促進作用(<0.05),油脂產量相比于試驗對照組提高了36.9%、19.6%,其他細菌對斜生柵藻的油脂產量無顯著影響.故選取EM菌、LAS菌作為后續進一步優化的對象.
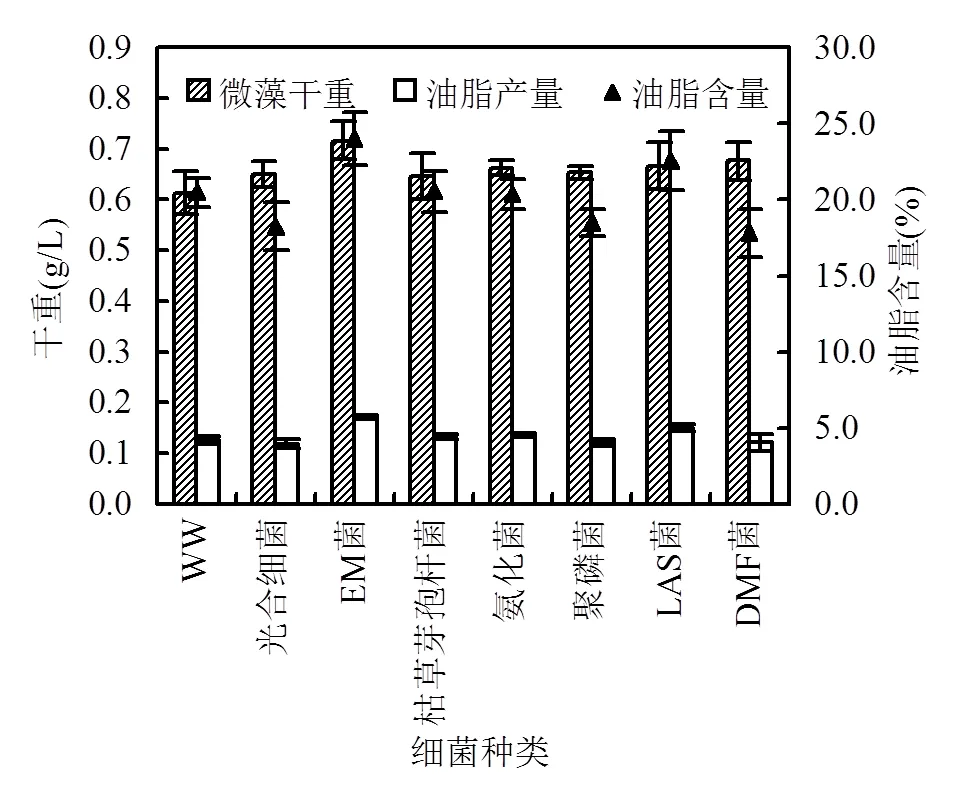
圖1 斜生柵藻在投加不同細菌城市污水中的產脂情況
2.2 細菌促進斜生柵藻產脂的進一步優化
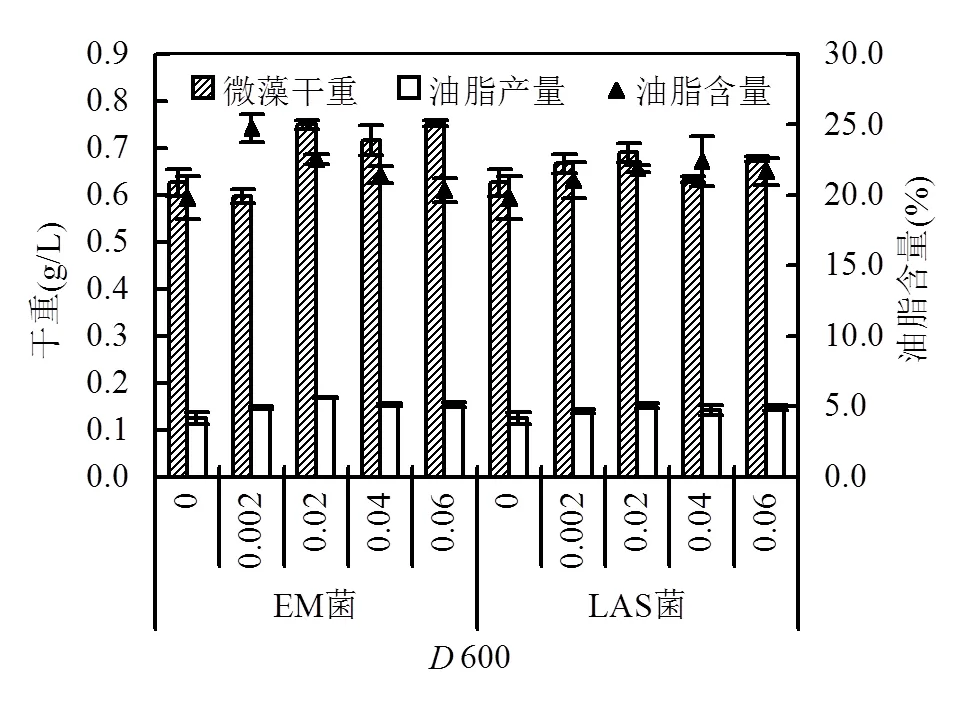
圖2 斜生柵藻在添加不同量細菌城市污水中油脂產量
2.2.1 菌種最佳濃度的確定 細菌可以分解有機物為微藻生長提供所需碳源,但細菌與微藻間亦存在著空間與營養物質的競爭,因此對EM菌、LAS菌在城市污水中的投加量進行進一步優化,以尋求最佳的細菌投加量.從圖2中可以看出,EM菌與LAS菌600值均為0.02時,對斜生柵藻的產脂促進作用最大,斜生柵藻油脂產量分別可達0.17 和0.15g/L,相較于試驗對照組顯著提高了36.2%和21.5%(<0.05).因此選取初始吸光度600為0.02的EM菌和LAS菌作為后續研究對象.
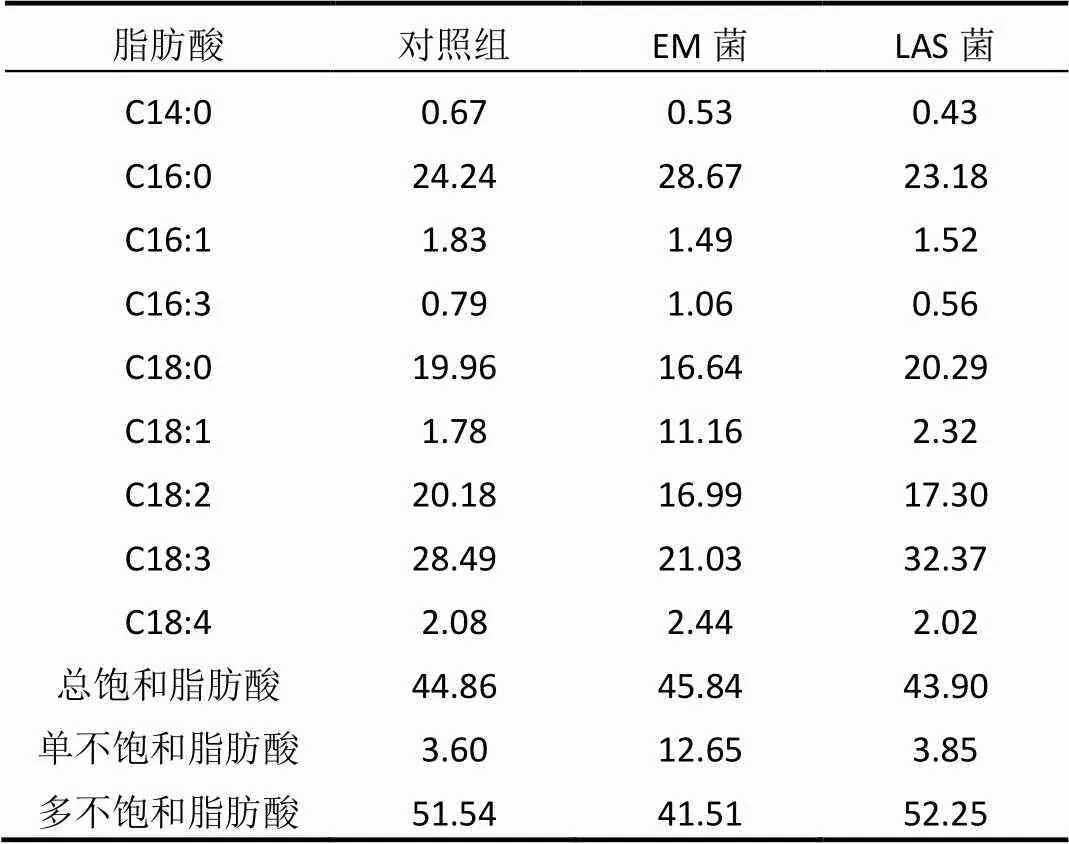
表1 添加細菌組與對照組脂肪酸分析
2.2.2 細菌對斜生柵藻脂肪酸甲酯的影響 投加EM菌、LAS菌與空白對照組的斜生柵藻脂肪酸組成如表1所示.由表1可知,各試驗組斜生柵藻脂肪酸組成均以C16、C18為主,為綠藻中常見脂肪酸[21-22].Song等[23]和Ma等[24]的研究表明,適合制備生物柴油的原料應含有較多的C16~C18脂肪酸,主要包括十六烷酸(C16:0)、十八烷酸(C18:0)、十八烯酸(C18:1)、十八碳二烯酸(C18:2)、十八碳三烯酸(C18:3).對照組與投加EM菌、LAS菌的試驗組中該5種脂肪酸在總脂肪酸中的含量占比分別可達94.65%、94.49%、95.46%,適宜于作為制備生物柴油的原料.同時,脂肪酸甲酯的結構會對生物柴油的性能(十六烷值、低溫流動性、氧化安定性等)產生影響.研究表明,生物柴油的十六烷值隨著飽和脂肪酸甲酯含量的增加而增加,多不飽和脂肪酸甲酯含量的增加而降低[25].生物柴油低溫流動性隨著飽和脂肪酸甲酯尤其是長碳鏈質量分數增高而變差.生物柴油的氧化安定性隨著不飽和脂肪酸不飽和度增高而變差.高品位的生物柴油應盡量少的含有多不飽和脂肪酸甲酯和飽和脂肪酸甲酯,盡量多的含有單不飽和脂肪酸,以改善其十六烷值、低溫流動性、氧化安定性、運動粘度等性能[26].從表1中可以看出,投加LAS菌后,各成分含量變化不大,但投加EM菌的試驗組中單不飽和脂肪酸的含量相比于對照組提高了251%,有利于提升所得生物柴油的質量.
2.3 細菌對菌群結構影響
取培養達到穩定期的試驗對照組與投加細菌(EM菌、LAS菌)的試驗組藻液,通過DNA提取、16S V4V5高變區PCR擴增,高通量測序考察藻液中菌群的組成與多樣性.
2.3.1 菌群多樣性分析 菌群多樣性是指某個集合群落內,不同類型微生物的變化以及它們之間的相對豐度.一般而言,系統中微生物菌群多樣性越高,越有利于抵抗外界環境的變化,較快的進行系統自我調整和更新.
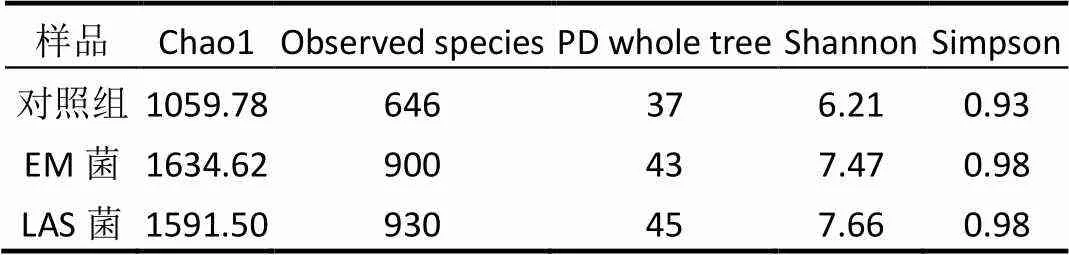
表2 不同樣品的生物多樣性
Alpha多樣性主要關注局域均勻生境下的物種數目,因此也被稱為生境內的多樣性.多樣性指數是反映豐富度和均勻度的綜合指標,與以下兩個因素有關:(1)種類數目,即豐富度;(2)種類中個體分配上的均勻性.群落豐富度指數,包括Chao1指數和observed species指數,數值越大,說明樣品中物種越豐富;群落多樣性的指數,包括PD whole tree指數、Shannon指數和 Simpson指數,數值越大,說明樣品群落多樣性越高.所得試驗組與對照組樣品的Alpha多樣性參數統計結果如表2所示.從表2可以看出,投加EM菌、LAS菌的試驗組各項指數均大于對照組,表明投加細菌會提高斜生柵藻藻液中菌群的豐富度和多樣性,有利于系統穩定.
2.3.2 主導菌群分析 對投加EM菌、LAS菌的試驗組與試驗對照組有效序列在不同物種分類水平上的豐度進行分析.圖3(a)為樣品在門分類級別上的豐度.從圖中可以看出,對照組與試驗組在門級別上,均以變形菌門()占主導.這與世界各地分布的污水處理廠中微生物菌群結構的相關報道一致[27].對污水中有機物具有較好降解作用,試驗對照組與投加EM菌、LAS菌組,豐度分別高達62.3%、73.8%和87.2%,可為斜生柵藻生長提供所需二氧化碳.其他占主導的門為擬桿菌門()豐度分別為33.1%、24.4%和10.6%.有研究表明擬桿菌門是太湖中占主導的藻際微生物之一,除了可以降解復雜有機大分子外,還可裂解微囊藻細胞與藍藻細胞[28],加菌處理組相比于試驗對照組斜生柵藻生物量增加,擬桿菌門豐度降低,可能與擬桿菌門對微藻的裂解作用有關.圖3(b)為樣品在綱分類級別上的豐度,由于門的豐度高達62.3%~87.2%,且處理組比對照組有大幅度提高,因而分析了其下屬的-、-、-、-、-的豐度.結果表明,試驗對照組-的豐度最大,為39.4%,其它依次為β-、-,豐度分別為12.9%、9.8%.而投加EM菌與LAS菌組,-的豐度(分別為32.1%、28.8%)均有所降低,-的豐度(分別為28.6%、31.4%)與-的豐度(分別為12.9%、26.9%)相較于對照組均有較大幅度增高.研究表明-、-均為水華期間占主導的藻際微生物[28],尤其是-是典型的植物(包括微藻)生長促進細菌[29].此外,,對微藻絮凝有關鍵作用[30],加菌處理組的降低,可一定程度減少斜生柵藻的絮凝沉降,更有利于斜生柵藻與環境中營養物質的充分接觸,從而有利于其生長.
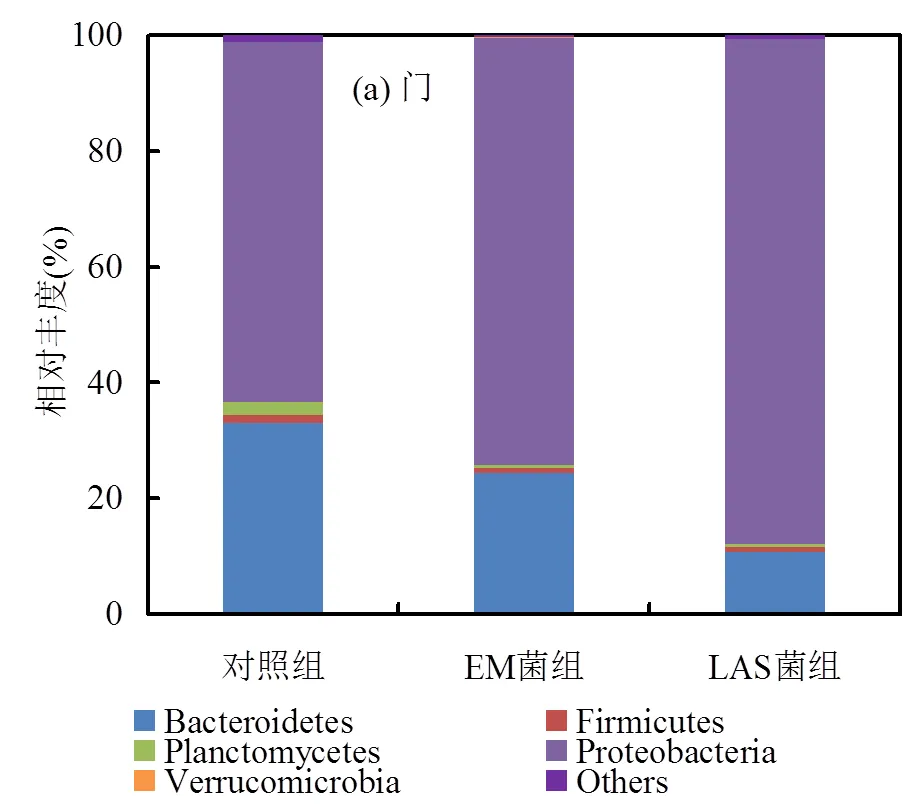
(a)
(b)
圖3 樣品在不同層級上的豐度
Fig.3 The relative abundances of the samples
3 結論
3.1 城市污水中EM菌初始吸光度600為0.02, LAS菌初始吸光度600為0.02時,對斜生柵藻的干重和油脂產量促進作用最顯著,油脂產量分別可達0.17和0.15g/L,比試驗對照組提高了36.2%和21.5%.通過對生成的脂肪酸甲酯進行氣相色譜分析,結果顯示EM菌的添加可提升斜生柵藻單不飽和脂肪酸的含量,有利于提升所得生物柴油的質量.
3.2 培養結束后污水的菌群結構分析顯示投加細菌會增加污水中菌群的豐富度和多樣性,且加菌后的試驗組中豐度有所降低,-、-豐度增加.
[1] Chisti Y. Constraints to commercialization of algal fuels [J]. Journal of Biotechnology, 2013,167(3):201-214.
[2] Han S F, Jin W B, Tu R J,et al. Biofuel production from microalgae as feedstock: current status and potential [J]. Critical Reviews in Biotechnology, 2015,35(2):255-268.
[3] Abomohra A E, Jin W B, Tu R J, et al. Microalgal biomass production as a sustainable feedstock for biodiesel: current status andperspectives [J]. Renewable & Sustainable Energy Reviews, 2016,64(64):596–606.
[4] Yang J, Xu M, Zhang M X, et al. Life-cycle analysis on biodiesel production from microalgae: Water footprint and nutrients balance [J]. Bioresource Technology, 2011,102:159-165.
[5] Morales-Amaral M d M, Gómez-Serrano C, Acién F G, et al. Production of microalgae using centrate from anaerobic digestion as the nutrient source [J]. Algal Research, 2015,9:297–305.
[6] Han S F, Jin W B, Tu R J, et al. Optimization of aeration for biodiesel production bygrown in municipal wastewater [J]. Bioprocess and Biosystems Engineering, 2016, 39(7):1073-1079.
[7] 張亞雷,褚華強,周雪飛,等.廢水微藻資源化處理原理與技術 [M]. 北京:科學出版社, 2015:166-169.
[8] 巫小丹,阮榕生,王 輝,等.菌藻共生系統處理廢水研究現狀及發展前景[J]. 環境工程, 2014,(3):34-37.
[9] 王 冰,周集體,楊寶靈,等.光合細菌-藻類共固定深度凈化污水的研究[J]. 大連民族學院學報, 2014,16(3):249-252.
[10] Gonzalez L E, Bashan Y. Increased growth of the microalgaewhen coimmobilized and cocultured in alginate beads with the plant-growth-promoting bacterium Azospirillum brasilense [J]. Applied and Environmental Microbiology, 2000,66(4):1527-1531.
[11] Mayali X, Doucette G J. Microbial community interactions and population dynamics of an algicidal bacterium active against Karenia brevis (Dinophyceae) [J]. Harmful Algae, 2002,1(3): 277-293.
[12] Ramsundar P, Guldhe A, Singh P, et al. Assessment of municipal wastewaters at various stages of treatment process as potential growth media forunder different modes of cultivation [J]. Bioresource Technology, 2017,227:82-92.
[13] Ryu B G, Kim E J, Kim H S, et al. Simultaneous treatment of municipal wastewater and biodiesel production by cultivation ofwith indigenous wastewater bacteria [J]. Biotechnology and Bioprocess Engineering, 2014,19(2):201-210.
[14] Abomohra A E, Wagner M, El-Sheekh M, et al. Lipid and total fatty acid productivity in photoautotrophic fresh water microalgae: screening studies towards biodiesel production [J]. Journal of Applied Phycology, 2013,25(4):931-936.
[15] Stainier R Y, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order Chroococcales) [J]. Bacteriology Reviews, 1971,35(2):171?205.
[16] 閆 韞.布吉河生物修復過程中氮循環功能菌群分布研究[D]. 哈爾濱:哈爾濱工業大學, 2008.
[17] 丁彬彬.菌藻生物轉盤中LAS高效降解菌群的構建與分析 [D]. 哈爾濱:哈爾濱工業大學, 2010.
[18] 孫萃芳.二甲基甲酰胺降解菌的分離篩選及其降解途徑的研究 [D]. 哈爾濱:哈爾濱工業大學, 2010.
[19] Folch J, Lees M, Stanley G H S. A simple method for the isolation and purification of total lipids from animal tissues [J]. Journal of Biological Chemistry, 1957,226:497-509.
[20] Kaczmarzyk D, Fulda M. Fatty acid activation in cyanobacteria mediated by acyl-acyl carrier protein synthetase enables fatty acid recycling [J]. Plant Physiology, 2010,152(3):1598–1610.
[21] 劉林林,黃旭雄,危立坤,等.15株微藻對豬場養殖污水中氮磷的凈化及其細胞營養分析 [J]. 環境科學學報, 2014,34(8):1986-1994.
[22] Vidyashankar S, VenuGopal K S, Swarnalatha G V, et al.Characterization of fatty acids and hydrocarbons of chlorophycean microalgae towards their use as biofuel source [J]. Biomass & Bioenergy, 2015,77:75-91.
[23] Song M, Pei H, Hu W,et al. Evaluation of the potential of 10microalgal strains for biodiesel production [J]. Bioresource Technology, 2013,141:245–251.
[24] Ma Y, Wang Z, Yu C,et al. Evaluation of the potential of 9strains for biodiesel production [J]. Bioresource Technology, 2014,167:503–509.
[25] Stansell G R, Gray V M, Sym S D. Microalgal fatty acid composition: implications for biodiesel quality [J]. Journal of Applied Phycology, 2012,24(4):791-801.
[26] Hoekman S K, Broch A, Robbins C, et al. Review of biodiesel composition, properties, and speci?cations [J]. Renewable & Sustainable Energy Reviews, 2012,16:143–169.
[27] Zhang T, Shao M F, Ye L. 454Pyrosequencing reveals bacterial diversity of activated sludge from 14sewage treatment plants [J]. ISME Journal, 2012,6(6):1137-1147.
[28] Shao K Q, Zhang L, Wang Y P,et al. The responses of the taxa composition of particle-attached bacterial community to the decomposition of Microcystis blooms [J]. Science of the Total Environment, 2014,488-489:236-242.
[29] Ramanan R, Kang Z, Kim B, et al.Phycosphere bacterial diversity in green algae reveals an apparent similarity across habitats [J]. Algal Research, 2015,8:140-144.
[30] Lee J, Cho D, Ramanan R, et al.Microalgae-associated bacteria play a key role in the flocculation of[J]. Bioresource Technology, 2013,131:195-201.
Effects of bacteria on growth and lipid production ofcultivated in municipal wastewater.
HAN Song-fang, JIN Wen-biao*, TU Ren-jie, ZHOU Xu, CHEN Hong-yi
(Shenzhen Engineering Laboratory of Microalgal Bioenergy, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China)., 2017,37(10):3867~3872
In the study, EM bacteria and LAS bacteria were found to enhance the growth and lipid production ofcultivated in municipal wastewater. The results showed that the lipid production ofwas increased by 36.2% and 21.5% after adding the above-mentioned bacteria, respectively. According to the GC analysis of the lipids, EM bacteria could increase the content of monounsaturated fatty acid in, and thus improving the grade of biodiesel. The analysis of microbial community structure in municipal wastewater showed that the richness and diversity of bacteria in wastewater were increased significantly. In addition, the abundances of-、-were increased, while the abundance ofwas decreased.
;municipal wastewater;bacteria;lipid production
X172
A
1000-6923(2017)10-3867-06
韓松芳(1989-),女,河南周口人,哈爾濱工業大學深圳研究生院博士研究生,主要從事微藻生物質能源與污水資源化研究.
2017-03-22
深圳市科技計劃資助項目(JCYJ20150529114024234)
* 責任作者, 教授, jinwb@hit.edu.cn

