交聯(lián)羧甲基殼聚糖小球對水體中Ni2+的去除研究*
謝燕華 張璐璐 刁志強 劉 壯 黃敏睿 羅 婷
(成都理工大學環(huán)境與土木工程學院,四川 成都 610059)
交聯(lián)羧甲基殼聚糖小球對水體中Ni2+的去除研究*
謝燕華 張璐璐 刁志強 劉 壯 黃敏睿 羅 婷
(成都理工大學環(huán)境與土木工程學院,四川 成都 610059)
以羧甲基殼聚糖為原料,采用滴加到冰乙酸溶液中形成小球并用戊二醛交聯(lián)的方法,制備了交聯(lián)羧甲基殼聚糖小球(以下簡稱小球)。研究了pH、小球投加量以及溫度對Ni2+去除率的影響,同時考察了小球對其他金屬離子的去除效果。結果表明,制得的小球的平均粒徑為(2.04±0.05)mm,溶脹率為77%±1%;在pH為2.28~6.62,溫度為25~60 ℃,小球投加量≥0.77g/L的條件下,小球對50mg/L的Ni2+的去除率在30min內達到了平衡,Ni2+去除率達到了100%。此外,利用了X射線光電子能譜(XPS)、掃描電子顯微鏡(SEM)等手段對反應前后的小球進行了表征分析,探討其作用機理。
羧甲基殼聚糖Ni2+重金屬 去除
Abstract: A kind of cross-linked carboxymethyl chitosan beads (hereinafter called beads) were prepared by droping the carboxymethyl chitosan solution into glocial acetic acid and being cross-linked by glutaraldeyde. The effects of pH,dosages of beads and temperature on the removal rate of Ni2+were studied. The results showed that the average diameter of the beads was (2.04±0.05) mm,and the swelling ratio was 77%±1%. When the pH was 2.28-6.62,temperature was 25-60 ℃ and dosage of beads≥0.77 g/L,the removal rate of the beads on 50 mg/L Ni2+reached equilibrium within 30 min,the removal rate reached 100%. The samples were analyzed by X-ray photoelectron spectroscopy (XPS),scanning electron microscope (SEM),and the removal mechanism was discussed.
Keywords: carboxymethyl chitosan; Ni2+; heavy metal; removal
含鎳廢水是一種危害較大的工業(yè)廢水,主要來自礦業(yè)、有色冶金、電鍍、儀器儀表及各種應用鎳化合物的企業(yè)[1]。鎳是人體必需的生命元素,在人體內含量極微,一旦攝入過量則會引起各種疾病[2]。鎳污染具有長期性、累積性、潛伏性和不可逆性等特點,危害大、治理成本高。目前常用的處理方法有化學沉淀法、混凝沉淀法、吸附法、浮選法、重金屬螯合法等[3],但仍需尋找經濟、高效的處理方法。
近年來,對具有特別選擇性、螯合離子能力強的高分子化合物的研究與日俱增[4]。殼聚糖是一種多糖[5],其分子鏈中含有大量—NH2和—OH基團[6],對多種金屬離子具有良好的螯合作用[7-8]。但是,殼聚糖難溶于水,在實際應用中有很大的局限性。殼聚糖分子鏈中的—NH2和—OH具有良好的化學反應活性[9-10],便于進行功能化改性[11]。羧甲基殼聚糖是殼聚糖羧化后的一種衍生物,與殼聚糖相比,羧甲基殼聚糖具備良好的水溶性、生物相容性、安全無毒等優(yōu)點。由于羧甲基化破壞了殼聚糖的晶體結構,增加了殼聚糖無定形結構[12-13];同時,功能基團—COOH 的引入,使得羧甲基殼聚糖對重金屬離子的吸附性能更為優(yōu)秀[14]。
本研究以羧甲基殼聚糖為原料,采用簡單的滴加成球方法,制備了交聯(lián)羧甲基殼聚糖小球(以下簡稱小球),并用于Ni2+及其他重金屬離子的去除研究,考察了pH、投加量、溫度等因素的影響,并初步探討了作用機理。
1 材料與方法
1.1 儀器與試劑
1.1.1 實驗試劑
羧甲基殼聚糖(白色片狀,脫酰度≥80%);戊二醛(質量分數(shù)為50%);鎳粉(純度≥99%);冰乙酸、氫氧化鈉、丁二酮肟、檸檬酸銨、乙二胺四乙酸二鈉、碘、硝酸銅、硫酸鋅、七水硫酸亞鐵均為分析純。
1.1.2 實驗儀器
電子天平(TB-214);恒溫磁力攪拌器(78HW-1);鼓風干燥箱(101-3);超純水機(UPT-I-10T);恒溫水浴振蕩器(SHZ-82);可見光分光光度計(V-1100D);火焰原子吸收分光光度計(GGX-9);臺式pH計(FiveEasy PlusTMFE28);X射線光電子能譜(XPS)儀(Thermo ESCALAB 250XI);冷場發(fā)射掃描電子顯微鏡(SEM,S4800)。
1.2 實驗方法
1.2.1 小球的制備
稱取一定量的羧甲基殼聚糖溶解于超純水中,制得質量分數(shù)為3%~5%的羧甲基殼聚糖溶液。用注射器移取配制好的羧甲基殼聚糖滴加到0.7 mol/L的冰乙酸溶液中形成小球,并在30 ℃下強化2 h。之后,將小球置于質量分數(shù)為2%的戊二醛溶液中,在60 ℃下交聯(lián)5 h。最后,將交聯(lián)好的小球浸沒于1 mol/L的氫氧化鈉溶液中5~15 min,并用超純水清洗至中性備用。
1.2.2 小球溶脹率
隨機選取30~50顆小球稱重,將稱量好的小球放入燒杯中,用超純水浸泡1 h,取出再次稱重,按式(1)計算小球的溶脹率。
Sw=(mt-md)/md×100%
(1)
式中:Sw為溶脹率,%;mt和md分別為小球溶脹后和溶脹前的質量,g。
1.2.3 XPS分析
采用XPS儀對小球進行成分分析,陽極操作電壓為15 kV,操作電流為10 mA,并將所得譜圖以284.6 eV的C1s基碳峰校正,采用Avantage 3.22軟件擬合譜峰。
1.2.4 SEM分析
分別取去除重金屬前后的小球,在70 ℃的鼓風干燥箱烘干至恒質量,用研缽將干燥的小球研成粉末狀,采用SEM對小球進行觀察。
1.2.5 去除實驗
取100 mL Ni2+污染液于三角燒瓶中,加入一定量的小球,在(25±1) ℃的恒溫水浴中振蕩反應,反應結束后過濾,采用丁二酮肟分光光度法[15-16]測定去除前后溶液中Ni2+的濃度,按照式(2)計算去除率。
Q=(C0-C)/C0×100%
(2)
式中:Q為去除率,%;C0為去除前溶液中Ni2+的質量濃度,mg/L;C為去除后溶液中Ni2+的質量濃度,mg/L。
2 結果與討論
2.1 小球的物理性質
圖1為小球溶脹前和溶脹后的對比圖。從圖1可以看出,小球的平均粒徑約為(2.04±0.05) mm。此外,實驗測得小球質量約為0.008 8 g,其密度約為1.981 g/cm3。相對于溶脹前,溶脹后小球的體積增加了約4倍,溶脹率約為77%±1%。此實驗結果與朱壽進等[17]所合成小球的溶脹率(76%)基本一致。小球在吸水溶脹時,體積增加,內部孔徑擴大,有利于污染物質快速擴散進入小球體內,減少遷移時間,實現(xiàn)污染物快速高效的去除。并且,小球的沉降性能良好,在去除污染物過后利用自身的重力自然沉降,從而實現(xiàn)固液分離。

圖1 溶脹前與溶脹后的小球Fig.1 The cross-linked carboxymethyl chitosan beads before and after swelling
2.2 去除實驗結果分析
2.2.1 pH對Ni2+去除率的影響
由于Ni2+污染液的初始pH較低(約為2.28),溶液pH對Ni2+去除的影響較大。圖2顯示了Ni2+質量濃度為50 mg/L,不同pH下,小球對Ni2+的去除率隨時間變化曲線。在實驗條件下,隨著pH的增大,交聯(lián)羧甲基殼聚糖對Ni2+的去除率也大致呈增加趨勢。由圖2可知,當pH為1.03時,小球對Ni2+的去除率基本不到20%。當pH≥2.28時,小球對Ni2+的去除效果顯著提升,反應30 min后,Ni2+的去除達到平衡,去除率達到100%。可能的原因是羧甲基殼聚糖和Ni2+之間的主要作用力來源于羧甲基殼聚糖分子結構上的—COOH和—NH2基團。當pH低時,—COOH的離解度減小,—NH2以—NH3+形式存在,絡合能力變小,去除率低;隨著pH的增大,—COOH和—NH2官能團增加,絡合能力隨之變大[18]。當pH>6.62時,隨著溶液中OH-濃度增加,Ni2+的去除以沉淀為主。

圖2 pH對Ni2+去除率的影響Fig.2 Effect of pH on the adsorption capacity of Ni2+
圖3為小球去除Ni2+后的pH變化曲線。由圖3可知,當溶液初始pH為1.03時,反應后pH變化不大,仍為強酸性環(huán)境。因羧甲基殼聚糖不溶于酸,過低的pH會使其變成實心小球,無法吸水溶脹,從而去除效果較差。隨著溶液初始pH的不斷增加,反應后溶液呈強堿性,pH大致為10.00~12.00。產生這一結果的原因可能是交聯(lián)后的小球在氫氧化鈉中浸泡溶脹,使得小球內部含有大量OH-,在后續(xù)的去除反應過程中釋放進入溶液,使得溶液pH上升。當pH≥2.28時,除絡合作用之外,Ni2+可在小球內部及表面與OH-形成Ni(OH)2沉淀而被去除。故在實際應用中,溶液的pH應不低于2.28。

圖3 反應后溶液的pHFig.3 pH of the solution after the reaction
2.2.2 小球投加量對Ni2+去除率的影響
圖4為小球投加量對Ni2+去除率的影響。由圖4可知,隨著投加量的增加,Ni2+的去除率基本呈增大趨勢。當投加量≤0.38 g/L時,小球對Ni2+的去除率小于10%;當小球投加量≥0.77 g/L時,小球對Ni2+的去除效果迅速增加,反應15 min后,Ni2+的去除達到平衡,去除率達到100%。可能原因為:隨著小球投加量的增加,所攜帶的活性官能團—COOH和—NH2也隨之增加,對Ni2+絡合能力增強;此外,隨著投加量的增加,小球攜帶的OH-隨之增加,可與Ni2+生成Ni(OH)2沉淀,增加去除效率。在本實驗條件下,綜合考慮經濟成本和去除效率,確定較佳的投加量為0.77 g/L。

圖4 小球投加量對Ni2+去除率的影響Fig.4 Effect of the dosage of cross-linked carboxymethyl chitosan beads on the removal rate of Ni2+
2.2.3 溫度對Ni2+去除率的影響
圖5為小球對Ni2+的去除率隨溫度的變化曲線。由圖5可知,當反應溫度≤50 ℃時,溫度對Ni2+的去除影響較小,小球對Ni2+的去除在2 min內即可達到平衡,去除率達到100%。當溫度進一步提高,反應趨于平衡所需的時間延長。當反應溫度增加到60 ℃時,系統(tǒng)達到平衡所需的時間較常溫條件下延長到了8 min,即低溫有利于去除反應的進行。綜上,溫度對小球去除Ni2+的影響較小,反應可在常溫條件下進行,無需提供苛刻的反應條件。
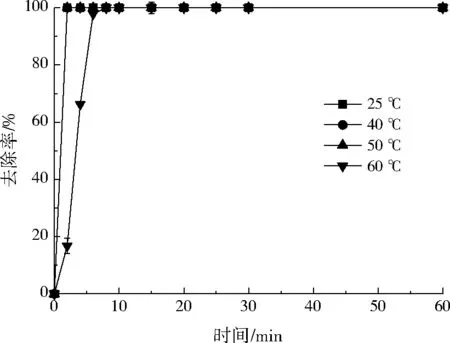
圖5 溫度對Ni2+去除率的影響Fig.5 Effect of temperature on Ni2+ removal rate
2.2.4 小球對其他金屬離子去除效果
在電鍍廢水和工業(yè)廢水中,不僅僅只有Ni2+,還含有其他重金屬離子,本實驗探討了小球對其他金屬離子的去除效果,結果如圖6所示。在混合溶液中,各金屬離子的初始質量濃度均為50 mg/L,小球投加量為0.77 g/L,反應時間為1 h。由圖6可知,相同條件下,小球能高效去除Cu2+和Fe2+,反應在10 min內大致可達到平衡,去除率將近100%。此外,小球對Zn2+也有較好的去除效果,反應在2 min內基本達到平衡,去除率約為85%。由于其他金屬離子的競爭作用,小球對Ni2+的去除在30 min后才逐漸趨于平衡,去除率約為75%。綜上,小球對共存的金屬離子具有良好的去除作用,去除的先后順序大致為:Fe2+、Cu2+、Zn2+、Ni2+。當多種金屬離子共同存在的情況下,由于存在競爭作用,要提高Ni2+的去除率,需增加小球的投加量。此外,使用該小球處理電鍍廢水和工業(yè)廢水相比于現(xiàn)有處理工藝的費用稍高,總價約為7元/t。但是該反應所需時間短,反應容器小,從而減少了基本建設的費用。因此,該小球在處理電鍍廢水和工業(yè)廢水上有較好的應用前景。

圖6 小球對其他金屬離子去除率的影響Fig.6 Effect of cross-linked carboxymethyl chitosan beads on the removal rate of other metal ions
2.3 小球的SEM分析結果
對反應前后小球的局部表面進行了SEM分析,結果見圖7。與施曉文等[19]所合成表面光滑的羧甲基殼聚糖微球相比,本實驗合成的小球表面(見圖7(a))較為粗糙和疏松,具有多孔結構,有利于金屬離子向小球內部遷移。由圖7(b)可知,反應后小球表面變得光滑密實,可能是由于小球溶脹后,內部孔徑擴大,Ni2+可進入小球內部空隙,并發(fā)生絡合和沉淀反應填充小球表面和內部多孔結構,使表面變得密實少孔。
2.4 小球的XPS分析結果
圖8為小球的XPS譜圖。由圖8(a)、圖8(c)、圖8(e)可知,反應前,小球分別在284.64、286.26、289.84 eV處探得C1s的3個峰;在結合能399.80、405.55 eV處觀察到—NH—和—NH2的2個峰;在530.96、533.04 eV處探得O1s的2個峰。由圖8(b)、圖8(d)、圖8(f)可知,反應后,羧甲基殼聚糖表面的C1s結合能分別為284.57、286.18、287.73 eV。配位后羧甲基殼聚糖表面的C原子所處的化學環(huán)境沒有發(fā)生顯著變化,即C原子沒有參與配位反應[20]。而O1s和N1s在XPS譜上均只剩下1個峰,其結合能分別是532.40、399.61 eV,表明O和N參與了Ni2+的配位去除反應,即—COOH和—NH2與Ni2+發(fā)生了絡合反應,使得O和N的結合能發(fā)生了改變[21]。反應后小球表面在結合能為856.09 eV處探測到Ni2+的特征峰(見圖8(g)),進一步表明,Ni2+已通過配位或沉淀作用結合于交聯(lián)羧甲基殼聚糖小球表面。

圖7 反應前后小球的SEM圖Fig.7 SEM images of cross-linked carboxymethyl chitosan beads before and after reaction
3 結 論
本實驗以羧甲基殼聚糖為原料,采用簡單的滴加成球并用戊二醛交聯(lián)的方法制備得到小球,該小球對Ni2+、Fe2+、Cu2+、Zn2+等金屬離子具有快速、高效的去除效果。實驗研究了溶液的pH、溫度、小球的投加量等對Ni2+去除率的影響。結果表明,Ni2+的去除率大致隨pH的增加而增加,當溶液pH≥2.28時,Ni2+的去除率可達到100%;低溫有利于Ni2+的去除,隨著溫度的升高,去除Ni2+所需的平衡時間延長;此外,隨著小球投加量的增加, Ni2+的去除率大體隨之提高。SEM分析結果表明,所合成的小球表面具有多孔結構,有利于金屬離子的擴散遷移。XPS分析結果顯示,羧甲基殼聚糖小球的—COOH和—NH2基團參與了Ni2+去除反應過程。綜合溶液反應前后pH的變化情況可知,Ni2+的去除是由—COOH和—NH2基團絡合與沉淀共同作用的結果。

圖8 小球的XPS譜圖Fig.8 XPS spectra of cross-linked carboxymethyl chitosan beads
(致謝:在實驗研究過程中,得到了整個課題組幫助和指導,尤其是后期的論文修改,課題組更是給出了寶貴的意見,在此表示感謝!)
[1] LIAO Bing,SUN Weiyi,GUO Na,et al.Equilibriums and kinetics studies for adsorption of Ni(Ⅱ) ion on chitosan and its triethylenetetramine derivative[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2016,501:32-41.
[2] 趙家軍.電鍍銅鎳合金廢水中銅,鎳離子的去除研究[D].南京:南京理工大學,2008.
[3] 馮立偉,劉緒光.吉恩鎳業(yè)選礦廠工業(yè)廢水循環(huán)利用生產實踐[J].有色礦冶,2011,27(2):51-53.
[4] SUN Shengling,WANG Li,WANG Aiqin.Adsorption properties of crosslinked carboxymethyl-chitosan resin with Pb(Ⅱ) as template ions[J].Journal of Hazardous Materials,2006,136(3):930-937.
[5] 劉維俊.高分子殼聚糖對微量金屬離子的螯合作用研究[J].環(huán)境科學與技術,2003,26(3):11-12.
[6] NGAH W S W,TEONG L C,TOH R H,et al.Comparative study on adsorption and desorption of Cu (Ⅱ) ions by three types of chitosan-zeolite composites[J].Chemical Engineering Journal,2013,223:231-238.
[7] GUIBAL E.Interactions of metal ions with chitosan-based sorbents:a review[J].Separation and Purification Technology,2004,38(1):43-74.
[8] NGAH W S W,TEONG L C,HANAFIAH M.Adsorption of dyes and heavy metal ions by chitosan composites:a review[J].Carbohydrate Polymers,2011,83(4):1446-1456.
[9] 孫新枝,蘇中興.改性殼聚糖的制備及其對金屬離子的吸附性能[J].化學研究,2005,16(1):29-31.
[10] 張艷雅,馬啟敏.殼聚糖改性吸附劑的制備及其吸附性能研究[J].中國海洋大學學報(自然科學版),2006,36(增刊):153-156.
[11] SAKKAYAWONG N,THIRAVETYAN P,NAKBANPOTE W.Adsorption mechanism of synthetic reactive dye wastewater by chitosan[J].Journal of Colloid and Interface Science,2005,286(1):36-42.
[12] LASKO C L,HURST M P.An investigation into the use of chitosan for the removal of soluble silver from industrial wastewater[J].Environmental Science & Technology,1999,33(20):3622-3626.
[13] WONGPANIT P,SANCHAVANAKIT N,PAVASANT P,et al.Preparation and characterization of microwave-treated carboxymethyl chitin and carboxymethyl chitosan films for potential use in wound care application[J].Macromolecular Bioscience,2005,5(10):1001-1012.
[14] 尚超.羧甲基殼聚糖吸附劑對鈾離子的吸附特性研究[D].撫州:東華理工大學,2013.
[15] 趙春祿,孫鵬程,劉輝.接枝交聯(lián)改性殼聚糖吸附性能研究[J].青島理工大學學報,2011,32(1):53-57.
[16] 國家環(huán)境保護總局《水和廢水監(jiān)測分析方法》編委會.水和廢水監(jiān)測分析方法[M].4版.北京:中國環(huán)境科學出版社,2002.
[17] 朱壽進,劉法謙.新型羧甲基殼聚糖水凝膠的合成與表征[J].高等學校化學學報,2014,35(4):863-868.
[18] 林友文,陳偉,羅紅斌.羧甲基殼聚糖對鉛離子的吸附性能研究[J].離子交換與吸附,2001,17(4):333-338.
[19] 施曉文,杜予民,覃采芹,等.交聯(lián)羧甲基殼聚糖微球的制備及其對Pb2+的吸附性能[J].應用化學,2003,20(8):715-718.
[20] 張軍麗,李瑞玲,潘慶才.DNS改性殼聚糖對重金屬鎳離子的吸附研究[J].非金屬礦,2011,34(4):62-65.
[21] 郝志峰,楊陽,余堅.殼聚糖膜與Co(Ⅱ),Ni(Ⅱ),Cu(Ⅱ)復合物的IR光譜和XPS譜[J].光譜實驗室,2003,30(6):799-802.
StudyonNi2+removalbycross-linkedcarboxymethylchitosanbeadsinthewater
XIEYanhua,ZHANGLulu,DIAOZhiqiang,LIUZhuang,HUANGMinrui,LUOTing.
(CollegeofEnvironmentandCivilEngineering,ChengduUniversityofTechnology,ChengduSichuan610059)
2016-11-02)
謝燕華,女,1981年生,博士,副教授,主要從事地表水及地下水污染修復與防治、納米材料的開發(fā)與應用、微污染水體的治理研究。
*國家自然科學基金資助項目(No.41472230);中國博士后科學基金第57批面上資助項目。
10.15985/j.cnki.1001-3865.2017.08.005

