尿素改性生物質炭吸附水中氨氮研究*
史良于 韋安磊 薛科社 鄭曉青 高 歡
(西北大學城市與環境學院,陜西 西安710127)
尿素改性生物質炭吸附水中氨氮研究*
史良于 韋安磊#薛科社 鄭曉青 高 歡
(西北大學城市與環境學院,陜西 西安710127)
利用尿素對小麥秸稈生物質炭進行改性,用于吸附水中氨氮。研究了尿素添加量、pH、改性生物質炭投加量、共存陽離子等因素對改性生物質炭吸附氨氮的影響,并研究了吸附的熱力學和動力學機制。結果表明,1.00g未改性生物質炭中添加2.4g尿素時制備得到的改性生物質炭UBC-4對氨氮吸附能力最好,零電荷點相比改性前明顯降低。處理20mL60mg/L的氯化銨溶液,UBC-4最佳投加量為0.20g,最適pH為8。實際廢水處理中應考慮Na+、Mg2+等共存陽離子對UBC-4吸附氨氮的競爭吸附作用。Langmuir方程能較好地擬合UBC-4對氨氮的吸附等溫過程,準二級動力學模型能較好地描述其動力學過程。吸附為自發的吸熱過程,主要機制是物理吸附。
生物質炭 尿素 改性 氨氮 吸附
氨氮會造成水體水質惡化,加速水體富營養化[1-2]。目前,國內外處理廢水中氨氮的方法有吹脫法、折點加氯法、離子交換法、化學沉淀法和吸附法等物理化學處理法[3],光催化氧化、濕法催化氧化等化學處理法[4],膜生物反應器等生物處理法[5]。吸附法具有工藝簡單、操作方便、無二次污染等優點而得到廣泛應用。生物質炭是一種新型的吸附材料,孔隙結構發達、比表面積大、來源廣泛,有廣闊的應用前景[6]。生物質炭對重金屬離子有較好的吸附效果,但對氨氮的吸附效果并不理想,需對其進行改性[7]。尿素毒性低、易制得且含有氨基官能團,因此本研究采用尿素對生物質炭進行化學改性,研究其對氨氮的吸附特性及影響因素,并探討改性生物質炭吸附氨氮的機制,為廢水中氨氮的去除提供一些參考。
1 材料與方法
1.1 儀 器
粉碎機(RRH-A400);pH計(PHK-616);紫外—可見分光光度計(日本島津UV-1700);恒溫搖床(RH-Q);箱式馬弗爐(SGM.M25/12A);電子天平(美國奧豪斯EX125DZH);電熱鼓風干燥箱(101);傅立葉紅外光譜儀(德國布魯克EQUINOX-55)。
1.2 改性生物質炭的制備
以小麥秸稈作為生物質炭的原料,用水洗去灰塵和泥土并浸泡12 h,烘干至恒質量,用粉碎機粉碎,過100目篩備用。用電子天平稱取一定質量上述制備的小麥秸稈,放入坩堝中,用高純氮氣保護,在箱式馬弗爐中隔絕空氣加強熱,400 ℃條件下反應3 h,自然冷卻至室溫,即得未改性生物質炭,用水沖洗干凈后在電熱鼓風干燥箱中75 ℃烘干,記作BC。
取1.00 g BC分別與0.6、1.2、1.8、2.4、3.0、3.6 g尿素混合,加入20 mL無氨水,置于恒溫搖床中室溫下振蕩24 h,過濾,重復加入無氨水并振蕩后過濾,直至過濾液pH呈中性,將改性后的生物質炭在電熱鼓風干燥箱中75 ℃烘干,得到不同尿素添加量改性的生物質炭,依次記作UBC-1、UBC-2、UBC-3、UBC-4、UBC-5、UBC-6。
1.3 吸附實驗
尿素添加量對改性生物質炭吸附氨氮的影響:分別取0.20 g BC、UBC-1、UBC-2、UBC-3、UBC-4、UBC-5、UBC-6分別置于20 mL不同質量濃度(5、10、20、40、60、80、100 mg/L)的氯化銨溶液中,在pH為7、25 ℃下以150 r/min的轉速振蕩4 h,過濾,測定氨氮濃度并根據式(1)計算吸附量(q,mg/g)。
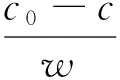
(1)
式中:c0、c分別為吸附前、后氨氮的質量濃度,mg/L;w為吸附材料投加量,g;V為溶液體積,L。
pH對改性生物質炭吸附氨氮的影響:將一系列20 mL質量濃度為60 mg/L的氯化銨溶液調節pH分別為2、3、4、5、6、7、8、9,各加入0.20 g UBC-4,在25 ℃下以150 r/min的轉速振蕩3 h,過濾,測定氨氮濃度并根據式(2)計算去除率(η,%)。

(2)
UBC-4投加量對改性生物質炭吸附氨氮的影響:分別取0.02、0.04、0.06、0.08、0.10、0.15、0.20、0.30 g UBC-4置于20 mL 60 mg/L的氯化銨溶液中,調節pH為8,在25 ℃下以150 r/min的轉速振蕩3 h,過濾,測定氨氮濃度并根據式(2)計算去除率。
共存陽離子對改性生物質炭吸附氨氮的競爭作用:用NaCl或MgCl2配制Na+或Mg2+質量濃度為40、60、80 mg/L的溶液10 mL,分別與10 mL 60 mg/L 的氯化銨溶液混合,各加入0.20 g UBC-4,調節pH為8,在25 ℃下以150 r/min的轉速振蕩3 h,過濾,測定氨氮濃度并根據式(2)計算去除率。
吸附前氨氮濃度通過氯化銨濃度換算得到。吸附后氨氮濃度采用納氏試劑比色法在420 nm波長下用紫外—可見分光光度計測定。
1.4 結構表征
將干燥的BC和UBC-4樣品與高純KBr共同研磨,混合均勻后進行壓片處理,用傅立葉紅外光譜儀在波數為500~4 000 cm-1內進行掃描。
根據文獻[8]測定BC和UBC-4的零電荷點。
1.5 吸附等溫實驗
分別取5、10、20、40、60、80、100 mg/L的氯化銨溶液20 mL于50 mL錐形瓶中,加入0.20 g BC或UBC-4,調節pH為8,在25、35 ℃下以150 r/min的轉速振蕩至平衡,過濾,測定氨氮濃度并根據式(1)計算吸附量。通過Langmuir方程(見式(3))和Freundlich方程(見式(4))對生物質炭吸附氨氮的吸附等溫線進行擬合。

(3)
(4)
式中:qe為氨氮平衡吸附量,mg/g;qm為氨氮飽和吸附量,mg/g;kL為Langmuir吸附常數,L/mg;ce為氨氮的平衡質量濃度,mg/L;kF為Freundlich吸附常數,mg1-1/n·L1/n/g;n為經驗常數。
1.6 UBC-4的熱力學參數計算
分別取5、60、100 mg/L的氯化銨溶液20 mL于50 mL錐形瓶中,加入0.20 g UBC-4,調節pH為8,在15、25、35 ℃下以150 r/min的轉速振蕩至平衡,過濾,測定氨氮濃度并根據式(1)計算吸附量。對不同濃度的氯化銨溶液計算不同溫度下的qe/ce,并通過式(5)擬合得到吸附焓(ΔH,J/mol)和吸附熵(ΔS,J/(mol·K)),通過式(6)計算吸附自由能(ΔG,J/mol)。
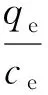
(5)
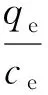
(6)
式中:R為理想氣體常數,J/(mol·K),R=8.314 J/(mol·K);T為熱力學溫度,K。
1.7 UBC-4的吸附動力學擬合
分別取60、100 mg/L的氯化銨溶液20 mL于50 mL錐形瓶中,加入0.20 g UBC-4,調節pH為8,在25 ℃下以150 r/min的轉速振蕩,按一定時間間隔取樣過濾,測定氨氮濃度并根據式(1)計算吸附量。分別以準一級動力學模型(見式(7))和準二級動力學模型(見式(8))對UBC-4吸附氨氮的吸附動力學進行擬合。
qt=qe(1-e-k1t)
(7)

(8)
式中:qt為t時刻的氨氮吸附量,mg/g;k1為準一級動力學反應速率常數,min-1;t為吸附時間,min;k2為準二級動力學反應速率常數,g/(mg·min)。
2 結果與討論
2.1 尿素添加量對改性生物質炭吸附氨氮的影響
不同尿素添加量下制備得到的改性生物質炭對氨氮的吸附量如圖1所示。由圖1可知,不同生物質炭對氨氮的吸附量表現為UBC-4>UBC-5>UBC-6>UBC-3>UBC-2>UBC-1>BC,即尿素添加量為2.4 g的UBC-4對氨氮的吸附能力最好。

圖1 不同生物質炭對氨氮的吸附量Fig.1 Adsorption quantity on ammonia nitrogen by different biochars
2.2 pH對UBC-4吸附氨氮的影響

2.3 UBC-4投加量對氨氮去除率的影響
由圖3可見,UBC-4投加量從0.02 g增加到0.20g,氨氮的去除率從15.8%增加到61.6%,這是因為隨著吸附材料的增加,吸附位點也增加,從而氨氮去除率顯著提高。但當UBC-4投加量過量時,只會造成成本增大,卻不會顯著提高氨氮去除率[10]。因此,在本研究中對處理20 mL、60 mg/L的氯化銨溶液而言,UBC-4的最佳投加量為0.20 g。

圖2 pH對氨氮去除率的影響Fig.2 Effect of pH on ammonia nitrogen removal rate

圖3 UBC-4投加量對氨氮去除率的影響Fig.3 Effect of UBC-4 dosage on ammonia nitrogen removal rate
2.4 共存陽離子對UBC-4吸附氨氮的競爭

2.5 生物質炭的結構表征
2.5.1 傅立葉紅外光譜分析
BC和UBC-4的傅立葉紅外光譜分析結果如圖5所示。UBC-4與BC相比,官能團的強度明顯增強。1 107 cm-1附近的吸收峰來自C—O鍵的伸縮振動,與酚、醚和內酯基等的官能團有關;1 453、2 920 cm-1處是—CH2—伸縮振動峰[12];1 600 cm-1附近的吸收峰主要是由氨基的振動引起的;3 421 cm-1處的吸收峰主要是由分子間氫鍵締和的醇、酚的—OH伸縮振動引起的[13]。
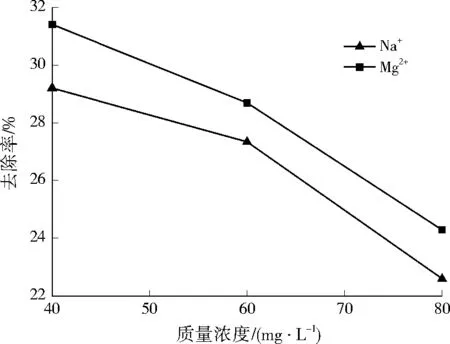
圖4 共存陽離子對氨氮去除率的影響Fig.4 Effect of competitive cations on ammonia nitrogen removal rate

圖5 傅立葉紅外光譜圖Fig.5 Fourier transformation infrared spectra
2.5.2 零電荷點

2.6 吸附等溫模型
BC和UBC-4的吸附等溫線如圖6所示,相關擬合參數列于表1。從圖6可以觀察到,UBC-4吸附效果比BC好。由表1可知,Langmuir方程的擬合程度比Freundlich方程高,25、35 ℃時的UBC-4對氨氮的飽和吸附量分別為5.34、6.10 mg/g,而BC僅分別為2.97、3.12 mg/g。
2.7 吸附熱力學
熱力學參數的計算結果見表2。ΔG為負值,說明吸附過程是自發進行的。一般認為,ΔG在-20~0 kJ/mol內為物理吸附[14]。UBC-4在不同溫度下對不同濃度氨氮吸附的ΔG均在-20~0 kJ/mol內,表明UBC-4對氨氮吸附機制以物理吸附為主。ΔH>0 kJ/mol說明吸附是吸熱過程,ΔS>0 J/(mol·K)說明吸附過程以熵增推動為主。
2.8 吸附動力學

表1 吸附等溫方程擬合參數
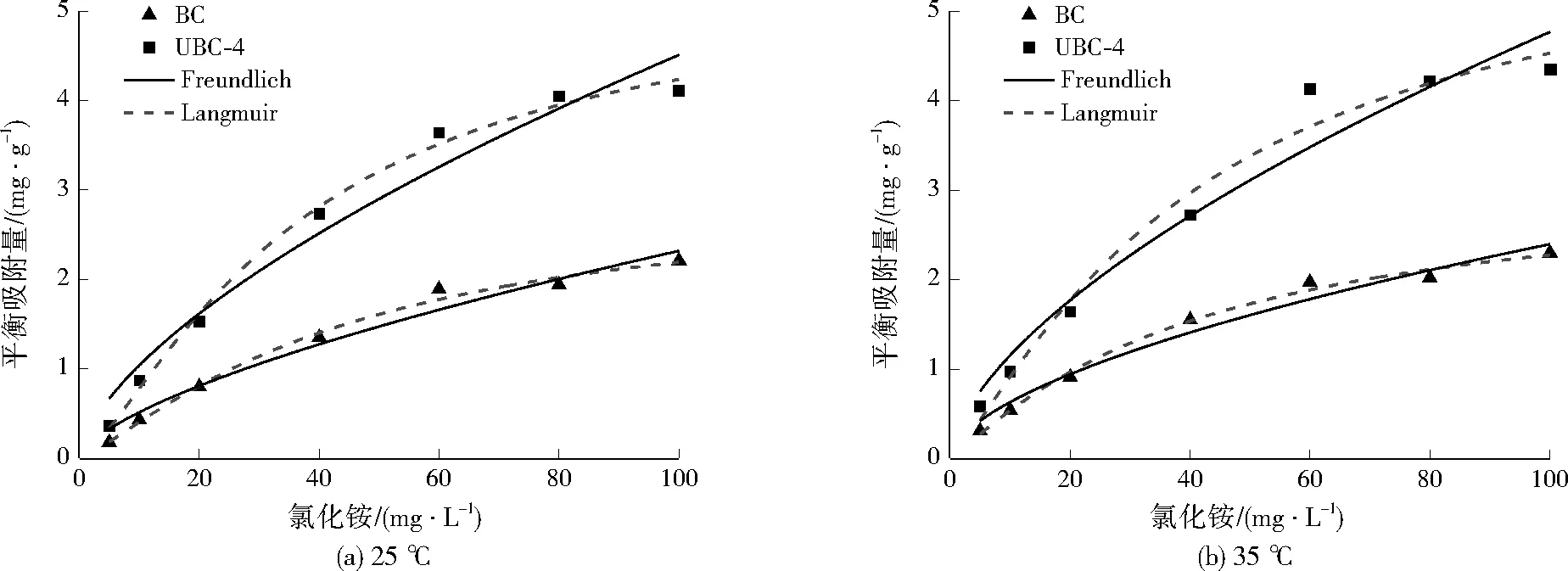
圖6 吸附等溫線Fig.6 Adsorption isothermal curves

氯化銨/(mg·L-1)溫度/℃ΔS/(J·mol-1·K-1)ΔH/(kJ·mol-1)ΔG/(kJ·mol-1)15-9.5335250.13128.652-10.30235-12.17215-9.84160250.0494.542-10.17135-10.83615-8.638100250.0516.074-9.20635-9.661

圖7 吸附動力學曲線Fig.7 Adsorption kinetic curves

氯化銨/(mg·L-1)準一級動力學模型k1/(10-2min-1)qe/(mg·g-1)R2準二級動力學模型k2/(10-2g·mg-1·min-1)qe/(mg·g-1)R2605.6253.470.94452.7143.680.98621005.5104.000.93442.3544.250.9824
由圖7可知,UBC-4對氨氮的吸附在初始階段速率很快,這是因為剛開始進行吸附時,吸附材料表面的吸附位點較多,而溶液中的氨氮濃度較高,吸附的傳質速率快,氨氮易被吸附位點吸附;隨著吸附時間的延長,氨氮濃度降低,UBC-4表面的吸附位點大部分被占據,傳質速率降低,吸附速率下降;當吸附位點趨于飽和時,吸附也就達到了平衡[15]。
從表3可以看出,準二級動力學模型的擬合程度較高,說明UBC-4吸附氨氮的動力學過程包括了吸附的所有過程,即外部擴散、表面吸附和內部擴散。氯化銨質量濃度為60 mg/L時,準二級動力學模型擬合得到的平衡吸附量為3.68 mg/g,與實驗值3.64 mg/g較接近;氯化氨質量濃度為100 mg/L時,準二級動力學模型擬合得到的的平衡吸附量為4.25 mg/g,也與實驗值4.11 mg/g較接近。因此,準二級動力學模型能較好地描述UBC-4吸附氨氮的過程。
3 結 論
(1) 1.00 g BC中尿素添加量為2.4 g制備得到的改性生物質炭UBC-4的對氨氮吸附能力最好。處理20 mL 60 mg/L的氯化銨溶液,UBC-4最佳投加量為0.20 g,pH應調節為8。共存陽離子Na+、Mg2+會與氨氮競爭吸附,實際廢水處理時應考慮共存陽離子的影響。
(2) Langmuir方程可很好地擬合UBC-4吸附氨氮的吸附等溫過程,準二級動力學模型可很好地擬合UBC-4吸附氨氮的動力學過程。吸附過程是自發的吸熱過程,吸附機制主要是物理吸附。
[1] 李飛躍,謝越,石磊,等.稻殼生物質炭對水中氨氮的吸附[J].環境工程學報,2015,9(3):1222-1226.
[2] ZHANG Y,SHI Z,CHEN M X,et al.Evaluation of simultaneous nitrification and denitrification under controlled conditions by an aerobic denitrifier culture[J].Bioresource Technology,2015,175:602-605.
[3] SHARMA G,KUMAR A,NAUSHAD M,et al.Polyacrylamide@Zr(Ⅳ) vanadophosphate nanocomposite:ion exchange properties,antibacterial activity,and photocatalytic behavior[J].Journal of Industrial and Engineering Chemistry,2016,33:201-208.
[4] 付迎春.催化濕式氧化法處理氨氮廢水的研究[D].南京:南京工業大學,2004.
[5] KATARZYNA S K,MALGORZATA W,DAWID M.Lysozyme adsorption on the colloidal chromium(Ⅲ) oxide surface:its impact on the system stability[J].Applied Surface Science,2015,347(5):491-498.
[6] TAN X F,LIU Y G,ZENG G M,et al.Application of biochar for the removal of pollutants from aqueous solutions[J].Chemosphere,2015,125:70-85.
[7] MARC F,MARIALAURA T,TERESA J B.NO2adsorption at ambient temperature on urea-modified ordered mesoporous carbon[J].Carbon,2013,63(15):283-293.
[8] FRANZ M,ARAFAT H A,PINTO N G.Effect of chemical surface heterogeneity on the adsorption mechanism of dissolved aromatics on active carbon[J].Carbon,2000,38(13):1807-1819.
[9] SIMON K,SHUBIAO W,KIPKEMOI K,et al.Evaluation of slow pyrolyzed wood and rice husks biochar for adsorption of ammonium nitrogen from piggery manure anaerobic digestate slurry[J].Science of the Total Environment,2015,505:102-112.
[10] 李際會.小麥秸稈炭改性活化及其氮磷吸附效應研究[D].北京:中國農業科學院,2015.
[11] 張璐,賈麗,陸文龍.不同碳化溫度下玉米秸稈生物炭的結構性質及其對氮磷的吸附特性[J].吉林大學學報(理學版),2015,53(4):803-808.
[12] 孔露露,周啟星.新制備生物炭的特性表征及其對石油烴污染土壤的吸附效果[J].環境工程學報,2015,9(5):2463-2468.
[13] SAHU J N,ACHARYA J,MEIKAP B C.Optimization of production conditions for activated carbons fromTamarindwoodby zinc chloride using response surface methodology[J].Bioresource Technology,2010,101(6):1974-1982.
[14] 馬鋒鋒,趙保衛,念斌.玉米秸稈生物炭對水中氨氮的吸附特性[J].蘭州交通大學學報,2015,34(1):126-131.
[15] XUE L H,GAO B,WAN Y S,et al.High efficiency and selectivity of MgFe-LDH modified wheat-straw biochar in the removal of nitrate from aqueous solutions[J].Journal of the Taiwan Institute of Chemical Engineers,2016,63:312-317.
Adsorptiononammonianitrogeninwaterbybiocharmodifiedbyurea
SHILiangyu,WEIAnlei,XUEKeshe,ZHENGXiaoqing,GAOHuan.
(CollegeofUrbanandEnvironmentSciences,NorthwestUniversity,Xi’anShaanxi710127)
Wheat straw biochar was modified by urea to adsorb ammonia nitrogen in water. The impact factors (urea dosage,pH,adsorbent dosage and competitive cations) and adsorption mechanisms were studied. Results showed that the modified biochar UBC-4 which was prepared by 1.00 unmodified biochar with 2.4 g urea had the best adsorption capaicity on ammonia nitrogen because UBC-4 had low zero-charge point. When treating 20 mL NH4Cl solution of 60 mg/L,optimal pH was 8 and optimal adsorbent dosage was 0.20 g. Competitive cations like Na+and Mg2+should not be ignored especially when treating real wasterwater. Langmuir equation could effectively fit the isothermal adsorption data. The pseudo second order kinetic model could effectively describe its adsorption dynamic process. The adsorption on ammonia nitrogen by UBC-4 was an endothermic and spontaneous process. The adsorption mechanism was physical adsorption.
biochar; urea; modify; ammonia nitrogen; adsorption
10.15985/j.cnki.1001-3865.2017.10.007
史良于,男,1992年生,碩士研究生,研究方向為水污染防治和環境吸附材料。#
。
*國家自然科學基金資助項目(No.51208424);城市水資源與水環境國家重點實驗室開放基金面上基金資助項目(No.QA201318);陜西省重點科技創新團隊計劃項目(No.2014KCT-27);陜西省環境保護專項基金資助項目。
2017-03-29)

