我院48種注射用抗菌藥物藥品說明書分析
承昊宜
(池州市第二人民醫院中心藥房,安徽 池州 247000)
我院48種注射用抗菌藥物藥品說明書分析
承昊宜
(池州市第二人民醫院中心藥房,安徽 池州 247000)
目的收集并分析我院48種注射用抗菌藥物藥品說明書,為抗菌藥物的合理應用提供參考依據。方法 根據《化學藥品和生物制品說明書規范細則》和《藥品說明書和標簽管理規定》,對我院注射用抗菌藥物藥品說明書應標注項目進行調查分析。結果 所調查的藥品說明書有一些與臨床用藥息息相關的項目敘述簡單,內容差異大。結論 建議生產廠家完善抗菌藥物藥品說明書的標注內容,使其更規范化和科學化。
注射用抗菌藥物;標注內容;臨床用藥;調查分析
藥品說明書是患者獲取藥品信息的直接來源,是醫師開具處方、藥師審核處方的法律依據。注射用抗菌藥物在臨床應用廣泛,不良反應與用藥注意事項較多,醫護人員及患者對其說明書的內容具有很大的依賴性。調查分析我院使用的注射用抗菌藥物藥品說明書,就其項目內容進行了初步的分析研究,為進一步規范藥品說明書內容提出建議。現報告如下。
1 資料與方法
收集本院中心藥房正在使用的注射用抗菌藥物藥品說明書(截至2017年5月),根據藥物的藥理作用和抗菌機制分類,并以《化學藥品和生物制品說明書規范細則》和《藥品說明書和標簽管理規定》(以下簡稱《規定》)為標準,對收集的說明書進行了整理分析[1]。
2 結 果
2.1 注射用抗菌藥物種類
我院注射抗菌藥物按藥理作用和抗菌機制分為11大類共有48種,都是現在臨床普遍常用的一線抗菌藥物,具體品種見表1(同一廠家不同規格藥品不重復計算)。

表1 我院注射用抗菌藥物種類(%)
2.2 藥品說明書各項目內容標注情況
2.2.1 說明書基礎項目標注情況
按照說明書標準格式,應標注的基礎項目共有23個,實際調查中標注率為100%的共有16個,占應標注項目約70%比例。有部分項目標注率較低,包括藥物相互作用、老年用藥、兒童用藥及臨床試驗4個項目。還有藥動學、藥理毒理、不良反應等標注項目敘述內容簡單,詳細程度差異較大。
2.2.2 配置溶液相關項目標注情況
注射藥物絕大部分在輸液前需進行配液操作,這一操作對藥液安全性和穩定性要求很高。我院藥物中使用前需進行配置的有36種,見表2。
2.2.3 用法用量有關內容標注情況 用法用量有關內容是臨床用藥的依據和標準,在說明書中占有極其重要的地位。表3統計了用法用量的有關項目。
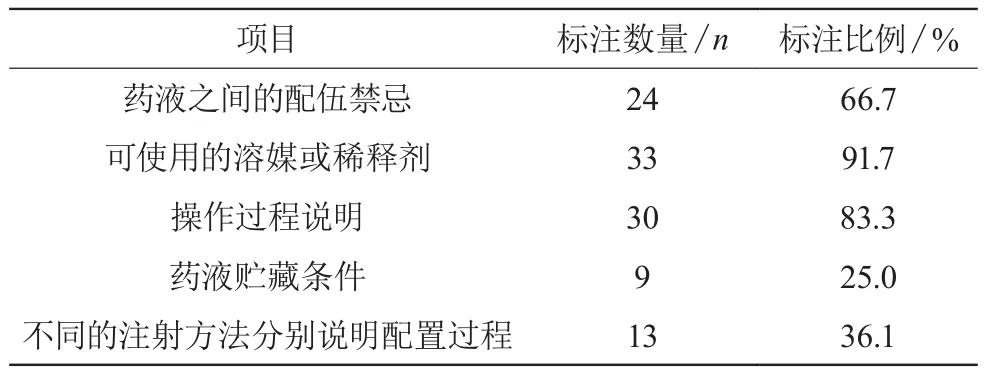
表2 配置溶液相關項目標注情況(n,%)

表3 用法用量有關項目標注情況(n,%)
2.2.4 藥品不良反應有關項目標注情況
提供完整的藥品不良反應信息供醫患雙方參考是說明書的基本功能,見表4。
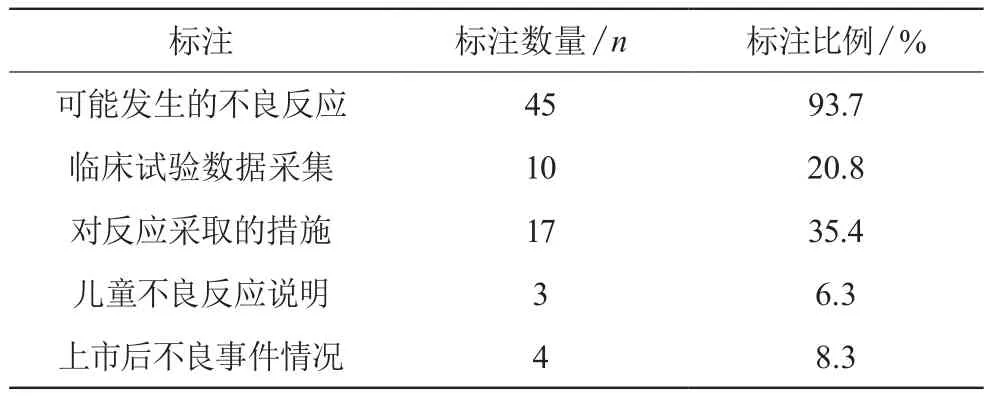
表4 不良反應有關項目標注情況(n,%)
2.2.5 過敏性試驗有關項目標注情況
青霉素類和頭孢菌素類在使用時易發生過敏反應,嚴重者發生過敏性休克可危及生命,臨床要求在使用前應進行皮試[2]。此次收集此類藥物說明書共23份(47.9%),見表5。
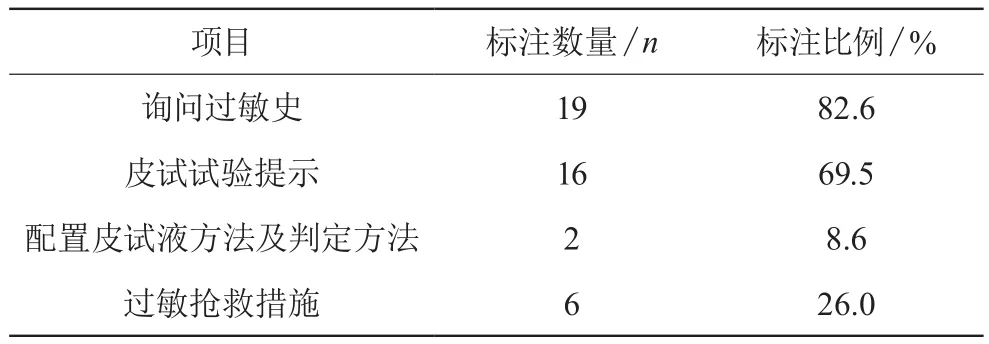
表5 過敏性試驗有關項目標注情況(n,%)
3 討 論
本次調查的我院注射用抗菌藥物共48種,發現存在以下問題
3.1 核準日期和修改日期標注
《規定》第二章第十五條提出,藥品說明書核準日期和修改日期應醒目標注。在我院所統計的說明書中,標注核準日期的說明書有47種,其中26種標有核準日期,而無修改日期。有1種即無核準日期又無修改日期,應給予改正。藥品生產企業應當根據上市后的不良反應監測,藥物再評價結果等信息主動、及時得對說明書更新修改,此內容還有待相關企業引起重視和改進[3]。
3.2 配液操作標注
在本次的調查分析中,發現使用前需配液的36種藥物說明書雖然標注了所需的溶液,但對實際操作中出現的問題敘述較少,內容也過于簡單,建議廠家多增加理化配伍禁忌和藥液配置步驟等內容,使輸液藥品得到安全保障。
3.3 用法用量標注
用法用量是說明書的核心內容之一,包括用法、用量、療程、期限等內容,應該給予較大的篇幅登載。本次調查中發現有29種說明書記載了腎功能下降或腎功能衰竭患者劑量調整方案,6種指出腎功能下降對劑量無影響,其余13種沒有提及這方面內容。肝功能損害患者的用藥情況生產企業標注的更少,已標明的也不夠詳細,無實驗數據說明,建議廠家加以改進。兒童是一類特殊的用藥群體,各個器官還不完善,對藥物的耐受性較差,極易發生藥源性危害。此次調查中標注兒童用藥方法和注意事項的有35種(包括兒童禁用的6種藥物),標注率為72.9%,實際藥物標注率還要更低,這值得我們的注意。孕婦及哺乳婦女用藥標注率雖很高,但由于缺少臨床試驗數據,所以大多敘述過于簡單,在給此類人群用藥時因進一步查閱相關資料。
3.4 不良反應標注
藥品猶如一把雙刃劍,在具有治療作用的同時,必然存在不良反應。不良反應是當今醫患糾紛的一個爆發點,患者因為不了解藥物不良反應,或是對不良反應重視程度不夠,對藥品質量和療效產生了懷疑。醫護人員應通過說明書積極向患者說明不良反應的危害性和采取的措施,增加患者的用藥信心,減少其帶來的危害。建議企業通過評估臨床實驗數據來分析不同反應發生的概率,組織專業技術人員對不良反應情報進行分析評價,及時收集并整理藥品上市后的安全監測報告。需要對藥品說明書進行修改的,應及時向SFDA提出申請。
3.5 過敏性實驗標注
青霉素類、頭孢菌素類、內酰胺類復方制劑等都屬于β-內酰胺類藥物,所以在使用前必須進行皮膚過敏實驗。皮試時必須采用原藥配制皮試液,不能用普通青霉素配制的皮試液,也不能用某一種頭孢菌素類配制的皮試液替代原皮試液。這次調查分析此類藥物有23種,詢問過敏史和有皮試實驗提示的比例分別占82.6%和69.5%,標注率還有待提高。詳細敘述了皮試液配置及判定方法只占2例,廠家對此項內容標注敘述簡單,未寫出規范化處理過程,應及時修訂。
通過調查分析48種藥品說明書,發現一些項目內容存在較大的問題,內容書寫未達到規定要求,標注比例低。此外還有一些項目如不良反應,過敏藥物的皮試等標注敘述簡單,缺乏藥物實驗數據,內容詳細程度差異較大,大部分企業的藥品說明書更新程度較慢。希望生產企業能及時修改說明書內容,按照規定提高內容的書寫要求,使之具有更高的規范性和科學性,為臨床用藥提供安全有效的信息保證。
[1]陳永法,黃 麗.我國超說明書用藥現象探析[J].中國藥房,2013,24(13):1162-1164.
[2]畢 瑞,洪雪嬌.4種不同規格哌拉西林鈉他唑巴坦鈉藥品說明書分析[J].中國藥業,2014,23(16):10-11.
[3]陳東偉.藥品說明書的調查與分析[J].中國實用醫藥,2013,8(8):271-273.
R954
B
ISSN.2095-8242.2017.058.11360.03
本文編輯:趙小龍

