歐盟傳統草藥藥品法規疑難問題解析
瞿禮萍 張曉群 熊晏 王一濤 鄒文俊

[摘要]歐盟在全球植物藥市場的地位舉足輕重,開展歐盟注冊對中藥國際化具有重要意義。回溯國內對中藥歐盟注冊法規的研究已有10余年,仍存部分認識偏差和研究不足。該文旨在系統分析國內歐盟草藥藥品法規的研究現狀,并針對其中研究認識不足的主要方面,即,歐盟傳統草藥藥品集中與分權的監管體系、傳統草藥的上市審批類別、歐盟草藥專論和草藥目錄等,對2004/24/EC法令的疑難問題進行進一步解析,以期為中藥歐盟注冊提供參考。
[關鍵詞]2004/24/EC法令; 上市審批程序; 草藥專論和目錄; 中藥歐盟注冊
[Abstract]Registration of Chinese patent medicine in European Union (EU) is of great significance to the internationalization of traditional Chinese medicine as EU market acts as an important position in the global botanical market In retrospect, the domestic studies on EU regulations of traditional herbal medicinal products have been conducted for more than 10 years, but there is still some cognitive bias and lack of research In this paper, a review of the relevant research progress and the main misunderstanding problems about Directive 2004/24/EC, like the centralized and decentralized supervision system of traditional herbal medicinal products in the EU, marketing authorization procedures for traditional herbal medicinal products, Community Herbal Monograph and List Entries, would be systematically analyzed, so as to provide reference for the registration of Chinese patent medicine in EU.
[Key words]Directive 2004/24/EC; marketing authorization procedures; Community Herbal Monograph and List Entries; EU registration for traditional Chinese medicine
我國自“九五”已經確立歐盟注冊是中藥國際化的重要方向,然而歐盟傳統草藥藥品法令(2004/24/EC法令)頒布實施至今已有12年時間,僅有地奧心血康膠囊和天士力丹參膠囊2個中成藥獲得歐盟成員國的注冊批準。回溯國內對歐盟傳統草藥藥品相關法規的研究已有10余年,但是,由于歐盟法規自身完善進程等客觀和其他主觀原因,國內對歐盟傳統草藥法規尚存在部分認識偏差和研究不足。本文旨在系統分析國內對歐盟傳統草藥藥品相關法規的研究現狀,并針對其中的認識不足和研究薄弱環節,進一步解析2004/24/EC法令的疑難問題,以期為中藥歐盟注冊提供參考。
1國內歐盟傳統草藥藥品法規研究現狀分析
隨著2004/24/EC這部轟動全球的傳統草藥藥品法令的頒布實施,蘇鋼強等[1]率先編撰《歐盟草藥藥品注冊指南》,對歐盟草藥藥品相關法令、審批程序與申請類別及注冊申報資料要求等問題進行了系統介紹。同時,國內也掀起了對中藥歐盟注冊法規的研究熱潮。對中國知識基礎設施工程(China National Knowledge Infrastructure,CNKI)進行初步檢索統計后發現,截至2017年3月,國內學者先后發表歐盟傳統草藥法規相關研究論文約40余篇。
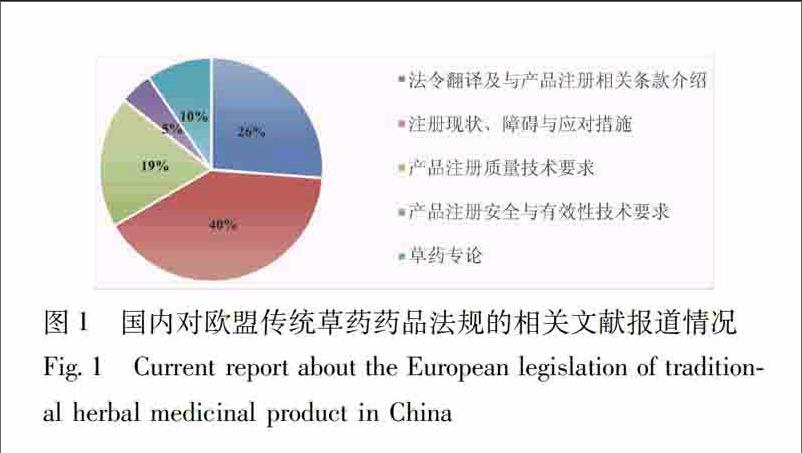
從具體內容看,現有研究文獻可大致分為5類,見圖1,一是2004/24/EC法令翻譯及與傳統草藥藥品注冊相關條款的介紹;二是對產品注冊的質量技術要求介紹;三是對產品注冊的安全與有效性技術要求介紹;四是對中藥歐盟注冊或歐盟草藥注冊現狀及中藥注冊的障礙與應對措施分析;五是歐盟草藥專論相關報道。其中,前3類主要為針對2004/24/EC法令對傳統草藥的規定及產品注冊相關技術要求(以質量方面為主)的研究分析,在所有發表文獻的占比為50%,第4類占比40%;其余10%為草藥專論相關論述,均由筆者所在課題組發表。
從文獻報道時間看,國內對歐盟傳統草藥藥品法規的相關研究,多集中在2004/24/EC法令頒布初期和法令規定的7年過渡期結束,即,2004年和2011年這2個時間點前后。其中,對歐盟傳統草藥藥品注冊規定和中藥注冊相關技術要求的研究多集中在2004/24/EC法令頒布初期(2004—2008年),主要涉及對歐盟傳統草藥概念、申報要求、相關技術指南等的闡述與分析;2009年以后,多為針對過渡期結束后中藥產品應對歐盟新規策略的分析報道。
2歐盟傳統草藥藥品法規疑難問題解析
隨著歐盟法律的修訂更新以及草藥藥品領域的技術發展,歐盟草藥藥品的監管法規一直處于不斷發展與完善之中,單就草藥藥品有關指南的數量,即從2008年的十余個增至目前的數十個。歐盟于2005—2006年發布的草藥藥品質量、臨床安全性與有效性評價等重要技術指南也都于近幾年進行了修訂。盡管國內對歐盟法規的研究數量較多,但從上述研究現狀可見,國內對歐盟草藥藥品注冊規定和技術要求的相關文獻報道時間,多為2004/24/EC法令頒布初期,其研究分析大多系歐盟自身相關法規體系尚未完善的情況下開展,再加之其他多種因素,難免造成對法令中某些問題未能正確理解,亦存在研究薄弱環節,因而導致產生諸多疑難問題,主要涉及:對歐盟傳統草藥藥品集中與分權的監管體系缺乏足夠的理解和認識;對傳統草藥藥品的上市審批程序存在一定認識偏差;對草藥專論和草藥目錄存在認識不足。具體解析如下。endprint
21歐盟傳統草藥藥品集中與分權的監管體系
與中國、美國、日本等國家不同,歐盟的藥品監管具有集中與分權的獨特特點,其監管部門包括歐盟層面的歐洲藥品管理局(European Medicines Agency,EMA)和成員國層面的各國藥品監管當局(National Competent Authorities,NCAs),其法規制定亦在歐盟和成員國2大層面均有所體現。目前國內歐盟傳統草藥法規的研究,主要集中在對傳統草藥藥品在成員國注冊相關技術要求及中藥產品開展歐盟成員國注冊的策略制定方面,且尚未完全認識到歐盟傳統草藥藥品法令在歐盟層面的重要內容。
根據“歐盟藥品管理法規集(EudraLex)”第二卷申請人須知中有關藥品上市審批程序的規定,歐盟藥品的審批程序包括集中程序(centralized procedure,CP)、分散程序(decentralized procedure,DCP)、互認可程序(mutual recognition procedure,MRP)及成員國程序(national procedure,NP)4種。其中,CP是針對整個歐盟市場的上市審批程序,由EMA負責審評;DCP與MRP針對歐盟2個或以上成員國市場,而NP則針對單一國家市場,它們均由各成員國NCAs負責審評,這亦是歐盟藥品監管集中與分權并存的重要體現。深入理解2004/24/EC法令的具體內容可以發現,一方面,法令針對草藥特殊性對傳統草藥藥品的概念、申報資料和技術要求、標簽與廣告等產品注冊的相關問題作出了具體規定。另一方面,法令亦明確指出傳統草藥藥品不能采用由EMA負責審評的CP程序,只能通過由NCAs負責的NP,DCP和MRP程序上市,與此同時,首次在EMA設立草藥藥品委員會(Committee on Herbal Medicinal Products,HMPC),專門負責歐盟草藥專論(Community Herbal Monographs,CHM)與草藥目錄(Community List Entries,CLE)的建立以及草藥其他問題相關指南文件的制定,以發揮其在歐盟層面促進草藥藥品領域技術協調統一的作用。可以看出,2004/24/EC法令的核心內容實質亦可概括為成員國和歐盟層面2大部分。其中,傳統草藥藥品在NCAs注冊的相關規定是法令在成員國層面的內容,CHM和CLE則為歐盟層面主要內容,2個層面共同反映了歐盟在草藥藥品監管領域的集中與分權并存的重要特點。雖然歐盟不允許傳統草藥藥品采用EMA負責的CP程序上市,但在某種程度上,CHM及CLE與CP程序非常類似,并對傳統草藥草藥在成員國NCAs的注冊具有重要作用。
22傳統草藥藥品的上市審批程序
歐盟藥品的上市審批途徑包括了集中程序(CP)、分散程序(DCP)、互認可程序(MRP)及成員國程序(NP)4種。國內某些學者在分析歐盟藥品上市程序時,將NP與MRP審批程序錯誤理解為下屬于DCP的2種子類別[1],認為歐盟藥品審批程序只有CP,MRP和NP 3種。具體到傳統草藥藥品可采用的審批程序,認為除了MRP和NP程序,還可以通過CP程序使產品在整個歐盟市場上市,亦未能認識到傳統草藥采用互認可上市程序必須建立相應草藥專論[2]。實則不然,系統分析2004/24/EC法令具體內容可以發現法令已指出傳統草藥藥品不能采用由EMA負責審評的CP程序,只能通過由成員國NCAs負責的NP,DCP和MRP上市。法令第16b條指出,傳統草藥藥品的上市申請必須提交至NCAs,而不是負責CP審評的EMA。同時,法令第16e(1)條進一步規定的簡化注冊應被拒絕的幾種情況,也包括了申請未提交至NCAs的情形。可見,傳統草藥藥品實際上并不能采用CP審批程序,而只能通過NP或DCP和MRP這3種審批程序上市。如果產品只希望在歐盟一個成員國上市,可直接采用NP程序;如果希望在多個成員國上市,則可采用DCP程序;同時,如果產品已在某一成員國上市,希望進一步進入其他歐盟成員國市場,則同樣可采用MRP程序。但必須說明的是,對于MRP和DCP審批程序,2004/24/EC法令第16d(1)條明確指出此2種程序只適用于已建立相應CHM或CLE的傳統草藥藥品,未建立者只能采用NP,即成員國程序上市。
23草藥專論(CHM)與草藥目錄(CLE)
2004/24/EC法令是歐盟傳統草藥藥品法規的核心,HMPC針對草藥藥品相關技術要求發布的指南文件均圍繞法令所制定。鑒于上述22項的分析,2004/24/EC法令實質上主要包含了傳統草藥藥品在成員國NCAs注冊相關規定和歐盟CHM及CLE這2大層面的核心內容。根據本文對國內歐盟草藥藥品法規研究現狀的分析,針對傳統草藥在成員國的注冊規定及相關技術要求已有較多報道,而CHM和CLE作為2004/24/EC法令在歐盟層面的重要內容,卻少有關注,僅本課題組前期就CHM基本概念、評價情況、在歐盟草藥藥品注冊中的作用等問題進行了相關論述[36],國內尚無CLE的相關報道。
231概念、作用及其關聯性草藥專論(CHM)是由HMPC根據2004/24/EC法令第16h(3)條,針對草藥及相關制品的所有安全性、有效性相關資料,進行科學評價后制定的類指南性文件,其主體內容結構與產品特性摘要(summary of product characteristics,SPC)類似,包括藥品名稱、定性和定量組成(草藥拉丁學名、植物學名、草藥物質、草藥提取物類型等)、制劑形式、臨床特點(適應癥、劑量、使用方法、禁忌癥、特別警告、藥物相互作用、懷孕或哺育期用藥、對駕駛和操作機器的影響、不良反應、超劑量使用等)、藥理學特點(藥代動力學、藥效學、臨床前安全性數據等)、藥學特點、專論撰寫/修訂時間等七方面內容[7]。HPMC對CHM的評價依據包括了2001/83/EC和2004/24/EC法令分別對固有應用(wellestablished medicinal use,WEU)和傳統應用(traditional medicinal use,TU)草藥的規定,因而CHM也包括固有應用和傳統應用兩種類別。根據法令規定,CHM建立后,歐盟各成員國在審評相應產品的上市申請時,應充分考慮其內容;當新的CHM建立后,已上市產品的上市許可持有人應考慮根據CHM內容與結論對產品注冊申請資料進行修改。雖然CHM并無強制法律效力,但法令對CHM賦予的意義與作用,亦體現了CHM代表歐盟層面對草藥安全與有效性科學評價結論的地位,CHM為歐盟成員國的草藥藥品上市審評奠定了重要基礎,并對實現歐盟草藥藥品的技術協調統一發揮著重要作用。endprint
草藥目錄(CLE)則為2004/24/EC法令第16f(1)條首次提出,其主要內容包括草藥名稱、適應癥、特定提取物類型和劑量、給藥途徑以及其他任何與草藥安全使用有關的必要資料,在呈現形式上細分為13個方面,但從內容上與CHM類似,均反映了HMPC對草藥安全與有效性(或傳統應用)的科學評價結論。建立CLE的草藥均同時建立相應CHM。與CHM不同的是,CLE只針對傳統草藥,只有傳統應用的類別。此外,CLE不由HMPC發布,而由職能級別更高的歐盟委員會發布,具有強制法律效力。CLE建立后,成員國必須依據CLE內容審查相應產品的注冊申請,且申請者不必再提供2004/24/EC法令第16c(1)(b),(c),(d)條中要求的藥品上市許可批準相關資料、安全性綜述與報告、傳統應用證據等,審評部門也不得另行要求產品補充其他有關安全與有效性的資料或實驗數據。CLE可被視為歐盟認定傳統草藥的金標準,一旦草藥建立CLE,各成員國必須認可其安全性與傳統應用。
CHM與CLE的區別與關聯,見表1。
232草藥專論(CHM)對現階段傳統草藥藥品注冊更具現實意義草藥目錄(CLE)相較草藥專論(CHM)具有更強法律效力,其對相關資料和數據的要求也更高,尤其是要求草藥必須具有充分的遺傳毒性研究數據。然而,事實上絕大多數草藥均缺乏該項研究,難以滿足CLE要求。亦正因如此,HMPC 2005年著手評價草藥至今,僅建立了12個草藥的CLE,見表2,這個數量對于歐盟評價草藥的初衷,即,促進草藥領域的技術協調統一所能發揮的作用極其有限。或許基于這個原因,歐盟在2014年進一步對CHM的重要性做出了進一步強調,指出“雖然歐盟并不從法律上強制要求成員國遵照CHM內容對相應產品進行上市批準,但考慮到CHM在歐盟草藥技術協調及促進草藥藥品上市方面的重要作用,成員國做出任何不遵循CHM決定的情況均須給出充分合理的解釋”[8]。與僅有12個草藥CLE相對應的是,HMPC目前已建立并發布142個傳統草藥CHM。Wieland Peschel[9]對截至2012年12月31日CHM在歐盟各成員國獲批單方傳統草藥藥品注冊申請中應用情況的統計結果表明,超過50%的注冊申請應用了CHM,其中,不僅涉及申請者提出注冊申請時
采用CHM作為申報資料,而且在相當數量的申請中,成員國藥品主管部門在審評注冊申請時亦參考了CHM的內容和結論。
因而,盡管CLE是歐盟傳統草藥的金標準,考慮到歐盟建立CLE的草藥數量十分有限,而CHM具有相似的評價方式、結構內容,并與CLE共同作為促進歐盟草藥藥品技術協調統一的重要官方文件,筆者認為CHM在目前傳統草藥評價與注冊審批的實際中發揮著更為重要的作用,更具有現實意義。
3結語
歐盟是全球最重要的植物藥市場之一,開展中藥歐盟注冊對中藥國際化意義重大。盡管國內業界對中藥歐盟注冊法規研究尤為關注,但由于歐盟傳統草藥藥品法規體系自身完善進程等客觀和其他主觀因素,國內對此仍存部分認識偏差和研究不足,業內一度將歐盟草藥專論概念與藥典專論混淆。本文在系統分析國內歐盟傳統草藥藥品法規研究現狀的基礎上,發現歐盟傳統草藥藥品集中與分權的監管體系、傳統草藥允許采用的上市審批類別、草藥專論(CHM)和草藥目錄(CLE)等問題,是國內存在的主要認識不足和研究薄弱環節。傳統草藥藥品只能采用由成員國NCAs負責審評的NP,DCP和MRP這3種程序,而并不能通過由EMA負責審評的CP程序上市;CHM和CLE的評價建立程序與CP程序類似,代表著歐盟層面的科學評價結論,與傳統草藥藥品在NCAs的注冊規定,二者共同體現了歐盟藥品監管集中與分權特點,并構成了2004/24/EC法令在歐盟與成員國2大層面的核心內容。
綜合來看,國內對歐盟草藥藥品法規的研究認識不足實質上主要集中在2004/24/EC法令在歐盟層面的內容,即草藥專論(CHM)和草藥目錄(CLE)。其中,CLE是歐盟傳統草藥藥品對安全與有效性審評的金標準,CHM是草藥藥品NP程序申請和審評中的關鍵參考資料,是采用DCP和MRP程序注冊的必須前提條件。二者均代表歐盟層面對草藥的科學評價結論,為成員國NCAs對草藥藥品安全與有效性的具體審評提供了評價的統一參考標準與基礎,并在草藥藥品的上市注冊過程中發揮著重要推動作用。雖然CLE法定效力更強,與CHM均作為法令在歐盟層面核心內容的重中之重,考慮目前CHM對傳統草藥評價與產品注冊審批更具現實意義,在中藥歐盟藥品注冊研究過程中應當予以充分重視。
[參考文獻]
[1]蘇鋼強, 李伯剛歐盟草藥藥品注冊指南[M]北京:人民衛生出版社,2005.
[2]葉祖光,鄒健強 歐洲藥品注冊的管理規定——兼論歐盟傳統草藥的簡化申請[J]. 中藥研究與信息,2005, 7(10):4.
[3]瞿禮萍, 施晴, 曾慧敏, 等. 深度解析草藥專論對中藥歐盟注冊的價值與重要性[J]. 中草藥,2017,48(9): 1916.
[4]鄒文俊, 瞿禮萍, 葉祖光, 等. 歐盟傳統草藥專論述評[J]. 中國中藥雜志,2011, 36(23): 3386.
[5]瞿禮萍, 王文珺, 周禎祥,等. 基于“歐盟草藥專論”解析中藥歐盟注冊關鍵問題[J]. 中草藥,2014, 45(24):3509.
[6]Qu L, Zou W, Zhou Z, et al NonEuropean traditional herbal medicines in Europe: a community herbal monograph perspective [J]. J Ethnopharmacol,2014, 156:107.
[7]European Medicines Agency Procedure for the preparation of community monographs for traditional medicinal herbal products [EB/OL]. (20070111)[20170804]. http://academygmpcomplianceorg/guidemgr/files/2013_EMA_COMM_MONPDF.
[8]European Medicines Agency Community Herbal Monographs [EB/OL]. (20140301) [20170804]. http://wwwemaeuropaeu/ema/indexjsp?curl=pages/regulation/document_listing/document_listing_000212jsp&mid=WC0b01ac058003380a .
[9]Wieland Peschel The use of community herbal monographs to facilitate registrations and authorizations of herbal medicinal products in the European Union 2004—2012[J]. J Ethnopharmacol,2014,158:471
[責任編輯孔晶晶]endprint

