單核細胞性李斯特菌基因dal的敲除及其生物學特性初步分析
曾海娟,劉武康,謝曼曼,丁承超,董慶利,劉 箐*
(上海理工大學醫療器械與食品學院,上海 200093)
單核細胞性李斯特菌基因dal的敲除及其生物學特性初步分析
曾海娟,劉武康,謝曼曼,丁承超,董慶利,劉 箐*
(上海理工大學醫療器械與食品學院,上海 200093)
在單核細胞性李斯特菌(Listeria monocytogenes)野生株EGDe actA及in lB雙基因缺失株(EGDe ΔactAΔinlB)的基礎上,利用同源重組的方法進一步構建了缺失營養基因dal的菌株(EGDe ΔactAΔinlBΔdal),并對該缺失菌株生長狀態、毒力基因表達水平、生物被膜的形成量及細胞侵襲等方面作進一步分析。結果顯示,37 ℃搖床培養6 h后,缺失株的菌濃度顯著低于EGDe ΔactAΔinlB(P<0.001),培養基中補充D-丙氨酸的缺失株生長速率與親本株相比無顯著差異;實時熒光定量聚合酶鏈式反應結果顯示,缺失株的sigB基因表達水平變化最明顯(P<0.01),約下調90%;缺失株生物被膜形成量顯著增加(P<0.05),培養基補充D-丙氨酸后缺失株生物被膜的生成量與親本株相比無差異;對Coca-2細胞的侵襲無影響,表明該基因對細菌生長能力及生物被膜形成具有重要的調控作用,并不影響菌株對細胞的侵襲力。此缺失株的構建為進一步研究基因dal的功能提供了理論支持。
單核細胞性李斯特菌;基因敲除;生長能力;細胞侵襲;生物被膜
單核細胞性李斯特菌(Listeria monocytogenes)是一種重要的革蘭氏染色陽性食源性致病菌,在自然環境中廣泛分布[1]。單核細胞性李斯特菌具有較強的生存能力,pH 4.5~9、溫度0~45 ℃均可增殖[2],在干酪、原奶、冰淇淋、生肉、海鮮及方便食品,如:熟肉、熏魚中均有檢出[3-6]。超過99%的單核細胞性李斯特菌感染是由于食用了被該菌污染的食物[7],死亡率達30%以上。單核細胞性李斯特菌是典型的胞內寄生菌,它可通過李斯特菌溶血素、磷脂酰肌醇特異性磷脂酶C和卵磷脂酶的裂解作用逃離吞噬小體[8-9],并在細胞質中增殖。單核細胞性李斯特菌可穿透腸道屏障、胎盤屏障和血腦屏障,引起哺乳動物和人的腸胃炎、敗血癥、孕畜流產及腦膜炎等[10]。
基因dal為營養基因,存在于多種細菌中。其編碼丙氨酸消旋酶(alanine racemase,A lr)蛋白,可將L-丙氨酸轉化為D-丙氨酸(D-A la),后者為細菌細胞壁肽聚糖的重要組成成分[11]。在革蘭氏陽性菌中,例如芽孢桿菌屬與乳桿菌屬[12],僅存在一種催化生成D-A la的酶,即為A lr。而革蘭氏陰性菌中,例如大腸桿菌[13],存在兩種可催化產生D-A la的酶(A lr與DadX)。在單核細胞性李斯特菌中,同樣存在2 種途徑生成D-A la:基因dal編碼A lr,可將L-A la轉化為D-A la;基因dat編碼D-氨基酸氨基轉移酶蛋白,可將D-谷氨酸與丙酮酸通過轉氨作用生成D-A la與α-酮戊二酸,當dal與dat基因全部缺失時,由于不能合成D-A la,在無外源D-A la添加時,該dal/dat雙基因缺失菌株將發生溶菌死亡[14]。目前尚鮮有研究報道,當菌株缺失dal基因時,對該缺失菌株在生長狀態、毒力基因表達水平、細胞侵襲性、生物被膜的生成量等方面的影響。
本研究以單核細胞性李斯特菌野生株EGDe actA及inlB雙基因缺失株(EGDe ΔactAΔinlB)為親本,利用同源重組的方法進一步構建缺失dal基因的菌株(EGDe ΔactAΔinlBΔdal),并對構建的該缺失菌株生長狀態、毒力基因表達水平、細胞侵襲性及生物被膜的生成量等方面作進一步分析。該項研究對菌株EGDe ΔactAΔinlBΔdal的特性提供了依據,為研究dal基因的功能提供材料。
1 材料與方法
1.1 材料與試劑
單核細胞性李斯特菌野生株E G D e由本實驗室保存,EGD e Δa c tAΔin lB由本實驗室構建。大腸桿菌(Esch erich ia co li)DH 5α感受態細胞購自天根生化科技(北京)有限公司,穿梭質粒pKSV7由上海交通大學史賢明教授惠贈。
細菌總DNA提取試劑盒、膠回收試劑盒、質粒提取試劑盒 天根生化科技(北京)有限公司;實時熒光定量聚合酶鏈式反應(quantitative real-time polymerase chain reaction,qRT-PCR)相關試劑、PCR相關試劑、DNA連接酶、限制性內切酶 寶生物工程(大連)有限公司;腦心浸液培養基(brain heart infusion,BHI) 北京陸橋技術有限公司;氨芐青霉素、氯霉素及其他常規試劑國藥集團化學試劑有限公司。
1.2 儀器與設備
PCR熱循環儀、q RT-PCR儀 美國A p p lied Biosystems公司;凝膠成像儀、NANODROP濃度測定儀美國Thermo公司;M ini-power電泳儀、電穿孔儀 美國伯樂公司;SpectraM ax M 2多功能酶標儀 美國分子儀器公司。
1.3 方法
1.3.1 引物
根據GenBank登錄的基因序列(Gene ID:986294),用Prim er3 Inpu t設計擴增上游同源臂引物P1/P2,下游同源臂引物P3/P4。連接后PCR引物為P1/P4,全長1 342 bp,缺失片段大小為1 202 bp。相關引物序列見表1,由生工生物工程(上海)股份有限公司合成。

表1 PCR擴增所用的引物序列Table 1 Primer sequences used for PCR am p lifi cation
1.3.2 基因缺失株的構建
1.3.2.1 穿梭重組質粒的構建
利用引物P1/P2及P3/P4分別擴增dal基因的上下游同源臂片段,經Eco RⅠ單酶切后30℃進行連接16 h。以連接體系為模板,利用引物P1/P4對連接產物進行擴增。擴增產物經DNA回收試劑盒割膠純化回收,再經SalⅠ、SmaⅠ雙酶切。酶切后經割膠純化回收,與經Sa lⅠ、SmaⅠ酶切的穿梭質粒pKSV 7連接,并轉化至大腸桿菌DH5α中,涂布含氨芐青霉素(100 μg/m L)的LB固體培養基培養。
1.3.2.2 電轉化與同源重組
挑取LB平板的單菌落培養,利用P1/P4進行PCR鑒定。鑒定為陽性的克隆抽提質粒后進行雙酶切鑒定,并送華大基因測序。測序正確的重組質粒經11.25 kV/c m、4 ms電轉化至EGDe ΔactAΔinlB中,氯霉素(10 μg/m L)抗性平板培養48 h,并用引物P1/P4對平板上的單菌落進行鑒定。鑒定為陽性的克隆在42 ℃和氯霉素雙重壓力下傳15 代,使之發生單交換同源重組。然后在30 ℃無抗性條件下傳15 代,末代培養物劃線于無抗性BHI平板。
1.3.2.3 缺失株的鑒定
挑取BHI平板上的單菌落于液體培養基30 ℃培養,分別用引物P1/P4及引物dal-F/dal-R進行PCR鑒定,鑒定成功的菌株分別劃線于BHI平板及含氯霉素(10 μg/m L)抗性平板,37 ℃培養。
1.3.3 缺失株生長曲線測定
為確定該基因是否會對菌株生長能力有影響,采用酶標儀對EGDe ΔactAΔinlB及敲除da l菌株EGDe ΔactAΔinlBΔdal(外源不補充及補充200 μg/m L D-A la)的生長進行測定[15-16]。挑取平板上的單菌落37 ℃過夜培養15 h后,按1∶100轉接種到新鮮BHI培養基中,37℃搖床培養。每間隔1 h吸取樣品于96 孔酶標板中,酶標儀測定600 nm波長處的光密度(OD600nm)后繼續37 ℃搖床培養,連續測12 h。
1.3.4 毒力基因表達水平的qRT-PCR檢測

表2 qRT-PCR所用的引物序列Table 2 Primer sequences used for qRT-PCR
為確定該營養基因缺失后是否會對其他毒力基因及dat的表達量有影響,本實驗選取了李斯特菌EGDe的12 個毒力基因[17]及與D-A la合成有關的2 個基因,比較了3 株菌在毒力基因表達量上存在的差異。分別挑取EGDe、EGDe ΔactAΔinlB及EGDe ΔactAΔinlBΔdal平板上的單菌落過夜培養后,各取5 m L飽和菌液提取RNA后,按照TaKaRa反轉錄試劑盒的操作說明先去除其中的DNA,再反轉錄為cDNA。以cDNA為模板進行qRTPCR,實驗中選取的毒力基因引物序列參照文獻[18],見表2。數據采用2-ΔΔCt法進行相對定量分析,以EGDe的基因表達水平為對照,以16S rRNA為內參。計算公式為:ΔCt=菌株目的基因Ct均值-各自內參基因Ct均值;ΔΔCt=ΔCt(敲除株及親本株目的基因)-ΔCt(對應的EGDe目的基因)。2-ΔΔCt為毒力基因對EGDe相應毒力基因的表達量的倍數,即EGDe的每個目的基因表達水平均以1表示,EGDe ΔactAΔinlB及EGDe ΔactAΔinlBΔdal的目的基因表達水平大于1為表達上調,反之則為表達下調。
1.3.5 生物被膜生成量的測定
構成生物被膜的胞外多糖可與結晶紫結合,可利用胞外多糖的量來衡量生物被膜的生成量。操作方法根據文獻報道并稍作改良后進行[19]。將過夜培養的細菌用BHI液體培養基調整至OD600nm為0.15,取200 μL菌懸液加入96 孔細胞培養板中,于37 ℃條件下培養48 h后,無菌PBS洗3 遍,150 μL 1%的結晶紫染色30 m in,無菌水洗3遍,每孔滴加170 μL 95%乙醇溶液洗脫30 m in,酶標儀測量其在570 nm波長處的吸光度。
1.3.6 細胞侵襲實驗
按照相關文獻報道[20],將生長良好的Caco-2細胞消化并轉移至12 孔細胞培養板中,過夜培養20 h左右。細菌侵襲前,將細胞培養板中完全培養基吸出,換成不含血清的不完全培養基,然后按細菌和細胞100∶1的比例分別加入新鮮的野生株EGDe、親本株EGDe ΔactAΔinlB及敲除株EGDe ΔactAΔinlBΔdal共培養3 h。侵襲結束后,換用慶大霉素(200 μg/m L)37 ℃處理30 m in。將慶大霉素吸出,無菌生理鹽水輕柔清洗2 次,再用1% Triton X-100裂解細胞,釋放細菌。每孔充分吹打并收集至離心管中,生理鹽水梯度稀釋涂布BHI平板,置于37 ℃培養箱培養并計數。
2 結果與分析
2.1 上下游片段擴增及連接
上下游同源臂的PCR擴增產物經1.5%瓊脂糖凝膠電泳,條帶大小分別為607 bp和735 bp左右(圖1a),連接后PCR擴增產物經電泳,顯示一條約1 342 bp的條帶(圖1b),與預期結果一致。
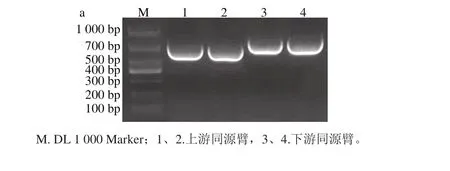
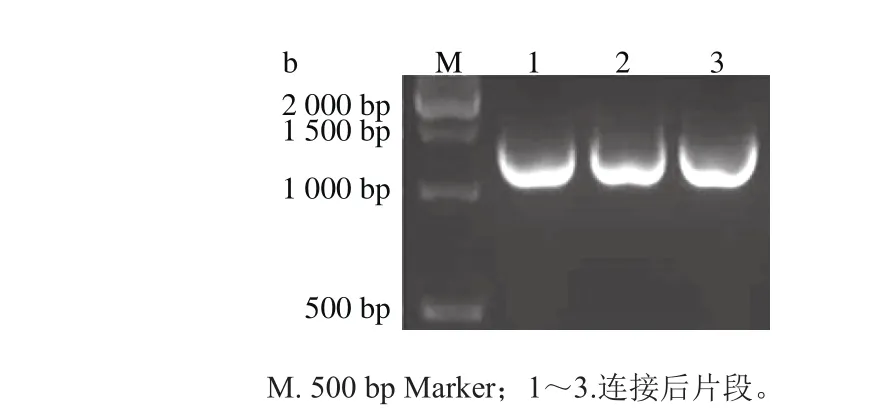
圖1 上下游同源臂(a)及連接后片段(b)大小Fig. 1 Fragment sizes of separate and connected upstream and downstream homologous arm s
2.2 穿梭重組載體構建及雙酶切鑒定結果
連接后片段經SalⅠ、SmaⅠ雙酶切后,與同樣酶切的穿梭質粒pKSV7連接,并轉化至大腸桿菌DH5α中。陽性克隆測序成功后,經雙酶切鑒定,片段大小與預期一致(圖2a),表明重組載體構建成功。抽提質粒電轉化至EGDe ΔactAΔinlB中,引物P1/P4進行PCR鑒定,可見1 342 bp左右的條帶(圖2b泳道1~3),表明重組質粒已經電轉化至EGDe ΔactAΔinlB中。
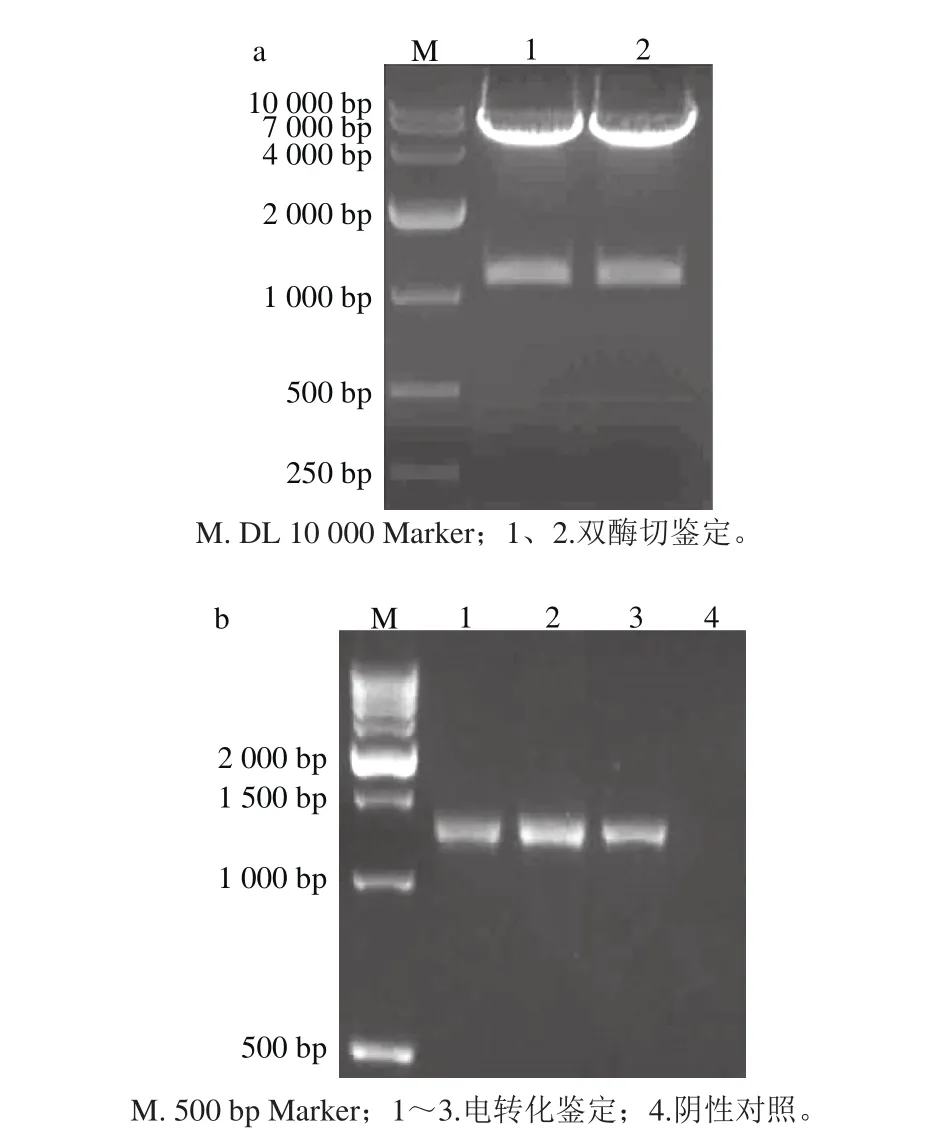
圖2 雙酶切(a)及電轉化(b)鑒定結果Fig. 2 Identifi cation by doub le enzyme digestion and electrotransform ation
2.3 缺失株的鑒定
dal-F/dal-R的結合位點位于上游同源臂引物P2及下游同源臂引物P3之間1 202 bp的序列上,若dal基因被敲除,則該引物將不會擴增出條帶。鑒定時,采用引物P1/P4及引物dal-F/dal-R對單菌落分別進行PCR擴增,若P1/P4擴增出1 342 bp左右的條帶,而dal-F/dal-R未擴增出條帶,則該菌株為疑似敲除菌株。如圖3a所示,引物P1/P4擴增出1 342 bp左右的條帶(泳道3),而未敲除菌株(泳道1、2)擴增出約2 544 bp的條帶;如圖3b所示,引物dal-F/dal-R未擴增出條帶(泳道3),而未敲除株擴增出約428 bp的條帶(泳道1、2),表明3號為疑似敲除株,經氯霉素抗性進一步鑒定,該克隆不能在抗性平板上生長,確定3號為敲除株。
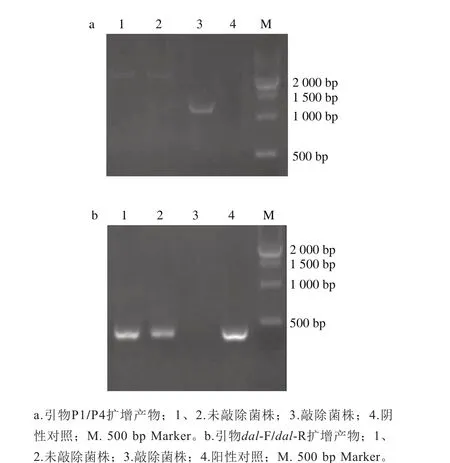
圖3 基因缺失株的鑒定Fig. 3 Identification of dal deletion mutant
2.4 生長曲線分析
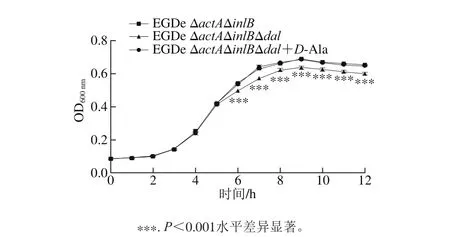
圖4 生長曲線Fig. 4 Grow th curves
酶標儀測定連續12 個時間點的OD600nm值繪制生長曲線,如圖4所示,與親本株EGDe ΔactAΔinlB相比,敲除株EGDe ΔactAΔinlBΔdal從培養6 h的對數生長期到12 h平臺期達到的菌濃度顯著降低(P<0.001),而在敲除株培養基中添加D-A la后生長趨勢與親本株相比無差別。表明盡管李斯特菌可通過另一途徑經丙氨酸轉氨酶作用產生D-Ala,但dal基因的缺失使菌株的生長能力降低。
2.5 毒力基因表達結果
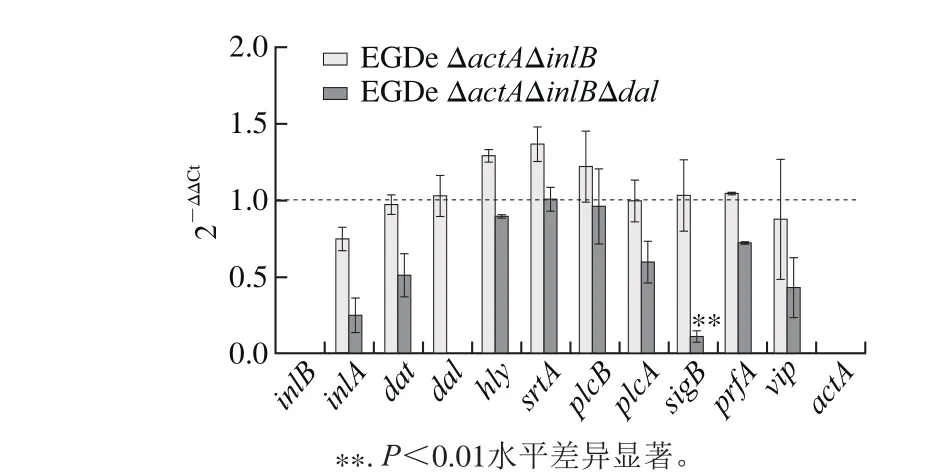
圖5 qRT-PCR結果Fig. 5 Viru lence gene exp ression levels detected by RT-PCR
由圖5可知,菌株EGDe ΔactAΔinlBΔdal的dal基因無信號,進一步驗證dal基因的缺失;EGDe ΔactAΔinlB與EGD e相比,未有顯著性差異(P>0.0 5);EGDe ΔactAΔinlBΔdal與EGDe ΔactAΔinlB相比,基因表達量均略微下調,其中sigB基因表達水平變化最明顯(P<0.01),約下調90%。
2.6 生物被膜生成量分析
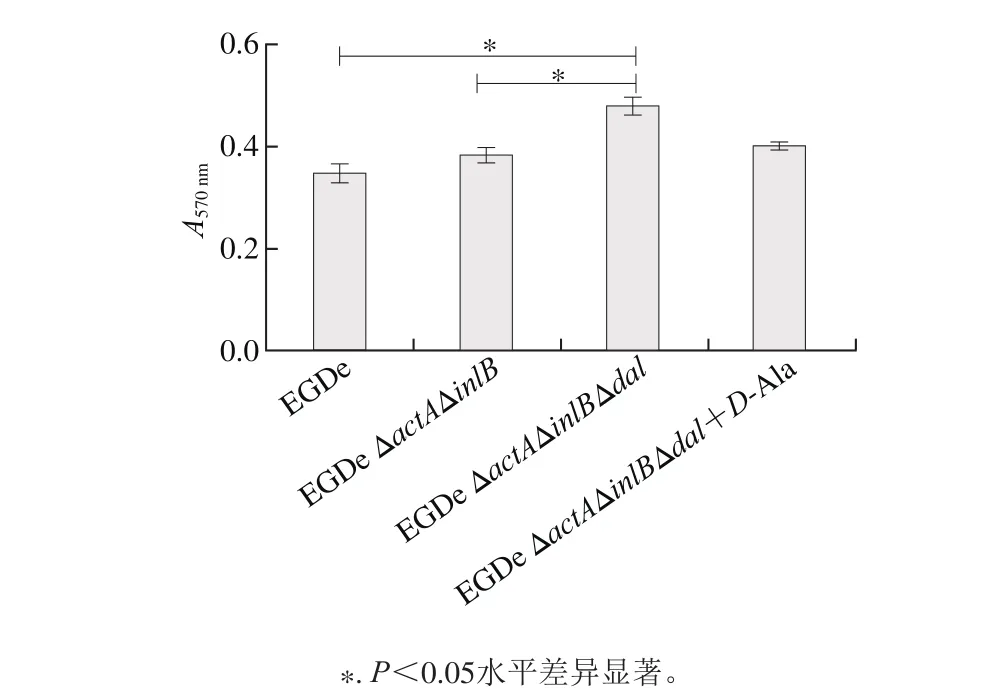
圖6 生物被膜生成量比較Fig. 6 Comparison of biofi lm formation between the wild-type and the mutant strains
生物被膜是細菌抵抗外界不利環境時形成的,它是一種多細胞聚合物,由細菌團塊與表多糖、蛋白和胞外DNA構成的細胞外基質形成的復合物。由圖6可知,dal缺失株與野生株EGDe及親本株EGDe ΔactAΔinlB相比,形成生物被膜的能力顯著增加(P<0.05),而在培養基中添加D-A la后缺失株菌膜生成量與EGDe及EGDe ΔactAΔinlB相比均無顯著差異,推測由于dal基因的缺失使菌株處于D-A la營養不足的脅迫狀態,因而對于外界不利條件形成自我保護的生物被膜。
2.7 細胞侵襲結果
由圖7敲除株對Caco-2細胞侵襲結果可以看出,與野生株相比敲除actA及inlB基因后,菌株EGDe ΔactAΔinlB的侵襲能力顯著下降(P<0.01),表明actA及inlB基因在細胞侵襲過程中發揮了重要作用[21]。但dal基因敲除后,與菌株EGDe ΔactAΔinlB相比,并未對侵襲結果產生顯著影響,表明dal基因敲除后,菌株對細胞的侵襲力并無發生變化,也不會引起菌株毒力返祖的現象。
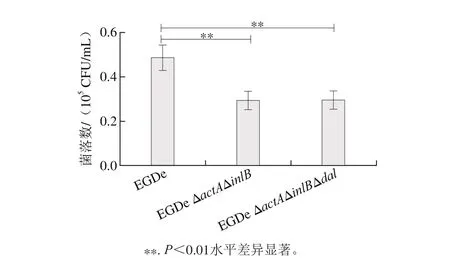
圖7 細胞侵襲結果Fig. 7 Com parison of cell invasion ability between the w ild-type and the mutant strains
3 討 論
單核細胞性李斯特菌識別、黏附與侵入宿主細胞的過程與內化素基因(inl)分泌的內化素A和B有關[22-23],而其細胞內增殖及細胞間擴散能力則由毒力基因plcA、plcB、hly、prfA、actA等介導[24-26]。本研究在單核細胞性李斯特菌actA及inlB雙基因缺失株的基礎上成功構建了dal基因缺失的三基因缺失株,并對該缺失菌株的生長特性、毒力基因表達的變化、生物被膜的生成量及對細胞的侵襲性進行了研究。結果顯示,缺失dal基因的菌株在無外源D-A la補充時,雖不影響菌株的生存,但從生長曲線可以看出,缺失株6 h后菌濃度低于親本株,而外源補充D-A la后生長能力與親本株相比無差異,表明通過丙氨酸轉氨作用單一途徑合成D-A la不足以維持菌株原有的生長繁殖速率,使得菌濃度降低。qRT-PCR結果顯示,sigB基因表達水平約下調90%。由于sigB基因在許多革蘭氏陽性菌,例如芽孢桿菌屬、李斯特菌和金黃色葡萄球菌中,作為應激反應的中心調節子[27-28],推斷菌株EGDe ΔactAΔinlBΔdal在外界不利條件下生長能力可能有一定影響。缺失株生物被膜生成量顯著增加(P<0.05),但在培養基中添加D-A la后生物被膜生成量與親本株相比無差異,表明基因dal缺失使菌株處于一種外界營養脅迫狀態,該脅迫對菌體生長是不利的,因而產生了應對不利環境的菌膜。該缺失株的構建表明dal基因在菌株生長及生物被膜形成上起重要的調控作用,但不會對菌株毒力產生影響。
在革蘭氏陽性菌如鼠傷寒沙門菌、豬霍亂沙門菌中[29-30],同樣存在類似功能的基因asd,編碼天冬氨酸β-半乳糖脫氫酶。asd缺失菌株在無外源二氨基庚二酸存在的條件下會發生溶菌死亡,通過質粒回補asd基因并攜帶外源抗原基因而表達相應抗原蛋白,能有效解決質粒攜帶外源基因表達不穩定的問題,為沙門菌活疫苗載體的研發開辟了新的途徑。本研究的下一步實驗是進一步缺失dat基因,并通過質粒回補dal基因并攜帶外源抗原基因,構建能穩定表達外源基因的單核細胞性李斯特菌活疫苗載體。研究通過對缺失株生長曲線、qRT-PCR、生物被膜的生成量、細胞侵襲實驗的研究,為基因dal缺失后菌株的生物學特性提供了依據,對進一步缺失dat基因,構建李斯特菌活疫苗載體提供了理論支持。
[1] REDA W W, ABDEL-MOEIN K, HEGAZI A, et al. Listeria monocytogenes: an emerging food-borne pathogen and its public health implications[J]. Journal of Infection in Developing Countries,2016, 10(2): 149-154. DOI:10.3855/jidc.6616.
[2] HA IN T, CHATTERJEE S S, GHA I R, et al. Pathogenom ics of Listeria spp.[J]. International Journal of Medical M icrobiology, 2007,297: 541-557. DOI:10.1016/j.ijmm.2007.03.016.
[3] QUERO G M, SANTOVITO E, V ISCONTI A, et al. Quantitative detection of Listeria monocytogenes, in raw m ilk and soft cheeses:culture-independent versus liquid- and solid-based culture-dependent real time PCR approaches[J]. Food Science & Technology Research,2014, 58(1): 11-20. DOI:10.1016/j.lw t.2014.03.005.
[4] MASTRONICOLIS S K, DIAKOGIANNIS I, BERBERI A, et al.Eff ect of cold adaptation on the survival of Listeria monocytogenes,in ice-cream formulations during long-term frozen storage[J]. Annals of Microbiology, 2011, 61(4): 931-937. DOI:10.1007/s13213-011-0216-7.
[5] PESAVENTO G, DUCCI B, N IERI D, et al. Prevalence and antibiotic susceptibility of Listeria spp. isolated from raw meat and retail foods[J]. Food Control, 2010, 21(5): 708-713. DOI:10.1016/j.foodcont.2009.10.012.
[6] GUSMAN V, MEDIC D, JELESIC Z, et al. Listeria monocytogenes isolated in ready-to-eat food in south Backa region of Vojvodina province, Serbia[J]. Archives of Biological Sciences, 2014, 66(1): 11-14. DOI:10.2298/ABS1401011G.
[7] ALLEN K J, WALECKA-ZACHARSKA E, CHEN J C, et al. Listeria monocytogenes-an exam ination of food chain factors potentially contributing to antim icrobial resistance[J]. Food M icrobiology, 2015,54: 178-189. DOI:10.1016/j.fm.2014.08.006.
[8] LAM G, FATTOUH R, MUISE A, et al. Listeriolysin O suppresses phospholipase C-mediated activation of the m icrobicidal NADPH oxidase to promote Listeria monocytogenes infection[J]. Cell Host &M icrobe, 2011, 10(6): 627-634. DOI:10.1016/j.chom.2011.11.005.
[9] YEUNG P S, ZAGORSKI N, MARQUIS H. The metalloprotease of Listeria monocytogenes controls cell wall translocation of the broadrange phospholipase C[J]. Journal of Bacteriology, 2005, 187(8):2601-2608. DOI:10.1128/JB.187.8.2601-2608.2005.
[10] LOW J C, DONACHIE W. A review of Listeria monocytogenes, and listeriosis[J]. Veterinary Journal, 1997, 153(1): 9-29. DOI:10.1016/S1090-0233(97)80005-6.
[11] AWASTHY D, BHARATH S, SUBBULAKSHM I V, et al. Alanine racemase mutants of Mycobacterium tuberculosis require D-alanine for grow th and are defective for survival in macrophages and m ice[J].M icrobiology, 2012, 158(2): 319-327. DOI:10.1099/mic.0.054064-0.
[12] STEEN A, PALUMBO E M, COCCONCELLI P S, et al. Autolysis of Lactococcus lactis is increased upon D-alanine dep letion of peptidoglycan and lipoteichoic acids[J]. Journal of Bacteriology, 2005,187(1): 114-124. DOI:10.1128/JB.187.1.114-124.2005.
[13] W ILD J, HENNIG J, LOBOCKA M, et al. Identifi cation of the dadX,gene coding for the predom inant isozyme of alanine racemase in Escherichia coli K12[J]. MGG-Molecular and General Genetics, 1985,198(2): 315-322. DOI:10.1007/BF00383013.
[14] ZHAO X, LI Z, GU B, et al. Pathogenicity and immunogenicity of a vaccine strain of Listeria monocytogenes that relies on a suicide plasm id to supply an essential gene product[J]. Infection & Immunity,2005, 73(9): 5789-5798. DOI:10.1128/IAI.73.9.5789-5798.2005.
[15] YANG Y, HOU J, LIN Z, et al. Attenuated Listeria monocytogenes as a cancer vaccine vector for the delivery of CD24, a biomarker for hepatic cancer stem cells[J]. Cellular and Molecular Immunology,2014, 11(2): 184. DOI:10.1038/cm i.2013.64.
[16] 康美琴, 蔡雪薛, 談衛軍, 等. 單核細胞增生李斯特菌hfq基因缺失株的構建及其生物學特性[J]. 微生物學報, 2015, 55(4): 433-439.DOI:10.13343/j.cnki.wsxb.20140342.
[17] 亢春雨, 于宏偉, 郭潤芳, 等. 單增李斯特氏菌Lm319主要毒力基因的時序性表達研究[J]. 農業生物技術學報, 2015, 23(6): 788-797.DOI:10.3969/j.issn.1674-7968.2015.06.011.
[18] 劉武康, 陳國薇, 吳嫚, 等. inlA和inlB基因缺失對單核細胞增生性李斯特菌侵襲HT29結腸癌細胞的影響[J]. 食品科學, 2016, 37(23):166-172. DOI:10.7506/spkx1002-6630-201623028.
[19] DJORDJEVIC D, W IEDMANN M, MCLAMDSBOROUGH L A.M icrotiter p late assay for assessment of Listeria monocytogenes biofi lm formation[J]. Applied & Environmental M icrobiology, 2002,68(6): 2950. DOI:10.1128/AEM.68.6.2950-2958.2002.
[20] YAMADA F, UEDA F, OCH IA I Y, et al. Invasion assay o f Listeria monocytogenes, using Vero and Caco-2 cells[J]. Journal of M icrobiological Methods, 2006, 66(1): 96-103. DOI:10.1016/j.m imet.2005.10.017.
[21] 丁承超, 曾海娟, 鐘菲菲, 等. 雙基因敲除減毒單增李斯特菌(ΔactA/ΔinlB)的構建及其生物學初步鑒定[J]. 現代食品科技, 2016(7): 66-71.DOI:10.13982/j.m fst.1673-9078.2016.7.011.
[22] SCHAIK W V, ABEE T. The role of σ B, in the stress response of Gram-positive bacteria-targets for food preservation and safety[J].Current Opinion in Biotechnology, 2005, 16(2): 218-224. DOI:10.1016/j.copbio.2005.01.008.
[23] GRUNDLER T, QUEDNAU N, STUMP C, et al. The surface proteins InlA and InlB are interdependently required for polar basolateral invasion by Listeria monocytogenes in a human model of the bloodcerebrospinal fluid barrier[J]. M icrobes and Infection, 2013, 15(4):291-301. DOI:10.1016/j.m icinf.2012.12.005.
[24] CARRERO J A, CALDERON B, UNANUE E R. Listeriolysin O from Listeria monocytogenes is a lymphocyte apoptogenic molecule[J].Journal of Immunology, 2004, 172(8): 4866-4874. DOI:10.4049/jimmunol.172.8.4866.
[25] HERAS A D L, CAIN R J, BIELECKA M K, et al. Regulation of Listeria virulence: PrfA master and commander[J]. Current Opinion in M icrobiology, 2011, 14(2): 118-127. DOI:10.1016/j.m ib.2011.01.005.
[26] LE MONNIER A, AUTRET N, JOIN-LAMBERT O F, et al. ActA is required for crossing of the fetop lacental barrier by Listeria monocytogenes[J]. Infection & Immunity, 2007, 75(2): 950-957.DOI:10.1128/IAI.01570-06.
[27] SOMOLINOS M, ESPINA L, PAGAN R, et al. sigB absence decreased Listeria monocytogenes EGD-e heat resistance but not its pulsed electric fields resistance[J]. International Journal of Food Microbiology,2010, 141(1/2): 32-38. DOI:10.1016/j.ijfoodm icro.2010.04.023.
[28] GAO X, LORINCZI M, HILL K S, et al. M et receptor tyrosine kinase degradation is altered in response to the leucine-rich repeat of the Listeria invasion protein internalin B[J]. Journal of Biological Chem istry, 2009, 284(2): 774-783. DOI:10.1074/jbc.M 805989200.
[29] 李靜, 陳松彪, 余祖華, 等. 鼠傷寒沙門菌SL1344株環化腺苷酸合成酶缺失株平衡致死系統的構建及其雛雞免疫保護試驗[J]. 微生物學報, 2015, 55(7): 942-948. DOI:10.13343/j.cnki.wsxb.20140559.
[30] 趙戰勤, 徐引弟, 吳斌, 等. 豬霍亂沙門氏菌?asd C500株的生物學特性及作為活疫苗表達載體的應用[J]. 生物工程學報, 2009, 25(1):29-36. DOI:10.3321/j.issn: 1000-3061.2009.01.005.
Knockout of dal Gene and Its Effect on Listeria monocytogenes
ZENG Haijuan, LIU Wukang, XIE Manman, DING Chengchao, DONG Qingli, LIU Qing*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
In this study, the actA and inlB double gene deletion mutant (EGDe ΔactAΔinlB) of Listeria monocytogenes w ild-type (WT) strain EGDe was used as the parent to delete the dal gene by homologous recombination technology, and the biological characteristics of the dal-deficient mutant such as grow th capacity, virulence gene expression, cell invasion and biofilm formation were further studied. Grow th curves showed that the concentration of the new mutant strain was significantly lower than that of EGDe ΔactAΔinlB after 6 h of shaking culture at 37 ℃ (P < 0.001), but there was no diff erence in the grow th rates of the parental and the mutant strains when D-alanine was added to the medium. Quantitative real-time-PCR showed that the sigB gene expression level of the mutant strain was changed most significantly (P < 0.01) and down-regulated by 90% compared w ith EGDe ΔactAΔinlB. The biofi lm formation of the mutant strain increased compared w ith EGDe ΔactAΔinlB, but this diff erence did not exist when D-alanine was added to the medium for the mutant. There was no significant diff erence in Caco-2 cells invasion ability compared w ith EGDe ΔactAΔinlB. The results indicated that the dal gene played an important regulatory role in the grow th and biofi lm formation of bacteria and did not aff ect the ability of cell invasion. The construction of this deletion strain can provide a tool for further study of the function of the dal gene.
Listeria monocytogenes; gene knockout; grow th capacity; biofi lm; cell invasion
10.7506/spkx1002-6630-201722008
TS201.3
A
1002-6630(2017)22-0048-06
曾海娟, 劉武康, 謝曼曼, 等. 單核細胞性李斯特菌基因dal的敲除及其生物學特性初步分析[J]. 食品科學, 2017, 38(22):
48-53.
10.7506/spkx1002-6630-201722008. http://www.spkx.net.cn
ZENG Haijuan, LIU Wukang, XIE Manman, et al. Knockout of dal gene and its effect on Listeria monocytogenes[J]. Food
Science, 2017, 38(22): 48-53. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722008. http://www.spkx.net.cn
2016-12-29
國家自然科學基金面上項目(31371776)
曾海娟(1990—),女,博士研究生,研究方向為食源性致病菌致病機理。E-mail:zenghaijuan12@126.com
*通信作者:劉箐(1970—),男,教授,博士,研究方向為食源性致病菌致病機理及快速檢測技術。E-mail:liuq@usst.edu.cn

