RRM2基因過表達卵巢癌細胞株SKOV3的構建及對順鉑敏感性觀察
王中山,張夢,張冬梅,楊新慧
(1徐州醫科大學,江蘇徐州221004;2徐州市中心醫院)
·基礎研究·
RRM2基因過表達卵巢癌細胞株SKOV3的構建及對順鉑敏感性觀察
王中山1,張夢2,張冬梅2,楊新慧2
(1徐州醫科大學,江蘇徐州221004;2徐州市中心醫院)
目的構建核糖核苷酸還原酶亞基M2(RRM2)基因過表達的卵巢癌細胞株SKOV3,并觀察RRM2基因過表達的SKOV3細胞對順鉑的敏感性。方法提取SKOV3細胞總RNA,反轉錄得到cDNA,以其為模版進行PCR反應,獲得RRM2基因。通過酶切(XhoⅠ、BamHⅠ)連接的方法,將RRM2基因插入慢病毒表達載體pLVX-IRES-ZsGreen1中,得到重組質粒pLVX-IRES-RRM2。利用脂質體將重組質粒轉染293FT細胞,包埋病毒。將SKOV3細胞分為實驗組和對照組,實驗組轉染pLVX-IRES-RRM2慢病毒,96 h后測算慢病毒感染效率。對照組不進行轉染。采用Western blotting法檢測兩組細胞中的RRM2蛋白;流式細胞儀檢測兩組凋亡細胞與死亡細胞,反映細胞對順鉑的敏感性。結果重組質粒pLVX-IRES-RRM2經限制性內切酶XhoⅠ和BamHⅠ雙酶切驗證,各片段大小符合預期,測序結果顯示RRM2基因序列正確。實驗組、對照組細胞中RRM2 mRNA相對表達量分別為0.280±0.055、0.102±0.022,RRM2蛋白相對表達量分別為0.582±0.049、0.228±0.032,實驗組高于對照組,說明RRM2基因過表達的SKOV3細胞構建成功。實驗組、對照組凋亡細胞比例分別為0.39%±0.08%、9.60%±1.20%,死亡細胞比例分別為26.65%±2.20%、44.96%±2.80%,實驗組凋亡細胞比例和死亡細胞比例均低于對照組(P均<0.01)。結論成功構建了RRM2基因過表達的SKOV3細胞,RRM2基因過表達的SKOV3細胞對順鉑的敏感性降低。
卵巢癌;卵巢癌細胞株;核糖核苷酸還原酶家族成員2;順鉑;藥物耐受性;藥物敏感性
卵巢癌是常見的婦科腫瘤,病死率位居婦科惡性腫瘤之首[1],多數(85%)為上皮性卵巢癌(EOC)[2]。卵巢癌主要的治療手段為最大程度的減瘤術繼之以鉑類為主的化療[3,4]。但卵巢癌細胞對順鉑等化療藥物存在耐受性[5],導致腫瘤復發率高,患者3年生存率較低[6]。順鉑耐藥的一個重要因素是DNA損傷修復。順鉑誘發的DNA損傷以30 nt單鏈的形式被從基因組切除[7,8],隨后單鏈間隙由聚合酶填補,形成完整無錯的DNA。為了修復損傷的DNA,細胞將通過p53調控核糖核苷酸還原酶(RNR)增加脫氧核糖核苷酸(dNTP)的合成[9,10]。RNR由兩個核糖核苷酸還原酶家族成員(RRM)1大亞基和兩個RRM2小亞基組成,能催化核糖核苷酸轉變為dNTP,為DNA復制和修復提供原料[11,12]。RRM1在不同的細胞周期均穩定表達,且表達量超過RRM2;而RRM2表達量則隨著細胞周期波動較大,并決定了RNR活性[11~16]。因此,RRM2在DNA損傷的修復過程中具有至關重要的作用,其在所有物種中高度保守,表達受到嚴格調控[17,18]。本研究構建了RRM2基因慢病毒過表達載體,包埋病毒,感染卵巢癌細胞SKOV3,觀察RRM2基因過表達的SKOV3細胞對順鉑藥物敏感性的變化,為闡明RRM2參與卵巢癌細胞耐藥的機制奠定理論基礎。
1 材料與方法
1.1 細胞與主要實驗材料卵巢癌細胞株SKOV3、293FT、大腸桿菌DH5α、pLVX-IRES-ZsGreen1、psPAX2和pMD2.G病毒載體均為本實驗室保持。pfu DNA聚合酶、T4 DNA連接酶、限制性內切酶XhoⅠ和BamHⅠ購自Fermentas公司。RRM2一抗(兔源)和二抗(羊抗兔IgG)、GAPDH一抗和二抗均購自Abcam公司。凋亡檢測試劑盒購于Beyotime公司。引物合成與測序由金唯智(蘇州)公司完成。所用試劑均為分析純。
1.2 RRM2基因過表達慢病毒的制備 RRM2基因上游引物序列為5′-CGTCCTCGAGATGCTCTCCCTCCGTGTCCC-3′,下游引物序列為5′-CGTCGGATCCTTAGAAGTCAGCATCCAAGGTAAAA-3′。TRIzol試劑提取卵巢癌細胞株SKOV3總RNA,反轉錄獲得cDNA,進行PCR反應,得到RRM2基因,并在基因兩端插入XhoI、BamHI酶切位點。通過酶切連接的方法將RRM2基因插入慢病毒表達載體pLVX-IRES-ZsGreen1(Clontech)中,得到重組質粒pLVX-IRES-RRM2。重組子質粒經XhoⅠ、BamHⅠ雙酶切鑒定后送測序。于60 mm細胞培養板接種293FT細胞,在細胞匯合度為80%~90%時進行轉染。用Lipofectamine2000轉染質粒pLVX-IRES-RRM2、psPAX2和pMD2.G,96 h后收集細胞培養液上清,經0.45 μm濾膜過濾,隨后用濃縮管在4 000 g、4 ℃下離心濃縮并進行滴度測定,分裝成小份于-80 ℃保存。
1.3 RRM2基因過表達的SKOV3細胞的構建 人卵巢癌細胞株SKOV3用含有10%小牛血清的RMPI1640培養基在37 ℃、5% CO2細胞培養箱內培養。待細胞長至培養瓶壁的80%~90%,棄去培養瓶中的培養液,PBS沖洗2遍,去除細胞碎片及殘余培養基,加入胰酶。將細胞置于倒置顯微鏡下觀察,當細胞變圓,加入含血清培養液終止胰酶消化。反復輕輕吹打細胞,傳代,分裝。將重懸液轉入離心管中,1 000 r/min離心5 min。棄上清,加入PBS重懸細胞、離心,重復3遍,洗凈胰酶及血清。加入PBS重懸細胞,并將懸液移入無菌EP管中,離心棄上清,-80 ℃保存備用。將SKOV3細胞分為實驗組和對照組。實驗組細胞轉染pLVX-IRES-RRM2,并于轉染96 h后,利用表達載體中的報告基因(EGFP),通過熒光顯微鏡觀察卵巢癌細胞的慢病毒感染效率。對照組不進行轉染。采用RT-PCR法檢測兩組細胞中RRM2 mRNA。RRM2基因上游引物序列為5′-CGCTTTGTCATCTTCCC-3′,下游引物序列為5′-CATAAAGTCAAATGGGTTCT-3′;GAPDH上游引物序列為5′-GGGGAAGGTGAAGGTCG-3′,下游引物序列為5′-GCTGTAGCCAAATTCGTTGT-3′。采用Western blotting法檢測兩組細胞中的RRM2蛋白:使用胰蛋白酶消化、并離心收集細胞,棄上清液,細胞沉淀中加入裂解液重懸,獲得SKOV3細胞總蛋白;通過SDS-PAGE分離不同分子量的蛋白質,然后通過半干轉/濕轉方法轉移到PVDF膜上;將膜用含有5%脫脂奶粉的PBS室溫孵育2 h,加入一抗于4 ℃孵育過夜,隨后PBST洗膜3次,加入二抗室溫孵育1 h,PBST再次洗膜;加入發光液,X線片曝光、顯影、定影,掃描圖像,采用Image J軟件分析圖像,得出RRM2蛋白相對表達量。
1.4 RRM2基因過表達的SKOV3細胞對順鉑敏感性觀察 將實驗組與對照組細胞分別以3 μg/mL的順鉑處理48 h,按照Annexin V-FITC試劑盒進行操作:將收集的細胞用4 ℃預冷的PBS緩沖液洗2次,再重懸細胞轉移至1.5 mL的EP管內;用400目篩網過濾細胞,除去細胞碎片及成團細胞;1 000 r/min離心5 min,去上清;1×結合緩沖液重懸細胞,調整濃度為2×106個/mL;取300 μL的細胞懸液于流式管中;加入5 μL的Annexin V-FITC混勻后,避光,室溫孵育15 min;上機前5 min再加入5 μL的碘化丙錠溶液(PI)染色。上機前,補加200 μL的1×結合緩沖液,混勻后上流式細胞儀檢測分析。
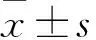
2 結果
重組質粒pLVX-IRES-RRM2經限制性內切酶XhoI和BamHI雙酶切驗證,各片段大小符合預期(圖1),測序結果顯示RRM2基因序列正確。RRM2基因開放閱讀框長1 170 bp,編碼389個氨基酸,其蛋白質分子量為44.8 kD。熒光顯微鏡觀察SKOV3細胞的慢病毒感染效率達到40%,可應用于后續研究。實驗組、對照組細胞中RRM2 mRNA相對表達量分別為0.280±0.055、0.102±0.022,RRM2蛋白相對表達量分別為0.582±0.049、0.228±0.032,兩組相比,P均<0.01。說明RRM2基因過表達的SKOV3細胞構建成功。見圖2。實驗組、對照組凋亡細胞比例分別為0.39%±0.08%、9.60%±1.20%,死亡細胞比例分別為26.65%±2.20%、44.96%±2.80%,實驗組凋亡細胞比例和死亡細胞比例均低于對照組(P均<0.01)。

注:M為Marker;1為pLVX-IRES-RRM2質粒的XhoⅠ單酶切產物;2為pLVX-IRES-RRM2質粒的XhoⅠ和BamHⅠ雙酶切產物;3為RRM2基因的PCR產物。
圖1RRM2病毒過表達質粒雙酶切驗證情況

注:A為RRM2蛋白檢測結果;B為RRM2 mRNA檢測結果;M為Marker;1為實驗組;2為對照組。
圖2實驗組和對照組細胞中RRM2蛋白、mRNA表達情況
3 討論
多年來,盡管惡性腫瘤相關研究取得了很大的進展,但卵巢癌患者的5年生存率仍保持在30%左右,對順鉑等化療藥物的耐受可能是卵巢癌患者死亡的重要因素。因此,闡明卵巢癌耐藥的分子機制,尋找耐藥相關基因對于卵巢癌的臨床治療具有重要意義。
RRM2基因編碼的蛋白質亞基是DNA合成和修復的限速單位,在RNR催化核糖核苷酸轉變為dNTP過程中必不可少,而dNTP是DNA復制和修復的原料。RRM2表達量則隨著細胞周期波動較大,調控了RNR的催化活性。正因為承載著這種至關重要的功能,RRM2在細胞增殖和DNA損傷的修復過程中具有舉足輕重的作用。
順鉑是腫瘤治療常用的一線化療藥物,其主要是通過結合到DNA的雙分子鏈上,抑制DNA復制、轉錄等功能,從而達到殺傷腫瘤細胞的效果。順鉑損傷DNA后,腫瘤細胞本身將啟動切除修復等機制,剪切掉順鉑結合的DNA區域,消除順鉑對細胞的殺傷作用,而切除后的DNA鏈則亟需dNTP原料進行修復,所以RRM2在順鉑所造成的DNA損傷修復過程中也是必需的。RRM2基因很可能在卵巢癌細胞對順鉑的耐藥過程中扮演著重要角色。
前期研究證實,RRM2在耐藥卵巢癌患者的組織和血液中均高表達[19,20],而RRM2表達與患者的5年生存率呈負相關,即RRM2表達量越高則患者可能因耐藥等因素導致的死亡發生越早[2]。為了深入研究RRM2在卵巢癌順鉑耐藥機制中的作用,我們構建了RRM2基因慢病毒過表達載體,感染卵巢癌細胞SKOV3,結果顯示,感染慢病毒后SKOV3細胞中RRM2蛋白表達上調,說明慢病毒載體的構建和病毒包埋都是成功的,這也為后續RRM2的功能研究奠定了基礎。
本研究結果還顯示,RRM2基因過表達的SKOV3細胞對順鉑的化療敏感性明顯降低。在同樣濃度的順鉑作用下,實驗組死亡細胞比例和凋亡細胞比例均低于對照組,說明RRM2過表達在卵巢癌細胞對順鉑的耐藥過程中發揮了重要作用。考慮到RRM2的主要功能是參與dNTP的合成,我們推測,RRM2基因過表達能夠提高卵巢癌細胞內dNTP水平,為順鉑所造成的DNA損傷的修復過程提供充足原料;DNA損傷修復以后,卵巢癌細胞的凋亡和死亡趨勢得到緩解,從而降低了順鉑對腫瘤細胞的殺傷作用。
總之,本研究成功構建了RRM2過表達的SKOV3細胞,并初步證實RRM2過表達能夠使卵巢癌細胞對順鉑的敏感性降低。上述研究結果為進一步闡明RRM2基因參與卵巢癌細胞耐藥的機制奠定了基礎。
[1] Grisham RN, Hyman DM, Iyer G. Targeted therapies for treatment of recurrent ovarian cancer[J]. Clin Adv Hematol Oncol, 2014,12(3):158-162.
[2] Aird KM, Li H, Xin F, et al. Identification of ribonucleotide reductase M2 as a potential target for pro-senescence therapy in epithelial ovarian cancer[J]. Cell Cycle, 2014,13(2):199-207.
[3] Barber EL, Doll KM, Gehrig PA. Hospital readmission after ovarian cancer surgery: Are we measuring surgical quality?[J]. Gynecol Oncol, 2017,146(2):368-372.
[4] Lago V, Domingo S, Matute L, et al. Ghost ileostomy in advanced ovarian cancer[J]. Gynecol Oncol, 2017,8258(17):31255-31256.
[5] 阮雯聰.卵巢癌多藥耐藥機制及其逆轉藥物的應用[J].山東醫藥,2012,52(19):95-96.
[6] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008[J]. CA: Cancer J Clin, 2008,58(2):71-96.
[7] Reardon JT, Vaisman A, Chaney SG, et al. Efficient nucleotide excision repair of cisplatin, oxaliplatin, and Bis-aceto-ammine-dichloro-cyclohexylamine-platinum(IV) (JM216) platinum intrastrand DNA diadducts[J]. Cancer Res, 1999,59(16):3968-3971.
[8] Hu J, Lieb JD, Sancar A, et al. Cisplatin DNA damage and repair maps of the human genome at single-nucleotide resolution[J]. Proc Natl Acad Sci U S A, 2016,113(41):11507-11512.
[9] Souglakos J, Boukovinas I, Taron M, et al. Ribonucleotide reductase subunits M1 and M2 mRNA expression levels and clinical outcome of lung adenocarcinoma patients treated with docetaxel/gemcitabine[J]. Br J Cancer, 2008,98(10):1710-1715.
[10] Ferrandina G, Mey V, Nannizzi S, et al. Expression of nucleoside transporters, deoxycitidine kinase, ribonucleotide reductase regulatory subunits, and gemcitabine catabolic enzymes in primary ovarian cancer[J]. Cancer Chemother Pharmacol, 2010,65(4):679-686.
[11] Nordlund P, Reichard P. Ribonucleotide reductases[J]. Annu Rev Biochem, 2006,75:681-706.
[12] Xia G, Wang H, Song Z, et al. Gambogic acid sensitizes gemcitabine efficacy in pancreatic cancer by reducing the expression of ribonucleotide reductase subunit-M2 (RRM2) [J]. J Exp Clin Canc Res, 2017,36(1):107.
[13] Specks J, Lecona E, Lopez-Contreras AJ, et al. A Single Conserved Residue Mediates Binding of the Ribonucleotide Reductase Catalytic Subunit RRM1 to RRM2 and Is Essential for Mouse Development[J]. Mol Cell Biol, 2015,35(17):2910-2917.
[14] Chabes A, Thelander L. Controlled protein degradation regulates ribonucleotide reductase activity in proliferating mammalian cells during the normal cell cycle and in response to DNA damage and replication blocks[J]. J Biol Chem, 2000,275(23):17747-17753.
[15] D′Angiolella V, Donato V, Forrester FM, et al. Cyclin F-mediated degradation of ribonucleotide reductase M2 controls genome integrity and DNA repair[J]. Cell, 2012,149(5):1023-1034.
[16] Engstrom Y, Eriksson S, Jildevik I, et al. Cell cycle-dependent expression of mammalian ribonucleotide reductase. Differential regulation of the two subunits[J]. J Biol Chem, 1985,260(16):9114-9116.
[17] Newman WC, Kim WJ, Amankulor NM. BRCA1-Regulated RRM2 Expression Protects Glioblastoma Cells from Endogenous Replication Stress and Promotes Tumorigenicity[J]. Neurosurgery, 2017,80(5):N34.
[18] Zhong Z, Cao Y, Yang S, et al. Overexpression of RRM2 in gastric cancer cell promotes their invasiveness via AKT/NF-kappaB signaling pathway[J]. Die Pharmazie, 2016,71(5):280-284.
[19] 張夢,王蕾,焦金文,等.siRNA介導RRM2沉默對卵巢癌細胞順鉑敏感性影響研究[J].中華腫瘤防治雜志,2014,21(4): 273-279.
[20] Wang LM, Lu FF, Zhang SY, et al. Overexpression of catalytic subunit M2 in patients with ovarian cancer[J]. Chinese Med J, 2012,125(12):2151-2156.
10.3969/j.issn.1002-266X.2017.39.008
R737.31
A
1002-266X(2017)39-0030-04
2017-06-19)

