開心散含藥血清對β-淀粉樣蛋白致SH-SY5Y細胞損傷的影響
張景泉,桑旭星,姜艷艷,楊依,方芳
(北京中醫藥大學中藥學院,北京 100029)
開心散含藥血清對β-淀粉樣蛋白致SH-SY5Y細胞損傷的影響
張景泉,桑旭星,姜艷艷,楊依,方芳*
(北京中醫藥大學中藥學院,北京 100029)
目的:研究開心散含藥血清對β-淀粉樣蛋白所致人神經母細胞瘤SH-SY5Y損傷的影響及其機制。方法:SD大鼠灌胃給予開心散(0.58 g/Kg,1.16 g/Kg,2.32 g/Kg),連續7天,每天2次,第8天末次給藥后1 h腹主動脈取血,制備開心散含藥血清,將不同濃度的開心散含藥血清加入SH-SY5Y細胞孵育2 h后,加入Aβ25-35(10 μmol/L),共同培養24 h。采用MTT法檢測細胞活力,流式細胞儀檢測細胞凋亡,活性氧表達及線粒體膜電位。結果:與正常對照組細胞比較,Aβ25-35(10 μmol/L)可以明顯降低SH-SY5Y細胞的細胞存活率,增加細胞凋亡率,升高細胞內活性氧的含量,降低線粒體膜電位;開心散含藥血清可以明顯抑制細胞凋亡,提高細胞存活率,降低活性氧表達及提高線粒體膜電位(P<0.01)。 結論:開心散含藥血清能減輕Aβ25-35所致的細胞損傷,可能與保護線粒體,減少細胞凋亡有關。
開心散;含藥血清;Aβ25-35;SH-SY5Y
阿爾茨海默病(Alzheimer’s disease,AD)是一種與年齡相關的神經退行性病變,且隨時間病情不斷惡化,60%~70%患者出現癡呆癥狀,最終機體功能喪失,直至死亡[1]。其發病原因尚不明確,主要的病理變化為神經元細胞外淀粉樣斑塊、神經元細胞內Τau蛋白高度磷酸化的神經纖維纏結以及神經細胞和突觸數量減少[2]。眾多的研究發現,腦內淀粉樣斑塊的的主要成分β-淀粉樣蛋白(Aβ)水平增高時,可引起突觸及神經元的損傷,神經元離子平衡改變、氧化損傷及細胞凋亡等一系列后果的產生[3],減少Aβ神經毒性是抗阿爾茨海默病治療藥物研究的一個方向。
中醫學認為,阿爾茨海默病的病因病機為“腎虛髓虧為本,痰瘀阻滯為標”,五臟失調,腦髓失用是AD的關鍵。由人參、遠志、石菖蒲和茯苓組成的傳統中藥復方開心散,源自孫思邈的《備急千金藥方》,具有養心安神益智之功效,主要用于心氣不足、神志不寧、健忘失眠等癥。臨床應用于神經衰弱、神經官能癥、抑郁癥、老年癡呆等確有療效。現代藥理研究表明,開心散具有抗抑郁[4]、抗氧化損傷[5]、延緩衰老[6]及改善多種認知障礙動物模型的學習記憶能力[7-9]等作用。本課題組前期研究已證實開心散具有改善AD模型小鼠的學習記憶能力,為進一步探討開心散改善AD的認知功能的作用,本研究采用中藥血清藥理學的原理,研究開心散含藥血清對Aβ25-35引起人神經母細胞瘤SH-SY5Y細胞損傷的作用及相關機制。
1 材料與方法
1.1 試驗藥物
開心散組成藥物人參、遠志、石菖蒲、茯苓均購自北京同仁堂藥店,并經北京中醫藥大學中藥鑒定與資源系張媛副教授鑒定為正品并符合《中國藥典》標準。按開心散處方比例(茯苓∶人參∶石菖蒲∶遠志=2∶1∶1∶1)將藥材混合,10倍量水浸泡1 h后煎煮1.5 h,過濾,濾渣繼續用10倍量水煎煮2次,每次1.5 h,過濾,合并濾液,濃縮成干粉。計算產率為19.92%,備用。
1.2 動物
SD大鼠,雄性,體質量200~230 g,清潔級,購自北京斯貝福生物技術有限公司,許可證號SCXK(京)2011-0004。
1.3 試劑
Aβ25-35(A4559)(美國Sigma公司,規格1 mg);磷酸鹽緩沖液(PBS)(21-040-CVR)、RPMI 1640培養基(10-040-CVR)和胎牛血清(430639)(Corning公司);含0.25%EDTA的胰酶(25200-072)(Gibco公司); MTT試劑(298-97-1)(拜爾迪公司);Annexin V-PI細胞凋亡試劑盒(CA1020)(索萊寶公司);活性氧試劑盒(S0033)和線粒體膜電位試劑盒(C2006)(碧云天公司)。
1.4 儀器
超凈工作臺(BJ-2CD,上海博迅實業有限公司);CO2恒溫培養箱(RCO-3000T-5V型,美國G.S.公司);酶標儀(ThermoLabsystems Multiskan Mk3,美國Thermo公司);離心機(LD5-2A,北京京立離心機有限公司);流式細胞儀(Canpo-2,美國BD公司)。
1.5 實驗方法
1.5.1 開心散含藥血清的制備
健康成年雄性SD大鼠,適應性飼養1周后,隨機分為4組,每組4只,空白對照組及開心散藥粉三個劑量組(0.58 g/kg,1.16 g/kg,2.32 g/kg),開心散組大鼠連續7天灌胃給予不同劑量的開心散,10 mL/kg,每天2次,空白對照組大鼠給予相應容積的蒸餾水。于第8日給藥后1 h經腹主動脈取血,全血靜置3 h,于離心機4℃,3 500 r/min 離心10 min,取上清血清,置于56℃水浴鍋滅活30 min,0.22 μm微孔濾膜過濾2次,-80℃保存備用。
1.5.2 SH-SY5Y細胞培養
SH-SY5Y細胞由中國醫學科學院藥物研究所張丹研究員惠贈,用含10%胎牛血清+1%青鏈霉素混合液的RPMI 1640完全培養基,于37℃,5% CO2細胞培養箱培養。細胞融合度至80%左右,按照1∶3進行傳代,去對數生長期的細胞進行實驗。
1.5.3 實驗分組與給藥
實驗時將細胞分成空白對照組、Aβ25-35模型組和開心散組。空白對照組、Aβ25-35模型組細胞換用含10%空白鼠血清的RPIM 1640培養基,開心散組換用含10%不同劑量開心散含藥血清的RPIM 1640培養基,培養2 h后,除空白對照組外,其余各組加入終濃度為10 μmol/L的Aβ25-35,培養24 h后進行相關指標測定。
1.5.4 細胞活力測定
SH-SY5Y細胞每孔接種1×104個細胞于96孔板,融合度至80%時,按上述分組給藥處理后,吸除96孔培養板中培養基,PBS洗滌2次,每孔加入配制好的MTT溶液(1 mg/mL)200 μL,于37℃ CO2細胞培養箱孵育4 h,孵育后吸除孔中液體,每孔加入150 μL DMSO,搖床上振搖10 min,待紫色結晶充分溶解,酶標儀于490 nm處測定器吸光度值。
1.5.5 細胞凋亡檢測
SH-SY5Y細胞每孔接種1×106個細胞于6孔板,融合度至80%時,按上述分組給藥處理后,參照Annexin V-PI細胞凋亡試劑盒說明書,吸除6孔培養板中培養基,BS洗滌2次,胰酶消化1 min,收集細胞至離心管,1 000 r/min離心5 min,用稀釋好的Binding Buffer溶液重懸細胞2次,棄上清后用100 μL Binding Buffer將每孔收集的細胞混懸至1.5 ml Eppendorf管中,避光加入Annexin-V試劑5 μL,輕輕混勻后加入PI試劑5 μL,每管補加Binding Buffer 200 μL,置于冰浴反應30 min,流式細胞儀檢測細胞凋亡。
1.5.6 活性氧檢測
SH-SY5Y細胞每孔接種1×106個細胞于6孔板,融合度至80%時,按上述分組給藥處理后,去除培養液,PBS洗滌2次,胰酶消化1 min,1 000 r/min離心5 min。棄置上清,重懸細胞后加入1 mL稀釋好的DCFH-DA,37℃細胞培養箱內孵育20 min。用無血清細胞培養液洗滌3次,收集細胞,流式細胞儀檢測熒光強度。
1.5.7 線粒體膜電位檢測
SH-SY5Y細胞每孔接種1×106個細胞于6孔板,融合度至80%時,按上述分組給藥處理后,吸除6孔板內培養基,PBS洗滌2次。胰酶消化1 min,收集細胞入離心管內,1 000 r/min離心5 min。棄上清,重懸細胞于0.5 ml細胞培養液,加入0.5 mL JC-1染色工作液,顛倒數次混勻。細胞培養箱中37℃孵育20 min。孵育結束后,1 000 r/min離心5 min,收集細胞。JC-1染色緩沖液(1×)洗滌2次,300 μL PBS重懸細胞,流式細胞儀檢測熒光強度。
1.5.8 統計學方法
數據以均值±標準差表示,采用SAS 9.3軟件進行統計分析,多組之間比較用單因素方差分析,兩組之間比較采用t檢驗。P<0.05為有顯著性差異。
2 結果
2.1 開心散含藥血清對Aβ25-35損傷SH-SY5Y細胞活力影響
與空白對照組比較,10 μmol/L Aβ25-35處理后的SH-SY5Y細胞活力明顯下降(68.3%),而給予不同劑量開心散含藥血清能顯著對抗Aβ25-35造成的細胞損傷(P<0.01),其中以中劑量效果最佳。結果見表1。

表1 開心散含藥血清對Aβ25-35致SH-SY5Y細胞活力的影響
注:與Aβ25-35模型組比較,**P<0.01。
2.2 開心散含藥血清對Aβ25-35致SH-SY5Y細胞凋亡的影響
經流式細胞儀檢測結果顯示,Q3區域表示正常細胞百分數,Q4區域為早期凋亡細胞百分數,Q2區域為晚期凋亡細胞百分數,將早期凋亡細胞百分數和晚期凋亡細胞百分數之和作為總凋亡率。與正常對照組比較,Aβ25-35處理后的細胞凋亡率達37%左右,而預先給予不同劑量的開心散含藥血2 h后,再給予Aβ25-35,可顯著抑制細胞凋亡(P<0.01),以中劑量效果最佳。結果見表2,圖1。
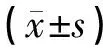
表2 開心散含藥血清對Aβ25-35致SH-SY5Y細胞凋亡的影響
注:與Aβ25-35模型組比較,**P<0.01。

圖1 開心散含藥血清對Aβ25-35致SH-SY5Y細胞凋亡的影響 注:與空白對照組比較,##P<0.01;與Aβ25-35模型組比較,**P<0.01。
2.3 開心散含藥血清對Aβ25-35致SH-SY5Y細胞內活性氧生成的影響
應用熒光探針DCFH-DA來檢測活性氧水平。細胞內活性氧可以氧化水解生成的DCFH產生有熒光的DCF。以染色的陰性細胞為基線,與正常染色細胞比較,經Aβ25-35損傷后的細胞活性氧生成明顯增加(P<0.01),而預先使用開心散含藥血清處理2 h后,可顯著降低Aβ25-35引起的活性氧的生成(P<0.01)。結果見表3,圖2。
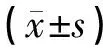
表3 開心散含藥血清對Aβ25-35致SH-SY5Y細胞活性氧生成的影響
注:與Aβ25-35模型組比較,**P<0.01。

圖2 開心散含藥血清對Aβ25-35致SH-SY5Y細胞活性氧生成的影響注:與空白對照組比較,##P<0.01;與Aβ25-35模型組比較,**P<0.01。
2.4 開心散含藥血清對Aβ25-35致SH-SY5Y細胞線粒體膜電位的影響
流式細胞儀對細胞線粒體膜電位進行檢測,線粒體膜電位的檢測應用JC-1探針,JC-1積累于線粒體內,當線粒體膜電位較低時,JC-1以單體形式存在而不可聚集于線粒體基質中。P2區域內細胞為正常細胞,即此區域內細胞線粒體膜電位處于正常水平,而啟動凋亡的細胞處于P2區域外,其線粒體膜電位較低。與正常對照組比較,10 μmol/L Aβ25-35可以明顯導致SH-SY5Y細胞線粒體膜電位降低(P<0.01);而開心散含藥血清處理2 h后給予Aβ25-35,10 μmol/L細胞線粒體膜電位顯著升高(P<0.01)。結果見表4,圖3。
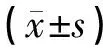
表4 開心散含藥血清對Aβ25-35致SH-SY5Y細胞線粒體膜電位的影響
注:與Aβ25-35模型組比較,**P<0.01。

圖3 開心散含藥血清對Aβ25-35致SH-SY5Y細胞線粒體膜電位的影響 注:與空白對照組比較,##P<0.01;與Aβ25-35模型組比較,**P<0.01。
3 討論
在中藥及中藥復方的體外藥理研究中,直接給藥法難以確定發揮藥效的主要成分,因離體反應系統難以模擬真實的體內環境,其次,多數中藥經復雜體內的過程,一些原藥可能會發生理化變化[10]。故本實驗采用血清藥理方法來模擬藥物體內過程。
APP經Aβ肽途徑切割形成Aβ1-40與Aβ1-42[11]。以Aβ1-42疏水性強,易聚集,且更具細胞毒性[12]。本實驗采用Aβ25-35片段,Aβ25-35片段為Aβ1-42有效片段,且具備細胞毒性[13]。Aβ假說一直是公認的阿爾茨海默癥病理學理論依據,即Aβ胞外聚集,可引起神經細胞突觸損傷,進而導致細胞凋亡的產生[14]。細胞凋亡是一種高度調節與控制的過程,當細胞受到到外界刺激或損傷時,啟動凋亡[15]。本實驗采用MTT法檢測細胞活力及Annexin V-PI雙染試劑盒對細胞凋亡進行檢測,Annexin V為鈣離子依賴性磷脂結合蛋白,可檢測到細胞凋亡過程中的磷脂酰絲氨酸并與之特異性結合,從而區分正常細胞與凋亡細胞。結果顯示,Aβ25-35可降低細胞存活率,引起細胞凋亡的發生,而當給予開心散含藥血清進行保護后,細胞存活率顯著提高,凋亡的細胞明顯減少。
在阿爾茨海默癥病因的研究中,有兩大因素一直被認為與阿爾茨海默癥存在直接聯系,即氧化應激與線粒體功能障礙[16]。當活性氧生成增加,細胞內環境失衡,傾向氧化,造成DNA鏈斷裂,破壞細胞信號傳導,直至細胞凋亡[17]。另一主要因素線粒體功能障礙的主要表現為線粒體膜電位的破壞,即受損傷細胞線粒體膜電位顯著降低,而Aβ的胞外聚集又與線粒體功能障礙有很大的關聯[18]。線粒體膜通透性轉運孔的開放可導致線粒體膜電位降低,而活性氧既可促使線粒體膜通透性轉運孔的開放,又是線粒體膜通透性轉運孔開放后的產物,由此可見,線粒體功能障礙與氧化應激也存在密切聯系。而在細胞凋亡過程中,線粒體又起到了關鍵的作用,例如釋放Caspase的激活因子細胞色素C,從而啟動凋亡[19]。本實驗通過流式細胞儀檢測線粒體膜電位變化及活性氧的表達。結果顯示,Aβ25-35可提高活性氧表達,降低細胞線粒體膜電位,而開心散含藥血清可通過提高線粒體膜電位及降低活性氧生成來對細胞進行保護,提示其保護途徑可通過線粒體途徑。綜上所述,開心散含藥血清可通過線粒體途徑,抑制細胞凋亡,從而減輕Aβ25-35誘導的細胞損傷,為開心散改善AD認知功能的研究提供了支持依據。
[1] Loef M,von Stillfried N,Walach H. Zinc diet and Alzhermer’s disease: a systematic review[J].Nutritional Neuroscience,2012,15(5):2-12.
[2] Querfurth HW,LaFerla FM. Alzheimer’s disease[J].The New England Journal of Medicine,2010,362(4):329-344.
[3] Mattson MP. Pathways towards and away Alzheimer’s disease[J].Nature,2004,430(7000):631-639.
[4] 溫智林,王真真,賀文彬,等.開心散及其有效成分抗抑郁作用的研究進展[J].中藥新藥與臨床藥理,2015,26(3):420-423.
[5] 曹寅,胡園,趙海霞,等.開心散對缺氧和力竭運動小鼠的抗氧化及抗疲勞作用研究[J].解放軍藥學學報,2011,27(4):307-313.
[6] 周高超,王華,王袆丹,等.開心散對D-半乳糖致衰老小鼠非酶糖基化和自由基的抑制作用研究[J].時珍國醫國藥,2008,19(6):1400-1401.
[7] 劉明,閆娟娟,周小江,等.開心散對慢性應激抑郁模型大鼠學習記憶的影響[J].中國中藥雜志,2012,37(16):2439-2443.
[8] 李炎,劉斌,劉學偉,等.開心顆粒改善Aβ 誘導大鼠認知障礙的機制研究[J].中醫藥信息,2016,33(2):34-36.
[9] 劉學偉,張博,汪娜,等.開心散血中移行成分的抗癡呆作用研究概況[J].中醫藥學報,2016,44(2):101-104.
[10] 李晶,戴雨霖,鄭飛,等.人參皂苷的口服吸收及體內轉化[J].中國生物制品學雜志,2014,27(12):1633-1636.
[11] Mucke L, Selkoe DJ. Neurotoxicity of amyloid beta-protein: synaptic and network dysfunction[J].Cold Spring Harbor Perpectinve in Medicine,2012,2(7):1-17.
[12] Vivekanandan S,Brender JR,Lee SY,et al.A partially folded structure of amyloid-beta (1-40) in an aqueous environment[J].Biochemical and Biophysical Research Communications,2011,411(2):312-316.
[13] 羅磊,杜艷軍,孫國杰. Aβ1-40、Aβ1-42與 Aβ25-35在阿爾茨海默病模型復制中的評價[J].中國老年學雜志,2014,34(5):2585-2587.
[14] Asadi F, Jamshidi AH, Khodagholi F, et al.Reversal effects of crocin on amyloid β-induced memory deficit: Modification of autophagy or apoptosis markers[J].Pharmacology Biochemistry and Behavior,2015,139(Pt A):47-58.
[15] Tiwari M,Prasad S,Tripathi A,et al.Apoptosis in mammalian oocytes: a review[J].Apoptosis,2015,20(8):1019-1025.
[16] Yan MH, Wang X, Zhu X. Mitochondrial defects and oxidative stress in Alzheimer disease and Parkinson disease[J]. Free Radical Biology and Medicine,2013,62:90-101.
[17] Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. International Journal of Biochemistry and Cell Biology,2007,39(1):44-84.
[18] Blanch M, Mosquera JL, Ansoleaga B, et al. Alter mitochondrial DNA methylation pattern in Alzheimer disease-related pathology and in Parkinson disease[J]. The American Journal of Pathology,2016,186(2):385-397.
[19] Deka SJ, Mamdi N, Manna D, et al. Alkyl cinnamates induce protein kinase C translocation and anticancer activity against breast cancer cells through induction of the mitochondrial pathway of apoptosis[J].Journal of Breast Cancer,2016,19(4):358-371.
ProtectiveEffectofKXS-medicatedSerumagainsttheInjuryofSH-SY5YCellInducedbyβ-amyloidProtein
ZHANG Jing-quan,SANG Xu-xing, JIANG Yan-yan, YANG Yi, FANG Fang*
(SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective: To investigate the protective effect of medicated serum of Kaixin san(KXS) on neuroblastoma SH-SY5Y induced by Aβ25-35and its possible mechanism. Methods: Healthy SD rats were orally given KXS twice a day for seven days, blood was taken from abdominal aorta and KXS-medicated serum was prepared 1h after KXS administration on 8th day. SH-SY5Y cells were cultured with Aβ25-35(10 μmol/L) for 24 h in the presence and absence of KXS-medicated serum. Cell viability was measured by MTT method. Cell apoptosis, ROS level and mitochondrial membrane potential were detected by flow cytometry. Results: Compared to the blank serum control group, Aβ25-35significantly inhibited cell viability, increased the cell apoptosis and ROS level, and decreased the mitochondrial membrane potential. The addition of KXS-medicated serum prior to the intervention of Aβ25-35could significantly enhance the cell survival rate, attenuate the production of ROS, reduce the cell apoptosis, and increase the mitochondrial membrane potential. Conclusion: Medicated serum of KXS has a protective effect against the Aβ25-35-induced injury in SH-SY5Y cells, which may be associated with the inhibition of apoptosis and the protection of mitochondria.
Kaixin san; Medicated serum; Aβ25-35; SH-SY5Y
R285.5
A
1002-2406(2017)06-0027-05
國家自然科學基金項目(No.81373995)
張景泉(1991-),男,北京中醫藥大學中藥藥理學專業碩士研究生。
方芳*(1972-),女,博士,副教授,主要研究方向:中藥防治神經退行性疾病。
2017-02-26
修回日期:2017-03-10

