外源性氧化脅迫對釀酒酵母突變株Y518合成谷胱甘肽的影響
鄭麗雪 - 齊 斌 孫 姜 王立梅 -
(1. 常熟理工學院生物與食品工程學院,江蘇 常熟 215500;2. 中海海洋無錫海洋工程裝備有限公司,江蘇 無錫 214000) (1. College of Biological and Food Engineering, Changshu Institute of Technology, Changshu, Jiangsu 215500, China; 2. Wuxi Ocean Engineering Equipment Co. Ltd. of Zhonghai Ocean, Wuxi, Jiangsu 214000, China)
外源性氧化脅迫對釀酒酵母突變株Y518合成谷胱甘肽的影響
鄭麗雪1ZHENGLi-xue1齊 斌1QIBin1孫 姜2SUNJiang2王立梅1WANGLi-mei1
(1. 常熟理工學院生物與食品工程學院,江蘇 常熟 215500;2. 中海海洋無錫海洋工程裝備有限公司,江蘇 無錫 214000) (1.CollegeofBiologicalandFoodEngineering,ChangshuInstituteofTechnology,Changshu,Jiangsu215500,China; 2.WuxiOceanEngineeringEquipmentCo.Ltd.ofZhonghaiOcean,Wuxi,Jiangsu214000,China)
利用外源過氧化氫對釀酒酵母突變株Y518進行氧化脅迫來研究外源性氧化脅迫對Y518合成谷胱甘肽的影響。結果表明:添加過氧化氫會抑制Y518細胞生長,但會促進其合成谷胱甘肽;當過氧化氫的添加時間為24 h,添加量為0.6 mmol/L時,Y518胞內谷胱甘肽含量達到(13.69±0.28) mg/g,比未添加過氧化氫時提高了約14%;在24 h時添加0.6 mmol/L 過氧化氫會對Y518產生外源性氧化脅迫,激活轉錄調節子YAP1和SKN7調控γ-谷氨酰半胱氨酸合成酶和谷胱甘肽合成酶編碼基因GSHI和GSHII的表達,提高γ-谷氨酰半胱氨酸合成酶和谷胱甘肽合成酶的活力,以促進Y518合成谷胱甘肽。因此,添加外源過氧化氫能夠使釀酒酵母突變株Y518產生外源性氧化脅迫,促進Y518進一步合成谷胱甘肽。
過氧化氫;釀酒酵母;氧化脅迫;谷胱甘肽
谷胱甘肽(glutathione,GSH)是由谷氨酸、半胱氨酸和甘氨酸3種氨基酸殘基組成的小分子化合物,自然界中的絕大多數動植物和微生物細胞均能夠合成GSH[1-3]。作為細胞內的一種天然抗氧化活性物質,GSH能夠直接與氧化性物質反應或者作為清除自由基的基質進而抵御由活性氧(reactive oxygen species,ROS)造成的氧化性損傷[4-6],因此GSH常作為天然抗氧化劑被添加到各類食品及其原料中。隨著食品安全意識的不斷提高,人們對食品中天然抗氧化劑的應用需求越來越強烈,因此國內外對于GSH的需求量日益增大,這其中存在的巨大商業價值推動了GSH的生產。
以釀酒酵母(Saccharomycescerevisiae)作為發酵菌株通過微生物發酵法生產GSH是目前常用的一種GSH生產方法,相比溶劑萃取法、化學合成法和酶轉化法具有安全、高效、無污染和操作簡便等優點[7-9]。然而,普通Saccharo-mycescerevisiae菌株的胞內GSH含量一般不足細胞干重的1%[10],因此通過各種物理、化學或者生物方法對Saccharomycescerevisiae進行處理從而提高其胞內GSH積累量已經成為研究的熱點[11-13]。
在前期的研究中,本實驗室通過亞硝基胍誘變篩選得到一株高產GSH的Saccharomycescerevisiae突變株Y518[14],并且通過轉錄組學研究發現內源性氧化脅迫能夠促進Y518合成GSH[15]。本研究欲在此基礎上,進一步通過添加外源過氧化氫對Y518進行氧化脅迫來研究外源性氧化脅迫對Y518合成GSH的影響,以期能夠為進一步提高Y518的谷胱甘肽發酵產量提供一定的理論依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
Saccharomycescerevisiae突變株Y518:本實驗室(蘇州食品生物技術重點實驗室)篩選保藏。
1.1.2 試劑
GSH檢測試劑盒、Cu/Zn超氧化物歧化酶(Cu/Zn-superoxide dismutase,Cu/Zn-SOD)檢測試劑盒、過氧化氫酶(catalase,CAT)檢測試劑盒、酵母細胞裂解液:上海碧云天生物技術有限公司;
γ-谷氨酰半胱氨酸合成酶(γ-glutamyl systeine synthetase,GSH I)檢測試劑盒、GSH合成酶(GSH II)檢測試劑盒:蘇州科銘生物技術有限公司;
總RNA提取試劑盒、DNA酶試劑盒:德國Qiagen公司;
cDNA合成試劑盒、熒光染料試劑盒、RNA制膠試劑盒:美國Bio-Rad公司;
過氧化氫(hydrogen peroxide,H2O2):分析純,生工生物工程(上海)股份有限公司。
1.1.3 培養基
Saccharomycescerevisiae培養基[16]:酵母膏5 g/L、葡萄糖20 g/L、磷酸二氫鉀6 g/L、硫酸鉀3 g/L、硫酸銨5 g/L、硫酸鎂1.5 g/L,pH 6.0。
1.2 儀器與設備
酶標儀:iMark型,美國Bio-Rad公司;
RCR儀:MyCycler型,美國Bio-Rad公司;
實時熒光定量PCR儀:CFX96 Touch型,美國Bio-Rad公司;
全自動電泳儀:Experion型,美國Bio-Rad公司;
高通量組織破碎儀:TissueLyser II型,德國Qiagen公司。
1.3 方法
1.3.1 酵母發酵培養 用接種環挑取活化好的突變株Y518單菌落,接種到Saccharomycescerevisiae培養基中,于30 ℃、180 r/min搖床培養18 h,得到種子液;再將種子液以10%(體積分數)的接種量接種到Saccharomycescerevisiae培養基中,于相同條件下發酵培養64 h。
1.3.2 GSH含量和細胞干重的測定 取發酵液于4 ℃、12 000 r/min離心5 min,收集菌體細胞并用0.85%生理鹽水洗滌2次后按照GSH檢測試劑盒說明書的要求利用酶標儀測定GSH含量,測定結果以mg/g(以細胞干重計)表示;細胞干重于105 ℃條件下烘干測定。
1.3.3 Cu/Zn-SOD、CAT、GSH I和GSH II活力的測定
Cu/Zn-SOD、CAT、GSH I和GSH II的活力分別按照對應檢測試劑盒說明書的要求在酶標儀上進行測定,測定結果以U/mg(以細胞干重計)表示。
1.3.4 酵母總RNA的提取、純化和完整性檢測 取發酵液于4 ℃、12 000 r/min離心5 min,棄去上清液,收集菌體細胞并用冷的焦碳酸二乙酯(diethy pyrocarbonate,DEPC)水洗滌2次后用液氮猝滅2 min;加入600 μL酵母細胞裂解液和適量直徑0.45~0.55 mm的玻璃珠,用高通量組織破碎儀于30 Hz震蕩破碎處理5 min;將裂解產物轉移至新的離心管中,于4 ℃、12 000 r/min離心5 min后按照總RNA提取試劑盒和DNA酶試劑盒說明書的要求提取和純化總RNA;根據RNA制膠試劑盒說明書的操作說明將總RNA樣品注入RNA檢測芯片內,利用全自動電泳儀對RNA的完整性進行檢測。
1.3.5 cDNA的合成和基因相對表達量的檢測 按照cDNA 合成試劑盒說明書的要求利用PCR儀將RNA反轉錄為cDNA,反轉錄反應程序為:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,保持4 ℃待用;按照熒光染料試劑盒說明書的要求利用實時熒光定量PCR儀測定基因的相對表達量,擴增效率采用cDNA梯度稀釋法計算,相對表達倍數按照2-△△Ct法計算,參照基因為β-Actin,反應程序為:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40個循環。
2 結果與分析
2.1 H2O2添加時間對GSH發酵產量的影響
分別在發酵8,16,24,32 h時添加0.4 mmol/L H2O2,并測定發酵周期64 h內Y518的生長曲線和胞內GSH含量,結果見圖1。未添加H2O2時,Y518 在前16 h快速生長,16~48 h緩慢生長,48 h后逐漸下降;而在不同發酵時間添加H2O2后Y518的細胞干重均呈現出下降的趨勢[圖1(a)],表明添加H2O2會抑制Y518的生長,與陳珊等[17]的研究結果一致,可能是H2O2作為強氧化劑會對酵母細胞產生一定的毒害作用。未添加H2O2時,Y518的胞內GSH含量隨著發酵時間的延長逐漸增加,在48 h達到最高[(12.02±0.12) mg/g],隨后開始下降;而在不同發酵時間添加H2O2后,Y518的胞內GSH含量均呈現出先快速增加后緩慢降低的趨勢[圖1(b)],相比之下在24 h添加H2O2后Y518的胞內GSH含量在40 h達到最高[(12.98±0. 24) mg/g],表明在24 h添加H2O2較為合適。
2.2 H2O2添加量對GSH發酵產量的影響
在發酵24 h時分別添加0.2,0.4,0.6,0.8 mmol/L H2O2,并測定發酵周期64 h內Y518的生長曲線和胞內GSH含量,結果見圖2。添加不同濃度H2O2后Y518的細胞干重均呈現出下降的趨勢,添加0.8 mmol/L H2O2后Y518的細胞干重下降最顯著,細胞生長抑制最嚴重[圖2(a)];而隨著H2O2濃度的增大,Y518的胞內GSH含量先呈現出逐漸增加的趨勢,在添加0.6 mmol/L時達到最高[(13.69±0.28) mg/g],繼續增大到0.8 mmol/L后GSH含量反而有所降低[圖2(b)],可能是過大的H2O2濃度對酵母細胞的生長抑制較嚴重[圖2(a)],減弱了胞內GSH的合成,表明在24 h添加0.6 mmol/L H2O2較為合適。
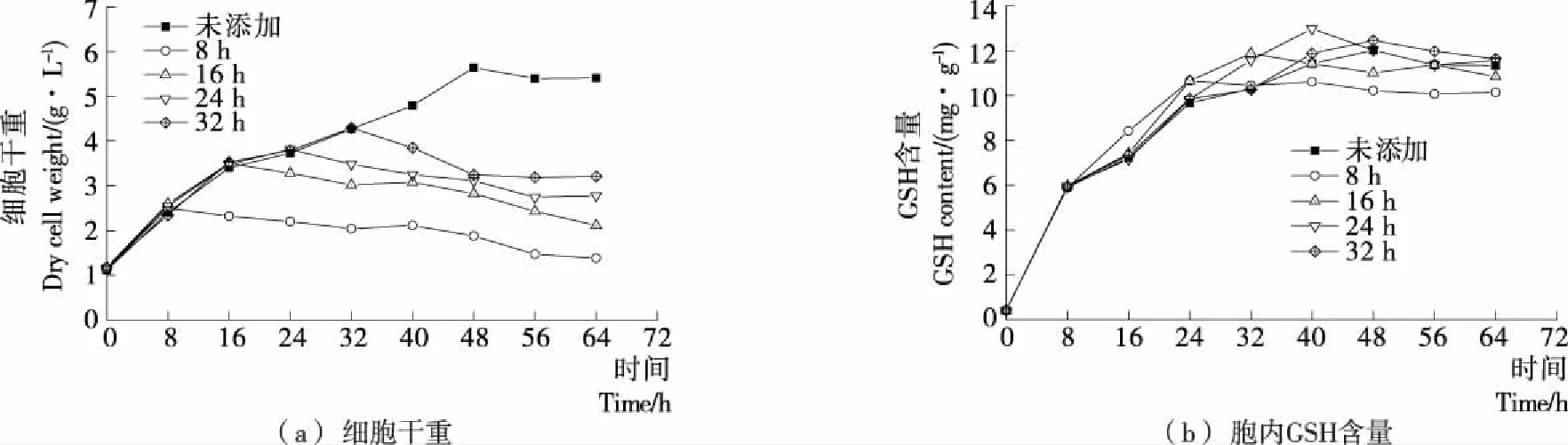
圖1 Y518在不同H2O2添加時間下的細胞干量和胞內GSH含量Figure 1 Dry cell weight and intracellular GSH content of Y518 under different addition time of H2O2
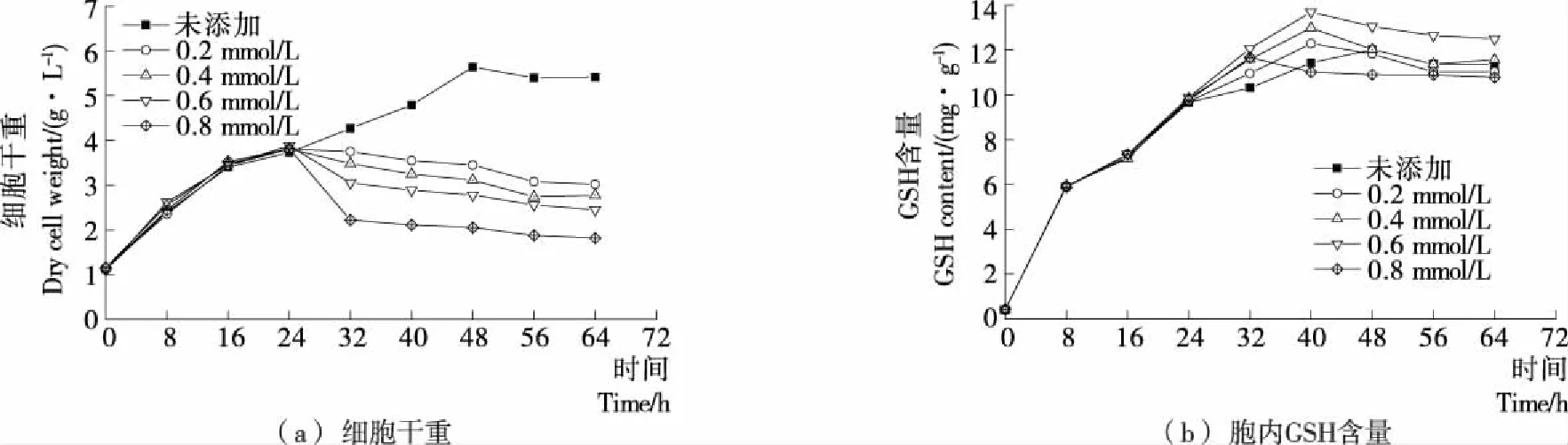
圖2 Y518在不同H2O2添加量下的細胞干量和胞內GSH含量Figure 2 Dry cell weight and intracellular GSH content of Y518 under differentaddition amount of H2O2
2.3 抗氧化酶系的活力
Cu/Zn-SOD和CAT是抗氧化酶系中的2種重要的活性酶,能夠在細胞遭受氧化脅迫時清除胞內過多的ROS,維持細胞氧化還原環境的平衡[18-19]。由圖3可知,隨著發酵時間的延長,未添加H2O2時Y518的Cu/Zn-SOD和CAT的活力變化趨勢一致,均呈現出先增加后降低的趨勢;而在24 h添加0.6 mmol/L H2O2后Cu/Zn-SOD和CAT的活力顯著高于未添加H2O2的,表明添加H2O2對Y518的細胞產生了氧化脅迫,使Cu/Zn-SOD和CAT活力提高。
2.4 GSH合成酶系的活力
酵母細胞內GSH的合成反應是由GSH合成酶系分步催化完成的,首先谷氨酸和半胱氨酸在限速酶GSH I的催化下反應生成γ-谷氨酰半胱氨酸,進一步在GSH II的催化下γ-谷氨酰半胱氨酸和甘氨酸反應生成GSH[20-21]。由圖4可知,隨著發酵時間的延長,未添加H2O2時Y518的GSH I和GSH II的活力變化趨勢一致,均呈現出逐漸降低的趨勢;而在24 h添加0.6 mmol/L H2O2后GSH I和GSH II的活力顯著高于未添加H2O2時的,表明添加H2O2對Y518細胞產生氧化脅迫使GSH I和GSH II活力提高,促進了GSH的合成。
2.5 總RNA的質量
對提取的總RNA完整性進行鑒定,結果見圖5。電泳圖上呈現的3條帶分別為28S、18S和5S,條帶清晰可見沒有彌散,表明提取的總RNA完整性好,沒有降解,符合后續基因相對表達量檢測的質量要求。
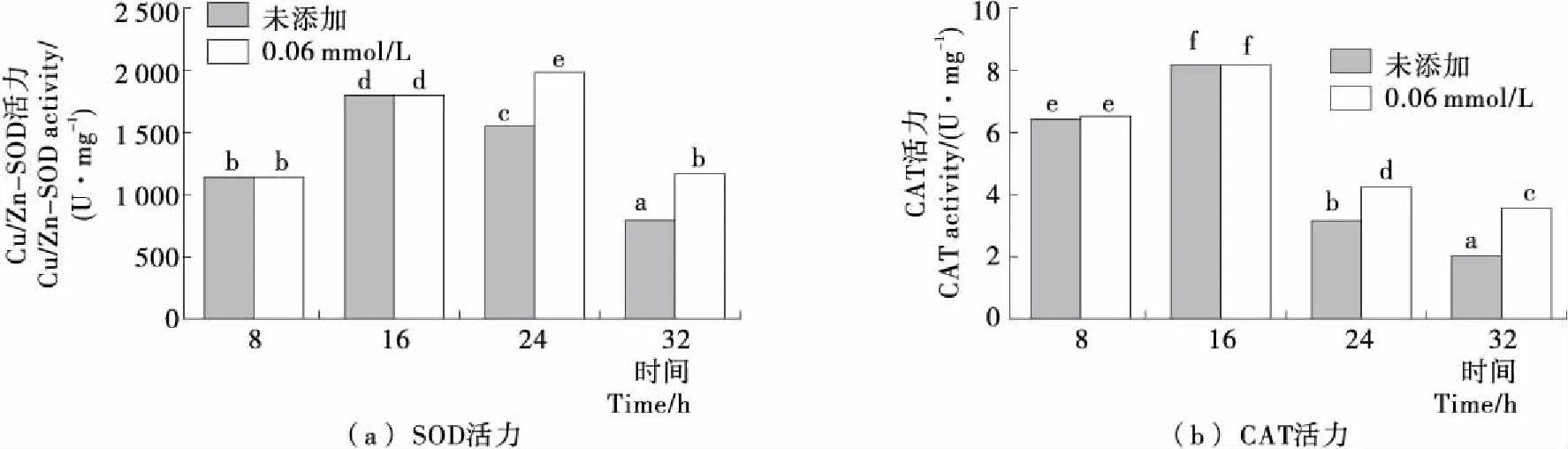
不同小寫字母表示差異顯著(P<0.05)圖3 Y518未添加和添加0.6 mmol/L H2O2的Cu/Zn-SOD和CAT活力Figure 3 Cu/Zn-SOD activity and CAT activity of Y518 added without and with 0.6 mmol/L H2O2
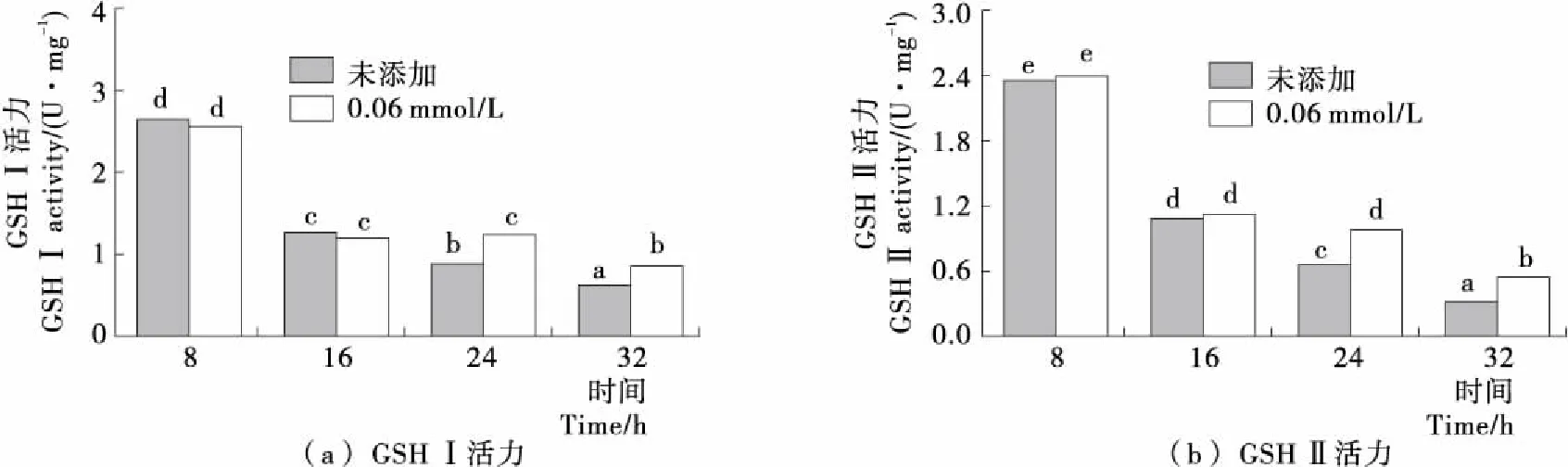
不同小寫字母表示差異顯著(P<0.05)圖4 Y518未添加和添加0.6 mmol/L H2O2的GSH I和GSH II活力Figure 4 GSH I activity and GSH II activity of Y518 added without and with 0.6 mmol/L H2O2
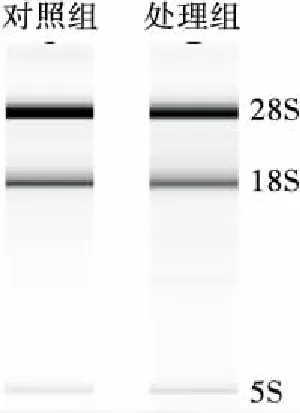
圖5 Y518未添加和添加0.6 mmol/L H2O2的 總RNA電泳圖
Figure 5 RNA electrophoretogram of Y518 added without and with 0.6 mmol/L H2O2
2.6 GSH合成酶系基因和轉錄調節子基因的相對表達量
基因GSHI和GSHII分別編碼GSH I和GSH II,其表達受到轉錄調節子YAP1和SKN7的聯合調控[22],在存在氧化脅迫的情況下,酵母細胞會激活YAP1和SKN7的表達上調GSHI和GSHII的表達量,進而增強GSH的合成[23],發酵32 h時Y518的GSHI、GSHII、YAP1和SKN7的相對表達量測定結果見表1。在24 h添加0.6 mmol/L H2O2后Y518的GSHI、GSHII、YAP1和SKN7的相對表達量均顯著上調(上調倍數≥2),結果表明,添加H2O2產生氧化脅迫后激活了轉錄調節子YAP1和SKN7調控GSHI和GSHII的表達,促進了Y518合成GSH。
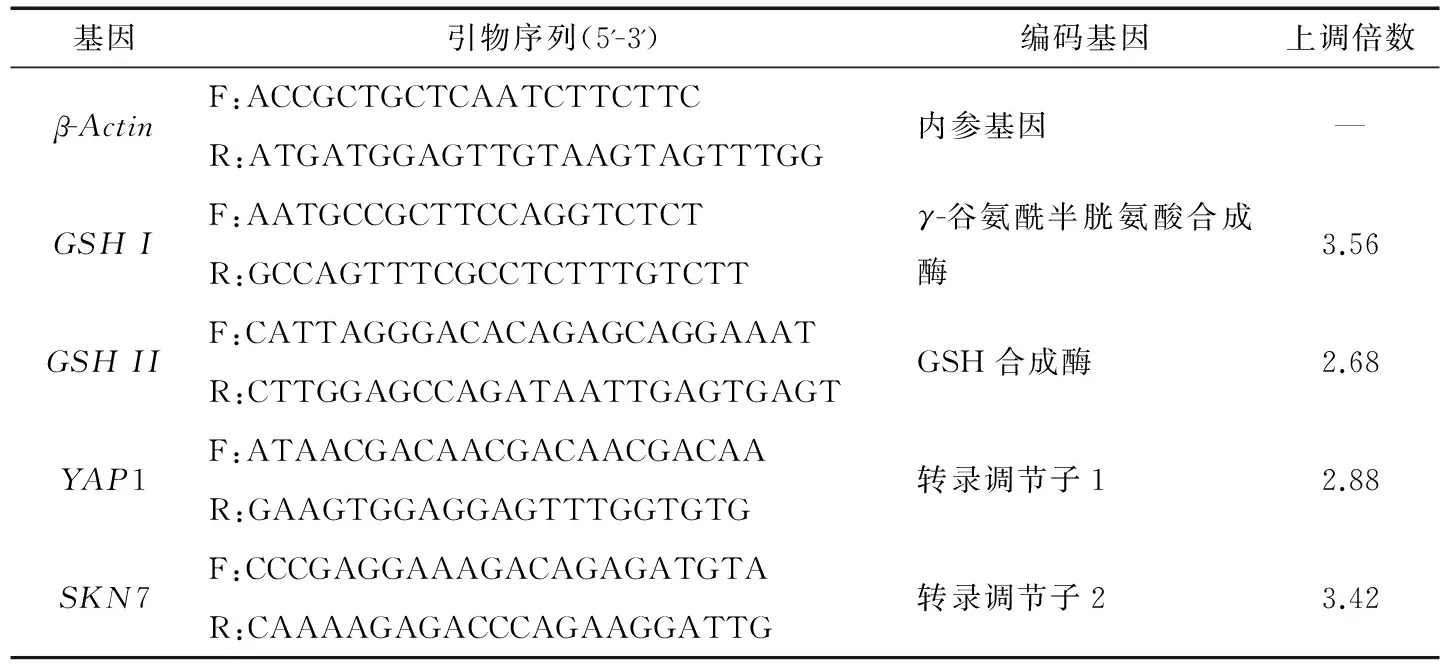
表1 Y518參與GSH合成的差異表達基因Table 1 Up or down-regulated gene expression of antioxidant activity in Y518 relative to 2-10515
3 結論
以亞硝基胍誘變篩選出的一株高產GSH的Saccharomycescerevisiae突變株Y518為研究對象,通過添加外源H2O2研究了外源性氧化脅迫對Y518合成GSH的影響。研究表明添加H2O2會抑制Y518的生長,但會促進其合成GSH;H2O2的最佳添加時間為24 h,最佳添加量為0.6 mmol/L,最佳條件下Y518胞內GSH含量達(13.69±0.28) mg/g,比未添加H2O2時提高了約14%;在24 h添加0.6 mmol/L H2O2會對Y518產生外源性氧化脅迫,激活轉錄調節子YAP1和SKN7,調控GSHI和GSHII的表達,進而提高GSH I和GSH II的活力,促進Y518進一步合成GSH。
[1] 陳志穎, 張子健, 焦瑞杰, 等. 利用啤酒廢酵母擴培物制備富含谷胱甘肽酵母抽提物[J]. 中國釀造, 2015, 34(11): 61-65.
[2] 姚晨陽, 劉敬, 張啟美, 等. 谷胱甘肽在水產養殖中的應用研究進展[J]. 山東科學, 2016, 29(1): 105-109.
[3] 鄭麗雪, 謝群凡, 王立梅, 等. 不同pH值釀酒酵母分批發酵生產谷胱甘肽數學模型建立[J]. 食品科學, 2013, 34(13): 162-164.
[4] SAFONOVA O A, POPOVA T N, KRYL’SKII E D, et al. Synthesis and estimation of the influence of 2,4-Dimethoxyphenylbiguanide on the glutathione antioxidant system activity in heart and blood serum of rats with experimental rheumatoid arthritis[J]. Pharmaceutical Chemistry Journal, 2016, 49(11): 749-752.
[5] KEI H, SATOSHI F, PAWEL B, et al. Glutathione and tryptophan metabolism are required forArabidopsisimmunity during the hypersensitive response to hemibiotrophs[J]. Proceedings of the National Academy of Sciences, 2013, 110(23): 9 585-9 594.
[6] CAROLE M, CHARLOTTE J, JEAN-FRAN?OIS M, et al. The utilization of sulfur amino acid in the mercapturate pathway to detoxify maximal therapeutic dose of acetaminophen is associated with glutathione and protein homeosteny in adult rats[J]. Faseb Journal, 2013, 27(7): 295-310.
[7] 劉千, 陳黎, 胡用軍, 等. 麥胚谷胱甘肽提取與含量測定方法研究[J]. 中國糧油學報, 2012, 27(10): 104-108.
[8] 李鑫. HPLC法檢測酶法合成中還原型/氧化型谷胱甘肽[J]. 廣東化工, 2014, 41(5): 158-159.
[9] 孫姜, 朱益波, 王立梅, 等. 原生質體誘變選育高產GSH菌株及基因表達分析[J]. 食品科學, 2013, 34(23): 176-179.
[10] PENNINCKX M J, JASPERS C J, LEGRAIN M J. The glutathione-dependent glyoxalase pathway in the yeastSaccharo-mycescerevisiae[J]. Journal of Biological Chemistry, 1983, 258(10): 6 030-6 036.
[11] 胡林華, 譚天偉. 高產谷胱甘肽酵母菌株的選育和培養條件的初探[J]. 高校化學工程學報, 2005, 19(2): 273-276.
[12] 鄭麗雪, 劉夢瀅, 王立梅, 等. 不同發酵時期添加金屬離子對釀酒酵母合成谷胱甘肽的影響[J]. 食品研究與開發, 2014, 35(6): 93-95.
[13] 邵娜, 衛功元, 葛曉光, 等. 紫外線γ-射線復合誘變篩選S-腺苷甲硫氨酸和谷胱甘肽聯產發酵菌株[J]. 輻射研究與輻射工藝學報, 2010, 28(2): 107-113.
[14] 王雅楠, 梅艷珍, 鄭麗雪, 等. 高產GSH酵母突變株Y518谷胱甘肽合成酶結構分析[J]. 食品科學, 2009, 30(17): 258-261.
[15] 王立梅, 任清華, 鄭麗雪, 等. 內源性氧化脅迫促進釀酒酵母合成谷胱甘肽的潛在機制分析[J]. 食品科學, 2017, 38(4): 26-31.
[16] GARRIDO E O, GRANT C M. Role of thioredoxins in the response ofSaccharomycescerevisiaeto oxidative stress induced by hydroperoxides[J]. Molecular Microbiology, 2002, 43(4): 993-1 003.
[17] 陳珊, 賀小賢, 潘亞磊. 過氧化氫和混合氨基酸對釀酒酵母發酵谷胱甘肽影響的研究[J]. 食品工業科技, 2008(11): 142-144.
[18] NEDEVA T S, PETROVA V Y, ZAMFIROVA D R, et al. Cu/Zn superoxide dismutase in yeast mitochondria-a general phenome-non[J]. FEMS Microbiology Letters, 2004, 230(1): 19-25.
[19] TANAKA T, IZAWA S, INOUE Y. GPX2, encoding a phospholipid hydroperoxide glutathione peroxidase homologue, codes for an atypical 2-Cys peroxiredoxin inSaccharomycescerevisiae[J]. Journal of Biological Chemistry, 2005, 280(51): 42 078-42 087.
[20] BLAIR I A. Analysis of endogenous glutathione-adducts and their metabolites[J]. Biomedical Chromatography, 2010, 24(1): 29-38.
[21] GRANT C M, MACIVER F H, DAWES I W. Glutathione is an essential metabolite required for resistance to oxidative stress in the yeastSaccharomycescerevisiae[J]. Current Genetics, 1996, 29(6): 511-515.
[22] LEE J, GODON C, LAGNIEL G, et al. Yap1 and Skn7 control two specialized oxidative stress response regulons in yeast[J]. Journal of Biological Chemistry, 1999, 274(23): 16 040-16 046.
[23] BROMBACHER K, FISCHER B B, RüFENACHT K, et al. The role of Yap1p and Skn7p-mediated oxidative stress response in the defence ofSaccharomycescerevisiaeagainst singlet oxygen[J]. Yeast, 2006, 23(10): 741-750.
EffectsofexogenousoxidationstressonglutathionesynthesisinSaccharomycescerevisiaemutantY518
Effects of exogenous oxidative stress on glutathione production bySaccharomycescerevisiaemutant Y518 were researched by addition of exogenous hydrogen peroxide. The results showed that the addition of hydrogen peroxide inhibited the growth of Y518 cells, but promoted the synthesis of glutathione of Y518. The best addition time and amount of hydrogen peroxide were respectively 24 h and 0.6 mmol/L. The content of gluconate reached (13.69±0.28) mg/g, increased by about 14% compared to that without hydrogen peroxide. Exogenous oxidation stress on Y518 was produced by adding 0.6 mmol/L hydrogen peroxide at 24 h, which activated the transcription regulation factorYAP1 andSKN7 to control expressions ofγ-glutamylcysteine synthetase, then that of glutathione synthetase encoded genesGSHIandGSHII, and finally enhanced the activities ofγ-glutamylcysteine and glutathione synthetases to promote glutathione synthesis in Y518. Therefore, the addition of exogenous hydrogen peroxide could produce exogenous oxidation stress on Y518 and further promote Y518 to synthesize glutathione.
hydrogen peroxide;Saccharomycescerevisiae; oxidation stress; glutathione
鄭麗雪,女,常熟理工學院高級實驗師,碩士。
齊斌(1965—),男,常熟理工學院研究員,博士。
E-mail:qibin65@126.com
2017—05—12
10.13652/j.issn.1003-5788.2017.09.004

