玫瑰發酵液的抗氧化及美白功效探究
趙 丹 曹玉峰 - 丁文玉 -,2 王昌濤,2 -,2 史豆豆 - 虞 旦 張佳嬋 - 李 萌
(1. 北京工商大學植物資源研究與開發重點實驗室,北京 100083;2. 北京食品營養與人類健康高精尖創新中心,北京 100083) (1. Beijing Key Laboratory of Plant Resources Research and Development, Beijing Technologyand Business University, Beijing 100083, China; 2. Beijing Advanced Innovation Centre for FoodNutrition and Human Health, Beijing 100083, China)
玫瑰發酵液的抗氧化及美白功效探究
趙 丹1ZHAODan1曹玉峰1CAOYu-feng1丁文玉1DINGWen-yu1,2王昌濤1,2WANGChang-tao1,2史豆豆1SHIDou-dou1虞 旦1YUDan1張佳嬋1ZHANGJia-chan1李 萌1LIMeng1
(1. 北京工商大學植物資源研究與開發重點實驗室,北京 100083;2. 北京食品營養與人類健康高精尖創新中心,北京 100083) (1.BeijingKeyLaboratoryofPlantResourcesResearchandDevelopment,BeijingTechnologyandBusinessUniversity,Beijing100083,China; 2.BeijingAdvancedInnovationCentreforFoodNutritionandHumanHealth,Beijing100083,China)
通過對玫瑰發酵液的抗氧化和美白功效及皮膚安全性進行評價,探究美白機理。利用釀酒酵母發酵玫瑰獲得玫瑰發酵液,檢測其對自由基的清除作用以及對酪氨酸酶活性與黑色素合成的影響,利用基因芯片檢測其美白機理,采用人體斑貼試驗評估其皮膚安全性。結果表明,玫瑰發酵液具有較強的清除DPPH自由基能力,對細胞外酪氨酸酶活性的抑制作用與濃度呈正比,對B16細胞內酪氨酸酶活性以及黑色素合成都有一定的抑制作用;玫瑰發酵液能夠抑制黑色素瘤通路上游的NGF和FGF2基因表達;人體斑貼試驗顯示玫瑰發酵液未引起陽性刺激反應。玫瑰發酵液具有較高的皮膚安全性,同時具有抗氧化、抑制酪氨酸酶活性與黑色素生成的功效,其通過抑制NGF和FGF2的表達發揮美白作用。
玫瑰;發酵;美白;抗氧化
蔬菜、谷物等經過發酵處理產生各種香味物質,原料本身的風味得到改善。此外,微生物代謝產生果膠酶、纖維素酶等胞外酶,可以促使植物細胞破裂,釋放有效成分,還能去除多種大分子的雜質,并將大分子物質有效降解為小分子物質,更易于人體吸收,從而增強藥效[1]。基于以上優勢,以及發酵產品價廉物美,質量穩定的特點,現已廣泛用于人們的食品和日用品中,如發酵獲得酸奶、酒、醋等食品,酵母發酵產品、乳酸菌發酵產品用于保濕、抗老化類的日用品[2-4]。
玫瑰是集藥用、食用、美化和綠化為一體的木本植物[5]。成熟的玫瑰中含有大量的維生素、氨基酸、可溶性糖及生物堿[6]。當前,人們對玫瑰進行發酵主要獲取玫瑰酒[7]、玫瑰醋[8]、玫瑰飲料[9]等。近年隨著酵素的興起,越來越多的人制作、食用玫瑰酵素,普遍認為其具有消除疲勞,增強體質,美容養顏的功效[10]。但玫瑰發酵后的抗氧化及美白功效方仍缺少科學性、理論性的報道。本試驗利用釀酒酵母對玫瑰進行發酵處理,并從抗氧化和美白功效上對其進行評價,以期挖掘發酵玫瑰在抗氧化及美白相關食品方面的應用價值。
1 材料與方法
1.1 材料和儀器
1.1.1 材料與試劑
酵母:釀酒酵母,食品釀造研究所;
玫瑰:大馬士革玫瑰,上海儀玳化妝品有限公司;
DPPH:分析純,西格瑪奧德里奇(上海)貿易有限公司;
鹽酸、過氧化氫:分析純,北京化工廠;
硫酸亞鐵、鄰苯三酚、L-酪氨酸、水楊酸:分析純,國藥集團化學試劑有限公司;
熊果苷:分析純,上海阿拉丁科技股份有限公司;
酪氨酸酶:25 kU,西格瑪奧德里奇(上海)貿易有限公司;
小鼠黑色素瘤細胞(B16)、人角質細胞、人成纖維細胞:中國醫學科學院基礎醫學研究所細胞資源中心;
DMEM低糖(干粉):D523 10×1L,西格瑪奧德里奇(上海)貿易有限公司;
二甲基亞砜(DMSO):99.7%,北京百靈威科技有限公司;
FBS:1×(無需稀釋可直接使用),美國康寧公司;
青霉素-鏈霉素:100× (稀釋100倍后使用),美國康寧公司。
1.1.2 主要設備儀器
紫外可見分光光度計:T6新世紀型,北京譜析通用儀器有限責任公司;
振蕩培養箱:HZQ-X100型,太倉市實驗設備廠;
CO2培養箱:WJ-80A-Ⅱ型,上海圣科儀器設備有限公司;
離心機:HC-2518型,北京東南儀誠實驗室設備有限公司;
酶標儀:Tecan Sunrise型,帝肯(上海)貿易有限公司;
微型離心機:5810R型,德國Eppendorf公司;
超凈工作臺:SV-CJ-1FD型,上海蘇凈實業有限公司。
1.2 試驗方法
1.2.1 玫瑰發酵液的制備 取10 g玫瑰干粉與300 mL去離子水于500 mL錐形瓶中混合,并于121 ℃滅菌30 min。吸取20 mL濃度為106~108CFU/mL的釀酒酵母菌菌液在無菌操作臺接種到玫瑰干粉與水的混合液中,于35 ℃搖床中震蕩培養30 h,獲得玫瑰發酵產物;產物于121 ℃滅菌30 min后,于5 000 r/min離心25 min,收集上清液,即為玫瑰發酵液。
1.2.2 成分測定
(1) 總糖:按GB/T 5009.8—2008執行。
(2) 總酚:按GB/T 8313—2008執行。
(3) 蛋白質:按GB 5009.5—2010執行。
(4) 總黃酮:按GB/T 5009.124—2003執行。
1.2.3 玫瑰發酵液的抗氧化能力測定
(1) DPPH 自由基清除試驗:取3 mL不同濃度的玫瑰發酵液與2×10-4mol/L的DPPH溶液混勻(A1);取等體積的去離子水與2×10-4mol/L的DPPH溶液混勻(A2);取等體積的無水乙醇與待測液混勻(A3);反應30 min后,在517 nm下測吸光度值。按式(1)計算DPPH自由基清除率。

(1)
式中:
EDPPH·——DPPH自由基清除率,%;
A1——樣品與DPPH混合液的吸光度;
A2——去離子水與DPPH混合液的吸光度;
A3——無水乙醇與DPPH混合液吸光度。
(2) 羥自由基清除試驗:取3 mL濃度為2 mmol/L的FeSO4與3 mL濃度為1 mmol/L的H2O2混勻;加入3 mL濃度為6 mmol/L的水楊酸,搖勻后放入37 ℃水浴中加熱15 min后取出;分別加入1 mL不同濃度的樣品;以1 mL去離子水作為對照。混勻后水浴加熱15 min,取出測其吸光度A樣,對照管(去離子水)為A對照。樣品用量不變,反應體系替換為去離子水,方法同上,測得樣品本底光密度A本。按式(2) 計算羥自由基清除率。

(2)
式中:
E——自由基清除率,%;
A樣品——樣品與反應液的吸光度;
A對照——以水代替樣品與反應液的吸光度;
A本底——與反應體系相同濃度下樣品的本底吸光度。
(3) 超氧陰離子清除試驗:取2.25 mL 0.05 mol/L 的Tris-HCl緩沖液(pH 8.2)于試管中,在25 ℃水浴中預熱20 min,加入0.5 mL不同濃度的玫瑰發酵液和0.2 mL 25 mmol/L的鄰苯三酚溶液并混勻,25 ℃水浴中反應5 min后加入0.5 mL 8 mol/L 鹽酸終止反應。以Tris-HCl緩沖液作參比,空白對照組以0.5 mL試樣溶劑代替樣品,以上處理均做3個重復,在299 nm處測吸光度(A樣品和A對照)。取不同濃度待測樣品0.5 mL,以去離子水代替反應體系于299 nm測定吸光度(A本底)。按式(2)計算超氧陰離子清除率。
1.2.4 玫瑰發酵液的美白能力測試
(1) 體外酪氨酸酶活性的測定:采用酪氨酸酶多巴速率氧化法。各反應體系的物質加入量及順序見表1。在加入酪氨酸酶后,將反應體系置于37 ℃水浴中保溫10 min,再加入0.98 g/L的L-多巴溶液,混勻,反應3 min后于475 nm處測定吸光值。其中,磷酸鹽緩沖液為pH=6.8,25 mmol/L。

(3)
式中:
A——對照組于有酪氨酸酶體系反應3 min時的吸光度值;

表1 反應液組成Table 1 Composition of reaction solution mL
B——對照組于無酪氨酸酶體系反應3 min時的吸光度值;
C——樣品組于有酪氨酸酶體系反應3 min時的吸光度值;
D——樣品組于無酪氨酸酶體系反應3 min時的吸光度值;
I——酪氨酸酶活性抑制率,%。
(2) 胞內酪氨酸酶活性抑制試驗:將對數生長期間的B16細胞,接種于6孔細胞培養板,于37 ℃,5% CO2培養箱中培養過夜。加入終濃度為0.1%,1.0%,10.0%的樣品,樣品用DMEM稀釋。未加樣品組做為細胞對照組,每組3個復孔。培養48 h后,棄上清液,PBS洗滌1次,每孔加入100 μL細胞裂解液,用刮刀刮取收集細胞,收集后取上清離心。取上清液50 μL至96孔板,加入1%左旋多巴50 μL,置于CO2培養箱中孵育1 h。測量475 nm處吸光度值。按式(4)計算細胞反應體系下酪氨酸酶的相對活性。

(4)
式中:
A細胞——細胞反應體系下酪氨酸酶相對活性,%;
OD樣品——含有待測樣反應體系的吸光度;
OD空白對照——不含任何物質的空板吸光度;
OD細胞對照——不含待測樣反應體系的吸光度。
(3) 黑色素合成抑制試驗:將對數生長期B16細胞接種于T25細胞培養瓶中,于37 ℃,5% CO2培養箱中培養過夜。分別加入終濃度為0.1%,1.0%和10.0%的玫瑰發酵液,未加樣品組做為細胞對照組。培養48 h后,棄上清,PBS洗滌1次,加入1 mol/L NaOH (10% DMSO),用刮刀刮取收集細胞,于80 ℃水浴30 min,取上清液于475 nm處測吸光值。按式(5)計算黑色素相對含量。

(5)
式中:
C黑色素——黑色素相對含量,%;
OD樣品——含有待測樣反應體系的吸光度;
OD空白對照——不含任何物質的空板吸光度;
OD細胞對照——不含待測樣反應體系的吸光度。
1.2.5 玫瑰發酵液作用機理研究
(1) 樣品處理及總RNA提取:取對數生長期人表皮角質形成細胞,接種于6孔細胞培養板,待細胞貼壁后,加入終濃度為1.82%的玫瑰發酵液(此濃度下細胞活率為80%),細胞對照組不加樣品。于37 ℃,5% CO2培養箱中培養24 h, PBS洗滌1次,按照總RNA提取試劑盒的說明提取細胞總RNA。提取得到RNA后進行瓊脂糖凝膠電泳,使用微量分光光度計進行分析。
(2) 人全基因譜表達芯片檢測:芯片檢測流程由博奧精典有限公司完成。
(3) RT-PCR驗證:RT-PCR驗證使用天根生化科技(北京)有限公司cDNA第一鏈合成試劑盒(去基因組)進行cDNA 第一條鏈合成反應。根據NCBI中發布的待測基因的序列,通過Primer Express軟件設計特異性引物,各基因引物序列見表2。

表2 熒光定量PCR引物序列Table 2 Primer sequence of Real-Time PCR
(4) 熒光定量PCR:以cDNA為模板,使用前在1 mL MIX 中加入40 μL的Dye Ⅰ混勻,取MIX 10.4 μL,加入上下游引物各0.5 μL, cDNA 1.0 μL,最后用ddH2O補足到20 μL。
1.2.6 玫瑰發酵液的安全性測試 采用人體皮膚斑貼試驗進行測試,具體試驗方法參照2007年版《化妝品衛生規范》。
2 結果與分析
2.1 玫瑰發酵液成分測定
玫瑰發酵液富含多糖和蛋白質。由表3可知,經發酵后,總糖含量顯著增加,蛋白含量無明顯變化;多酚與黃酮含量整體較低,不足1 mg/mL,與未發酵相比,均有下降,可能是高溫作用會使多酚和黃酮發生氧化損失。釀酒酵母在發酵過程中會產生多糖[11],可能是引起總糖含量增加的主要原因。
2.2 玫瑰發酵液抗衰老功效評價
如圖1所示,采用3種不同的方法檢測了20%濃度范圍內玫瑰發酵液對DPPH自由基、羥自由基和超氧陰離子的清除能力,在相同作用濃度下,玫瑰發酵液對DPPH自由基的清除作用遠高于其對羥自由基和超氧陰離子的。玫瑰發酵液中較高的多糖含量可能是其發揮抗氧化功效的主要成分[12-13]。
2.3 玫瑰發酵液的美白功效評價
2.3.1 生化水平對酪氨酸酶活性的抑制 由圖2可知,玫瑰發酵液濃度越高,其對酪氨酸酶活性的抑制效果越強。黑色素的生成過程需要氧化條件,而氧化條件也是影響酪氨酸酶活性發揮的重要因素[14]。玫瑰發酵液對酪氨酸酶活性的抑制可能是其較強的抗氧化作用導致的。

圖1 玫瑰發酵液對DPPH自由基、羥自由基和 超氧陰離子的清除作用
Figure 1 Scavenging effect of rose fermented broth on DPPH free radical, hydroxyl radical and superoxide anion
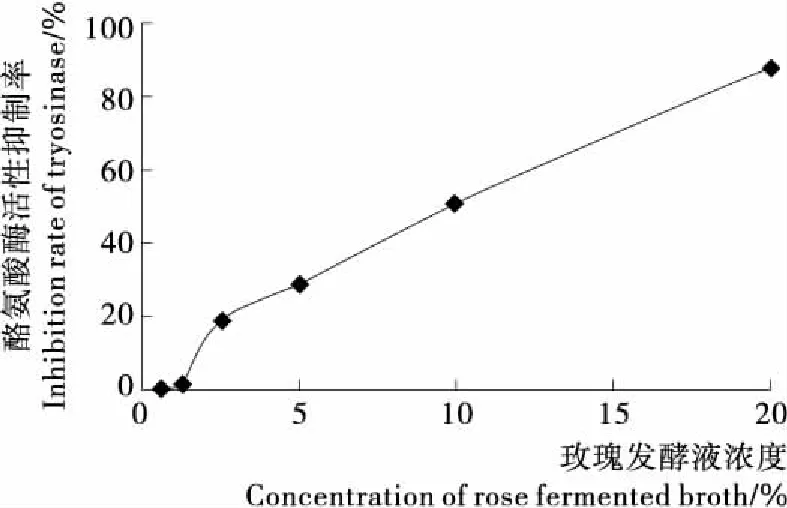
圖2 玫瑰發酵液對酪氨酸酶活性的抑制Figure 2 Inhibitory effect of rose fermented broth on activity of tyrosinase
2.3.2 細胞水平玫瑰發酵液的美白功效評價 由圖3可知,隨玫瑰發酵液濃度增加,其對B16細胞活率的抑制作用越強。0.2%,1.0%,5.0%的玫瑰發酵液作用均能在一定程度上抑制黑色素的合成,其中5.0%濃度時對黑色素的合成及酪氨酸酶活性抑制效果最為顯著。表明在此濃度范圍內,玫瑰發酵原漿對B16中的酪氨酸酶活性和黑色素合成有抑制效果。
2.3.3 美白作用機理研究 為探究玫瑰發酵液美白作用的分子機理,采用人全基因表達譜芯片對玫瑰發酵液作用后的角質細胞中基因表達情況進行檢測。由圖4可知,樣品所提RNA的電泳條帶清晰,同時28S rRNA∶18S rRNA 條帶亮度≥2∶1,表明RNA質量符合人全基因表達譜芯片試驗要求。OD260/280>1.9,純度符合要求,綜上玫瑰發酵液作用下所提取的角質細胞RNA純度、完整性均符合表達譜芯片試驗要求,可以進行后續的檢測。
玫瑰發酵液作用下,黑色素瘤通路發生改變,此通路中共有8個基因發生顯著變化,其中位于黑色素瘤通路上游的NGF基因和FGF2基因表達顯著降低(見表4)。
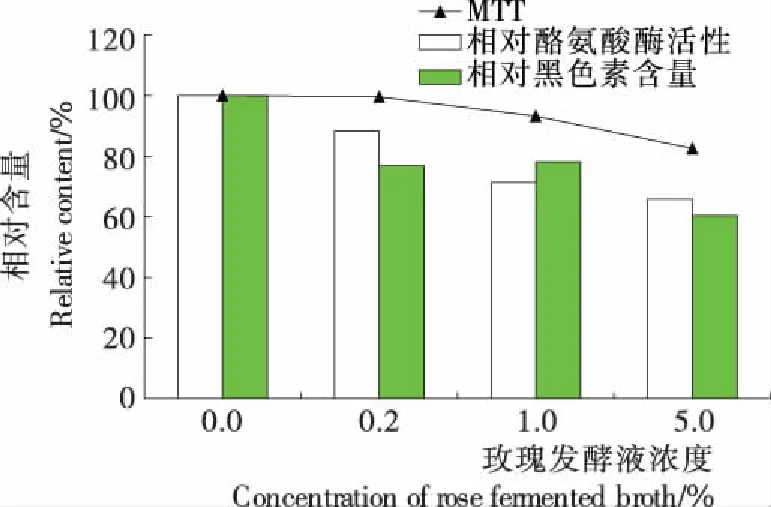
圖3 玫瑰發酵液對黑色素合成、酪氨酸酶活性及 細胞活率的影響
Figure 3 Effect of rose fermented broth on melanin synthsis, tyrosinase activity and cell viability

圖4 電泳檢測總RNA質量Figure 4 Quality detection of RNA by electrophoresis
在黑色素瘤通路中,神經細胞生長因子NGF基因屬于GF一類,在角質細胞中,NGF基因能夠促進黑色素的合成,其表達在黑色素的形成過程中起重要作用。神經營養因子(NTs)能夠提高中央和外周神經系統中神經元的生存神經生長因子(NGF)的表達,可以提高黑色素細胞的生存率。在受到紫外輻射后,NGF表達水平的增加能夠提高抗凋亡蛋白 Bcl-2 的表達水平,從而減少黑色素細胞的凋亡[15-16]。玫瑰發酵液作用下NGF基因的下調,可能是降低黑色素合成的關鍵機制。FGF2是黑色素細胞有絲分裂原[17-18]。角質細胞暴露于UVB下會刺激FGF2的產生,從而對黑色素細胞活性產生影響。然而FGF2 由角質細胞產生,其本身缺少分泌信號,因此FGF2 可能通過角質細胞與黑色素細胞之間的相互接觸來影響黑色素細胞的生長。GF家族因子位于黑色素瘤信號通路上游,FGF2、NGF通過與酪氨酸激酶跨膜受體相互作用,在cAMP 升高因子存在時誘導黑色素細胞的有絲分裂功能(見圖5)。玫瑰發酵液作用下FGF2和NGF表達降低,通過黑色素瘤通路抑制其有絲分裂,從而抑制黑色素的生成。

表4 黑色素瘤通路中主要變化基因Table 4 The main genes changed in Melanoma signaling pathway

圖5 Melanoma信號通路圖Figure 5 Melanoma signaling pathway
通過熒光定量方法對NGF和FGF2基因的表達情況進行確認(見圖6),NGF與FGF2的相對表達量均降低,小于內參基因β-actin的表達量,此熒光定量結果與芯片結果一致。表明基因芯片檢測結果可信。
2.4 皮膚安全性
根據化妝品衛生規范[19],人體斑貼試驗結果的判定準則:30例測試者中出現1級皮膚不良反應的多于5人,或者出現2級皮膚不良反應的多于2人,或出現任何1例3級或3級以上不良反應時,則認為受試物對人體有不良反應,反之,則視為對人體無不良反應。
如表5所示,空白組未發生可疑反應,玫瑰發酵組摘除斑試器30 min后有可疑反應1例,24 h后,該例可疑反應消失。根據2007年化妝品規范,可疑反應不足5例可視為樣品對人體是安全的,不會產生不良反應。

圖6 RT-PCR法驗證基因表達量Figure 6 Confirmation of genes expression by RT-PCR表5 人體斑貼試驗結果?Table 5 Results of human patch test

樣品名稱反應程度反應例數(去除斑試器)30min24h48h反應人數空白 -303030±———+———++———+++———0玫瑰發酵液 -293030±1——+———++———+++———1
? “—”表示陰性反應,0級;“±”表示可疑反應,1級;“+”表示弱陽性反應,2級;“++”表示強陽性反應,3級;“+++”表示極強陽性反應,4級。
3 結論
玫瑰發酵液富含多糖和蛋白質,具有較強的DPPH自由基清除能力;對酪氨酸酶活性有較強的抑制作用,且抑制效果隨濃度增加而增強;對B16細胞內的酪氨酸酶活性和黑色素合成有一定的抑制作用。其通過抑制黑色素瘤通路的上游基因FGF2和EGF的表達,降低黑色素細胞的增殖,從而發揮美白功效。玫瑰發酵液具有皮膚安全性。本試驗研究了玫瑰發酵液的成分、美白功效,可為其在抗衰老及美白功效食品中的應用提供參考。
[1] 孫靜, 馬琳, 呂斯琦, 等. 中藥發酵技術研究進展[J]. 藥物評價研究, 2011, 34(1): 49-52.
[2] 施昌松. 天然活性化妝品的現狀與發展趨勢[J]. 日用化學品科學, 2012, 35(2): 1-5.
[3] 方燕玉. 天然活性成分在化妝品中的應用研究[D]. 北京: 北京化工大學, 2008: 1-2.
[4] 趙興秀, 何義國, 鄒偉, 等. 發酵培養基對不同方法測量透明質酸結果的影響[J]. 食品與機械, 2016, 32(2): 7-10.
[5] 賈長虹, 常麗新, 楊亞男, 等. 玫瑰葉黃酮提取及其對亞硝酸鹽的清除作用[J]. 食品與機械, 2009, 25(5): 78-81.
[6] 張建成. 大馬士革玫瑰精油提取和綜合利用[D]. 北京: 北京化工大學, 2006: 1-3.
[7] 劉紹軍, 劉暢, 張艷霞, 等. 特色玫瑰香葡萄酒發酵工藝優化[J]. 河北科技師范學院學報, 2012(1): 1-4.
[8] 林森. 浙江玫瑰醋純種發酵技術的研究[D]. 杭州: 浙江工商大學, 2009: 8-12.
[9] 楊洋, 高航. 玫瑰櫻桃復合風味發酵乳的研制[J]. 中國奶牛, 2015(5): 43-46.
[10] 莫大美, 吳榮書. 復合菌種發酵法制備玫瑰酵素工藝研究[J]. 食品工業, 2016, 37(10): 64-69.
[11] 包怡紅, 劉奇, 王薇. 釀酒酵母胞外多糖發酵工藝條件優化[J]. 釀酒, 2012, 39(2): 58-62.
[12] 帕爾哈提·柔孜, 阿依姑麗·艾合麥提, 朱昆, 等. 玫瑰花瓣總黃酮和總多糖的體外抗氧化活性[J]. 食品科學, 2013, 34(11): 138-141.
[13] 白偉芳, 崔波. 玫瑰花多糖提取及抗氧化活性研究[J]. 食品與機械, 2009, 25(6): 83-86.
[14] 莊永亮, 張燕新, 唐遠龍. 玫瑰蜂花粉中不同存在形態酚類物質的組成及其抑制B16黑色素瘤細胞的活性[J]. 現代食品科技, 2016, 32(8): 1-7.
[15] MARCONI A, PANZA M C, BONNET M, et al. Expression and function of neurotrophins and their receptors in human melanocytes[J]. International Journal of Cosmetic Science, 2006, 28(4): 255-261.
[16] YAAR M, GROSSMAN K, ELLER M, et al. Evidence for nerve growth factor-mediated paracrine effects in human epidermis[J]. The Journal of Cell Biology, 1991, 115(3): 821-828.
[17] IMOKAWA G. Autocrine and paracrine regulation of melanocytes in human skin and in pigmentary disorders[J]. Pigment Cell Research, 2004, 17(2): 96-110.
[18] BRENNER M, VINCENT J. Modifying skin pigmentation - approaches through intrinsic biochemistry and exogenous agents[J]. Drug Discovery Today Disease Mechanisms, 2008, 5(2): 189-199.
[19] 中華人民共和國衛生部. 衛監督發〔2007〕1號 化妝品衛生規范[S]. 北京: [出版者不詳], 2007: 277-279.
Studyontheantioxidantandwhiteningeffectofrosefermentedbroth
To evaluate the antioxidant, whitening effect and skin safety of rose fermented broth. Method: Rose fermented broth was acquired by fermenting saccharomyces cerevisiae with rose. The skin safety, antioxidant effect and whitening effect were evaluated. The human whole gene expression profile chip was used to explore the whitening mechanism of rose fermented broth. The results showed that the scavenging effect of rose fermented broth on DPPH radical scavenging was obvious and its inhibitory effect on the activity of extracellular tyrosinase was in direct proportional to the concentration. The intracellular tests showed that rose broth had inhibitory effect on tyrosinase activity and melanin synthesis. The gene chip detection showed that the possible mechanism of whitening was inhibiting the growth of melanoma cells by down regulating the gene expressions ofNGFandFGF2 in the melanoma pathway. Human patch test showed that none positive reaction was caused by rose fermented broth. Conclusion: the rose fermented broth had a high skin safety as well as antioxidant and whitening effect. The whitening effect might be caused by down regulation ofNGFandFGF2.
rose; fermentation; whitening; antioxidant
北京工商大學青年教師科研啟動基金項目(編號:QNJJ2016-30);質檢公益性行業科研專項項目(編號:201410019)
趙丹,女,北京工商大學實驗師,碩士。
王昌濤(1975—),男,北京工商大學教授,博士。
E-mail: wangct@th.btbu.edu.cn
2017—06—27
10.13652/j.issn.1003-5788.2017.09.030

