高效耐鹽柴油降解菌的篩選、鑒定及降解基因
胡春輝,于 浩,趙陽國,田偉君,白 潔*
?
高效耐鹽柴油降解菌的篩選、鑒定及降解基因
胡春輝1,2,于 浩2,趙陽國1,田偉君1,白 潔1*
(1.中國海洋大學環境科學與工程學院海洋環境與生態教育部重點實驗室,山東青島266100;2.青島農業大學生命科學學院,山東青島266109)
在遼河口濕地油田石油污染土壤中分離到一株耐鹽柴油高效降解菌株L7,經過形態學觀察、16S rRNA基因序列分析鑒定菌株L7屬于不動桿菌屬().該菌株能夠以柴油、十五烷、十六烷、十七烷、十八烷、十九烷、二十烷和二十二烷為唯一碳源和能源生長.在柴油無機鹽培養基中,菌株的最適生長溫度為30°C,最適pH值為7.0,菌株L7在pH 6.0~9.0,鹽度范圍為3%以內都可以生長.與其他的菌株相比較,菌株L7在柴油中生長更加迅速,在最適培養條件下培養4d后菌株的OD600nm就可以達到4.0,通過紫外分光光度法測定培養5d后,柴油的降解效率為61.5%.通過對菌株L7的全基因組測序和分析,在基因組上找到一個烷烴羥化酶基因,將基因克隆到pME6032質粒上,并電轉至不依賴柴油生長的惡臭假單胞菌KT2440中,含有該質粒的KT2440菌株能夠在柴油無機鹽培養基中生長.GC-MS檢測確定了菌株L7及其基因對飽和烷烴的降解能力.推測菌株L7中烷烴降解途徑為末端氧化途徑,是由烷烴羥化酶催化反應生成相應的醇,最終通過β-氧化反應實現完全礦化.
不動桿菌;柴油;烷烴羥化酶;生物降解
柴油的組分以中長鏈的烷烴為主,是石油中的重要組分,每年有大量的柴油通過石油勘探、生產和運輸過程被泄漏到海洋環境中,對海洋生物和海洋環境造成了巨大破壞[1].目前處理柴油污染物的方法有物理法、化學法和生物法,物理法只是將污染物轉移,化學法可能會引入新的污染物,生物修復是徹底清除環境中柴油污染物的有效方法.微生物降解菌在柴油污染的生物修復中扮演重要角色[2].環境中存在大量的柴油降解菌株,當環境中柴油含量突然升高時這些菌株會迅速變成該區域的優勢菌株[3?5].已報道的柴油降解菌株分布于不動桿菌屬()、假單胞菌屬()、諾卡氏菌屬(、分支桿菌屬()、節桿菌屬()、無色桿菌屬()、芽孢桿菌屬()、微球菌屬()、弧菌屬()等.不同微生物降解的柴油成分也不盡相同,降解機理差異較大[6].低溫高鹽條件下石油類有機污染物的降解過程會發生較大的變化.因此研究低溫高鹽石油降解菌對于生物修復過程有重要的指導意義[7].
不同的柴油降解菌株中烷烴代謝途徑差異較大,代謝的烷烴種類也不盡相同[8].微生物中烷烴代謝途徑通常是先將烷烴進行羥化變成相應的醇,進一步氧化成酸,最終進入脂肪酸途徑或三羧酸(TCA)循環中徹底分解.其中烷烴羥化酶是烷烴代謝途徑中的關鍵酶,決定烷烴代謝的效率和途徑[9],同時這些烷烴羥化酶基因可用于探索和尋找環境中的烷烴降解菌株[10].
本文從遼河口濕地石油污染土壤中篩選出一株耐鹽高效柴油降解菌株,對菌株進行鑒定和降解性能研究,確定其最適降解條件,同時對其全基因組進行測序,在其基因組上找到一個烷烴羥化酶基因,通過分子生物學技術確定該基因的功能,以期為高鹽環境中柴油污染修復技術提供菌株資源和理論研究基礎.
1 材料與方法
1.1 樣品采集和培養基配制
樣品來源:樣品采自遼河口濕地油田石油污染土壤.
無機鹽(BSN)液體培養基:KH2PO40.5g/L, K2HPO4·3H2O 5.24g/L,KNO31g/L,NaSO40.2g/L, 10%MgCl2·6H2O 2mL,1%CaCl22mL,1%FeSO40.2mL,維生素混合液0.2mL,金屬離子混合液(1L的0.1mmol/L鹽酸中溶解0.05g CaCl2·2H2O, 0.05g CuCl2·2H2O,0.008g MnSO4·H2O,0.04g FeSO4·7H2O, 0.05g ZnSO4,0.1g Na2MoO4·2H2O, 0.05g Na2WO4·2H2O,0.038g CoCl2·6H2O,0.02g MnCl2·4H2O, 0.0124g H3BO3)5mL,調節pH值為7.0,121℃高壓蒸汽滅菌20min.
柴油培養基:無機鹽培養基中加入1%的柴油,柴油采用0.22μm濾膜過濾除菌.
飽和烷烴培養基:無機鹽培養基中加入0.2% (:)飽和烷烴.
LB液體培養基:蛋白胨10g/L,酵母粉5g/L,氯化鈉10g/L,pH7.0,121℃高壓蒸汽滅菌20min.
LB固體培養基即為LB液體培養基中添加1.5%的瓊脂.
1.2 柴油降解菌株的分離純化
稱取5g土壤樣品放入到已滅菌的無機鹽培養基中,加入1%的柴油置于170r/min、30℃恒溫振蕩搖床中培養5d后,取上清液5mL加入到新的柴油培養基中繼續培養,重復該過程4~5次后,取上清液1mL依次稀釋至10-5,10-6,10-7涂布于LB固體培養基平板上.置于30℃恒溫培養箱中培養,挑取單菌落接種到新的柴油培養基中,挑選生長較好的菌株進行后續實驗.
1.3 菌株的鑒定
選取一株生長最好的菌株命名為L7,利用基因組提取試劑盒提取菌株的總DNA,以其為模板,用細菌16S rRNA基因通用引物27F和1492R(引物序列見表1)擴增其16S rRNA基因.PCR反應體系:基因組DNA 0.5μL, 2×Pfu Mix 12.5μL,引物27F 1μL,引物1492R 1μL,用ddH2O補足至25μL.PCR反應條件為:94℃預變性5min, 94℃變性1min,55℃退火1min,72℃延伸2min,共30個循環;最后72℃延伸5min,4℃保溫.將PCR產物經瓊脂糖凝膠電泳檢測條帶單一、大小正確后,送至上海生工生物工程股份有限公司測序,測序結果遞交至NCBI數據庫進行比對,選取同源性較高的序列利用MEGA6.0軟件,采用Neighbor Joining法構建系統發育進化樹[11].
1.4 菌株的最適生長條件優化和降解效率測定
微生物對柴油的降解效率受溫度、pH值、鹽濃度等的影響.將菌株L7以1%的接種量接種到柴油無機鹽培養基中,分別置于25,30,37℃搖床中培養,搖床轉速為170r/min,每隔12h取樣1mL,12000r/min離心1min,用蒸餾水重懸后,利用分光光度計測定波長在600nm處的吸光度值(OD600nm)確定微生物的生長量.將菌株L7以1%的接種量接種到不同初始pH值的柴油無機鹽培養基(5.0、6.0、7.0、8.0、9.0)中,置于170r/min,30℃搖床中培養,每隔12h取樣測OD600nm處的吸收值繪制生長曲線.將菌株L7以1%的接種量接種到不同鹽濃度的柴油培養基中(氯化鈉濃度依次為0%、1%、2%、3%、5%),置于170r/min,30℃搖床中培養,每隔12h取樣測定生長情況并繪制生長曲線.
確定菌株的最適生長溫度、pH值和鹽濃度后,在最適生長條件下培養菌株L7,培養至穩定期后,每個實驗做3組平行.以不接菌的培養基作為空白對照,取樣并測定柴油降解效率.
通過測定不同柴油濃度的紫外吸收值,繪制標準曲線,根據標準曲線擬合得到方程:
=0.01414-0.0446,2=0.99318 (1)
式一中:為柴油濃度,為OD225nm處的吸收值.
柴油降解率的計算公式為:
=(0-1)/0×100% (2)
式二中:0為對照組柴油濃度,μL/L;1為實驗組柴油濃度,μL/L.
1.5 菌株L7的底物譜測定
柴油是一種成分復雜的混合物,主要組成成分是C10~C22的飽和烷烴.而每個菌株降解的柴油成分差異較大,因此將菌株L7分別接種到正己烷、正癸烷、十一烷、十二烷、十三烷、十四烷、十五烷、十六烷、十七烷、十八烷、十九烷、二十烷、二十一烷、二十二烷的烷烴培養基中,觀察其生長情況,對于能夠生長的培養基每隔12h取樣測定OD600nm,繪制生長曲線.
1.6 基因組測序和烷烴羥化酶基因分析
利用上海生工生物基因組提取試劑盒提取菌株L7的全基因組DNA,送至上海銳翌生物科技有限公司,采用Illumina Hi-Seq4000測序技術對菌株進行全基因組測序,將獲得的基因組序列提交到Rapid Annotation using Subsystem Technology(RAST)網站上進行自動注釋,獲得L7全基因組的注釋信息.將注釋得到的烷烴羥化酶基因跟已有的烷烴羥化酶進行Blast同源性分析,利用ClustalX軟件對蛋白序列進行比對.
1.7 烷烴羥化酶基因的功能驗證
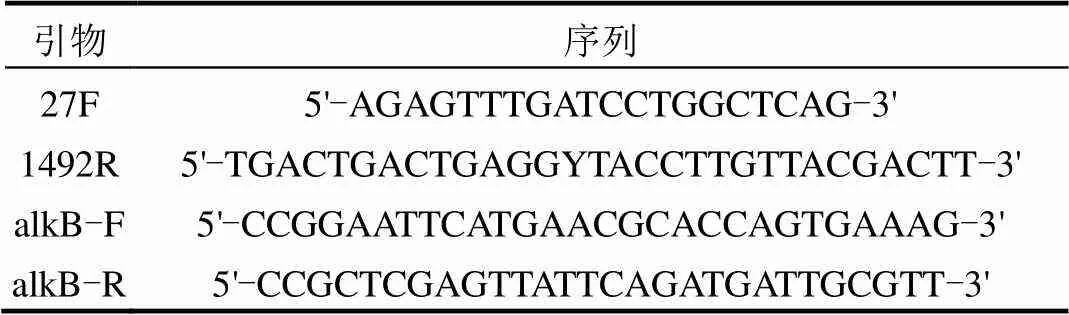
表1 本研究中所使用的PCR引物序列
1.8 直鏈烷烴含量的測定方法
樣品處理方法:準確量取培養液的體積,加入等體積的正己烷,超聲10min后8000r/min離心10min,靜置10min待其分層后,去掉水分,重復該過程.正己烷萃取兩次后,向分液漏斗中加入2g無水硫酸鈉,去除多余水分.
紫外分光光度法測定柴油含量[13]:柴油的最大吸收波長為225nm,分別配置不同濃度梯度的柴油溶液測定其吸光度,每個實驗做3組平行,繪制柴油標準曲線.
GC-MS檢測柴油的方法[14]:氣相色譜質譜聯用儀為美國安捷倫公司生產(5975B/6890N),色譜柱為DB-5MS Capillary column(0.32mm× 30m×0.25μm),FID檢測器,載氣為He,氣體流速為1.5mL/min,進樣器溫度為270℃,連接線溫度為280℃,離子源溫度為230℃,四級桿溫度為150℃,升溫程序為:150℃保持2min,然后以5℃/min的速度升溫至200℃,再以5℃/min的速度升溫至290℃,進樣量為1μL[14].
2 結果與分析
2.1 菌株L7的篩選與鑒定
從遼河口濕地石油污染的土壤中篩選到一株高效柴油降解菌通過革蘭氏染色和掃描電鏡觀察(圖1),確定其為革蘭氏陰性菌,在LB固體平板上的菌落形態為白色、半透明、邊緣整體、表面濕潤,菌體為球桿狀,直徑約為0.4~0.5μm,長度約為0.6~0.8μm.將該菌株命名為L7.將菌株L7的16S rRNA基因序列(GenBank accession number:KY817316)與標準菌株的16S rRNA基因序列(從LPSN數據庫下載)進行序列比對和進化樹分析,結果表明菌株L7的16S rRNA基因的序列與B2的序列相似性最高為~97%.選取了部分菌株的16S rRNA基因序列與菌株L7進行了系統發育樹分析(圖2).通過生理生化、形態學性狀和16S rRNA基因序列分析可以確定菌株L7屬于屬,并名為sp. L7.

圖1 菌株Acinetobacter sp. L7掃描電鏡細胞形態觀察
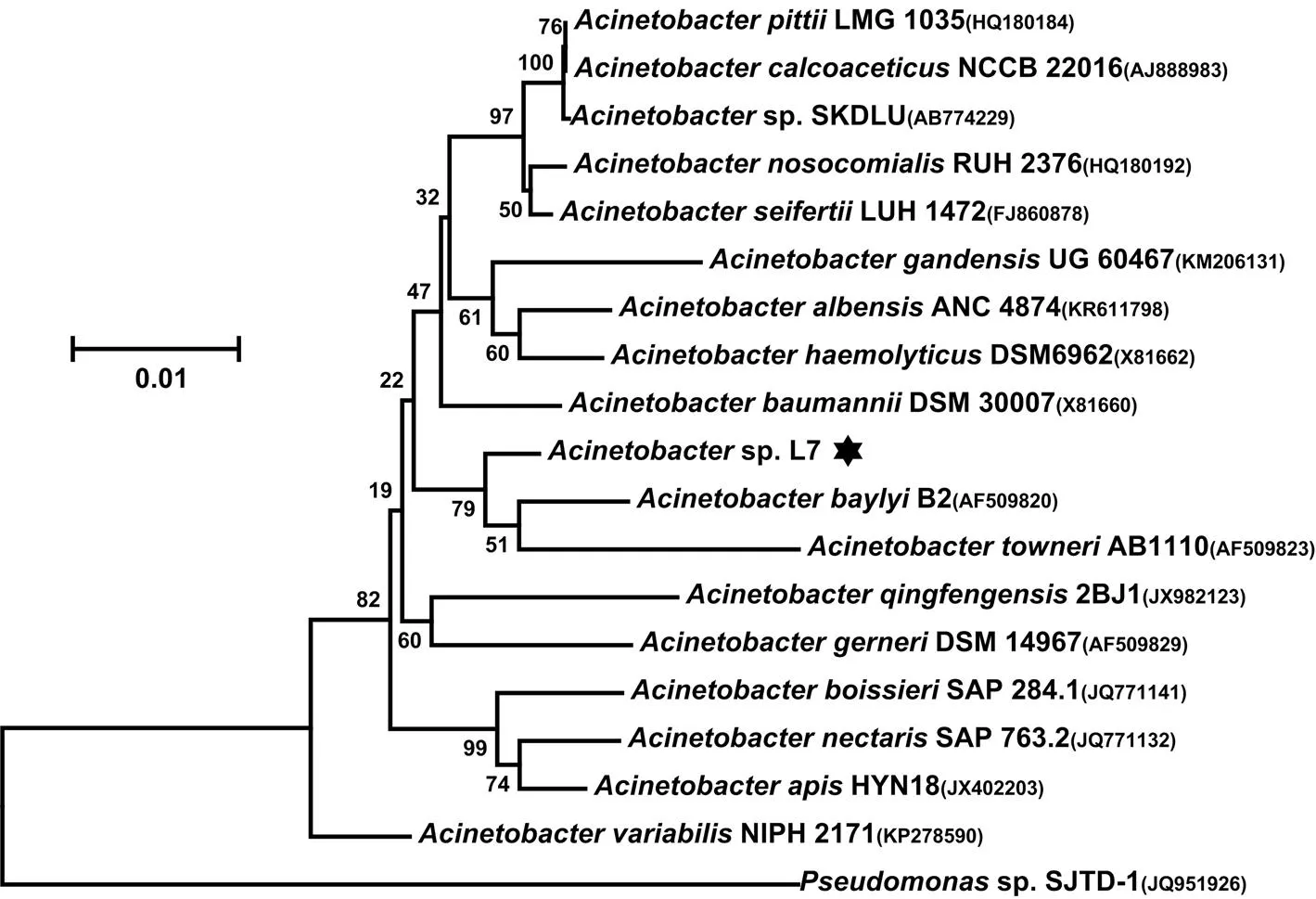
圖2 菌株L7的系統發育進化樹
2.2 菌株的最適生長條件
如圖3a所示,菌株在30℃生長最好,其次為25℃,在37℃以上生長緩慢,且穩定期的生物量(最大OD600nm吸收值)也依次減少.菌株L7是從遼河口石油污染土壤中篩選得到的,遼河口位于高緯度地區當地年最高氣溫常年等于或者低于30℃,因此菌株在該溫度下具有較強的柴油分解能力.
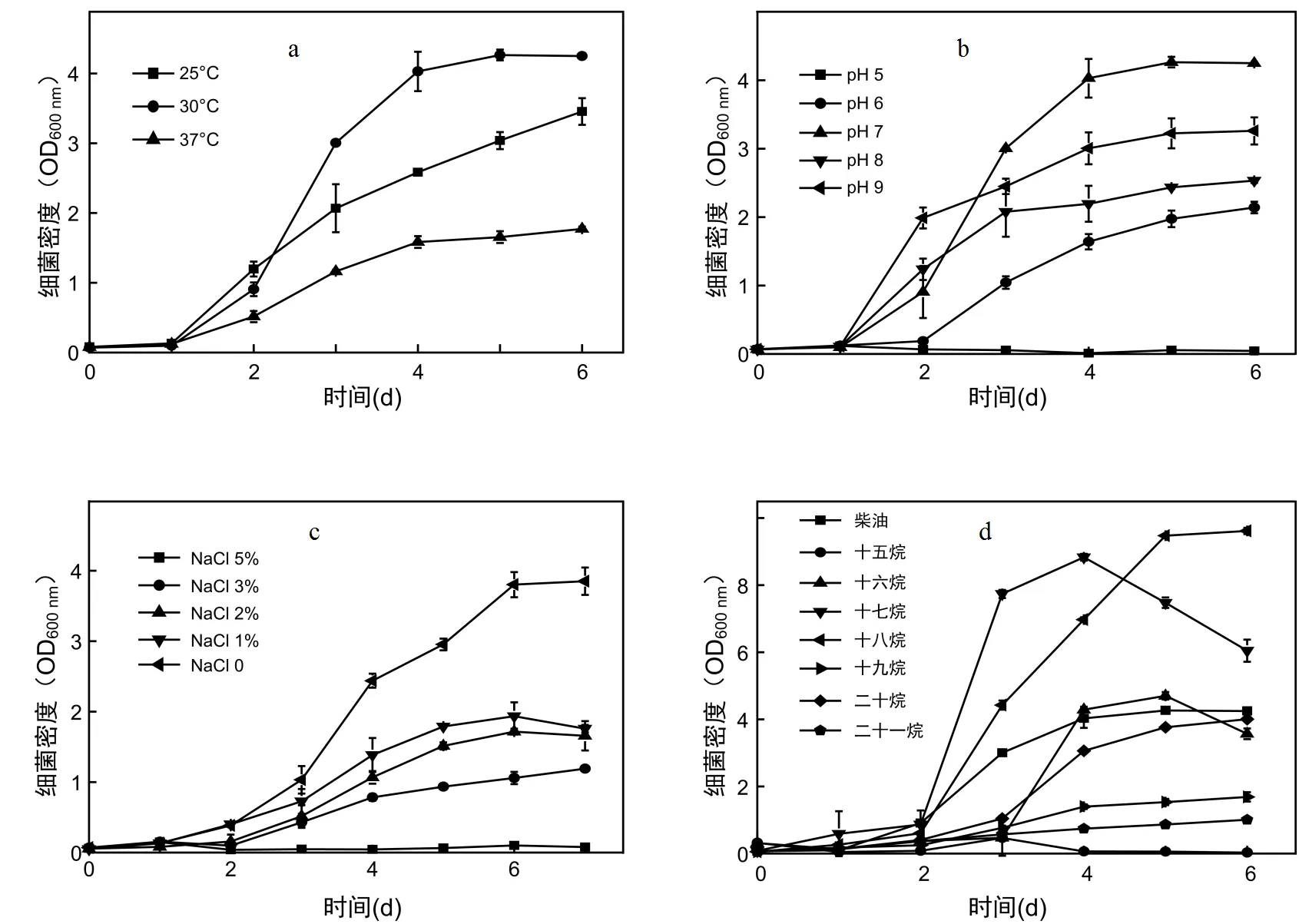
圖3 菌株L7在不同生長條件下的生長曲線
如圖3b所示,菌株L7的最適pH值為7.可以良好的適應弱堿性環境,在pH值為9的情況下仍能夠保持較好的生長,但酸性條件下菌株L7生長受到明顯抑制,培養基中pH值為5時基本不能夠生長.
如圖3c所示,在無機鹽培養基中,不添加NaCl時,菌株生長最好,隨著培養基中氯化鈉濃度的升高,生長受到抑制,但在1%氯化鈉條件下終OD600nm值仍能達到2.0左右,在3%氯化鈉條件下終OD600nm值仍能達到1.0以上.說明菌株L7具備一定的耐鹽能力.
如圖3d所示,菌株L7能夠利用十五烷、十六烷、十七烷、十八烷、十九烷、二十烷和二十二烷為唯一碳源進行生長,在正癸烷、十一烷、十二烷、十三烷、十四烷和二十一烷為唯一碳源的無機鹽培養基中不能生長,其中在柴油培養基中L7的適應能力最強,能夠在2d時間達到最大生物量,另外在十七烷和十八烷無機鹽培養基中L7菌體穩定期細胞密度(OD600nm值)明顯高于柴油培養基中的最大值.說明菌株L7對中長鏈烷烴有較好的利用和降解效果.
通過當前表格可以看出,實施不同的護理模式以后,研究組患者的護理滿意度為95.92%,對照組患者的護理滿意度為81.63%,研究組患者的護理滿意度高于對照組,差異有統計學意義(P<0.05)。說明相較于常規骨科護理模式,在骨科護理中應用臨床護理路徑,患者的護理滿意度更高。見表1。
2.3 烷烴羥化酶基因的分析
對菌株L7的全基因組進行測序,基因組已經遞交到DDBJ/ENA/GenBank數據庫,序列號為NBNP00000000.基因組(草圖)全長3388376bp, GC含量為42.89%,通過基因功能注釋(RAST)預測到3144個蛋白編碼基因(CDSs).在基因組上發現一個烷烴羥化酶基因(),該AlkB蛋白的氨基酸序列跟已報道的該家族蛋白氨基酸序列比對如圖4所示,跟不動桿菌ADP1菌株中AlkB蛋白的氨基酸相似性最高,為89%.進一步分析基因組信息在該基因上游發現一個反向AraC家族的轉錄調控蛋白基因,跟已有的不動桿菌ADP1中基因簇的排列順序一致[15].

圖4 L7中烷烴羥化酶的氨基酸序列比對
2.4 烷烴羥化酶基因的功能驗證

圖5 Acinetobacter sp. L7對飽和烷烴降解的GC-MS分析
(a)柴油樣品;(b)菌株r sp. L7對柴油的降解;(c)含有pME6032-質粒的KT2440對柴油的降解
利用正己烷萃取樣品,紫外分光光度法檢測在最適生長條件下(溫度30℃,pH值為7.0,鹽度0%,170r/min)OD225nm處的吸收值,菌株L7對柴油的降解效率為61.5%.
利用GC-MS法對碳鏈長度C16~C25的飽和烷烴的降解情況進行檢測.與未接種L7菌株的對照組相比,5d后L7菌株對柴油中的十六烷到二十五烷均有較好的降解效果.發現菌株L7對十九烷到二十五烷的降解效率接近100%(圖5).
2.5 烷烴羥化酶基因的功能驗證
為了驗證從L7基因組中比對獲得的基因的功能,將長度為1224bp的基因通過RI和I酶切位點連接到pME6032質粒上.將重組質粒pME6032-通過電擊轉化的方法轉化到惡臭假單胞菌KT2440中.將含有pME6032-的KT2440菌株接種到四環素抗性柴油培養基中,觀察其生長情況并檢測對柴油的降解,以進一步驗證基因的功能.
菌株KT2440在以柴油作為唯一碳源的無機鹽培養基中不能生長,而含有pME6032-質粒的KT2440菌株能夠在柴油無機鹽培養基中生長.對培養5d后的樣品用正己烷萃取后,用GC-MS檢測,結果如圖5c所示,含有基因的KT2440培養液中十八烷~二十三烷的含量均出現了下降,說明菌株L7中的AlkB蛋白參與催化十八烷到二十三烷的降解過程.這說明了該基因的確參與了柴油的降解.
3 討論
根據底物譜實驗和GC-MS圖譜分析,菌株L7對C19~C25的飽和烷烴的降解效率幾乎達到100%.對菌株L7基因組中的基因進行體外功能驗證,通過基因克隆表達技術和GC-MS確定AlkB蛋白參與催化十八烷、十九烷、二十烷、二十一烷、二十二烷和二十三烷的降解反應過程,但是跟L7菌株相比降解效果較差,原因可能是烷烴代謝過程還需要其他蛋白的參與,菌株KT2440中沒有相關蛋白,導致降解效率不高.菌株L7對碳鏈長度C14~C25的飽和烷烴均有一定的降解作用,說明菌株L7中還有存在有其他催化中長鏈烷烴的羥化酶基因.基因比對并沒有發現其他功能基因,說明該基因的序列可能跟已有的烷烴羥化酶基因相比相似性較低,這些有待于進一步研究.
不動桿菌屬在有氧條件下代謝飽和烷烴的途徑主要有2條:一是在末端氧化酶的催化下生成相應的醇,進一步氧化成醛,然后轉化成相應的脂肪酸通過β-氧化反應被完全降解[16];二是在雙加氧酶的催化下將飽和烴氧化為相應的過氧化物,然后生成醛和脂肪酸進入β-氧化反應[17].同時有大量的烷烴羥化酶被發現,如sp. DSM17874中降解長鏈烷烴的基因[18]、[19]和sp. BCP1[20]中的基因;這些基因的表達都受到烷烴的誘導.在L7基因組發現的烷烴羥化酶基因,跟已有的基因的序列相似性較高,并在該基因上游發現一個AraC家族的調控蛋白基因,基因結構跟已經報道的基因排列順序類似,說明菌株L7中的烷烴羥化酶基因也是受到調控蛋白的調控是誘導表達的.推測L7跟其他菌株一樣也是通過末端氧化途徑生成伯醇,伯醇經過氧化最終通過脂肪酸β-氧化途徑被完全分解.
與已經報道的柴油降解菌株相比較,當以柴油作為唯一碳源進行生長的時候L7可以獲得更高的細胞密度.菌株SJTD-1在柴油培養基中培養時終OD600nm在0.8左右[21],菌株SY-1在柴油培養基中培養時終OD600nm在0.4左右[22],而菌株L7在柴油培養基中培養時終OD600nm可達到4.0以上,這說明了L7對于柴油的高效利用能力和高效的烷烴降解能力.即使是在鹽濃度為3.0%的情況下,菌株L7的菌體密度仍然可以達到1.0以上,可以達到其他的柴油降解菌株在最適生條件下的菌體密度[21,22].這說明了菌株L7不僅僅適合在淡水環境中用于柴油污染的去除,也可以適應海洋環境中柴油的去除工作,是一株優秀的耐鹽柴油污染物生物修復菌株.
4 結論
4.1 從石油污染土壤中篩選到一株以柴油為唯一碳源,氮源和能源生長的高效降解菌株L7,經過形態學觀察和16S rRNA基因序列比對鑒定為不動桿菌(sp.).菌株L7降解柴油的最適溫度為30℃,最適pH值為7.0,能夠耐受3%鹽度的生長條件,在最適條件下培養5d后,對柴油的降解效率為61.5%.
4.2 菌株L7具有高效降解中長鏈烷烴的能力,對碳鏈長度在19~25的飽和烷烴降解效率接近100%.
4.3 對菌株L7的全基因組測序分析,通過序列比對找到一個烷烴羥化酶基因,通過對基因進行體外功能驗證確定基因的功能,為烷烴代謝相關基因的研究提供理論參考,并推測出菌株L7降解烷烴的途徑為末端氧化途徑.本研究可為柴油污染的生物修復提供降解效率高、耐鹽、耐堿的優質菌株.
[1] Hassanshahian M, Emtiazi G, Cappello S. Isolation and characterization of crude-oil-degrading bacteria from the Persian Gulf and the Caspian Sea [J]. Marine Pollution Bulletin, 2012, 64(1):7?12.
[2] 黃 藝,禮 曉,蔡佳良.石油污染生物修復研究進展[J]. 生態環境學報, 2009,18:361?367.
[3] Rojo F. Degradation of alkanes by bacteria [J]. Environmental Microbiology, 2009,11(10):2477?2490.
[4] 林瑩瑩,聶麥茜,王 琰,等.生物膜處理高含油廢水及膜表面微生物群落特性研究 [J]. 中國環境科學, 2016,36(9):2800?2806.
[5] 張 楠,初里冰,丁鵬元,等.A/O生物膜法強化處理石化廢水及生物膜種群結構研究[J]. 中國環境科學, 2015,35(1):80?86.
[6] Huan L, Jing X, Rubing L, et al. Characterization of the medium- and long-chain n-alkanes degradingstrain SJTD-1and its alkane hydroxylase genes [J]. PLOS ONE, 2014,9(8):e105506.
[7] 刁 碩,王紅旗,許 潔,等.低溫耐鹽芘降解菌的篩選鑒定及降解特性研究[J]. 中國環境科學, 2017,37(2):677?685.
[8] Shigeaki H, Yuki K, Akihiro H. Microbial communities in oil-contaminated seawater [J]. Current Opinion Biotechnology, 2004,15(3):205?214.
[9] Van Beilen J B, Funhoff E G. Alkane hydroxylases involved in microbial alkane degradation [J]. Applied Microbiology and Biotechnology, 2007,74(1):13?21.
[10] Diogo J, Vanessa M A, Raquel P, et al. The use of a combination ofprimers to better characterize the distribution of alkane-degradign bacteria [J]. PLOS ONE, 2013,8(6):e66565.
[11] Pearson W R, Lipman D J. Improved tools for biological sequence comparison [J]. Proceedings of the National Academy of Science of the United States of America, 1988,85(8): 2444?2448.
[12] Shan Z Y, Xu H J, Shi X Q, et al. The study of optimal conditions of electroporation in[J]. Acta Genetica Sinica, 2004,31(3):311?316.
[13] 黃延林,寧亞平,柴蓓蓓.石油高效降解菌的篩選及其降解特性[J]. 西安建筑科技大學學報(自然科學版), 2006,38(6):795?803.
[14] Wang X B, Chi C Q, Nie Y, et al. Degradation of petroleum hydrocarbons (C6-C40) and crude oil by a novelstrain [J]. Bioresource Technology, 2011,102(17):7755?7761.
[15] Andreas R, Walter G, Wolfgang H. Alkane hydroxylase fromsp. ADP1is encoded byand belongs to a new family of bacterial integral-membrane hydrocarbon hydroxylases [J]. Applied and Environment Microbiology, 1998,64(4): 1175?1179.
[16] Van Hamme J D, Singh A, Ward O P. Recent advances in petroleum microbiology [J]. Microbiology and Molecular Biology Reviews, 2003,67(4):503?549.
[17] Maeng J H, Sakai Y, Tani Y. Isolation and characterization of a novel oxygenase that catalyzes the first step of n-alkane oxidation inM-1 [J]. Journal of Bacteriology, 1996,178(13):3695?3700.
[18] Mimmi T H, Alexander W, Trond E, et al. Identification of novel genes involved in long-chain n-alkane degradation bysp. strain DSN 17874 [J]. Applied and Environmental Microbiology, 227,73(10)3327?3332.
[19] Mercedes M M, Luis Y, Fernando R. Differential expession of the components of the two alkane hydroxylases from[J]. Journal of Bacteriology, 2003,185(10): 3232?3237.
[20] Cappelltti M, Fedi S, Frascari D, et al. Analyses of both thegene transcriptional atart site andpromoter-inducing properties ofsp. strain BCP1grown on n-alkanes [J]. Applied and Environment Microbiology, 2011,77(5):1619?1627.
[21] Liu H, Xu J, Liang R B, et al. Characterization of the medium- and long-chain n-alkanes degradingstrain SJTD-1and its alkane hydroxylase genes [J]. PLOS ONE, 2014,9(8):e105506.
[22] 陸洪省,魏文超,王厚偉,等.高效石油烴降解菌SKD-1的分離、篩選及其降解性能[J]. 環境工程學報, 2013,7(10):4116?4120.
Isolation and identification of a high-efficient diesel degrading bacterial strainsp. L7.
HU Chun-hui1,2, YU Hao2, ZHAO Yang-guo1, TIAN Wei-jun1, BAI Jie1*
(1.Key laboratory of Marine Environmental Science and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;2.College of Life Science, Qingdao Agricultural University, Qingdao 266109, China)., 2017,37(11):4251~4258
A high-efficient diesel degrading bacterial strain isolated from oil-contaminated soil in Liaohe oil field was identified assp. and named as L7. The strain could efficiently grow with diesel, n-tridecane, n-hexadecane, n-heptadecane, n-octadecane and n-nonadecane as its sole carbon and energy source. The cultivation conditions of the strain L7 in diesel basic salt medium were investigated. The suitable pH value for the growth of the strain ranged from 6.0~9.0 with the optimum value of 7.0. The optimum temperature and salinity for the cultivation of the strain was 30°C and 1%, respectively. The degradation efficiency of diesel oil was 61.5% under the optimum conditions. Based on the whole-genome DNA sequence analysis of the bacterial strain, an alkane hydroxylase gene,, was identified. To study the function of thegene in n-alkane utilization by the bacterial strain, the-plasmid was constructed and electroporated into another bacterial strainKT2440, which could not grow in diesel. The electroporated bacteriaKT2440 could grow in diesel basic salt medium. Through gas chromatography-mass spectrometric analysis, the degradation capacity of the bacterial strain L7 for n-alkanes and the roles of thegene were determined. The results indicated that the n-alkanes were degraded by the strain L7 via the terminal oxidation and β-oxidation pathway.
;diesel;alkane hydroxylase;biodegradation
X703.5
A
1000-6923(2017)11-4251-08
胡春輝(1987-),女,山東青島人,實驗師,中國海洋大學博士研究生,主要從事環境中石油污染物降解.發表論文10篇.
2017-04-05
國家水體污染控制與治理科技重大專項(2013ZX07202- 007)
* 責任作者, 教授, baijie@ouc.edu.cn

