ANGPTL8調控糖代謝作用機制研究
馬石楠 李忠耀 郭興榮
(1. 湖北醫藥學院附屬太和醫院 胚胎干細胞研究湖北省重點實驗室,十堰 442000;2. 湖北醫藥學院生物醫學工程學院,十堰 442000)
ANGPTL8調控糖代謝作用機制研究
馬石楠1李忠耀2郭興榮1
(1. 湖北醫藥學院附屬太和醫院 胚胎干細胞研究湖北省重點實驗室,十堰 442000;2. 湖北醫藥學院生物醫學工程學院,十堰 442000)
探討ANGPTL8在胰島素作用下對人肝細胞糖代謝影響及可能的作用機制。利用尾靜脈水動力轉染證實在小鼠肝臟過表達ANGPTL8可提高進食期糖耐受;在HepG2細胞中利用qPCR檢測進食的主要調控因素胰島素、葡萄糖等對ANGPTL8表達影響,發現單獨的葡萄糖或胰島素對ANGPTL8表達影響不明顯,而葡萄糖和胰島素組合可顯著促進ANGPTL8表達;利用Western blotting分析在ANGPTL8敲除(ANGPTL8-/-)和ANGPTL8穩定過表達(ANGPTL8++)的HepG2細胞中胰島素介導PI3K/AKT信號通路蛋白及其蛋白磷酸化表達差異,結果顯示ANGPTL8可上調胰島素介導的AKT信號通路中AKT、GSK-3β、FoxO1 蛋白磷酸化;PAS染色分析ANGPTL8可促進胰島素介導的糖原合成。
ANGPTL8;糖耐受;PI3K/AKT信號通路;糖原合成
血管生成素樣蛋白8(ANGPTL8)又名Betatrophin,是在胰島素抵抗2型糖尿病小鼠肝臟中最新發現的一種異常高表達的分泌性蛋白[1-3]。大量流行病統計學結果顯示在2型糖尿病患者血漿中的ANGPTL8濃度明顯高于正常人群[4-7],尤其在最新診斷的2型糖尿病患者體內ANGPTL8濃度與胰島素含量、糖耐受等呈一定相關性[8]。Melton等[2]利用一種胰島素受體拮抗劑S961誘導小鼠胰島素抵抗模型時,發現ANGPTL8異常高表達并且可能是通過特異高效促進胰腺β 細胞增殖,提高糖耐受改善胰島素抵抗。然而,2014 年Yang等[3]發現在小鼠肝臟過表達ANGPTL8,只引起小鼠胰腺或者移植在腎被膜下的小鼠β細胞增殖,對移植在腎被膜下人胰島β細胞無任何作用。最近Viktoria等[9]研究發現,ANGPTL8并非是β細胞發揮功能或增殖的必要條件。面對Viktoria的質疑,Yi和Melton等[10]承認之前實驗存在疏漏,認同Viktoria等的研究結果:ANGPTL8并不是通過高效特異促進β細胞增殖來提高糖耐受。所以ANGPTL8改善糖耐受即其調控糖代謝作用機制目前還不清楚。本研究將利用水動力轉染技術在小鼠肝臟過表達ANGPTL8分析在進食期該基因對糖耐受影響,然后利用前期構建的ANGPTL8-/-和ANGPTL8++HepG2細胞為細胞模型,探討其可能調控機制。所以對ANGPTL8調控糖代謝機制研究,將為進一步研究ANGPTL8在胰島素抵抗時提高糖耐受作用機制奠定基礎,并為ANGPTL8臨床治療糖尿病的藥物開發提供一定理論依據。
1 材料與方法
1.1 材料
1.1.1 細胞 HepG2購自中國典型培養物保藏中心(CCTCC)。37℃,5%二氧化碳和飽和濕度條件下恒溫培養箱中培養,培養基為含10%胎牛血清(FBS)的α-MEM或DMEM加有雙抗液(青霉素100 U/mL,鏈霉素 100 μg /mL)。
1.1.2 動物 6-8周BALA/C雄鼠(購自華中科技大學同濟醫學院實驗動物中心)。在湖北醫藥學院SPF級動物實驗中心飼養,有關動物的實驗操作得到了該中心實驗動物倫理委員會的認可和批準。
1.1.3 試劑 ONETOUCH@ SursStep@血糖測定試紙購自美國LIfe Scan公司;熒光素酶底物(D-luciferin)購自美國Caliper Life Sciences公司;β-actin抗體購 自 Abcam 公 司;AKT,Phospho-AKT(Ser473),GSK3-β,Phospho-GSK-3β(Ser9),FoxO1,Phospho-FoxO1(Thr24),Phospho-IRS1(Ser307),Phospho-IRS1(Ser302),IRS1,等抗體購自Santa Cruz 公司;Flag抗體購自sigma公司;堿性磷酸酶標記(AP)羊抗兔,羊抗鼠二抗,彩色預染蛋白質分子量標準品、Western blotting及IP細胞裂解液、PMSF(100 mmol/L)、SDS-PAGE凝膠快速配制試劑盒、SDSPAGE電泳液、6×上樣緩沖液等均購自碧云天生物技術研究所購自碧云天生物科技公司;蛋白酶抑制劑,磷酸化蛋白酶抑制劑(PhosStop)購自Roche公司;qPCR supermix-UDG with ROX kit購自Invitrogen公司;胰島素、D-葡萄糖購自Sigma公司;PAS糖原染色試劑盒購自森貝伽公司。本實驗所用其他試劑均為國產分析純。
1.2 方法
1.2.1 水動力轉染技術 將待轉染質粒同生理鹽水稀釋至小鼠體重10%,如2 mL(20 μg質粒)/20 g(小鼠體重);用固定架把小鼠固定,75%酒精消毒尾巴,干棉球擦干,暴露尾靜脈;注射器吸取混勻的質粒溶液,經尾靜脈8-10 s快速注射入小鼠體內,每組3-5只,對照組為 LUC(pGL4.51[luc2/CMV/Neo])質粒組;分別在轉染質粒0、24、48、72、96、120和168 h后,小鼠活體成像儀觀察對照組的熒光素酶表達情況,從而確定目的質粒在小鼠體內表達最高時間點。
1.2.2 血糖的測定 采用剪尾測血糖法:將血糖儀調好,試紙插入血糖儀裝好;固定小鼠,用手術刀切除尾部1-0.5 mm,擠出一滴血,直接滴入血糖試紙,用紗布或者棉球給鼠尾壓迫止血;記錄血糖儀讀數。
1.2.3 測定 小鼠禁食過夜至少12 h,按1 mg(D-glucose)/g(小鼠體重)腹腔注射D-glucose 溶液,采用如前所述的剪尾測血糖法分別在注射0 min和60 min,120 min 和240 min檢測小鼠血糖變化。
1.2.4 引物設計 本實驗所用到引物,見表1。
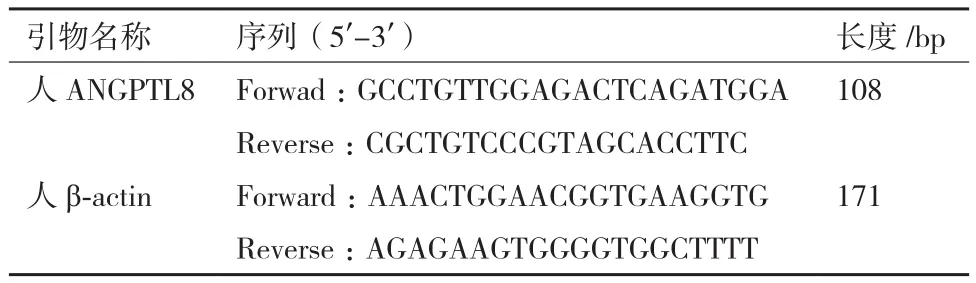
表1 PCR引物和產物片段大小
1.2.5 熒光定量Real-time PCR Real-time PCR(qPCR)過程根據SYBR Green RT-PCR試劑盒與擴增儀說明,用β-actin基因上為內參對照。加樣(每組樣品設2-3個復空),貼膜密封后使用StepOneTMReal-Time PCR Systems(Applied Biosystems) 進 行PCR反應。數據分析根據軟件默認值自動分析。得到精確的Ct值后導出數據,根據公式:2-ΔΔCt值確定目的基因與內標基因之間的相對表達倍數,繪制圖表。獨立樣本T-test(兩個樣品間比較)來進行處理間的差異比較分析。
1.2.6 Western blotting SDS-PAGE電泳后,取出凝膠,將膠浸入轉膜緩沖液中15 min,將濾紙、凝膠、NC膜等按一定次序放疊在一起后,放入轉膜儀器中進行轉膜(15 V,30 min)。轉膜后,取NC膜于5%脫脂奶粉中封閉1h。封閉后,NC膜浸泡于1×TBST溶液中清洗3次,每次5 min。清洗后,置NC膜于一抗稀釋液(V/V=1∶1 000)中孵育1 h,隨后,取出NC膜用TBST洗滌3次,加入二抗稀釋液(V/V=1∶1 000)孵育1 h,取出NC膜洗滌完畢后即可顯色(注意避光),觀察實驗結果。
1.2.7 PAS染色法檢測糖原合成 PAS染色(Periodic Acid-Schiff stain)按試劑盒說明書操作并稍加修改:將待檢測細胞去除培養基,ddH2O洗2-3次,加入細胞固定液室溫固定10 min;去除固定液,ddH2O洗2-3次,每次5 min,加入高碘酸酒精溶液室溫(17-20℃的室溫為最佳)孵育10 min;用ddH2O充分洗,吸水紙吸干水;Schiff氏試劑避光染色10-15 min;流動自來水沖洗10 min;顯微鏡下觀察并照相。
1.2.8 細胞處理 (1)ANGPTL8表達檢測:將HepG2細胞用無糖無血清培養基饑餓處理24 h 后,分別向培養基中添加胰島素、葡萄糖及兩者組合培養12 h,收取細胞提取RNA,用于RT-PCR。
(2)胰島素磷酸蛋白檢測方法:參考Zhou 等[11]方法,分別把前期構建的ANGPTL8++、ANGPTL8-/-和野生型HepG2 三種細胞各分為兩組,一組正常培養,一組向培養基中添加100 nmol/L 的胰島素,培養 20 min,Western blotting 分別檢測 AKT 與 pAKT(磷酸化AKT 蛋白)表達變化。
2 結果
2.1 肝臟過表達ANGPTL8對小鼠血糖影響
作為新基因ANGPTL8的功能還存在很多爭議,為了確定ANGPTL8是否影響糖代謝,將在小鼠體內重復Melton利用水動力轉染方法的實驗,檢測在肝臟過表達ANGPTL8后對糖耐受影響。利用活體成像儀器觀察水動力轉染對照質粒pGL4.51-LUC在小鼠肝臟轉染前0 h和轉染后不同時間點熒光素酶(LUC)表達情況,如圖1-A所示,對照質粒可持續在小鼠體內表達至少7 d,在轉染后48 h表達最高。根據對照質粒LUC在小鼠表達情況,選取在轉染人ANGPTL8-Flag和鼠ANGPTL8-Flag質粒(前期工作已構建)后0、48、72和168 h四個時間點提取小鼠肝臟組織蛋白,Western blotting檢測hANGPTL8-Flag和mANGPTL8-Flag表達情況。如圖1-B所示,hANGPTL8和mANGPTL8質粒在小鼠肝臟的表達趨勢基本和對照質粒一致。根據以上結果在轉染目的基因48 h后,小鼠禁食過夜(≤12 h)后,按1 mg(D-glucose)/g(小鼠體重)腹腔注射D-glucose 溶液,進行血糖測定實驗。如圖1-B所示,在禁食過夜后轉染人和鼠ANGPTL8質粒與對照組小鼠血糖無明顯差異,腹腔注射葡萄糖1-2 h注射人和鼠ANGPTL8質粒組血糖明顯低于對照組,而注射葡萄糖4 h后人ANGPTL8和鼠ANGPTL8質粒組的血糖又恢復到與對照組基本一致。結果顯示ANGPTL8在小鼠的進食期發揮重要作用,可提高糖耐受。
2.2 不同因素對ANGPTL8 mRNA表達影響
用胰島素、葡萄糖及兩者組合處理HepG2細胞后,RT-PCR和qPCR結果(圖2-A)表明單獨添加葡萄糖、胰島素都不會引起ANGPTL8表達升高,而兩者組合能顯著提ANGPTL8表達。為進一步分析在HepG2細胞中ANGPTL8的表達是否與胰島素劑量和作用時間相關,我們分別用100 nmol/L胰島素培養基(含5.5 mmol/L葡萄糖)處理0、1、4、16、36和48 h,如圖2-B顯示,隨著胰島素作用時間的延長,ANGPTL8的表達逐漸升高;當用不同濃度胰島素處理的結果(圖1-C)顯示隨著胰島素濃度的增加ANGPTL8的表達也逐漸升高。所以以上結果解釋為什么在進食期和胰島素抵抗時ANGPTL8表達顯著上調,因為這兩個時期機體都會出現高血糖和胰島素尤其在胰島素抵抗初期。
2.3 ANGPTL8調控糖代謝作用機制研究
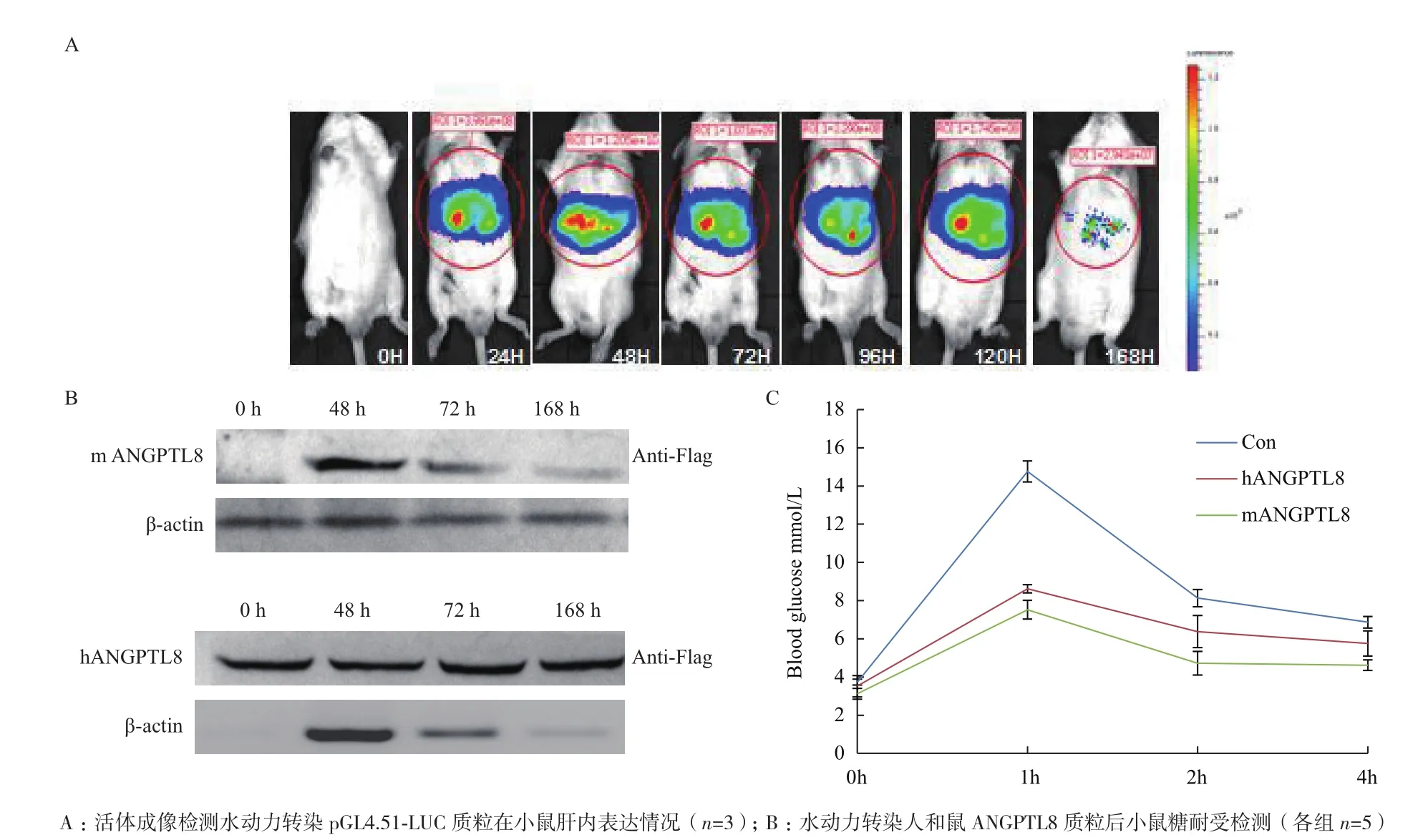
圖1 ANGPTL8在小鼠肝臟過表達對血糖影響
Western blot結果(圖3)顯示,當有胰島素存在時,ANGPTL8++、ANGPTL8-/-和野生型HepG2三種細胞的AKT蛋白磷酸化顯著上調,并且ANGPTL8++細胞株中AKT蛋白磷酸化程度明顯高于野生型和ANGPTL8-/-細胞株,而野生型和ANGPTL8-/-細胞株中AKT蛋白磷酸化水平沒有明顯區別。以上結果說明ANGPTL8可促進由胰島素介導的AKT蛋白磷酸化。
為了檢測ANGPTL8是否通過影響PI3K/AKT信號通路中AKT上游蛋白磷酸化來調節AKT磷酸化,我們分別檢測了其上游關鍵蛋白IRS-1、JNK及其磷酸化變化。結果(圖4)顯示,無論有無胰島素存在,IRS-1、JNK、pIRS-1(ser307)、pIRS-1(ser302)和pJNK在三組細胞中表達均無明顯差異。以上結果說明ANGPTL8可能不是通過對IRS-1和JNK蛋白直接磷酸化來調控影響AKT蛋白磷酸化。
進一步分析ANGPTL8通過對AKT蛋白磷酸化后對其下游GSK-3β、FoxO1 和mTOR 蛋白磷酸影響。如圖5結果所示,無論有無胰島素ANGPTL8對GSK-3β、FoxO1和mTOR總蛋白表達沒有影響,在胰島素作用下GSK-3β、FoxO1和mTOR蛋白磷酸化表達明顯上調,但ANGPTL8++細胞株中pGSK-3β和pFoxO1蛋白表達明顯高于野生型和ANGPTL8-/-細胞株,然而pmTOR在3組細胞中無明顯差異。以上結果說明ANGPTL8可調控由胰島素介導的AKT/FoxO1 or GSK-3β信號通路,但不影響AKT/mTOR通路。
2.4 ANGPTL8對糖原合成影響
利用PAS染色檢測ANGPTL8對糖原合成影響,結果(圖6)顯示,經過不同處理后對照組(培養基只含0.5% BSA)中3種細胞的糖原含量基本無明顯差異;0.5% BSA+glucose和0.5%BSA+glucose+insulin處理組中ANGPTL8++細胞中糖原含量明顯高于與對照和ANGPTL8-/-細胞,隨著胰島素的加入ANGPTL8促進糖原合成更加明顯,然而對照與ANGPTL8-/-細胞在這兩個處理組中的糖原含量無明顯差異。
以上結果表明在HepG2細胞中,ANGPTL8可提高胰島素敏感,促進胰島素對PI3K/AKT信號通路的FoxO1和GSK-3β蛋白磷酸化,從而促進糖原合成,提高糖耐受。
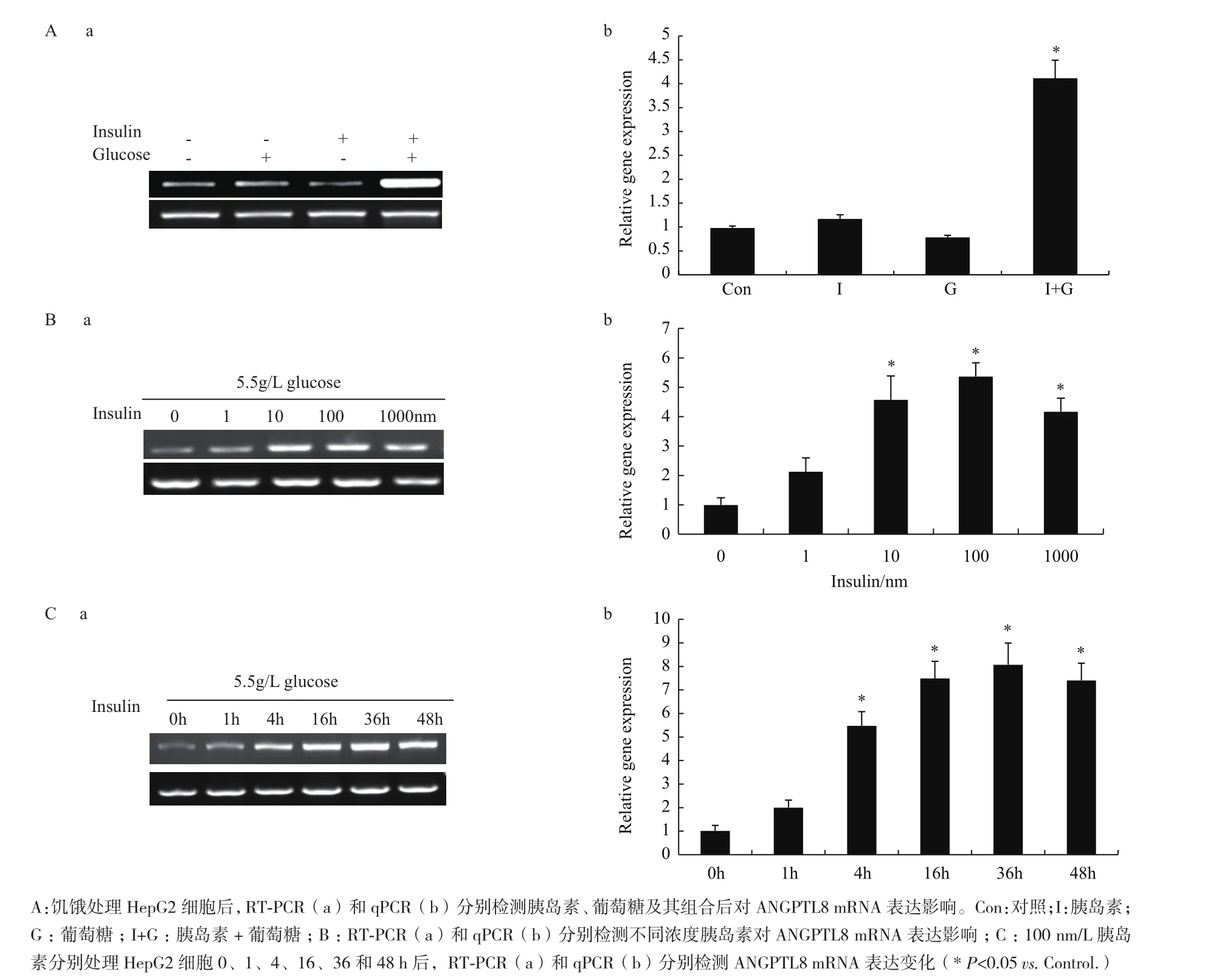
圖2 不同因素對ANGPTL8 mRNA表達影響
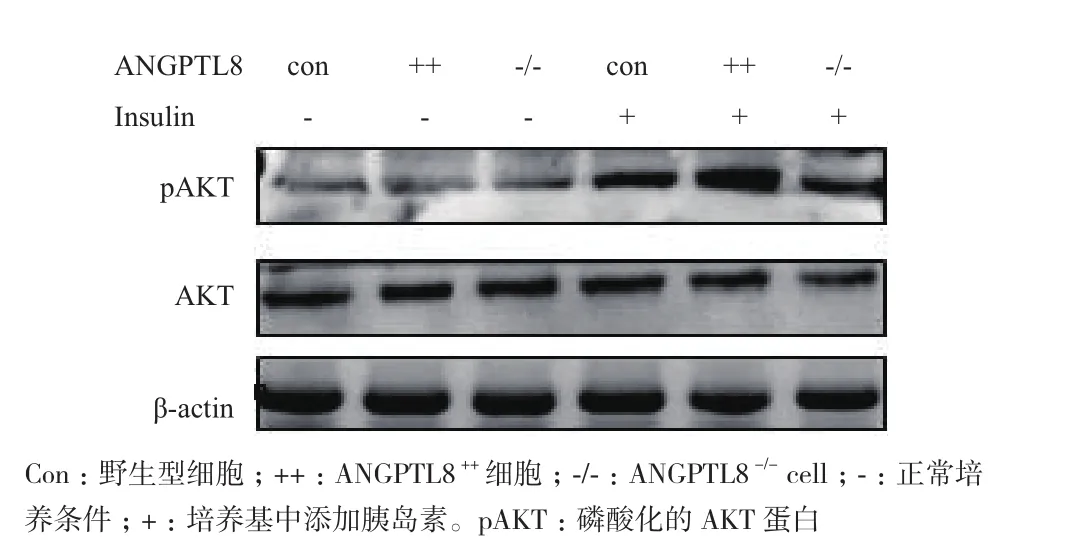
圖3 Western blotting檢測在HepG2細胞中ANGPTL8對AKT和pAKT蛋白表達影響
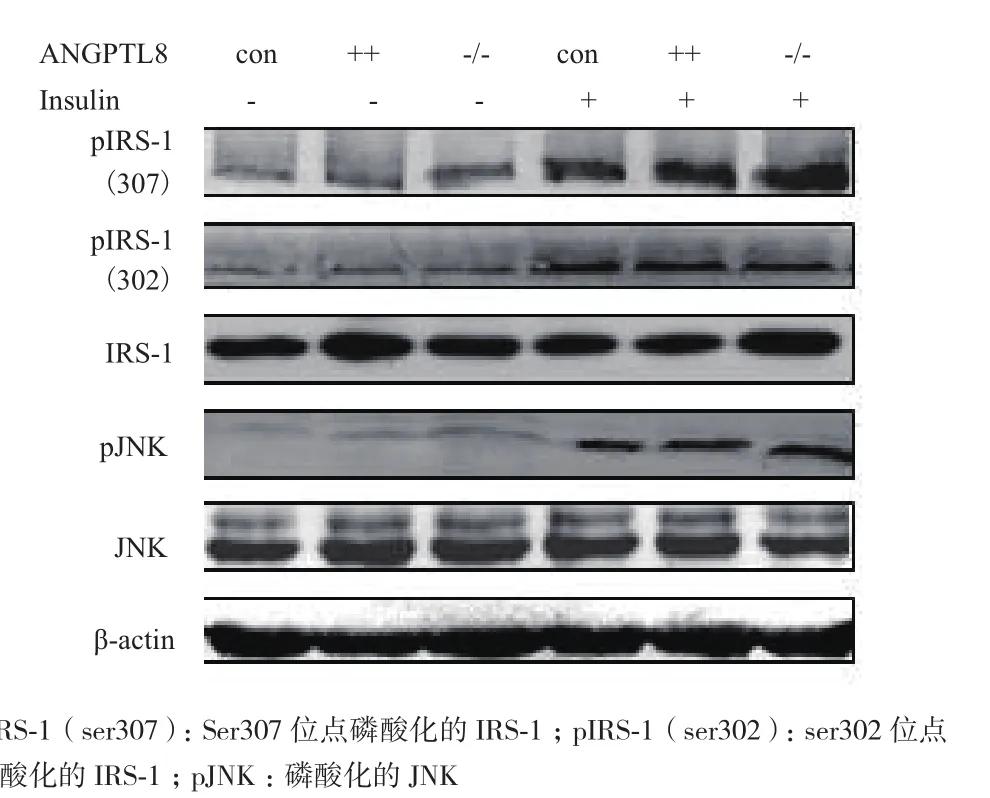
圖4 Western blotting檢測在HepG2細胞中ANGPTL8對IRS-1和JNK蛋白及其磷酸化蛋白表達影響
3 討論
pI磷
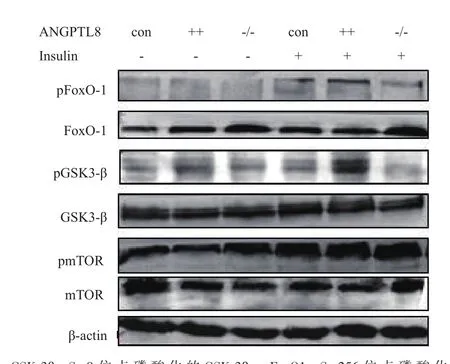
圖5 Western blotting檢測在HepG2細胞中ANGPTL8對GSK-3β、FoxO1和mTOR蛋白及其磷酸化表達影響
PI3K/AKT信號通路是胰島素的主要下游調控分子通路。當人或動物進食后,由血糖升高的刺激胰腺胰島β細胞分泌產生的胰島素,胰島素入血后作用于肝細胞膜表面的胰島素受體,使其位于細胞內的β 亞基的酪氨酸位點自磷酸化激活。激活的胰島素受體可通過磷酸化胰島素受體底物-1/2(IRS-1/2)酪氨酸位點而激活IRS-1/2,進而激活PI3K[12-13]。活化的PI3K可以催化4,5-二磷酸磷脂酰肌醇(PIP2)變成PIP3。PIP3是AKT第二信使,可激活AKT,后者可以通過調節GSK3β等一系列下游分子的活性增加糖原合成[14-16],同時可磷酸化FoxO1使其出核失活,從而降低葡萄糖-6-磷酸酶和磷酸烯醇式丙酮酸羧激酶等糖異生基因的表達,抑制糖異生,最終發揮降低血糖的作用[17]。PI3K-AKT信號通路的調節已是多種疾病包括糖尿病在內的潛在干預靶點。
作為一個新發現的基因,ANGPTL8的功能還存在很多爭議,為了明確其對糖代謝影響,我們首先在小鼠肝臟過表達ANGPTL8,發現人和鼠ANGPTL8基因都可以改善糖耐受。在小鼠體內ANGPTL8 mRNA 表達明顯受到進食和禁食的調節,它在進食期表達明顯升高,禁食期表達降低[18-19]。Ren等[20]和我們分別在3T3-L1 和HepG2細胞中,發現ANGPTL8 mRNA 表達受胰島素和葡萄糖的共同調控,然而單獨的胰島素或葡萄糖不會上調ANGPTL8 mRNA 的表達。這些研究結果提示ANGPTL8可能通過調控胰島素信號通路影響糖耐受。為進一步研究其改善糖耐受作用機制,我們以前期已構建的ANGPTL8++和ANGPTL8-/-的 HepG2細胞[21]為研究對象,分析ANGPTL8調控糖代謝的可能分子作用機制。通過RT-PCR、qPCR、Western blotting、PAS染色等檢測方法,我們發現胰島素可促進ANGPTL8表達,而高表達的ANGPTL8又可通過提高胰島素介導PI3K/AKT信號通路中AKT,FoxO1,GSK-3β蛋白磷酸化,提高HepG2細胞對胰島素敏感性,促進糖原合成,改善糖耐受;而ANGPTL8的低表達或缺失并不影響胰島素對PI3K/AKT信號通路蛋白磷酸化。所以以上結果提示ANGPTL8可能是通過胰島素介導PI3K/AKT信號通路調控肝臟糖代謝,改善肝細胞糖耐受。然而ANGPTL8調控PI3K-AKT信號通路的作用方式即ANGPTL8可能直接作用于此信號通路中哪個蛋白的磷酸化尚不清楚,還需要后期深入研究。
4 結論
本研究利用前期工作已構建的ANGPTL8++和ANGPTL8-/-的HepG2細胞為研究對象,首次從分子水平分析新基因ANGPTL8在肝細胞中調控糖代謝的可能作用機制。
[1]Gusarova V, Alexa CA, Na E, et al. ANGPTL8/betatrophin does not control pancreatic beta cell expansion[J]. Cell, 2014, 159(3):691-696.
[2]Yi P, Park JS, Melton DA. Betatrophin:A hormone that controls pancreatic beta cell proliferation[J]. Cell, 2013, 153(4):747-758.
[3]Jiao Y, Le L, Yu M, et al. Elevated mouse hepatic ANGPTL8 expression does not increase human beta-cell replication in the transplant setting[J]. Diabetes, 2014, 63(4):1283-1288.
[4]Fu Z, Berhane F, Fite A, et al. Elevated circulating lipasin/betatrophin in human type 2 diabetes and obesity[J]. Scientific Reports, 2014, 4(11):5013.
[5]Daniel MM, Per OC. Increased circulating betatrophin concentrations in patients with type 2 diabetes[J]. Int J Endocrinol, 2014, 10(5):323407-323413.
[6]Tokumoto HY, Fujimoto K, Yamaguchi E, et al. Correlation of circulating betatrophin concentrations with insulin secretion capacity, evaluated by glucagon stimulation tests[J]. J Clin Endocr Metab, 2015, 19(1):111-119.
[7]Chen X, Lu P, He W, et al. Circulating betatrophin levels are increased in patients with type 2 diabetes and associated with insulin resistance[J]. J Clin Endocrinol Metab, 2015, 100(1):E96-E100.
[8]Hu H, Sun W, et al. Increased circulating levels of betatrophin in newly diagnosed type 2 diabetic patients[J]. Diabetes Care, 2014,37(10):2718-2722.
[9]Viktoria G, Erqian Na, Panayiotis E, et al. ANGPTL8/betatrophin does not control pancreatic beta cell expansion[J]. Cell, 2014,159:691-696.
[10]Yi P, Park JS, Melton DA. Perspectives on the activities of ANGPTL8/betatrophin[J]. Cell, 2014, 159(3):467-468.
[11] Zhou L, Sell H, Eckardt K, et al. Conditioned medium obtained from in vitro differentiated adipocytes and resistin induce insulin resistance in human hepatocytes[J]. Febs Letters, 2007, 581(22):4303-4308.
[12]Neri LM, Borgatti P, Capitani S, et al. The nuclear phosphoinositide 3-kinase/AKT pathway:a new second messenger system[J].Biochimica et Biophysica Acta, 2002, 1584(23):73-80.
[13]Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science,2002, 296(5573):1655-1657.
[14]Liu P, Cheng H, Roberts TM, et al. Targeting the phosphoinositide 3-kinase pathway in cance[rJ]. Nat Rev Drug Discov, 2009, 8(8):627-644.
[15]Lochhead PA, Coghlan M, Rice SQ, et al. Inhibition of GSK-3 selectively reduces glucose-6-phosphatase and phosphatase and phosphoenolypyruvate carboxykinase gene expression[J].Diabetes, 2001, 50(5):937-946.
[16]Ishikawa M, Yoshida K, Okamura H, et al. Oral porphyromonas gingivalis translocates to the liver and regulates hepatic glycogen synthesis through the AKT/GSK-3beta signaling pathway[J].Biochimica et Biophysica Acta, 2013, 1832(12):2035-2043.
[17]Banks MJ, Mastracci TL, Kofler NM, et al. Dissociation of the glucose and lipid regulatory functions of FoxO1 by targeted knock in of acetylation-defective alleles in mice[J]. Cell Metab, 2011,14(5):587-597.
[18]Zhang R. Lipasin, a novel nutritionally-regulated liver-enriched factor that regulates serum triglyceride levels[J]. Biochem Bioph Res Co, 2012, 424(4):786-792.
[19]Fu ZY, Yao FY, Abou-Samra AB, et al. Lipasin, thermoregulated in brown fat, is a novel but atypical member of the angiopoietinlike protein family[J]. Biochem Bioph Res Co, 2013, 430(3):1126-1131.
[20]Ren G, Kim JY, Smas CM. Identification of RIFL, a novel adipocyte-enriched insulin target gene with a role in lipid metabolism[J]. Am J Physiol Endocrinol Metab, 2012, 303(3):E334-351.
[21]郭興榮, 陳云, 李東升. TALEN介導的Betatrophin敲除HepG2細胞株的建立[J]. 湖北醫藥學院學報, 2015, 10(5):427-431.
Study on the Molecular Mechanism of ANGPTL8 in Regulating the Glucose Metabolism
MA Shi-nan1LI Zhong-yao2GUO Xing-rong1
(1.Hubei Key Laboratory of Embryonic Stem Cell Research,Taihe Hospital,Hubei University of Medicine,Shiyan 442000 ;2. School of Biomedical Engineering,Hubei University of Medicine,Shiyan 442000)
This work aims to study the effect and molecular mechanism of ANGPTL8 on glucose metabolism by insulin. By tail vein hydrodynamic transfection we confirmed that over-expression of ANGPTL8 in the liver of mice improved glucose tolerance in feeding period.Detecting insulin and glucose effect on ANGPTL8 expression by qPCR in HepG2 cell,we found that ANGPTL8 was dramatically up-regulated only when insulin was added together with glucose into the medium;neither of these two reagents alone affected ANGPTL8 expression. Western blotting was employed to analyze the total proteins and their phosphorylation expressions of insulin-mediated PI3K/AKT signaling pathways in ANGPTL8 knockout(ANGPTL8-/-)and ANGPTL8 over-expression(ANGPTL8++)HepG2 cells. The results demonstrated that the overexpressed ANGPTL8 promoted insulin-mediated AKT,GSK3β or FoxO1 phosphorylation in PI3K/AKT signaling pathway in HepG2 cells. PAS staining results suggested that ANGPTL8 promoted glycogen synthesis.
ANGPTL8;glucose tolerance;PI3K/AKT signaling pathway;glycogen synthesis
10.13560/j.cnki.biotech.bull.1985.2017-0353
2017-05-03
國家自然科學基金應急管理項目(81641028),湖北省自然科學基金面上項目(2016CFB408),十堰市太和醫院與上海寶藤生物醫藥科技股份有限“精準醫學研究”青年項目(2016JZ21),湖北醫藥學院博士啟動金項目(2016QDJR02)
馬石楠,女,碩士,研究方向:糖尿病預防與治療;E-mail:815513350@qq.com
郭興榮,女,博士,副教授,研究方向:糖尿病預防與治療;E-mail:gxrdl@126.com
(責任編輯 李楠)

