氮脅迫對埃氏小球藻生長及油脂積累的影響
程蔚蘭 邵雪梅 宋程飛 史飛飛 季春麗 李潤植
(山西農業大學 分子農業與生物能源研究所,太谷 030801)
氮脅迫對埃氏小球藻生長及油脂積累的影響
程蔚蘭 邵雪梅 宋程飛 史飛飛 季春麗 李潤植
(山西農業大學 分子農業與生物能源研究所,太谷 030801)
以生長快、可除污的埃氏小球藻株系SXND-25為試材,研究不同氮濃度培養條件對其生物量和油脂產量的影響,以期建立優化培養體系利用該株小球藻生產優質生物燃油。以硝酸鈉為氮源、BG11培養基中的氮濃度為基準(1.5 g/L),設置氮濃度梯度對小球藻進行培養。通過光密度測定、尼羅紅染色、轉酯化法抽提油脂和GC分析,對小球藻生物量、油脂含量及脂肪酸組分進行分析。結果顯示,培養8 d時,在氮濃度為1.5 g/L時,生物量達到最大,干重為3.4 g/L,而油脂含量僅為28.24%,油脂產量為0.96 g/L;在氮濃度為0 g/L時生物量最小,干重為0.49 g/L,而油脂含量最高,為44.57%,油脂產量為0.22 g/L;在氮濃度為0.75 g/L時,干重為3.2 g/L,油脂含量為40.36%,油脂產量最高為1.3 g/L,是標準氮濃度下油脂產量的1.4倍。0.75 g/L氮濃度下連續培養8 d,藻油脂肪酸組成更適于制取優質生物柴油。綜合生物量、油脂含量及脂肪酸組成等指標,確定0.75 g/L氮濃度為該埃氏小球藻株系規模化培養以生產優質生物燃油的優化參數。
埃氏小球藻(Chlorella emersionii);缺氮培養;生物量;油脂積累;脂肪酸組成
小球藻(Chlorella spp.)是一種可自養或異養培養的單細胞真核綠藻,廣泛分布在世界范圍水系中,具有生長速度快、光合效率高、適應性強等特點[1,2]。小球藻通過光合作用可將CO2轉化為高值有機化合物,用于生產食物、飼料、餌料、高附加值的生物活性物質和保健食品,亦是生產可再生生物燃料的良好原料。由于其生物量大、生長快、易培養、油脂積累多,小球藻愈來愈多地用于規模化生產生物柴油研發[3,4]。分離培育高生物量、高含油、耐逆境的小球藻藻種和建立可連續培養的高效培養體系是實現微藻生物柴油商業化生產的關鍵環節。
氮是組成微藻的基本元素之一。在營養元素中,氮元素對微藻具有十分顯著的影響[5]。在一定條件下,氮濃度升高可以促進細胞生物量增加,但同時會使細胞內儲藏物積累量減少,油脂含量降低,特別是極性油脂含量。在缺氮脅迫條件下,微藻生長減慢甚至停止,細胞內的儲藏物大量積累,油脂含量快速增加,并且多為中性油脂[6]。氮脅迫不僅影響細胞內總脂的積累,還對細胞內的油脂組分產生影響。有研究表明[7]氮脅迫會促進短鏈飽和脂肪酸和單不飽和脂肪酸的積累。而優質的生物柴油對脂肪酸組分有一定要求,歐盟的生物柴油標準[8]EN14214規定亞麻酸(C18∶3)不能高于12%、多于4個雙鍵(含4個雙鍵)的脂肪酸含量不能高于1%。因此,研究不同氮濃度下微藻的油脂含量及組分變化對于制備優質的生物柴油具有重要的價值。
同時獲得高生物量、高油脂和良好的油脂組分是微藻規模化生產制備生物柴油難點之一[9]。本實驗室在山西一個煤化廠附近水體中分離到一株埃氏小球藻(Chlorella emersonii)新株系SXND-25。對該株系培養及鑒定發現其具有自絮凝的特點,生長速度是普通小球藻的1.15倍,含油量28%,凈化污水能力強,是進一步應用于生物柴油生產的優異種質。本研究以本實驗室分離的埃氏小球藻株系SXND-25為材料,用豎直密閉管式光反應器進行20 L放大培養,以BG11培養基為基礎,設置氮濃度梯度,研究不同氮濃度對埃氏小球藻生長、油脂積累和油脂組分的影響。旨在找出適宜的氮濃度和培養條件,以獲得小球藻生物量快速增長、油脂產量較高、適于生產優質生物柴油的油脂組分比例增加的生產指標。為該株特色小球藻規模化培養體系建立,以及生產優質微藻生物柴油提供科學依據。
1 材料與方法
1.1 材料
實驗藻種為本實驗室從山西一煤化廠附近水體分離和保存的小球藻株系SXND-25,經形態學和18S RNA鑒定其為埃氏小球藻(Chlorella emersonii)一個新株系。
1.2 方法
1.2.1 培養條件 埃氏小球藻用豎直密閉管式光反應器進行20 L放大培養,培養條件為:溫度(25±1)℃,濕度45%,光照強度4 500 lux,光暗比16 h∶8 h,CO2含量2%(V/V)。
1.2.2 氮濃度梯度設置 以BG11中的氮濃度(1.5 g/L)為基準,設置5個氮濃度梯度:0 g/L(0 N)、0.375 g/L(1/4 N)、0.75 g/L(1/2 N)、1.125 g/L(3/4 N)、1.5 g/L(1 N),并將STOCK 1中的硝酸鈉替換為氯化鈉,STOCK 2中的檸檬酸鐵銨替換為檸檬酸鐵。每組實驗設置3 個生物學重復試驗。
1.2.3 接種 在無菌條件下,取一定量處于對數生長期的小球藻藻液,將其轉入離心管中以5 000 r/min離心5 min,將離心后得到的藻團用雙蒸水進行3次重懸、離心以徹底去除小球藻表面的培養基,之后,分別用少量各個氮濃度的培養基等量重懸,并接種到對應氮濃度的培養基中,使接種后的藻液干重為0.28 g/L。
1.2.4 生物量及油脂含量的測定 小球藻共培養8 d,每2 d取樣一次。生物量的測定方法為:稱量孔徑為0.45 μm混合纖維素脂濾膜的質量m0,取一定量的藻液v在濾膜上抽濾去除水分,置于60℃烘箱烘至恒重,稱量濾膜及藻干重m1。根據公式DW=(m1-m0)/v計算藻樣干重。根據得到的結果計算干重為5 mg時所需要的藻液量,并取對應量的藻液用于油脂含量測定及油脂組分分析,另各取800 μL藻液進行尼羅紅染色。
1.2.5 藻粉的制備 將1.2.4中所取藻液,以5 000 r/min 離心3 min,收集藻樣并用雙蒸水重懸洗滌后,將藻樣冷凍干燥。凍干藻粉存入4℃冰箱中保存。
1.2.6 尼羅紅染色熒光拍照 將800 μL藻液與200 μL二甲基亞砜(DMSO),10 μL尼羅紅丙酮溶液(0.1 mg/mL)均勻混合,42℃條件下避光水浴5 min,使用藍光作為激發光,在正置熒光顯微鏡下觀察并拍照。
1.2.7 提取油脂與油脂組分的測定 本實驗提取油脂的方法是直接轉酯化法:將 5 mg凍干藻粉、0.1-0.3 mL 氯仿∶甲醇(2∶1,V/V)、0.1-0.5 mL HCl-甲醇(5%,V/V)依次加入特氟龍密封墊片的玻璃螺紋管中。85℃水浴30 min,冷卻至室溫后,加入 900 μL正己烷。將其在設定條件為25℃,150 r/min 的搖床上提取 1 h,靜置過夜,取正己烷萃取液,使用氣相色譜儀(GC)測定脂肪酸組成及含量。
1.2.8 氣相色譜(GC)測試條件 用 Agilent 7890D進行脂肪酸組分分析。色譜柱為 Agilent HP-88 弱極性毛細管色譜柱(30 m×250 μm×0.25 μm);樣品 1 μL 分流進樣,分流比1∶40 進樣口溫度260℃;使用氮氣作為載氣,流速為 1.0 mL/min。
計算各組分的百分含量:峰面積歸一化法。實驗重復 6 次,實驗結果值表示為:平均值±標準差(±s)(n = 6)。
2 結果
2.1 不同氮濃度培養對小球藻生物量的影響
用干重法測定不同氮濃度培養下各時段的小球藻樣品的生物量,結果(圖1)。顯示,在氮濃度為0 g/L時,小球藻處于基本不生長的狀態。在氮濃度為0.375 g/L時,小球藻前2 d生長較緩慢,從第2天開始生物量快速增加,進入對數生長期,第6-8天時進入穩定前期,生長速度減慢。其原因可能是培養基中的氮基本耗盡,處入缺氮脅迫狀態。在氮濃度為0.75 g/L、1.125 g/L、1.5 g/L時,生物量相差不大,小球藻生長趨勢基本相同。即前2 d處于延滯期,生物量增長較為緩慢。在培養的2-6 d時處于對數生長期,生物量迅速增加,在第6-8天達到穩定期,生物量增加緩慢。

圖1 不同氮濃度下生物量隨時間的變化
2.2 尼羅紅染色測試不同氮濃度培養條件下小球藻油脂積累變化
用尼羅紅染色定性測試不同氮濃度培養條件下小球藻油脂積累變化。結果(圖2)表明,在同一氮濃度下,藻細胞內油脂含量隨時間的增長而增多。在培養第2天時,A1、B1、C1藻細胞內可以觀察到小油滴,D1、E1基本觀察不到油滴;在培養第6天時,A2、B2、C2藻細胞內油滴清晰可見,D2、E2隱約可見小油滴;在培養第8天時,A3、B3、C3藻細胞內的油滴多且亮,D3、E3藻細胞內油滴較小。由此可知缺氮培養可以促進油脂的積累。
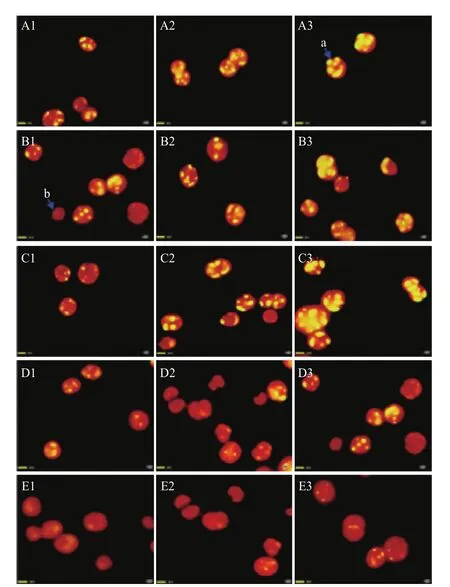
圖2 尼羅紅染色顯示不同氮濃度培養條件下小球藻油脂積累變化
2.3 不同氮濃度培養條件下小球藻油脂含量及組分分析
取不同氮濃度培養條件下不同時段的小球藻樣品,定量分析藻細胞總油脂含量。結果(圖3)顯示,在同一氮濃度條件下,藻細胞內的油脂含量隨培養時間的增加而增加,且氮濃度越低,油脂積累越快,最終的油脂含量也越高。在氮濃度為1.5 g/L時,培養8 d,最終的油脂含量僅為28.24%,而在氮濃度為0 g/L時,油脂含量達到最大值44.57%(干基),是氮濃度為1.5 g/L時的1.6倍。
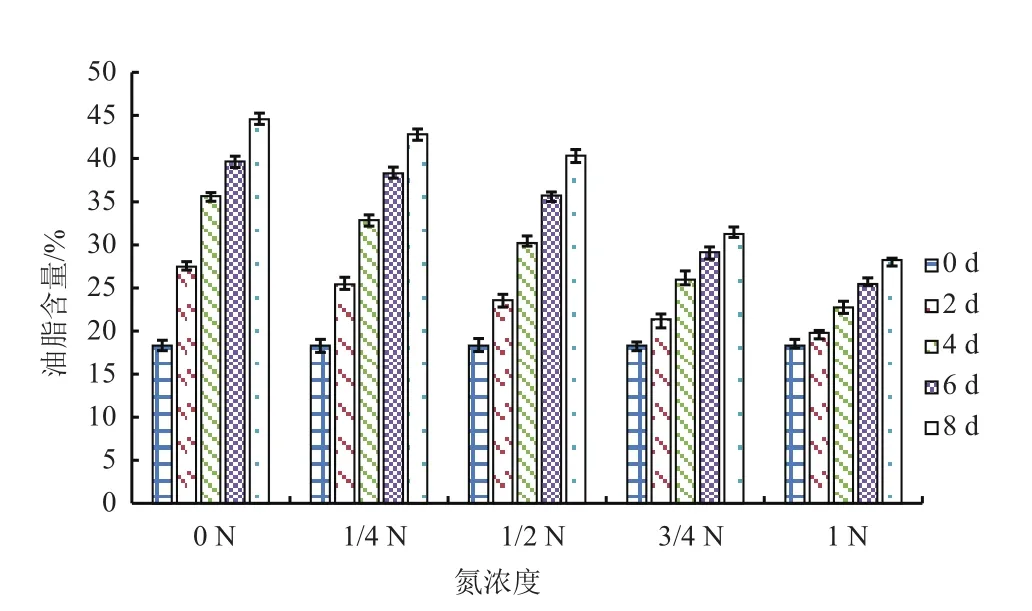
圖3 不同氮濃度下油脂含量的變化
對不同氮濃度培養條件下各時段微藻樣品單位油脂產量測試結果(圖4)顯示,在同一氮濃度下,單位體積油脂產量隨培養時間的增加而增加。培養8 d,單位體積油脂產量最大值出現在氮濃度為0.75 g/L時,達到1.3 g/L。
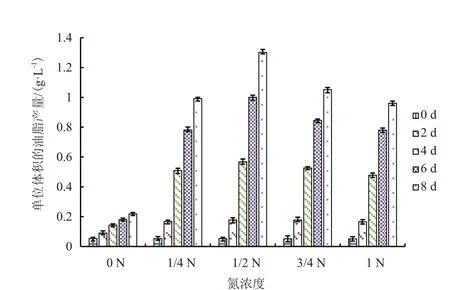
圖4 不同氮濃度下單位體積的油脂產量
進一步用GC定量分析不同氮濃度培養第8天小球藻脂肪酸組成測試結果(表1)表明,小球藻的脂肪酸組成包括C14∶0、C16∶0和C18∶0的飽和脂肪酸,C16∶1和C18∶1的單不飽和脂肪酸,以及C16∶2、C16∶3、C18∶2和C18∶3的多不飽和脂肪酸。隨著氮濃度的降低,飽和脂肪酸占總脂肪酸含量由26.2%降低至18%,其中C14∶0降低了3%,C16∶0含量降低了33%,C18∶0含量增加了2.2倍。N濃度減低也導致單不飽和脂肪酸含量占總脂肪酸含量由11%增加至51%,其中C16∶1含量增加了5.5倍,C18∶1含量增加了3.45倍。在低N或缺N脅迫下,多不飽和脂肪酸含量占總脂肪酸含量由62.8%降至31%,其中C16∶2含量降低了58%、C16∶3含量降低了80%、C18∶2含量降低了44%、C18∶3含量降低了27.5%。單不飽和脂肪酸含量增加及多不和脂肪酸含量減少正是制取優質生物柴油所要求的脂肪酸組成。顯然,氮脅迫有利于微藻積累更適合制取優質生物柴油的脂肪酸成分。
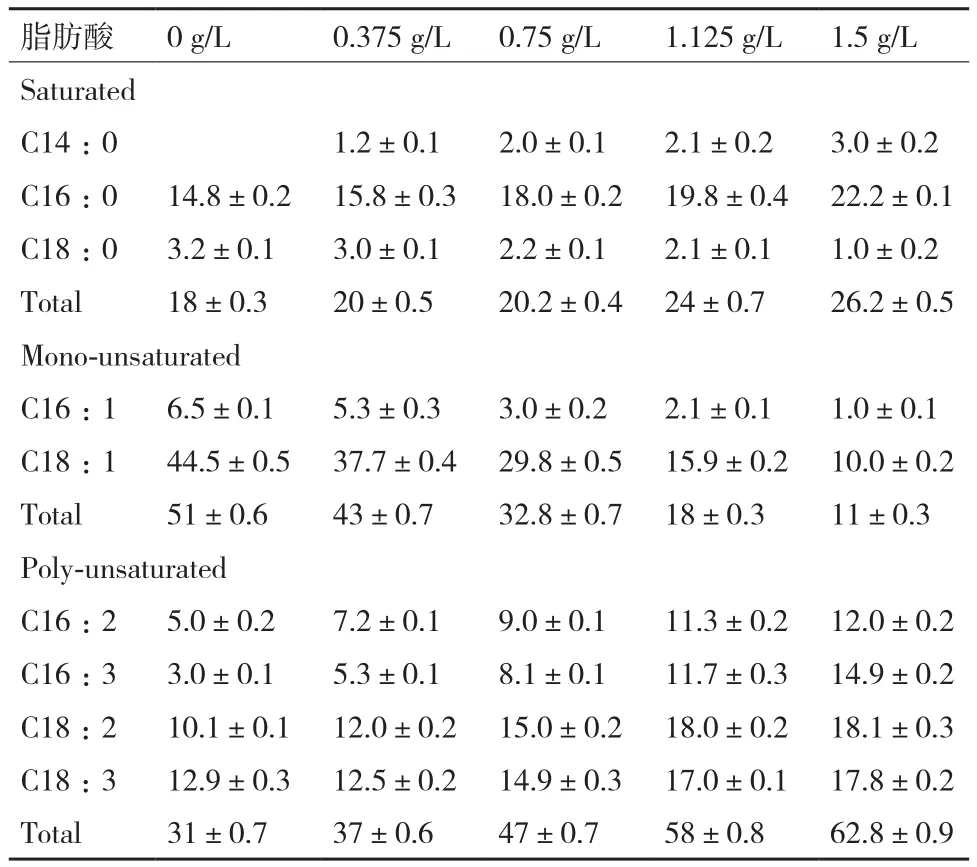
表1 不同氮濃度培養條件下藻細胞各脂肪酸組分的平均含量(%)
3 討論
已有研究表明氮脅迫促進微藻中油脂的積累,但會導致核酸合成受阻,限制微藻的繁殖與生物量的增加[10]。本試驗也證實這一點,即在氮濃度為0 g/L條件下培養3 d干重僅增加了0.12 g/L,生物量增長極其緩慢。微藻在缺氮培養時,還能極緩慢生長可能是因為接種時細胞內儲存了少量氮源。氮濃度為1.5 g/L時,干重增加量為1.82 g/L,是氮濃度為0 g/L增長量的15倍。很明顯,氮缺乏是限制生物量增加的重要因素。江懷真[11]等研究了不同硝酸鈉濃度對小球藻生長的影響,發現當f/2培養基中的初始氮濃度達到150 mg/L時,繼續增加氮供應量并不能進一步提高生物量。然而,本研究結果表明,當BG11培養基中初始氮濃度小于750 mg/L時,隨著初始氮濃度的增加,生物量快速增長;當初始氮濃度大于750 mg/L時繼續增加氮濃度,對生物量的增長影響不大。說明在氮濃度較低時,隨著氮濃度的增加生物量會迅速增長,當氮達到一定濃度時,繼續增加氮的初始濃度,并不能促進生物量的大量增加。
氮脅迫不僅影響微藻生物量的增長,而且對微藻的油脂積累也產生了明顯的影響。劉金麗[12]等研究表明氮脅迫條件下產油柵藻(Scenedesmus dimorphus)油脂含量由22.4%提高到36.3%。趙萍[13]對三角褐指藻(Phaeodactylum tricornutum)培養條件優化,經缺氮誘導產油,油脂含量由22.19%升高至31.02%。本研究中,隨著氮濃度的降低,該埃氏小球藻(Chlorella emersonii)株系油脂含量由28.24%提高到44.57%,提高后的油脂含量明顯高于其他產油微藻的油脂含量。氮濃度為0 g/L時,由于生物量極少,單位體積內的油脂產量很低。氮濃度為0.375 g/L時,雖然生物量低,但由于油脂含量較高,其單位體積的油脂含量也較高,8 d時達到0.99 g/L。氮濃度為0.75 g/L時微藻不僅能獲得相對較高的生物量,其油脂含量也很高,所以單位體積的油脂產量達到了1.3 g/L。在氮濃度為0.75 g/L時,氮源相對充足,沒有因缺氮嚴重限制微藻細胞的繁殖。當細胞達到一定濃度時,因消耗了大量的氮,進入了氮限制的條件,這樣就促進了細胞內油脂的快速積累。氮濃度為1.125 g/L和1.5 g/L條件下,雖然單位體積的生物量較高,但因細胞內的油脂含量并不太高,單位體積的油脂產量分別為1.05 g/L和0.96 g/L。顯然,在1/2 N濃度時,既獲得了較高的生物量,同時單位體積的油脂產量達最高。
氮脅迫對微藻細胞的脂肪酸組分及比例也產生了影響。本研究結果表明,隨著氮濃度的降低,在總脂中飽和脂肪酸和多不飽和脂肪酸的比例減少,單不飽和脂肪酸的比例增加。廖啟斌等[14]研究表明,伴隨氮濃度的升高,三角褐指藻(Phaeodactylum tricornutum Bohlin)內總脂中多不飽和脂肪酸的比例有所增加,這與本研究結果一致。梁英等[15]研究了NO3
-濃度對P. tricornutum MACC/ B226藻株脂肪酸組分的影響,多不飽和脂肪酸占總脂的比例在氮濃度為22.1 mmol/L時大于氮濃度為17.6 mmol/L時。這也可以間接地說明,氮脅迫能更好的促進微藻中單不飽和脂肪酸的積累。
綜上所述,對不同氮濃度下微藻的生物量和油脂含量等指標的分析顯示,氮濃度為1.5 g/L時生物量最高,干重為3.4 g/L,是氮濃度為0 g/L時的7倍,但油脂產量低。油脂含量在氮濃度為0 g/L時最高,為44.57%,是氮濃度為1.5 g/L時的1.6倍,然而生物量最低。在氮濃度為0.75 g/L時,既可獲得較高的生物量和油脂積累量,又能獲得更適合制取優質生物柴油的脂肪酸組成。
4 結論
綜合不同氮濃度下微藻的生物量、油脂含量及單位油脂產量等分析結果,可知氮濃度在0.75 g/L時,油脂產量最高達1.3 g/L,脂肪酸成分也更適合制取優質生物柴油。因此,0.75 g/L的氮濃度可作為一個優化參數,用于進一步建立該特色埃氏小球藻株系商業化培養體系以期生產優質生物柴油。
[1]趙卓, 李定國, 張玉霞. 不同光強和光質對室內小球藻生長的影響[J]. 化工管理 , 2015(20):186.
[2]塔依爾, 宋于洋, 周源. 氣象因子變化對沙棘速生期和果實成熟期光合速率的影響[J]. 西北林學院學報, 2006(5):37-39.
[3]袁程. 微藻生產生物柴油評價及其高產條件的優化[D]. 保定:河北農業大學, 2011.
[4]丁彥聰, 高群, 劉家堯, 等. 環境因子對小球藻生長的影響及高產油培養條件的優化[J]. 生態學報, 2011(18):5307-5315.
[5]張敬鍵, 展望, 李愛芬, 等. 不同硝酸鈉濃度對多形擬綠球藻和模式擬綠球藻生長及脂類積累的影響[J]. 熱帶海洋學報,2013(1):64-69.
[6]Kumaresan V, Nizam F, Ravichandran G, et al. Transcriptome changes of blue-green algae, Arthrospira sp. in response to sulfate stress[J]. Algal Research, 2017, 23 :96-103.
[7]沈雄, 焦媛媛, 朱葆華, 等. 培養基限氮和添加鎢酸鈉對微擬球藻脂肪酸組成的影響[J]. 海洋湖沼通報, 2011(4):78-82.
[8]Breuer G, Lamers PP, Martens DE, et al. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains[J]. Bioresource Technology, 2012, 124:217-226.
[9]陳林, 張維, 劉天中, 等. 兩步法催化高酸價微藻油脂制備生物柴油[J]. 生物質化學工程, 2011(3):1-7.
[10]朱云龍. 具有氣液分離膜的光生物反應器內微藻吸附生長及CO2固定特性研究[D]. 重慶:重慶大學, 2014.
[11]江懷真, 張維, 劉天中, 等. 氮、磷濃度對小球藻生長及油脂積累的影響[J]. 食品工業科技, 2011, 32(6):204-211.
[12]劉金麗, 王俊峰, 劉天中, 等. 缺氮條件對柵藻油脂積累與光合作用的影響[J]. 海洋科學, 2013(7):13-19.
[13]趙萍. 三角褐指藻富油培養條件的優化及活性物質分析[D].煙臺:魯東大學, 2013.
[14]廖啟斌, 李文權, 陳清花, 等. 營養鹽對三角褐指藻脂肪酸含量和百分組成的影響[J]. 海洋環 境科學, 2000, 19(2):6-9.
[15]梁英, 麥康森, 孫世春. 硝酸鈉濃度對三角褐指藻(Phaeodactylum tricornutum)MACC/ B226 生長及脂肪酸組成的影響[J]. 海洋科學, 2002, 26(5):48-51.
Effects of Nitrogen Stress on Growth and Oil Accumulation of Chlorella emersionii
CHENG Wei-lan SHAO Xue-mei SONG Cheng-fei SHI Fei-fei JI Chun-li LI Run-zhi
(Institute of Molecular Agriculture & Bioenergy,Shanxi Agricultural University,Taigu 030801)
Fast-growing Chlorella emersionii strain SXND-25 with great ability of purifying waste water was used as the target microalgae to investigate the effects of culture condition under varied nitrogen(N)concentration on microalgae biomass and oil yield,aiming at establishing an optimized culture system of such valued chlorella for commercial production of high quality biofuels. BG11 medium was used as the standard medium containing NaNO3as nitrogen(N)source(1 N). This new strain of C. emersionii was continuously cultured in the medium containing different nitrogen concentrations in the medium set as 0 g/L(0 N),0.375 g/L(1/4 N),0.75 g/L(1/2 N),1.125 g/L(3/4 N),and 1.5 g/L(1 N),respectively. The biomass,oil content and fatty acid composition of the microalgae were analyzed by means of optical density measurement,Nile red staining,direct ester extraction of oil and GC analysis. When cultured in 1 N-medium for 8 d,the C.emersionii increased its biomass up to the maximum level with 3.4 g/L dry weight(DW),whereas oil content was only 28.24% of DW,with 0.96 g/L oil yield on average. Culture of 8 days at 0 N-medium led to the minimum biomass of the C. emersionii with 0.49 g/L DW,but the highest level of oil accumulation(44.57% of DW)and small average oil yield(0.22 g/L). Notably,cultivation of 8 d in 1/2 N-medium resulted in the C. emersionii to achieve high biomass(3.2 g/L DW)and moderate oil contents(40.36% of DW),but the highest oil yield of 1.3 mg/L on average. which was 1.4 folds of oil yield cultured in the standard medium(1 N). Moreover,the fatty acid profile in the Chlorella cultured in 1/2 N-medium for 8 d was detected to be more suitable for production of high-quality biodiesel. In conclusion,comprehensive analysis of various indexes including biomass,oil content and oil yield per unit demonstrates that 0.75 g/L nitrogen concentration can be used as an optimized parameter for developing an effective cultivation system of this special Chlorella strain in producing high-quality biodiesel at large scale.
Chlorella emersionii;nitrogen-deficient cultivation;biomass;oil accumulation;fatty acid components
10.13560/j.cnki.biotech.bull.1985.2017-0519
2017-06-22
國家“948”項目(2014-Z39),山西省煤基重點科技攻關項目(FT-2014-01),山西省重點研發計劃重點項目(201603D312005)
程蔚蘭,女,碩士研究生,研究方向:微藻生物能源;E-mail:503491969@qq.com
李潤植,男,教授,博士生導師,研究方向:生物能源與代謝工程;E-mail:rli2001@126.com
(責任編輯 狄艷紅)

